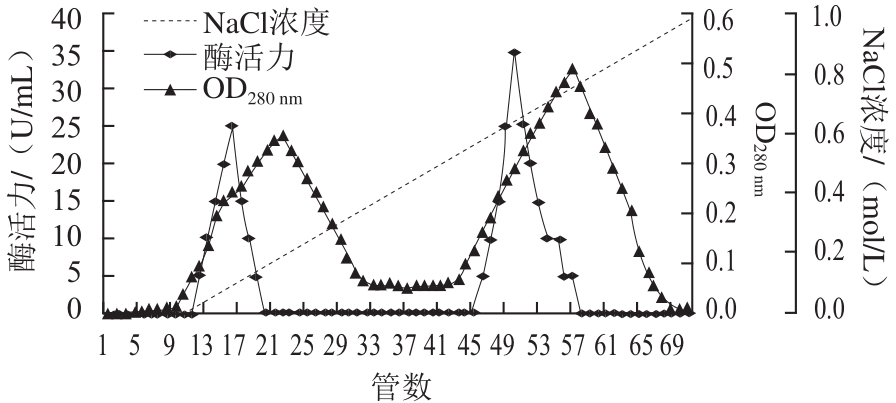
图1 香菜叶PPO的DEAE-Sepharose离子交换柱层析图
Fig.1 DEAE-Sepharose ion-exchange chromatography of PPO from coriander leaves
孙才云,方 玲,唐云明*
(西南大学生命科学学院,重庆市甘薯工程研究中心,三峡库区生态环境教育部重点实验室,重庆 400715)
摘 要:新鲜香菜叶经匀浆、缓冲液提取、硫酸铵分级沉淀、DEAE-Sepharose离子交换层析、Superdex-200凝胶过滤层析,获得电泳纯的多酚氧化酶。该酶比活力达到5 622.95 U/mg,酶活回收率为3.90%,纯化倍数为126.08;全酶分子质量为111.10 kD,亚基分子质量为55.60 kD;最适温度为37 ℃,最适pH值为6.5;在25~45 ℃及pH 6.0~7.0范围内有较好的稳定性;在最适条件下测得其Km值为4.04×10-2mol/L;甲醇、乙醇、异丙醇、氯仿及柠檬酸、抗坏血酸、Ca2+、Hg2+、Ba2+对其有抑制作用,Co2+、Pb2+对其具有一定的激活作用。
关键词:香菜叶;多酚氧化酶;分离纯化;性质
多酚氧化酶(polyphenol oxidase,EC1.10.3.1,PPO)是植物体内普遍存在的一类铜结合酶。它是引起水果、蔬菜发生酶促褐变的主要酶类[1]。当质粒与细胞液泡的分区被打破,酚类和PPO接触,在有氧情况下,酚类被PPO氧化成醌并聚合成褐色聚合物[2]。此外,PPO作为一种氧化还原酶还在光合作用中发挥作用,如调节叶绿体中有害的光氧化反应速率,参与其中电子传递;PPO还可促进伤口的愈合,也可增加植物对病原体的抗性[3]。
香菜(Coriandrum sativum)属伞形科植物,又名芜荽、胡菜等,是以茎和叶为菜肴调料的栽培种,为一年生草本植物[4]。其营养成分中胡萝卜素和铁的含量较高,是绿叶蔬菜中的佼佼者,并且富含蛋白质、脂肪、糖类、尼克酸、膳食纤维、维生素、视黄醇等营养物质[4-5]。适于寒性体质、胃弱体质以及肠腑壅滞者食用,可用来治疗胃脘冷痛、消化不良、麻疹不透等病症,还有降血压、美容等作用[4],越来越被人们重视。有关PPO与植物褐变方面的研究已有不少报道[6-11],但关于香菜PPO的研究尚未见报道。为此,本实验以香菜叶片为材料,对其PPO进行分离纯化和部分酶学性质进行研究,以期为控制香菜褐变提供一定理论依据,从而提高其经济价值。
1.1 材料与试剂
香菜,购于重庆市北碚区天生路永辉超市。
邻苯二酚(catechol,AR) 成都市科龙化工试剂厂;聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVPP)、牛血清白蛋白 美国Sigma公司;考马斯亮蓝G-250 美国Bio-Rad公司;DEAE-Sephrose、Superdex-200层析标准品、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)蛋白质标准品 美国GE公司;丙烯酰胺、甲叉双丙烯酰胺瑞士Fluka公司;其余试剂均为国产分析纯。
1.2 仪器与设备
AL204精密电子天平、Seven Easy pH计 瑞士Mettler-Toledo公司;Milli-Q plus纯水仪 美国Millipore公司;GL-21M高速冷冻离心机 长沙湘仪仪器有限公司;UV-2550型紫外分光光度计 日本岛津公司;AKTA Prime plus纯化系统 美国GE公司;MC4L冷冻干燥机 德国Uni-Equip公司;垂直电泳槽和电泳仪美国Bio-Rad公司。
1.3 方法
1.3.1 香菜叶PPO粗酶液的制备
取新鲜香菜叶片用去离子水洗净擦干后称取50.00 g剪碎,按照1∶4(m/V)加入已经预冷的50 mmol/L pH 6.5的磷酸氢二钠-磷酸二氢钠抽提缓冲液(其中加入2.00 g 的PVPP);放入组织匀浆机中打碎,置4 ℃冰箱抽提2 h,用4 层纱布过滤,在4 ℃条件下12 000 r/min离心30 min,取其上清液即为粗酶液[12-13]。
1.3.2 硫酸铵分级盐析
测定粗酶液体积,置于恒温磁力搅拌器上,向其中边搅拌边缓慢加入硫酸铵粉末至30%饱和度,4 ℃冰箱静置盐析2 h,4 ℃条件下12 000 r/min离心45 min收集上清液;然后向收集的上清液中继续缓慢加入硫酸铵粉末至70%饱和度,4 ℃冰箱静置盐析3 h,4 ℃条件下12 000 r/min离心45 min收集沉淀[14];沉淀用预冷的50 mmol/L pH 7.0的Tris-HCl缓冲液完全溶解,用5 mmol/L pH 7.0的Tris-HCl透析液4 ℃条件下透析24 h,透析后得到酶液保存于-20 ℃备用[12]。
1.3.3 DEAE-Sepharose离子交换层析
DEAE-Sepharose离子交换层析柱先用50 mmol/L pH 7.0 Tris-HCl缓冲液平衡,取透析后的酶液5 mL上样,用含有0~1.0 mol/L NaCl的50 mmol/L pH 7.0 Tris-HCl缓冲液进行线性梯度洗脱,收集时间为700 min,每管收集5 mL,流速设定为0.5 mL/min,测定各管酶活力以及蛋白质含量,收集酶活力较高的几管[13],4 ℃条件下用超纯水透析24 h除盐后冷冻干燥备用[12]。
1.3.4 Superdex-200凝胶过滤层析
Superdex-200凝胶过滤层析柱经过50 mmol/L pH 7.0 Tris-HCl缓冲液处理后,取1.3.3节冷冻干燥后的酶用50 mmol/L pH 7.0 Tris-HCl缓冲液溶解后上样5 mL,用50 mmol/L pH 7.0 Tris-HCl缓冲液进行洗脱,收集时间为500 min,每管收集3 mL,流速设定为0.3 mL/min,测定各管酶活力以及蛋白质含量,收集酶活力较高的几管,用超纯水透析后冷冻干燥得到酶的纯品,置于-20 ℃冰箱中保存备用[12]。
1.3.5 PPO活力的测定
参照文献[12]的方法并略作略改。向试管中加入2.0 mL 50 mmol/L pH 6.5磷酸氢二钠-磷酸二氢钠缓冲液和底物1.5 mL 0.2 mol/L邻苯二酚溶液,于30 ℃恒温水浴锅中预热5 min,再加入200 μL酶液,混匀后立即在408 nm波长处测定光密度(OD408 nm)值,以去离子水代替酶液作为对照调零,酶液加入后开始计时,每30 s记录1 次OD408 nm值,记录2 min内的变化值,以最初直线段的斜率计算酶活力。酶活力单位定义为:在测定条件下,反应后使每分钟光密度值增加0.001所需的酶量定义为一个酶活力单位(U)。
1.3.6 蛋白质含量测定
采用紫外分光光度法[15]以及考马斯亮蓝G-250法对蛋白质含量进行测定[16]。
1.3.7 PPO纯度鉴定以及分子质量测定
用SDS-PAGE对凝胶过滤后的酶样品进行纯度鉴定以及亚基分子质量的测定[17],凝胶过滤法对全酶分子质量进行测定[18]。
1.3.8 香菜叶PPO部分理化性质的研究
1.3.8.1 香菜叶PPO最适温度和最适pH值测定
分别在20~75 ℃和不同pH值条件下测定酶活力,以最适条件下测定的酶活力为100%,其余条件下测定的酶活力与之相比得到相对酶活力。
1.3.8.2 香菜叶PPO热稳定性和pH值稳定性测定
分别在25~75 ℃和pH 3.0~8.0条件下,处理1~5 h,每隔1 h测定酶活力。分别以35 ℃和pH 6.5条件下的酶活力为100%,其他条件下均为相对酶活力。
1.3.8.3 香菜叶PPO米氏常数(Km)测定
在最适温度和最适pH值条件下,以不同底物浓度邻苯二酚(0.020、0.025、0.040、0.050、0.080、0.100 mol/L),测定PPO的活力,采用双倒数作图法(Lineweaver-Burk法)[19]求出该酶的Km值。
1.3.8.4 不同有机溶剂对香菜叶PPO活性的影响
分别将异丙醇、乙醇、甲醇和氯仿与酶液混合,混合后有机溶剂的体积分数分别为10%、20%、30%、40%、50%、60%,4 ℃条件下处理30 min后,在最适条件下分别测定其活力。以酶在最适条件下测得酶活力为100%,加入不同有机溶剂后测得的酶活力与之相比得相对酶活力。
1.3.8.5 不同化合物对香菜叶PPO活性的影响
将尿素[12]、乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)[20]、柠檬酸[20]配成100 mmol/L母液,按一定的比例与酶液混合,混合后终浓度分别为0.01、0.02、0.03、0.04、0.05 mol/L;抗坏血酸[20]配成5 mmol/L母液,同样处理,混合后终浓度分别为0.000 5、0.001 0、0.001 5、0.002 0、0.002 5 mol/L,在4 ℃条件下处理30 min后,在最适条件下分别测其活力。以酶在最适条件下测得酶活力为100%,加入不同化合物后测得的酶活力与之相比得相对酶活力。
1.3.8.6 不同金属离子对香菜叶PPO活性的影响
将各种金属离子[6,10]配成10 mmol/L母液,再按一定比例分别与酶液混合,混合后终浓度分别为0.001、0.002、0.003、0.004、0.005 mol/L,在4 ℃条件下处理30 min后,在最适条件下分别测其活力。以酶在最适条件下测得酶活力为100%,加入不同金属离子后测得的酶活力与之相比得相对酶活力。
2.1 香菜叶PPO的分离纯化

图1 香菜叶PPO的DEAE-Sepharose离子交换柱层析图
Fig.1 DEAE-Sepharose ion-exchange chromatography of PPO from coriander leaves
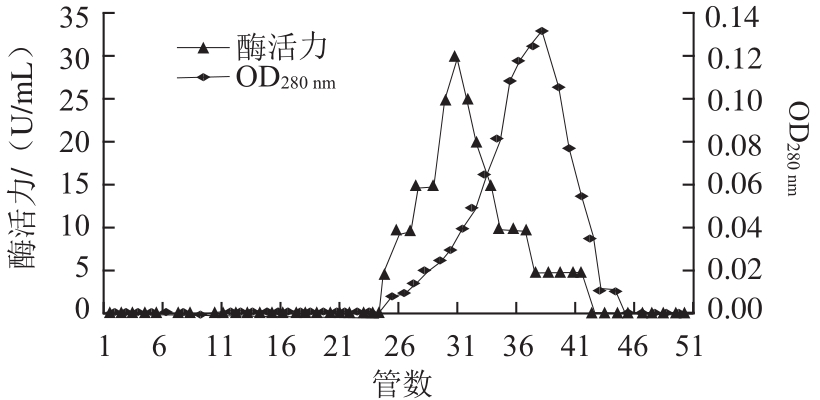
图2 香菜叶PPO的Superdex-200凝胶过滤层析图
Fig.2 Superdex-200 gel filtration chromatography of PPO from coriander leaves
经硫酸铵分级沉淀透析后的酶液经DEAE-Sepharose层析结果见图1,酶活性峰有2 个,第1个酶活性峰出现在第15管,第2个酶活性峰出现在第49管。收集第二个酶活性峰中酶活力较高的几管,透析并冷冻干燥后上Superdex-200层析柱,结果见图2。酶活力最高峰出现在第30管,收集酶活力最高峰对应管中样品,冷冻干燥后于-20 ℃冰箱中保存备用。整个分离纯化过程结果见表1。
表1 香菜叶PPO的分离纯化结果
Table 1 Purification of PPO from corianderleaves

2.2 香菜叶PPO的纯度和分子质量

图3 香菜叶PPO的SDS-PAGE图
Fig.3 SDS-PAGE of purified PPO from coriander leaves
S. 香菜叶PPO;M. 分子质量标准蛋白;1. 兔磷酸化酶B 97.0 kD;2. 牛血清白蛋白66.0 kD;3. 鸡卵清蛋白45.0 kD;4. 牛碳酸酐酶30.0 kD;5. 大豆胰蛋白酶抑制剂20.1 kD;6. α-牛乳清蛋白14.4 kD。
由图3可知,香菜叶PPO纯化后,经SDS-PAGE显示单一条带,说明该酶样品达到电泳纯,通过迁移率推算出该酶亚基的分子质量为55.60 kD;而通过凝胶过滤层析法测定的全酶分子质量约为111.10 kD(图4),可以推断出香菜叶PPO是由两个相同的亚基组成。
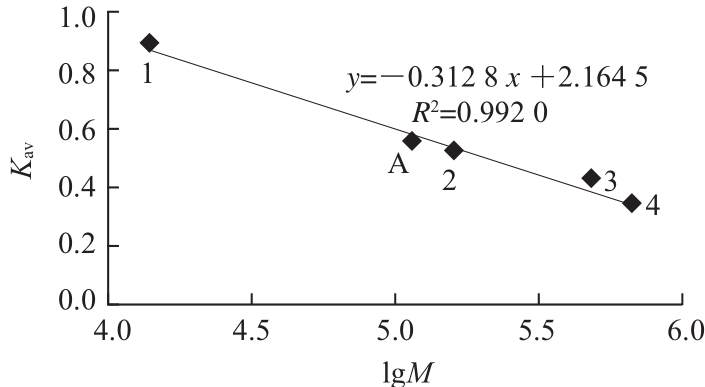
图4 Superdex-200凝胶过滤法测定香菜叶PPO的全酶分子质量
Fig.4 Estimation of molecular weight of PPO from coriander leaves by Superdex-200 gel filtration chromatography
1. 溶菌酶14.30 kD;2. 醛缩酶158.00 kD;3. 铁蛋白440.00 kD;4. 甲状腺球蛋白669.00 kD;A. 香菜叶PPO 111.10 kD。
2.3 香菜叶PPO部分理化性质
2.3.1 香菜叶PPO的最适温度和最适pH值

图5 温度对香菜叶PPO活力的影响
Fig.5 Effect of temperature on the activity of PPO from coriander leaves
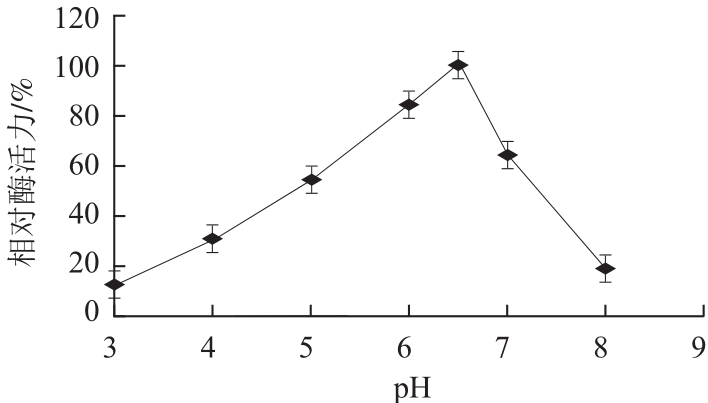
图6 pH值对香菜叶PPO活力的影响
Fig.6 Effect of pH on the activity of PPO from coriander leaves
由图5、6可知,该酶的最适反应温度为37 ℃,最适反应pH值为6.5。
2.3.2 香菜叶PPO热稳定性和pH值稳定性

图7 香菜叶PPO的热稳定性
Fig.7 Thermostability of PPO from coriander leaves
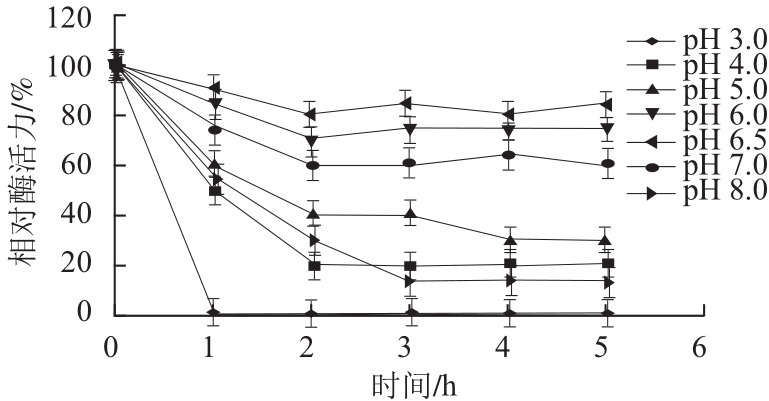
图8 香菜叶PPO的pH值稳定性
Fig.8 pH stability of PPO from coriander leaves
由图7可知,香菜叶PPO在25~45 ℃范围内比较稳定,在65~75 ℃酶活力迅速降低,其中75 ℃保温1 h后酶活力完全丧失。由图8可知,在pH 6.0~7.0时酶稳定性较好,酶活力变化趋势比较平缓;当pH<4.0或者>7.0时,酶蛋白分子结构受到破坏,酶活力迅速下降,当pH 3.0时,1 h后酶活力完全丧失,当pH值为8.0时,3 h后酶活力仅保留13.33%,说明该酶对酸特别敏感,对碱比较敏感。2.3.3 香菜叶PPO的米氏常数

图9 双倒数法测定香菜叶PPO的米氏常数
Fig.9 Kmdetermination of PPO from coriander leaves by Lineweaver-Burk plot
由图9可知,香菜叶PPO对邻苯二酚的Km值为4.04×10-2mol/L。
2.3.4 不同有机溶剂对香菜叶PPO活性的影响

图10 不同有机溶剂对香菜叶PPO活性的影响
Fig.10 Effects of various organic solvents on the activity of PPO from coriander leaves
由图10可知,该酶在异丙醇、乙醇、甲醇、氯仿作用下,酶活性均受到了强烈的抑制,随着有机溶剂体积分数的增大,这种抑制作用越强。特别是氯仿,当其体积分数达到30%,酶活性完全丧失。4 种有机溶剂对该酶的抑制作用强弱依次为氯仿、甲醇、异丙醇和乙醇。
2.3.5 不同化合物对香菜叶PPO活性的影响
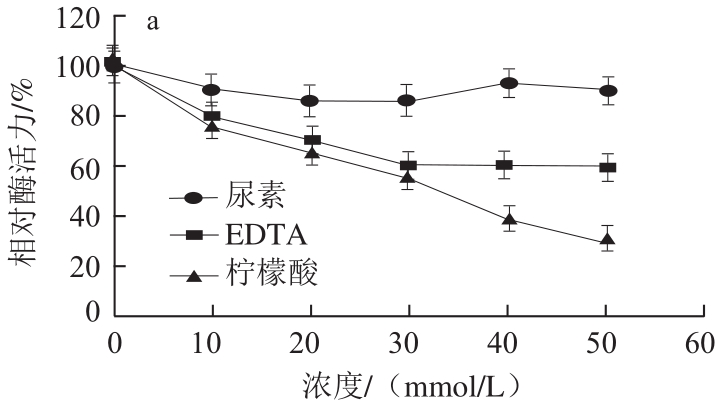

图11 不同化合物对香菜叶PPO活性的影响
Fig.11 Effects of various compounds on the activity of PPO from coriander leaves
由图11可知,随着化合物浓度的增加,抗坏血酸和柠檬酸对香菜叶PPO均有很强的抑制作用,当抗坏血酸浓度为2.5 mmol/L时,完全抑制该酶的活性,当柠檬酸的浓度达到50 mmol/L时,该酶活力仅剩余约30%。尿素对该酶活性的影响不大,EDTA在0~30 mmol/L浓度范围内对该酶的活性有抑制作用,浓度超过30 mmol/L则对酶活性基本没有影响。
2.3.6 不同金属离子对香菜叶PPO活性的影响

图12 不同金属离子对香菜叶PPO活力的影响
Fig.12 Effects of various metal ions on the activity of PPO from coriander leaves
由图12可知,不同金属离子对香菜叶PPO活性有不同的影响。随着离子浓度的增加,Co2+和Pb2+对酶活性有一定的激活作用,Ba2+、Ca2+、Hg2+对该酶均有较强的抑制作用,其中Hg2+对该酶活性的抑制作用最强烈,当Hg2+浓度达到5 mmol/L时,酶活性几乎完全丧失。
酶的分离纯化是对酶学研究和提高酶的应用价值的基础和前提。本实验以香菜叶为材料,经过捣碎、沉淀、层析等步骤后,从香菜叶中成功分离纯化得到电泳纯PPO。与其他材料中分离纯化的PPO相比较,本实验回收率偏低,可能的原因有:该酶的同工酶较多,在透析和离子交换层析等纯化过程中丢失了大部分同工酶,离子交换层析后回收率仅有10.02%,在纯化方法上还有待进一步改进。
香菜叶PPO全酶分子质量为111.10 kD,单亚基分子质量为55.60 kD,高于Lonicera japonica Thunb.(49 kD)[21]、双孢蘑菇(25.5 kD)[14]和中华芦荟(54.1 kD)[13];低于甘薯叶(64.40 kD)[12]和荔枝果皮(76 kD)[22];与Broccoli florets(51.3~57 kD)[23]相近。PPO分子大小的不同可能因为酚类底物氧化产物的反应或酶蛋白本身的分解所致[24],或者种属差异造成的。
香菜叶PPO最适反应温度为37 ℃,低于桑叶(40 ℃)[25],高于鸭梨果肉(25 ℃)[26]、人参果(30 ℃)[19],该酶在25~45 ℃活性较稳定,这与大多数文献报道的相符。最适pH值为6.5,与甘薯叶(pH 6.5)[12]相同,与鸭梨果肉(pH 6.4)[26]相近,稍低于蒲菜(pH 6.8)[20],高于Artichoke heads(pH 6.0)[27]。说明了不同植物来源的PPO在酶学性质方面存在一定的差异。
Ba2+、Ca2+、Hg2+对香菜叶PPO均有较强的抑制作用,可能由于它们能够与活性中心以外的基团结合,且作为重金属离子,高浓度会使PPO变性而达到抑制作用[6]。Co2+和Pb2+对该酶活性有一定的激活作用,它们可能能够促进底物与酶活性中心的亲和,进而有利于PPO的催化反应,实现激活效应[6]。这与已报道的中华寿桃[10]中Ca2+对PPO有促进作用不一致,表明了同一种金属离子对不同来源的PPO活性可能有不同的影响。
香菜叶PPO活性受到有机溶剂氯仿、甲醇、乙醇和异丙醇较强的抑制作用,主要原因是加入有机溶剂后破坏了该酶的水化层,降低了溶液的极性,使酶分子中维持构象的次级键被破坏,从而改变了酶的构象[12]。其中氯仿的抑制作用最强烈,推测可能原因是氯仿与酶液接触后会迅速导致分层,加速酶的变性失活。化合物中抗坏血酸对该酶的抑制作用最强,这可能是由于抗坏血酸可作为酶分子中铜离子的螯合剂,抑制酶促褐变反应的发生,另外过多的抗坏血酸可作为醌的还原剂,将体系中原有的醌类还原为无色物质[8]。柠檬酸对该酶的抑制作用较强,柠檬酸对PPO的抑制作用在于它的3 个羟基对PPO的铜有螯合作用[9]。
参考文献:
[1]田玉庭, 岳田利, 袁亚宏, 等. 澳洲青苹多酚氧化酶的分离纯化研究[J].食品研究与开发, 2006, 27(5): 180-182.
[2]袁德保, 杨昭, 李芬芳, 等. 香蕉多酚氧化酶的纯化、酶学性质及活性抑制的研究进展[J]. 食品科学, 2013, 34(19): 330-335. doi: 10.7506/spkx1002-6630-201319068.
[3]胡春和. 多酚氧化酶的研究现状[J]. 中国高新技术企业, 2009(3): 73-74.
[4]曾庆祝, 冯银花, 闫磊. 香菜水溶性提取物排铅效果的初步研究[J].广州大学学报: 自然科学版, 2008, 7(4): 47-49.
[5]郭红转, 陆占国, 李健. 芫荽的研究开发现状[J]. 食品研究与开发, 2005, 26(2): 104-106.
[6]林庆同, 王伟, 杨美花, 等. 金属离子对马铃薯多酚氧化酶活力的影响[J]. 厦门大学学报: 自然科学版, 2010, 49(4): 561-563.
[7]SÖDERHÄLL K, CARLBERG I, ERIKSSON T. Isolation andpartial purification of prophenoloxidase from Daucus carota L. cell cultures[J]. Plant Physiology, 1985, 78: 730-733.
[8]汤凤霞, 魏好程, 曹禹. 芒果多酚氧化酶的特性及抑制研究[J]. 食品科学, 2006, 27(12): 156-160.
[9]周坚, 万楚筠, 沈汪洋, 等. 甜柿多酚氧化酶特性的研究及褐变控制[J].食品科学, 2005, 26(1): 60-63.
[10]段玉权, 董维, 张明晶, 等. 中华寿桃多酚氧化酶的特性研究[J]. 中国农业科学, 2008, 41(3): 795-799.
[11]BENJAMIN N D, MONTGOMERY M W. Polyphenol oxidase of royal ann cherries: purification and characterization[J]. Journal of Food Science, 1973, 38(5): 799-806.
[12]梁建荣, 黄洁, 苏茉, 等. 甘薯叶多酚氧化酶的分离纯化和部分性质研究[J]. 西南大学学报: 自然科学版, 2011, 33(2): 76-81.
[13]王丽霞. 中华芦荟多酚氧化酶的分离纯化[J]. 淮阴师范学院学报:自然科学版, 2008, 7(4): 319-321.
[14]朱继英, 王健, 王相友. 双孢蘑菇多酚氧化酶的分离、纯化及特性分析[J]. 园艺学报, 2012 , 39(4): 763-768.
[15]余瑞元. 生物化学试验原理和方法[M]. 北京: 北京大学出版社, 1994: 171-176.
[16]王家政, 范明. 蛋白质技术手册[M]. 北京: 科学出版社, 2002: 42-46.
[17]朱广廉, 杨中汉. SDS-聚丙烯酰胺凝胶电泳法测定蛋白质的分子量[J].植物生理学通讯, 1982, 18(2): 43-47.
[18]杨安钢. 生物化学与分子生物学实验技术[M]. 北京: 高等教育出版社, 2001: 248-252.
[19]祁立波, 褚津, 郑皎皎, 等. 人参果多酚氧化酶的酶学特性及纯化[J].大连工业大学学报, 2013, 32(6): 391-394.
[20]孔庆新, 祝冬青. 蒲菜多酚氧化酶的酶学性质研究[J]. 安徽农业科学, 2011, 39(20): 12027-12028; 12033.
[21]LIU Nana, LIU Wei, WANG Daijie, et al. Purification and partial characterization of polyphenol oxidase from the flower buds of Lonicera japonica Thunb[J]. Food Chemistry, 2013, 138(1): 478-483.
[22]蒋跃明. 荔枝果皮褐变的研究[D]. 广州: 中山大学, 1999: 1-35.
[23]GAWLIK-DZIKI U, SZYMANOWSKA U, BARANIAK B. Characterization of polyphenol oxidase from broccoli (Brassica oleracea var. botrytis italica) florets[J]. Food Chemistry, 2007, 105(3): 1047-1053.
[24]林植芳, 李双顺, 张东林, 等. 采后荔枝果实氧化和过氧化作用的变化[J]. 植物学报, 1988, 30(4): 382-387.
[25]黄涛, 杨洋, 聂静然, 等. 桑叶多酚氧化酶分离及活性研究[J]. 食品科学, 2008, 29(12): 473-476.
[26]李桂琴, 刘坤, 高志华, 等. 鸭梨果肉多酚氧化酶的活性研究与纯化[J].河北农业大学学报, 2010, 33(5): 45-49.
[27]AYDEMIR T. Partial purification and characterization of polyphenol oxidase from artichoke (Cynara scolymus L.) heads[J]. Food Chemistry, 2004, 87(1): 59-67.
SUN Caiyun, FANG Ling, TANG Yunming*
(Key Laboratory of Eco-environments in Three Gorges Reservoir Region, Ministry of Education, Chongqing Sweet-Potato Engineering Research Center, School of Life Science, Southwest University, Chongqing 400715, China)
Abstract: Electrophoretically pure polyphenol oxidase (PPO) from fresh coriander leaves was obtained through homogenization, buffer solution extraction, ammonium sulfate precipitation, DEAE-Sepharose ion exchange chromatography and Superdex-200 gel filtration chromatography. The specific activity of purified PPO was 5 622.95 U/mg with a recovery of 3.90% and a purification factor of 126.08. The molecular weights of this enzyme and its subunits were 111.10 and 55.60 kD, respectively. It was relatively stable in the range of 25–45 ℃ and pH 6.0–7.0. Its optimum temperature and pH were 37 ℃and 6.5, respectively. Furthermore, its Kmwas 4.04 × 10-2mol/L under the optimum conditions. Its activity was inhibited by methanol, ethanol, isopropanol, trichloromethan, citric acid and ascorbic acid as well as some metal ions such as Ca2+, Hg2+and Ba2+, but was activated by Co2+and Pb2+.
Key words: coriander leaves; polyphenol oxidase; isolation and purification; characterization
doi:10.7506/spkx1002-6630-201507020
中图分类号:Q946.5
文献标志码:A
文章编号:1002-6630(2015)07-0105-06
*通信作者:唐云明(1960—),男,教授,博士,主要从事蛋白质与酶工程研究。E-mail:tbright@swu.edu.cn
作者简介:孙才云(1988—),男,硕士研究生,主要从事蛋白质与酶工程研究。E-mail:suncai1237@126.com
基金项目:重庆市科委重点攻关项目(CSTC2011AB1027)
收稿日期:2014-06-19