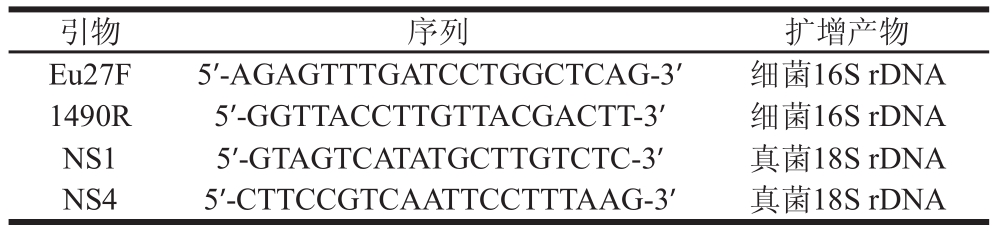
表1 16S rDNA、18S rDNA PCR扩增引物序列表
Table 1 Primers uused for PCR amplification of 16S rDNA and 18S rDNA
蒋云露1,王 猛1,常 伟2,李明元1,王 卫3,马 力1,饶 瑜1,*
(1.西华大学食品与生物工程学院,四川 成都 610039;2.通威集团三文鱼研究所,四川 都江堰 611800;3.成都大学生物产业学院,四川 成都 610106)
摘 要:研究传统风吹肉在整个生产过程的不同阶段中微生物的种类、优势菌群及其数量变化情况。选用7 种培养基对不同加工阶段风吹肉样品中的不同微生物进行分离纯化,并对其进行16S或18S rDNA分子生物学鉴定,鉴定得到加工过程存在于样品肉中的优势微生物9 种,其中细菌7 种和真菌2 种。结果表明:在传统风吹肉生产过程中,料泡引起 微生物大量死亡后,风吹肉样品中的各类微生物总数在风吹前10 d持续上升,在中后期达到稳定。以乳酸乳球菌(Lactococcus lactis)为主的乳酸菌是川味风吹肉风吹过程中的主要优势菌群,其次是以巴氏葡萄球菌(Staphylococcus pasteuri)为主的葡萄球菌,汉逊德巴利酵母(Debaryomyces hansenii)和解脂耶氏酵母(Yarrowia lipolytica)次之。此外,芽孢杆菌(Bacillus spp.)和水生拉恩菌(Rahnella aquatilis)为川味风吹肉制作过程中的主要腐败菌,但随着风吹过程显著减少。
关键词:风吹肉;菌群动态变化;优势微生物;16S rDNA;18S rDNA
风吹肉制品,是人们世代相传发展起来的传统肉类制品,具有加工简易、风味独特、便于贮藏等特点,深受广大消费者的喜爱。风吹肉香味浓郁、色泽金黄或红棕、咸鲜适口,是我国南方冬季长期贮藏的腌肉制品。而其作为一种传统手工制作的肉制品,必须对其工艺进行改良才能适应现代工业化生产的需要。开展风吹肉中微生物种类、数量的动态变化研究是改进传统加工工艺、控制产品质量、推动传统手工加工向现代化生产转变的客观需要[1]。
风吹肉制品制作过程中,微生物发酵是影响风吹肉制品成熟度、口感风味的重要环节。发酵不成熟的产品在贮藏过程中极易发生腐败变质,不仅造成经济损失,滋生的一些腐败微生物更是会对消费者的健康构成威胁。目前,对传统腌腊肉制品的微生物特性、风味形成机理、风味调控技术、风味成分等问题的研究成果表明,火腿、发酵香肠等中等水分含量的传统腌腊肉制品中的常见微生物有乳酸菌、葡萄球菌、微球菌、霉菌、酵母等[2-3]。本研究采用分子生物学方法,对风吹肉不同发酵时期的微生物进行分离鉴定,了解产品在发酵过程中微生物的动态变化,为推动传统风吹肉制品加工的转型提供基础数据。
1.1 材料、培养基与试剂
四川省雅安市某公司提供传统风吹肉生产工艺中不同阶段的肉样,包括:a.新鲜原料肉;b.料泡1 d后的肉;c.料泡1 d风吹2 d后的肉;d.风吹10 d的肉;e.风吹20 d的肉;f.风吹30 d的成品肉。
MRS 琼脂培养基、M17琼脂培养基、PCA培养基、虎红琼脂培养基、结晶紫中性红胆盐琼脂(VRBA)培养基、强化梭菌琼脂培养基、甘露醇氯化钠琼脂培养基、麦芽汁培养基 北京奥博兴生物科技有限公司。
DNA Marker、Taq DNA连接酶、dNTP、基因组提取试剂盒、基因组纯化试剂盒 天根生化科技(北京)有限公司;RNase A 美国Sigma公司。
1.2 仪器与设备
台式冷冻离心机 美国Beckman公司;聚合酶链式反应(polymerase chain reaction,PCR)仪、凝胶成像系统 美国Bio-Rad公司;电泳仪 北京六一仪器厂;立式压力蒸汽灭菌锅 上海申安医疗器械厂。
1.3 方法
1.3.1 菌株分离
用无菌剪刀剪取a~f样品各10 g,分别与90 mL无菌生理盐水混合,超声波振荡30 min。分别吸取100 μL的混合液涂布到MRS、M17、PCA、虎红、VRBA、强化梭菌及甘露醇氯化钠固体培养基上。涂布好后至于相应温度(MRS、M17、PCA、VRBA、强化梭菌培养基于37 ℃,虎红琼脂于30 ℃,甘露醇氯化钠琼脂于35 ℃)培养箱中培养24~48 h,参照GB 4789.15—2010《食品微生物学检验 霉菌和酵母计数》对菌落进行计数,并记录菌落形态。
1.3.2 菌株的鉴定
对不同形态的菌落进行计数并挑取接种于相应液体培养基中,相应温度下摇床培养24~48 h,得到浓度约106CFU/mL的菌液。采用相应基因组提取试剂盒,对各菌株培养液进行总基因组的提取,于1.0%琼脂糖凝胶电泳检验结果。细菌样品以各基因组为模版,以Eu27F和1490R为引物,扩增条件:95 ℃ 5 min,95 ℃ 1 min,50 ℃ 1 min,72 ℃ 2 min,35 个循环;72 ℃ 10 min,进行16S rDNA片段的扩增。真菌样品以NS1和NS4 为18S rDNA扩增引物,扩增条件:94 ℃ 3 min;94 ℃ 30 s,40 ℃ 1 min,72 ℃ 1 min,30 个循环;72 ℃10 min,进行18S rDNA片段的扩增。扩增产物经胶回收纯化后送上海华津生物科技有限公司进行测序,有关引物序列见表1。
表1 16S rDNA、18S rDNA PCR扩增引物序列表
Table 1 Primers uused for PCR amplification of 16S rDNA and 18S rDNA

测序序列于NCBI GenBank Database中进行BLAST比对,并使用MEGA 5.0构建系统发育树。
2.1 风吹肉加工过程中微生物总数的变化
有研究发现,四川腊肉、自然风干发酵香肠以及培根火腿中的微生物种类主要有:酵母菌、乳酸菌、葡萄球菌、产气荚膜梭菌以及肠杆菌等[4-6]。因此本实验选择了相应培养基对其进行分离筛选。选择MRS与M17培养基用于乳酸菌的分离筛选,虎红培养基用于真菌类的分离筛选,VRBA培养基用于肠道菌群微生物的分离筛选,强化梭菌培养基用于分离筛选梭菌类,甘露醇氯化钠培养基用于分离筛选葡萄球菌。
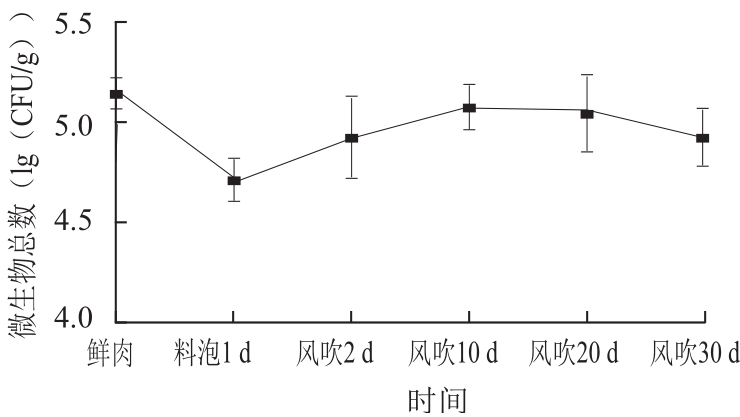
图1 风吹肉生产过程中微生物总数变化
Fig.1 Microbial amounts in meat samples during air-drying process
由图1可知,新鲜肉中的微生物总数为5.16(lg(CFU/g)),在料泡结束时微生物总数急剧减少到最低值。风吹肉酱料的盐含量一般为8%~10%,在鲜肉料泡过程中,酱料的高盐浓度形成高渗环境,造成微生物脱水死亡,泡料后微生物总数降为4.72(lg(CFU/g))。陈美春等[4]也报道在四川腊肉生产过程中,腌制会使鲜肉中的微生物数量降低1~2 个数量级。产品料泡结束后立即将样品放在室外风吹,料泡过程中存活的微生物及外界环境中附着到肉上的微生物开始大量繁殖,微生物总数量随着风吹时间延长而逐渐增加。在风吹初期(前10 d),微生物数量增长较快,达到5.08 (lg(CFU/g));风吹10~20 d,微生物数量相对平稳;风吹后期(20~30 d),微生物数量有所下降,为4.93 (lg(CFU/g))。
2.2 风吹肉生产过程中不同培养基上的微生物数量
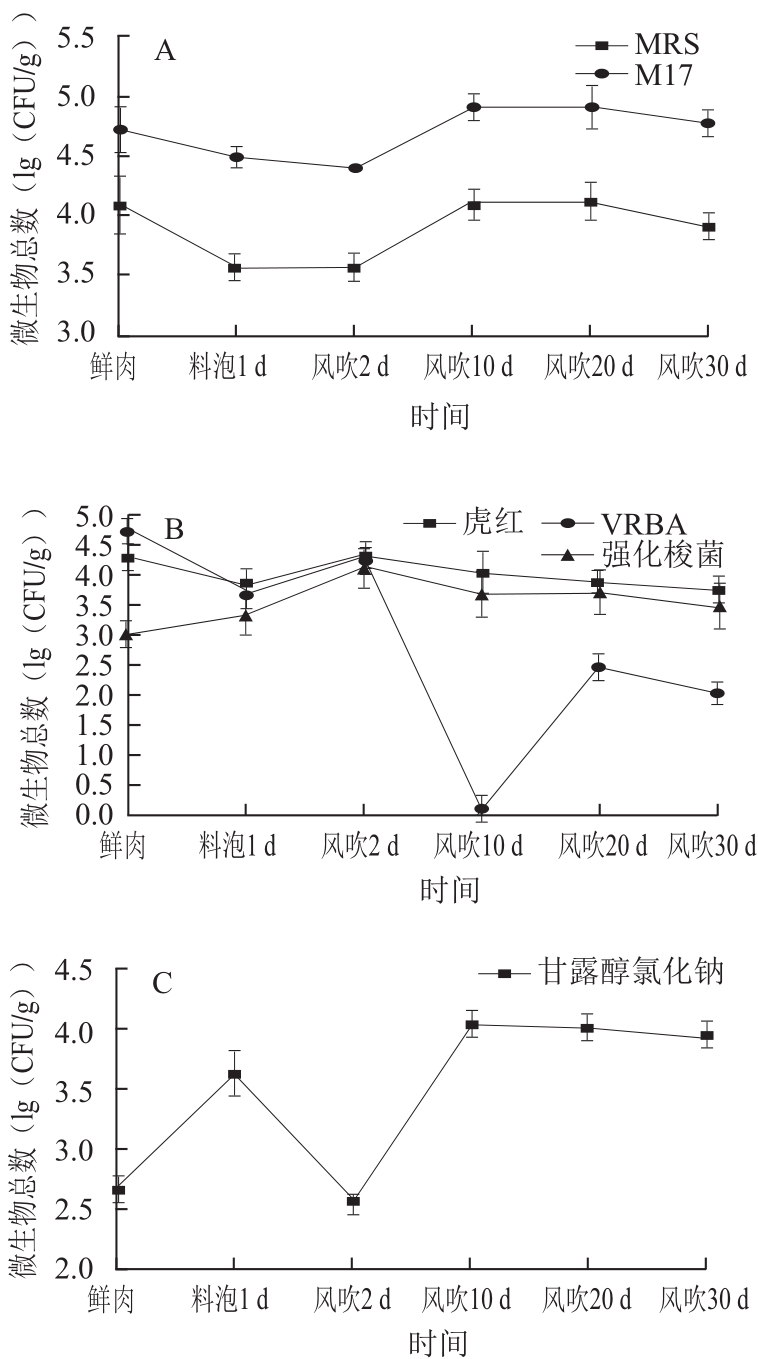
图2 风吹肉生产过程中不同培养基上的微生物总数
Fig.2 Microbial amounts in different media during air-drying process
由图2A可知,MRS、M17培养基中的微生物总数即乳酸菌数变化趋势类似。在料泡过程中,2 种培养基上的乳酸菌数从最初的4.10、4.72 (lg(CFU/g))分别降至3.58、4.48 (lg(CFU/g))。风吹前2 d,微生物总数保持一个较稳定的状态,在风吹2~10 d时出现了上涨的趋势,在第10天分别达到:4.10 (lg(CFU/g))(MRS)、4.91 (lg(CFU/g))(M17)。乳酸菌数逐渐增多成为优势菌群,同时分泌大量乳酸等代谢产物,改变产品风味口感的同时也会一定程度上抑制其他微生物的生长,乳酸菌对食品的保护作用主要是由于一些活性代谢产物的生成,比如有机酸(乳酸、醋酸、甲酸、丙酸、丁酸等),可通过降低体系的pH值来抑制其他微生物生长[7]。风吹中期(风吹10~20 d),两种平板上的乳酸菌数量均保持基本稳定的状态,而在风吹后期(风吹20~30 d),这两种平板上的微生物数量均呈现下降趋势,分别从4.11 (lg(CFU/g))(MRS)和4.90 (lg(CFU/g))(M17)下降至3.90 (lg(CFU/g))(MRS)和4.78 (lg(CFU/g))(M17)。
由图2B可知,虎红培养基、VRBA培养基、强化梭菌培养基这3 种培养基中的微生物总数在料泡及风吹前期的变化趋势类似。由于料泡时使用的酱料含盐量高,高渗环境会使微生物细胞大量脱水死亡,因此虎红培养基和VRBA培养基上的微生物总数分别从最初的4.30、4.78 (lg(CFU/g))迅速降至3.86、3.73 (lg(CFU/g))。料泡结束到风吹2 d之间,微生物重新开始大量繁殖,微生物总数呈现上升趋势,3 种培养基上的细菌均增加为4.36 (lg(CFU/g))(虎红)、4.29 (lg(CFU/g))(VRBA);4.13(lg(CFU/g))(强化梭菌)。一段时间后其生长所需某些营养成分消耗殆尽,加之受到乳酸菌等优势菌种所产生的抑制作用,其数量开始逐渐下降,分别降至4.08 (lg(CFU/g))(虎红)、0 (lg(CFU/g))(VRBA)、3.66 (lg(CFU/g))(强化梭菌)。在风吹后期(风吹20~30 d)这3 种培养基上的细菌或真菌数量均基本保持稳定。
由图2C可知,甘露醇氯化钠培养基中的微生物总数变化情况较为特殊,这是因为一些葡萄球菌能够耐受高浓度的盐含量。因此在料泡过程中,其他菌群的生长均受到抑制,而葡萄球菌被抑制程度则较弱。葡萄球菌在腌制过程中的变化趋势与陈美春等[4]的结论一致。在酱料腌制过程中,葡萄球菌的数量呈现一个上升的趋势,逐步增加达到3.62 (lg(CFU/g))。风吹前2 d,由于真菌、肠道菌、梭菌的增加,形成了种间竞争,从而破坏了葡萄球菌的生长趋势,使葡萄球菌的数量呈现下降状态。在之后的风吹初期,真菌、肠道菌、梭菌的数量逐渐减少,种间竞争也逐渐减弱,这使得葡萄球菌的数量再一次出现增长趋势,达到4.04 (lg(CFU/g)),赵俊仁等[5]在自然发酵风干肠发酵3~6 d时,也曾发现葡萄球菌出现增长的情况。在风吹10~30 d的过程中,葡萄球菌的数量呈连续缓慢下降状态,最终达到3.90 (lg(CFU/g))。
2.3 优势菌株的分离与菌落形态
筛选出在风吹肉加工过程中一直存在或者在某些阶段数量较多的菌种,对其进行更进一步的分离鉴定,挑选菌株形态如表2所示。
表2 挑取菌株的菌落形态
Table 2 Colony morphology of selected strains
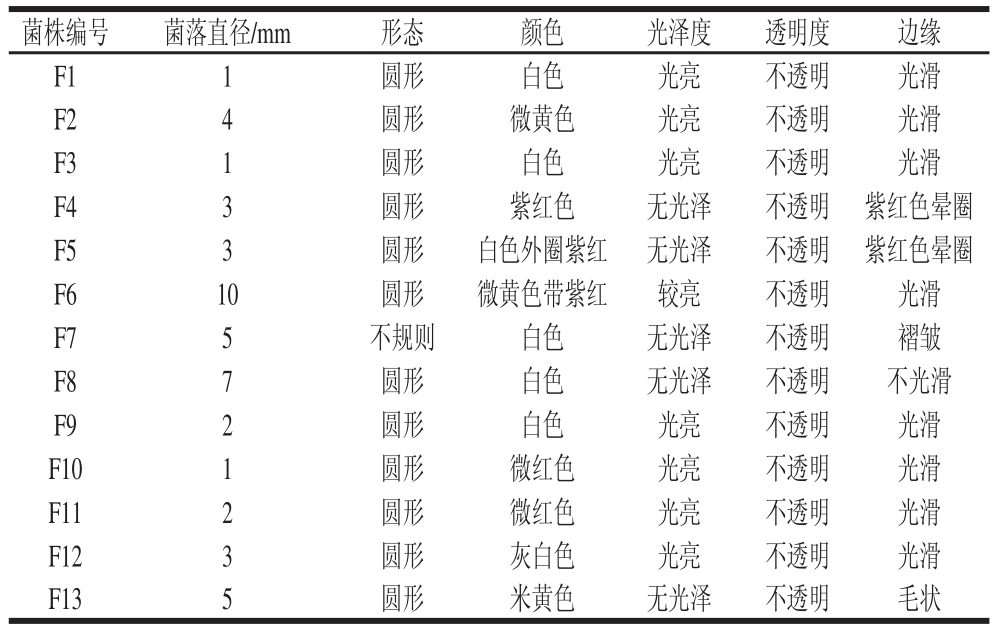
在各种培养基上各挑取1~2 个典型单菌落来进行鉴定。其中,真菌在前期用虎红培养基进行分离,后期点种到麦芽汁培养基上进行形态观察。M17培养基上挑取菌株F1,PCA培养基上挑取菌株F2、F3,强化梭菌培养基上挑取菌株F4、F5、F6,VRBA培养基上挑取菌株F7、F8,甘露醇氯化钠培养基上挑取菌株F9、F10、F11,麦芽汁培养基上挑取菌株F12、F13。
2.4 生产过程中优势菌株的鉴定

图3 细菌(A)和真菌(B、C)总基因组电泳图
Fig.3 Gel electrophoresis of genome DNA of bacteria (A) and fungi (B, C)
由图3可知,对细菌及真菌总基因组进行电泳,条带清晰,与Marker进行比较后可以发现,样品条带处于15 000 bp以上,因此可以确定总基因组提取成功。图4A、4B分别表示16S rDNA PCR及18S rDNA PCR扩增电泳图,可以看出样品条带均处于1 000~2 000 bp之间。16S rDNA扩增片段约为1 540 bp,18S rDNA扩增片段约为1 800 bp,因此可以确定16S rDNA PCR及18S rDNA PCR扩增成功。
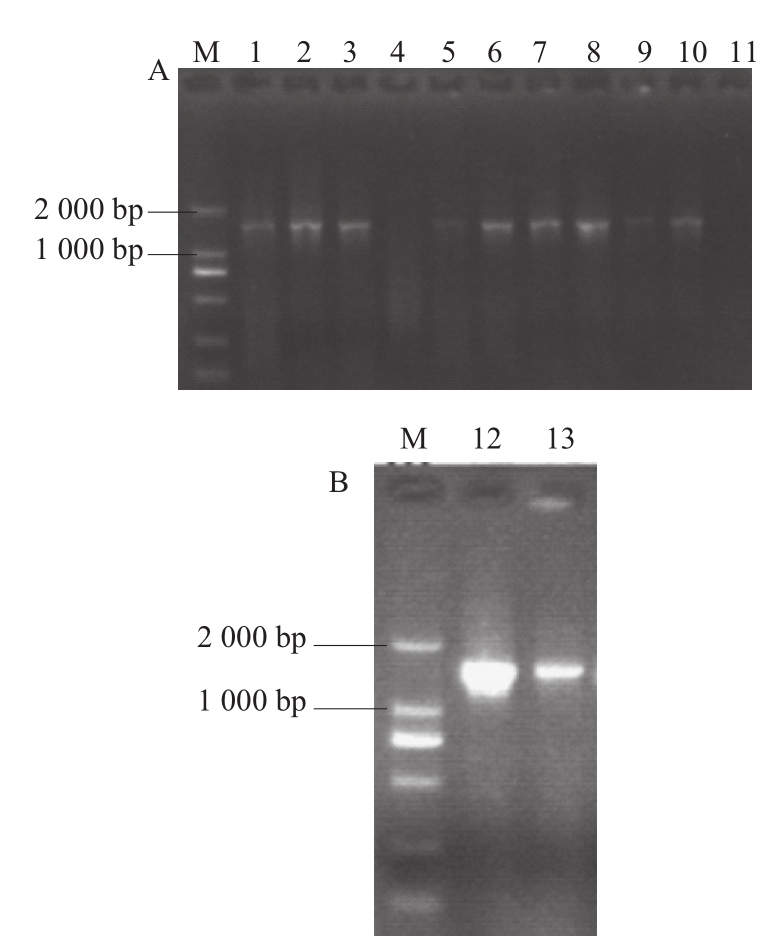
图4 16S rDNA(A)和18S rDNA(B)PCR扩增电泳图
Fig.4 Gel electrophoresis of PCR-amplified products of 16S rDNA (A) and 18S rDNA (B)
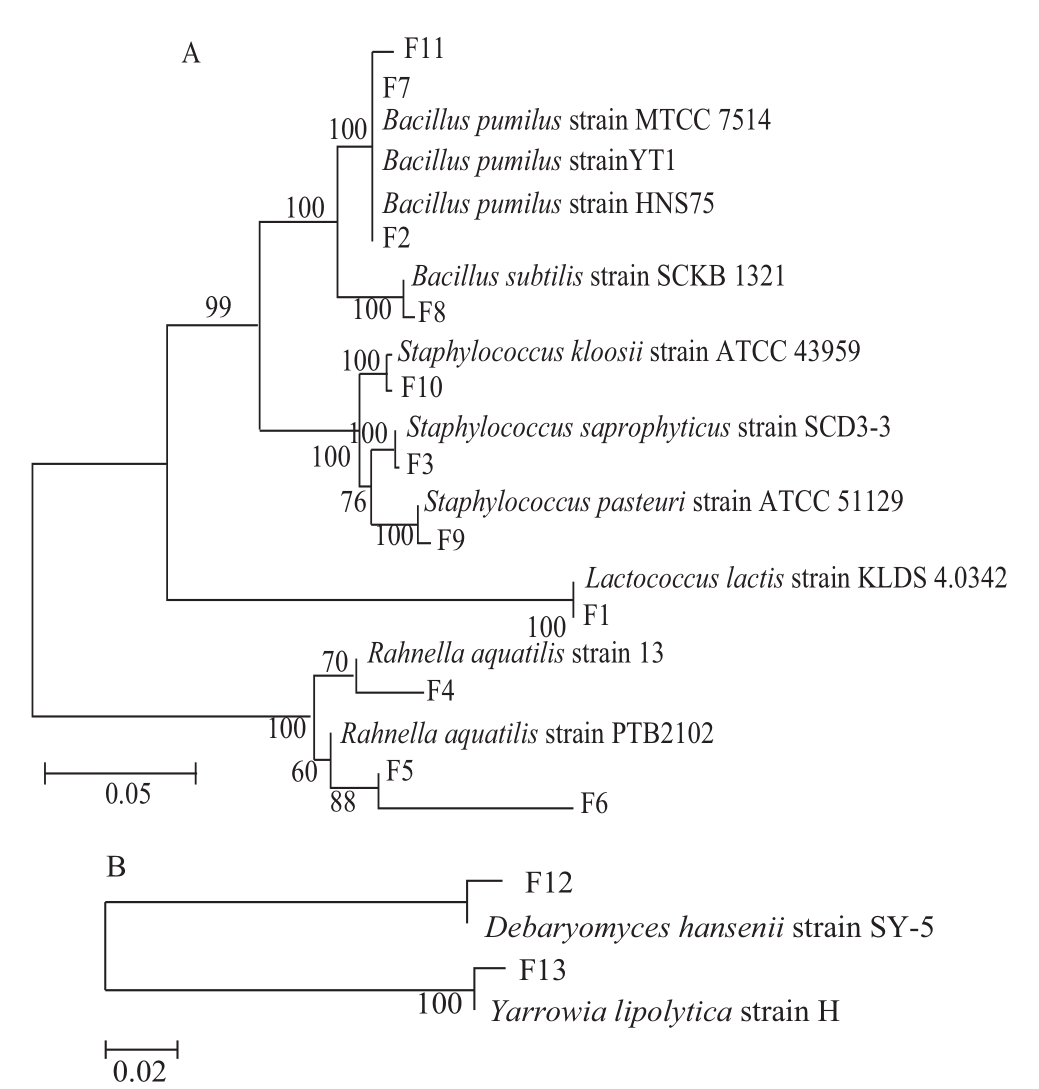
图5 细菌(A)和真菌(B)系统发育树
Fig.5 Phylogenetic trees of bacteria (A) and fungus (B)
菌株测序结果经BLAST比对后构建系统发育树如图5所示。分析可知F2、F7及F11菌为短小芽孢杆菌(Bacillus pumilus),F8菌为枯草芽孢杆菌(Bacillus subtilis),F10菌为克氏葡萄球菌(Staphylococcus kloosii),F3菌为腐生葡萄球菌(Staphylococcus saprophyticus),F9菌为巴氏葡萄球菌(Staphylococcus pasteuri),F1菌为乳酸乳球菌(Lactococcus lactis),F4、F5及F6菌均为水生拉恩菌(Rahnella aquatilis),F12菌为汉逊德巴利酵母(Debaryomyces hansenii),F13为解脂耶氏酵母(Yarrowia lipolytica)。这些微生物在风吹肉制作过程中的数量变化如图6所示。

图6 不同微生物在风吹肉生产过程中的数量变化
Fig.6 Microbial amounts in different cultures of meat samples during air-drying process
作为许多食品自然发酵过程中的优势菌群,乳酸菌被认为是安全的[8],同时其作为发酵剂也在制作发酵蔬菜、乳制品和肉制品等食品的过程中发挥着重要的作用[9-10]。由图6A可知,在整个风吹肉加工过程中,乳酸乳球菌基本处于优势地位。在料泡阶段,乳酸乳球菌受到高浓度盐的影响,数量迅速下降50%;在风吹初期(前10 d),乳酸乳球菌总体呈现一个先下降后上升的趋势,乳酸乳球菌适应新的环境开始重新生长繁殖,达到4.73(lg(CFU/g))。在风吹中期及后期(风吹10~30 d),乳酸乳球菌的数量在基本维持恒定的情况下稍有下降,最终降至4.72 (lg(CFU/g))。乳酸菌的数量变化情况与赵俊仁等[5]在风吹发酵肠过程中得出的结果类似,其研究得出,在自然风吹发酵肠的生产过程中,乳酸菌在风吹前3 d呈现上升趋势,而在之后的3~10 d则出现下降的趋势。
图6B为3 种葡萄球菌——巴氏葡萄球菌、克氏葡萄球菌、腐生葡萄球菌在风吹肉生产过程中的数量变化情况。其中最主要的是巴氏葡萄球菌,克氏葡萄球菌次之,腐生葡萄球菌数最少。在料泡过程中,巴氏葡萄球菌和腐生葡萄球菌数量急剧下降,而克氏葡萄球菌则增加至3.43 (lg(CFU/g))。这可能是因为克氏葡萄球菌对盐浓度的耐受能力较高,也可能是因为酱料中本身就带有这种菌体,从而引入到了肉制品中。在风吹前2 d,巴氏葡萄球菌数量迅速回升,从3.08 (lg(CFU/g))增加至4.13 (lg(CFU/g)),在风吹2~10 d的过程中开始下降,降到3.65 (lg(CFU/g)),而克氏葡萄球菌此期间逐渐成为优势葡萄球菌,并维持在4 (lg(CFU/g))。Kung等[11]曾在金枪鱼腊肠中分离得到巴氏葡萄球菌,Bermúdez等[12]也曾从传统香肠中分离得到了巴氏葡萄球菌和腐生葡萄球菌。
图6C为汉逊德巴利酵母和解脂耶氏酵母在风吹肉的加工过程中的变化情况。在料泡过程中,解脂耶氏酵母由于受到酱料高盐浓度的影响,数量开始下降,减少量达到2.90 (lg(CFU/g))。而汉逊德巴利酵母变化状况则与之相反,在风吹前两天呈现一定的上升趋势,这可能是由酱料引入的,同时汉逊德巴利酵母的耐盐性较高,而解脂耶氏酵母受盐浓度的影响相对更敏感[13]。而在之后的风吹过程中(2~30 d),汉逊德巴利酵母的数量则总体趋于减少的情况。从风吹2 d时的3.91 (lg(CFU/g))减少至最终的3.48 (lg(CFU/g))。解脂耶氏酵母的数量在风吹前20 d缓慢增加(从2.90(lg(CFU/g))增加至3.20 (lg(CFU/g))),在风吹后10 d又缓慢下降(从3.20 (lg(CFU/g))降至3.08(lg(CFU/g))),在整个风吹过程中,解脂耶氏酵母的数量基本保持恒定的状态。这与秦丹等[14]在四川香肠加工贮藏过程中所发现的酵母变化情况类似,在加工贮藏后期,酵母数量基本不改变。
图6D显示的是短小芽孢杆菌、枯草芽胞杆菌以及水生拉恩菌在风吹肉生产过程中的数量变化情况。有报道称,芽孢杆菌会在一定条件下引起软包装肉的变质[15]。料泡阶段使短小芽孢杆菌和水生拉恩菌急剧减少,但短小芽孢杆菌在风吹前2 d数量有所上升,风吹中后期其数量回落至2.78 (lg(CFU/g))。因此,芽孢杆菌是风吹肉加工过程中需要防控的主要腐败微生物。已有文献报道在腌腊肉制品加工过程中腐败或病原微生物数量有所下降的情况[16-17],如金黄色葡萄球菌、单增李斯特氏菌等病原菌在腊肉、培根等的加工或贮藏过程中有显著减少的现象。
在肉品腌制过程中,由于微生物代谢活动降低了pH值,使肉品得以保存同时改变了原料的质地、气味、颜色和成分,并赋予产品良好的风味[4]。有报道称,乳酸菌是最早从发酵肉制品中分离出来的微生物,是发酵肉制品中的优势菌种。乳酸菌可以利用碳水化合物产生乳酸而使pH值降低,产酸率高,耐酸性较强。乳酸菌可抑制一些致腐微生物生长、减少腐败、稳定产品的质量并提高产品的货架期,改善肉制品的组织结构,促进发色,降低亚硝酸盐残留量[18]。微生物代谢亮氨酸生成3-甲基丁醛,与含硫化合物反应,可产生类似培根的风味;其中葡萄球菌可代谢亮氨酸生成3-甲基丁醛,3-甲基丁醛对人类的感觉阈值很低,对发酵肉制品的典型风味有重要影响,可作为产香性能的量化指标[19]。酵母菌有时可以促进发酵后肉制品的风味形成,还可以对腌腊肉制品本身的红色起到一定的稳定作用[13]。此外,酵母还可提高发酵肉制品中氨含量,并降低其中的乙酸和乳酸含量[20]。
本实验结果表明,在料泡过程中除了由酱料引入或对盐浓度有较高耐受性的克氏葡萄球菌、汉逊德巴利酵母以及枯草芽孢杆菌外,其他菌株的生长均受到较大的抑制。经过料泡后,微生物重新开始大量繁殖,乳酸乳球菌是最主要的优势菌种,其次是葡萄球菌(尤其以巴氏葡萄球菌占主导),酵母菌(汉逊德巴利酵母和解脂耶氏酵母)次之。乳酸菌在改变产品风味的同时,一定程度上抑制了其他微生物的生长。虽然在风吹肉制作前期有一定数量的腐败菌芽孢杆菌和条件致病菌水生拉恩菌,随着料泡和风吹过程的进行却逐渐降低,但仍然需要在今后的加工过程中引起重视,加强生产过程中各个关键控制点的管理,采取相应手段控制腐败微生物的生长,避免对消费者的身体健康造成伤害。
参考文献:
[1]刘洋. 腊肉加工和贮藏期间菌相变化和理化变化[D]. 北京: 中国农业大学, 2005: 1-3.
[2]贺稚非, 甄宗圆, 李洪军, 等. 金华火腿发酵过程中微生物区系研究[J].食品科学, 2008, 29(1): 190-195.
[3]HOLM E S, SCHÄFER A, KOCH A G, et al. Investigation of spoilage in saveloy samples inoculated with four potential spoilage bacteria[J]. Meat Science, 2013, 93(3): 687-695.
[4]陈美春, 杨勇, 石磊. 四川腊肉生产过程中理化及微生物特性的研究[J]. 食品科学, 2008, 29(5): 149-156.
[5]赵俊仁, 纪玉刚, 孔保华, 等. 自然发酵风干肠生产过程中微生物变化及理化性质的分析[J]. 食品科技, 2010, 35(1): 137-140.
[6]JACKSON A L, SULLIVAN G A, KULCHAIYAWAT C, et al. Survival and growth of clostridium perfringens in commercial nonitrite-or-nitrite-added (nitrite and oranic) bacon and ham[J]. Journal of Food Protection, 2011, 74(3): 410-416.
[7]樊星, 张昊, 郭慧媛, 等. 乳酸菌抑菌功能的研究进展[J]. 中国乳业, 2012(9): 52-54.
[8]GANGULY N K, BHATTACHARYA S K, SESIKERAN B, et al. ICMR-DBT guidelines for the evaluation of probiotics in food[J]. Indian Journal of Medical Research, 2011, 134(1): 22-25.
[9]DEVLIEGHERE F, VERMEIREN L, DEBEVERE J. New preservation technologies: possibilities and limitations[J]. International Dairy Journal, 2004, 14(4): 273-285.
[10]LOZO J, JOVCIC B, KOJIC M, et al. Molecular characterization of a novel bacteriocin and an unusually large aggregation factor of Lactobacillus paracasei subsp. paracasei BGSJ2-8, a natural isolate from homemade cheese[J]. Current Microbiology, 2007, 55(3): 266-271.
[11]KUNG H F, TSAI Y H, CHANG S C, et al. Biogenic amine content, histamine-forming bacteria, and adulteration of pork in tuna sausage products[J]. Journal of Food Protection, 2012, 75(10): 1814-1822.
[12]BERMÚDEZ R, LORENZO J M, FONSECA S, et al. Strains of Staphylococcus and Bacillus isolated from traditional sausages as producers of biogenic amines[J]. Frontiers in Microbiology, 2012, 3: 1-6.
[13]NIELSEN D S, JACOBSEN T, JESPERSEN L, et al. Occurence and growth of yeasts in processed meat products-implications for potential spoilage[J]. Meat Science, 2008, 80(3): 919-926.
[14]秦丹. 四川腊肉加工和贮藏过程中微生态系统的RAPD分析[D]. 雅安: 四川农业大学, 2011: 16.
[15]孙翠焕, 王艳华, 朱万芹, 等. 肉制品腐败变质原因分析[J]. 微生物学杂志, 2011, 31(3): 106-109.
[16]TAORMINA P J, DORSA W J. Survial and death of Listeria monocytogenes on cooked bacon at these storage temperatures[J]. Food Microbiology, 2010, 27(5): 667-671.
[17]刘德雄. 防腐剂对粤式腊肉中金黄色葡萄球菌的抑制研究[D]. 广州: 华南理工大学, 2011: 1-5.
[18]MONTEL M C, TALON R, CANTONNET B M. Effects of starter cultures on the biochemical characteristics of French dry sausages[J]. Meat Science, 1993, 35(2): 229-240.
[19]杨勇, 张雪梅, 程艳, 等. 四川香肠产香葡萄球菌的分离与鉴定[J].食品与发酵工业, 2011, 37(6): 29-34.
[20]DURÁ M A, FLORES M, TOLDRÁ F. Effect of Debaryomyces spp. on the proteolysis of dry-fermented sausages[J]. Meat Science, 2004, 68(2): 319-328.
JIANG Yunlu1, WANG Meng1, CHANG Wei2, LI Mingyuan1, WANG Wei3, MA Li1, RAO Yu1,*
(1. School of Food and Biotechnology, Xihua University, Chengdu 610039, China; 2. Institute of Salmon, Tongwei Group Co. Ltd., Dujiangyan 611800, China; 3. Faculty of Biological Industry, Chengdu University, Chengdu 610106, China)
Abstract: The microbial population, diversity and dynamics of traditional air-drying meat during different processing stages were assessed. Seven culture media were used to separate different microorganisms from different air-drying meat samples. Nine species were selected as dominant microorganisms including seven species of bacteria and two species of fungi. 16S rDNA or 18S rDNA analysis was employed for species identifi cation. The results showed that following the microbial growth inhibition during the salted process, the population of different microbial communities in meat samples increased gradually during the fi rst 10 days and reached a stable level at the later stages of air-drying processing. Lactic acid bacteria based on Lactococcus lactis dominated the air-drying process, followed by Staphylococcus pasteuri, Debaryomyces hansenii and Yarrowia lipolytica. Furthermore, Bacillus spp. and Rahnella aquatilis were the major spoilage bacteria, but their amounts decreased signifi cantly during the air-drying processing. This study can provide a useful guidance for starter culture screening and safety control of traditional air-drying meat.
Key words: air-dried meat; microbial dynamics; dominant microorganisms; 16S rDNA; 18S rDNA
doi:10.7506/spkx1002-6630-201507021
中图分类号:TS251.5
文献标志码:A
文章编号:1002-6630(2015)07-0111-06
*通信作者:饶瑜(1982—),女,副教授,博士,研究方向为食品微生物。E-mail:ryfish@163.com
作者简介:蒋云露(1991—),女,硕士研究生,研究方向为食品工程。E-mail:jiangyl0104@hotmail.com
基金项目:肉类加工四川省重点实验室开放基金项目(13-R09);西华大学“西华杯”大学生科技创新项目(2014136);西华大学研究生创新基金项目(ycjj2014142)
收稿日期:2014-06-30