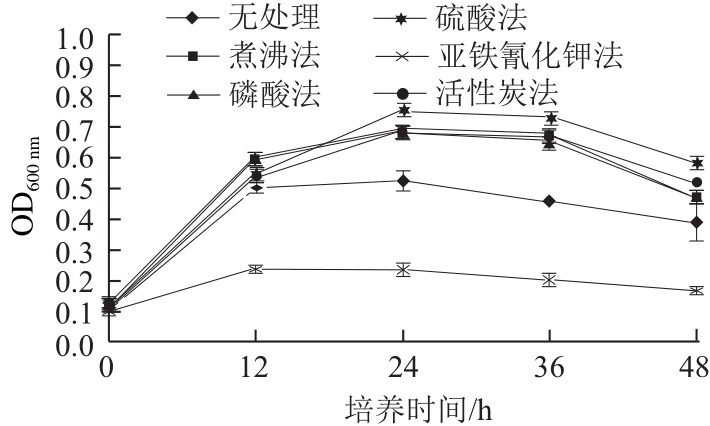
图1 糖蜜预处理方法对CM2生长的影响
Fig.1 Effect of molasses pretreatment on biomass production of CM2
蔡子康,王晓霞,秦晓杰,杨 蓉,司琳媛,肖红梅*
(南京农业大学食品科技学院,江苏 南京 210095)
摘 要:以葡萄有孢汉逊酵母CM2为研究对象,细胞生物量为测定指标,利用甘蔗糖蜜作为发酵原料,对糖蜜培养基的优化进行较为全面的探讨。采用煮沸法、磷酸法、硫酸法、活性炭法、亚铁氰化钾法对糖蜜进行预处理,结果表明硫酸处理法优于其他处理方法。通过单因素试验研究糖蜜质量浓度、氮源及其添加量、初始pH值、磷酸盐、硫酸镁、氯化钠等培养基组分对CM2生长的影响;采用Plackett-Burman试验设计、最陡爬坡试验和中心组合试验设计对培养基组分进行优化,得到优化培养基组分:预处理后糖蜜78.9 g/L、酵母粉2.2 g/L、初始pH 6.0。通过验证实验获知与PDB培养基相比,优化后糖蜜培养基使CM2生物量提高了83.1%。
关键词:葡萄有孢汉逊酵母;甘蔗糖蜜;Plackett-Burman试验设计;培养基;生物量
酵母菌是一种单细胞真核微生物,是子囊菌、担子菌等单细胞真菌的统称[1]。酵母菌适宜生长在含糖量较高的偏酸性(pH 4.0~7.0)环境中,其本身含有大量的蛋白质和丰富的维生素,营养要求不高,能够迅速生长[2]。在利用拮抗酵母菌发酵生产菌体及代谢产物时,培养基组分和配比对酵母菌的生长、发育、代谢以及发酵生产工艺有很大的影响,因此选择合适的培养基成分及优化培养基显得尤为重要。废糖蜜是制糖业的一种主要副产物,价格低廉,含有丰富的适宜酵母菌生长的营养成分,总糖和蔗糖含量均很高,是发酵生产酵母菌的良好原料,现已作为一种生产原料被广泛用于发酵领域[3]。利用甘蔗糖蜜作为碳源规模化培养酵母菌,具有重要意义。
葡萄有孢汉逊酵母(Hanseniaspora uvarum)CM2是本实验室从草莓果实上分离筛选获得的拮抗酵母菌,前期的研究表明其对草莓[4]和葡萄[5-6]果实采后病害具有良好的抑制效果,具有良好的商业化前景。拮抗酵母菌商业化的发展受生产成本的影响,而生产成本很大程度上来源于发酵培养基。因此,优化发酵培养基是从实验室到商业化生产的必要环节[7-8]。目前的研究表明,在优化微生物培养基的方法中,Plackett-Burman法和响应面法(response surface methodology,RSM)取得了良好的效果,其中Plackett-Burman法可以从多因子中筛选出主要影响因子,而RSM法通过对显著因子的优化评价,可快速有效地确定最佳条件[9]。本实验以CM2为研究对象,以甘蔗糖蜜为培养基碳源,研究糖蜜预处理方法及糖蜜培养基各组分对CM2生长的影响,最后利用Plackett-Burman和RSM法对培养基各组分进行优化,为发酵工艺提供数据参考。
1.1 菌种与培养基
供试菌株葡萄有孢汉逊酵母(Hanseniaspora uvarum)CM2为本课题组从草莓果实表面分离鉴定并培养保存[4]。
PDB培养基:马铃薯200.0 g/L,葡萄糖20.0 g/L,121 ℃灭菌20 min。PDA培养基:马铃薯200.0 g/L,葡萄糖20.0 g/L,琼脂17 g/L,121 ℃灭菌20 min。糖蜜发酵培养基:将未处理或预处理的甘蔗糖蜜稀释至适宜浓度,并按实验要求加入相关成分,121 ℃灭菌20 min。
1.2 仪器与设备
HVE-50自动灭菌锅 日本Hirayama有限公司;SWCJ-ID型单人净化工作台 苏州净化设备有限公司;Nikon显微镜 日本尼康公司;SPX-150B-Z型生化培养箱 上海博讯实业有限公司医疗设备厂;HZQ-F160型全温振荡培养箱 太仓市实验设备厂;GL-21MC高速冷冻离心机 湘潭湘仪仪器有限公司;HH-6数显恒温水浴锅 常州国华电器有限公司;紫外-可见分光光度计 北京莱伯泰科仪器有限公司。
1.3 方法
1.3.1 供试菌种的培养
从4 ℃保存菌种中挑取菌落,在PDA培养基上划线,28 ℃条件下培养48 h,分离单菌落,活化两代,将拮抗酵母菌从PDA斜面上挑取一环菌体转接于含有100 mL PDB培养基的250 mL三角瓶中, 28 ℃、180 r/min条件下摇床培养18 h,做种子液。将培养好的种子液按2%接种量接入装液量为100 mL的250 mL三角瓶中,在28 ℃、180 r/min条件下培养,每3 h测定600 nm波长处的光密度(OD600 nm)值,以未接种的酵母液体培养基校正紫外-可见分光光度计的零点。以测定的OD600 nm为纵坐标,以培养时间为横坐标,绘制酵母菌的生长曲线。由于发酵液浓度较大,需要适当稀释后测定,以下实验同。
1.3.2 糖蜜的预处理方法比较
对照:糖蜜用去离子水(1∶1,m/m,下同)稀释后,离心,取上清液。
煮沸法:糖蜜用去离子水稀释后,加热煮沸20 min,离心,取上清液。
磷酸法:糖蜜用去离子水稀释后,加热煮沸,加浓磷酸至pH 2.0~3.0,静置过夜离心,取上清液加入新配制的石灰乳回调至pH 6.0左右,65~70 ℃保温30 min,加0.8%活性炭,离心,取上清液。
硫酸法:糖蜜用去离子水稀释后,再加硫酸,调pH 2.0~3.0,95~100 ℃加热 20 min,静置过夜离心,取上清液加入新配制的石灰乳回调至pH 6.0左右,65~70 ℃保温30 min,加0.8%活性炭,离心,取上清液。
亚铁氰化钾法:糖蜜用去离子水稀释后,加0.1%亚铁氰化钾,调节酸碱度至pH 6.5,煮沸30 min后,同时加1%活性炭,离心,取上清液。
活性炭法:糖蜜用去离子水稀释后,加1%颗粒炭吸附处理,离心,取上清液。
糖蜜中总糖及还原糖含量测定:总糖含量测定参照SB/T 10203—1994《果汁通用试验方法》,将糖蜜样品稀释后用浓盐酸处理,处理组直接用滴定法测总糖含量;还原糖含量采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)比色法测定[10]。
将预处理后的糖蜜稀释至质量分数为5%,按2%接种量将种子液接入装液量为100 mL的250 mL摇瓶中,28 ℃、180 r/min条件下每隔12 h测定酵母菌OD600 nm值。
选取糖蜜预处理效果最好的方法,测定拮抗酵母菌生长曲线。
1.3.3 培养基组分筛选单因素试验
1.3.3.1 糖蜜质量浓度筛选
将硫酸法处理后的糖蜜用去离子水稀释,调整糖蜜质量浓度分别为40、50、60、70、80、90 g/L,作为培养基。按2%接种量将酵母菌种子液接入250 mL三角瓶中,28 ℃、180 r/min条件下培养24 h后测定发酵液OD600 nm值,比较不同糖蜜质量浓度对拮抗酵母菌生长的影响。
1.3.3.2 初始pH值筛选
分别用1 mol/L NaOH或1 mol/L HCl调整拮抗酵母菌液体培养基的pH值为4、5、6、7、8。按1.3.3.1节中的接种量和培养条件实验,以考察初始pH值对拮抗酵母菌生长的影响。
1.3.3.3 氮源筛选
加入不同氮源(鱼蛋白胨、胰蛋白胨、酵母粉、硫酸铵、硝酸钾、尿素),在不同添加量(0、0.5、1.0、2.0、3.0、4.0 g/L)的条件下,按1.3.3.1节中的接种量和培养条件进行实验,以考察不同氮源对酵母菌生长的影响。
1.3.3.4 无机盐筛选
按1.3.3.1节中的接种量和培养条件,分别选KH2PO4和K2HPO4质量浓度均为0.5、1.0、1.5、2.0、2.5 g/L;MgSO4质量浓度为0.00、0.01、0.02、0.03、0.04、0.05 g/L;NaCl质量浓度为1.0、2.0、3.0、4.0、5.0 g/L。考察无机盐对酵母菌生长的影响。
1.3.4 多种试验设计法优化糖蜜培养基
1.3.4.1 Plackett-Burman试验设计
采用Design-Expert进行Plackett-Burman试验设计,每个因素取高低2 个水平,分别以“+1”和“-1”表示,试验因子高低水平的选取以单因素试验结果为参考。接种量和培养条件同1.3.3.1节。
1.3.4.2 最陡爬坡试验设计
由Plackett-Burman试验设计筛选出对拮抗酵母菌生长的主要影响因子,根据回归方程中各因子回归系数大小及正负确定最陡爬坡的方向和步长,一般爬坡步长为Plackett-Burman试验设计步长的1/3~1 倍[11]。接种量和培养条件同1.3.3.1节。
1.3.4.3 中心组合试验设计
在最陡爬坡试验结果的基础上,采用具有旋转性的中心组合试验对显著因素进行优化,每个因素取3个水平,以“-1”、“0”、“+1”编码。接种量和培养条件同1.3.3.1节。
1.3.5 拮抗酵母菌菌数的检测
拮抗菌酵母的总菌数采用血球计数板进行观察、统计。拮抗酵母菌活菌数用稀释平板法记数,即将不同浓度梯度的菌液在PDA上铺板,放置28 ℃条件下培养48 h后统计菌落个数[12]。
1.3.6 拮抗酵母菌生物量的测定
1.3.6.1 细胞干质量法
取发酵液10 mL,6 000 r/min离心10 min,用蒸馏水洗涤沉淀3 次,所得酵母菌在105 ℃烘箱烘干至恒质量,称质量,换算成每毫升发酵液的菌体量,即为细胞生物量[13]。
1.3.6.2 比色法
在600 nm波长处测发酵液的光密度值,以未接种的酵母液体培养基作参照[14]。
1.3.7 验证实验
分别采用PDB培养基、无预处理糖蜜培养基、预处理糖蜜培养基及优化后的糖蜜培养基进行拮抗酵母菌摇瓶发酵实验,比较拮抗酵母菌在不同培养基中的生长情况,验证优化结果的可靠性。
1.4 数据分析
采用Design-Expert和SAS软件进行Plackett-Burman和中心组合试验设计与数据统计,通过ANOVA方式,采用Duncan’s multiple range tests对不同处理之间的差异性在α=0.05水平上进行分析。
2.1 糖蜜预处理方法对拮抗酵母菌生长的影响
糖蜜成分复杂,含有重金属离子、黑色素、胶体等不利于发酵的物质[15],因此糖蜜不能直接用于发酵,需要先进行预处理,提高还原糖含量以利于酵母菌的生长。经测定,糖蜜处理前总糖含量为43.7%,还原糖含量为20.4%;硫酸法预处理后总糖含量为34.1%,还原糖含量为29.5%。由此可知,糖蜜经过预处理后还原糖含量明显提高,有利于酵母菌的生长发酵。 由图1可知,硫酸处理方法均优于其他处理方法。这是因为在糖蜜中加入硫酸,一方面可以分解胶体物质,另一方面也可将多糖转化为酵母菌直接利用的单糖,促进其生长代谢;此外,硫酸法处理糖蜜在用加石灰乳回调pH值时可生成大量的石膏,过滤后得到澄清糖液[16],便于酵母菌的生长。

图1 糖蜜预处理方法对CM2生长的影响
Fig.1 Effect of molasses pretreatment on biomass production of CM2
2.2 拮抗酵母菌生长曲线
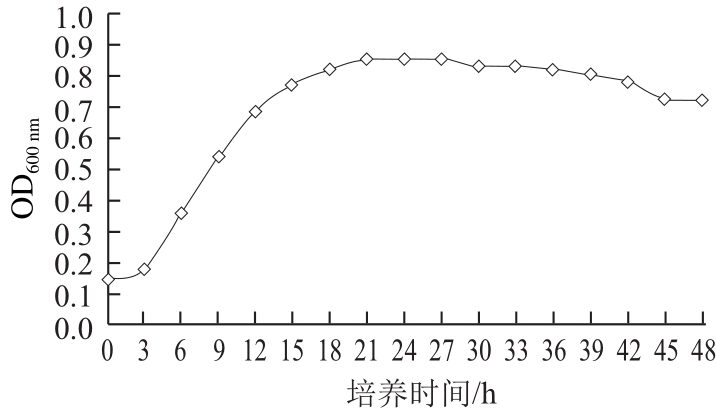
图2 拮抗酵母菌生长曲线
Fig.2 Growth curve of the antagonistic yeast CM2
由图2可知,CM2在糖蜜培养基中延滞期很短,3~12 h为指数生长期,此阶段细胞分裂速率快,酵母个数呈几何级数生长状态,12~21 h处于减速时期,酵母菌细胞数目虽然增加,但增加速率减缓,到21 h时CM2细胞数目达到最高值,21 h后生长处于稳定期,细胞数目基本保持不变。在后续实验中,选择细胞生物量比较稳定的时间作为培养时间,故选择CM2培养时间为24 h。
2.3 单因素试验筛选培养基组分
2.3.1 糖蜜质量浓度筛选
由图3可知,糖蜜质量浓度为60~70 g/L时,菌体生物量较大。考虑生产原料节约利用原则,在后续实验中选择60~70 g/L作为CM2生长最适糖蜜质量浓度。
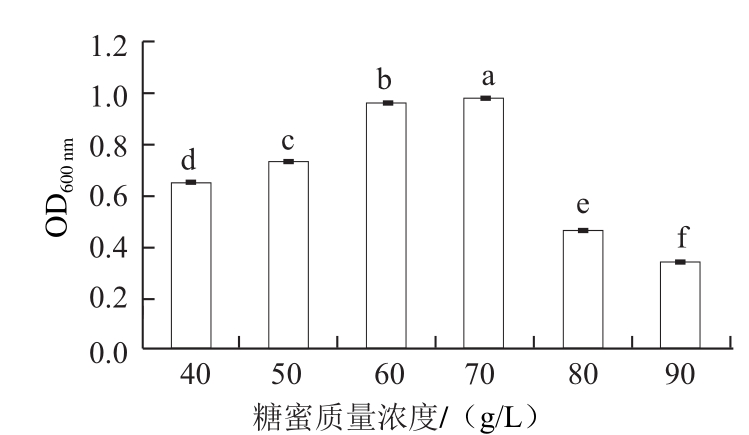
图3 糖蜜质量浓度对拮抗酵母菌生长的影响
Fig.3 Effect of molasses concentration on the growth of the antagonistic yeast
小写字母不同表示差异显著(P<0.05)。下同。
2.3.2 初始pH值筛选
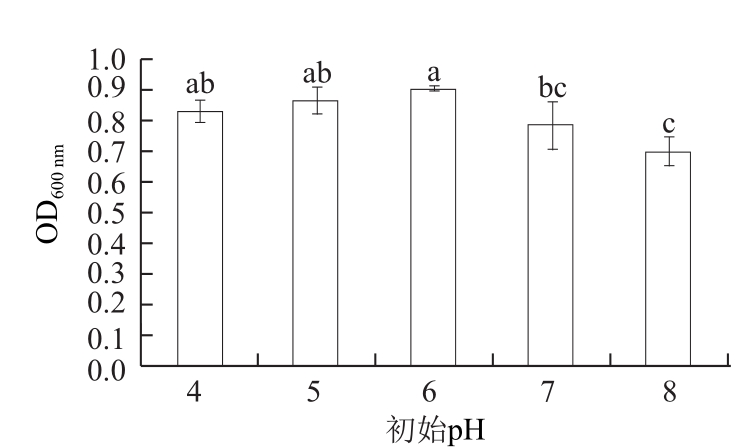
图4 初始pH值对拮抗酵母菌生长的影响
Fig.4 Effect of initial pH on the growth of the antagonistic yeast
培养基pH值通过影响酵母细胞对培养基营养基质的利用效率进而影响酵母菌的生长代谢[17-18]。由图4可知,CM2对较宽的pH值范围都具有良好的适应性,CM2在pH值略偏酸性的培养基中生长状况较好,且pH 5.0和pH 6.0基本无差异(P>0.05)。
2.3.3 氮源筛选
表1 不同种类氮源对CM2生长的影响
Table 1 Effect of different nitrogen sources on the growth of CM2
OD600 nm

注:同列大写字母不同表示不同氮源间差异显著(P<0.05),同行小写字母不同表示不同添加量间差异显著(P<0.05)。表4同。
甘蔗糖蜜中所含氮源可部分被酵母菌利用,但其含氮量一般不足以满足酵母菌生长的需要,通常都需要额外添加氮源以满足菌体的生长[19-20]。由表1可知,有机氮源比无机氮源更有利于CM2酵母菌的生长。在相同添加量下,有机氮源中酵母粉的加入对酵母菌增殖作用最大,与其他几种氮源相比差异显著(P<0.05)。无机氮源中只有硝酸钾的加入使其生物量有小幅度的增加,而硫酸铵和尿素的加入反而对酵母菌的生长有所抑制;从添加量上分析,酵母粉添加量为1.0 g/L时,培养液的OD600 nm值最大,随着添加量的增大,OD600 nm值反而下降。综合考虑,后续优化中选酵母粉的添加量在0.5~1.0 g/L较适宜。
2.3.4 磷酸盐筛选
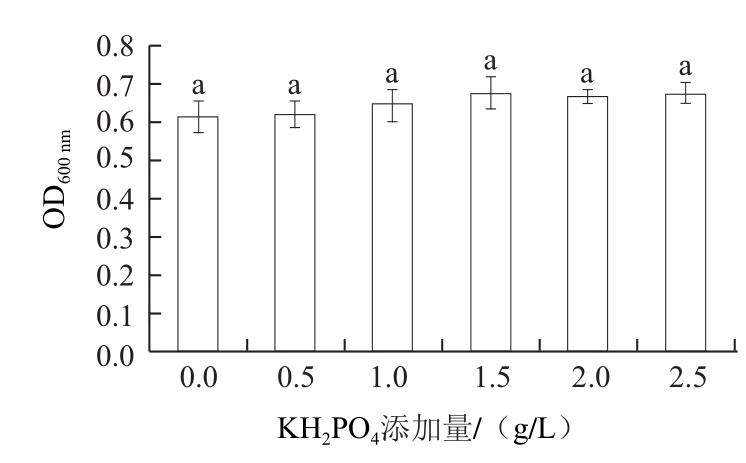
图 55 KKHH2PPOO4对拮抗酵母菌生长的影响
Fig.5 Effect of KH2PO4on the growth of the antagonistic yeast
由图5可知,KH2PO4的加入未使酵母菌生物量有显著增加(P>0.05),故糖蜜培养基中不需要额外加KH2PO4。
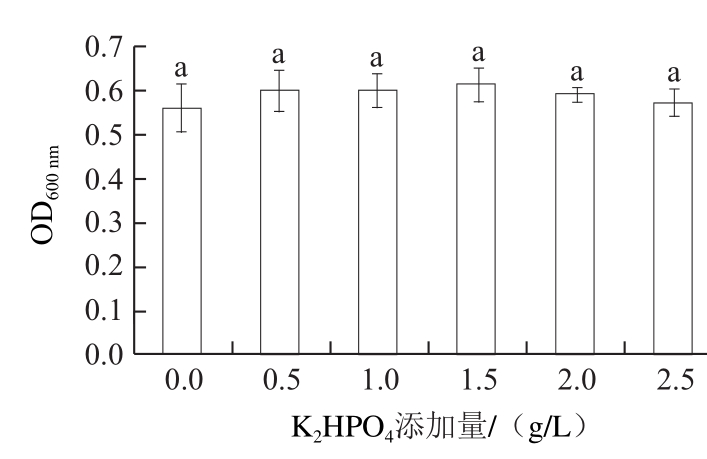
图 66 KK2HHPPOO4对拮抗酵母菌生长的影响
Fig.6 Effect of K2HHPPOO4on the growth of the antagonistic yeast
由图6可知,糖蜜培养基中加入K2HPO4后,未使酵母菌生物量有明显增加(P>0.05),故糖蜜培养基不需要额外加入K2HPO4。
2.3.5 MgSO4添加量筛选
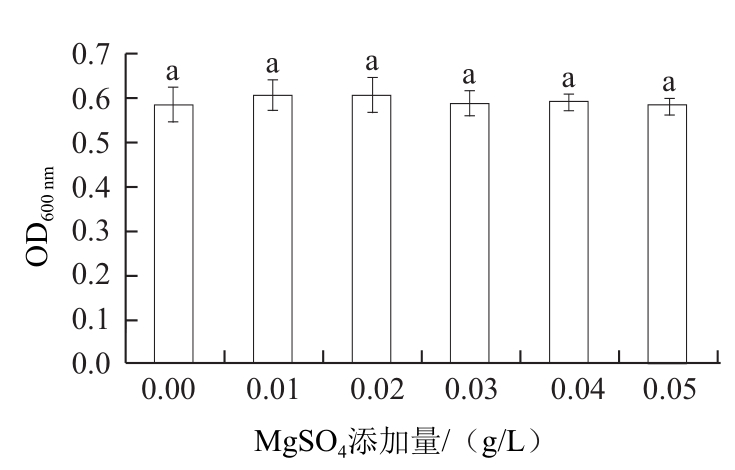
图7 MgSO4对拮抗酵母菌生长的影响
Fig.7 Effect of MgSO4on the growth of the antagonistic yeast
由图7可知,镁离子的添加没有使酵母菌的生物量显著增加(P>0.05),这说明糖蜜培养基中有足够的镁元素供酵母菌营养和代谢需要。
2.3.6 NaCl添加量筛选
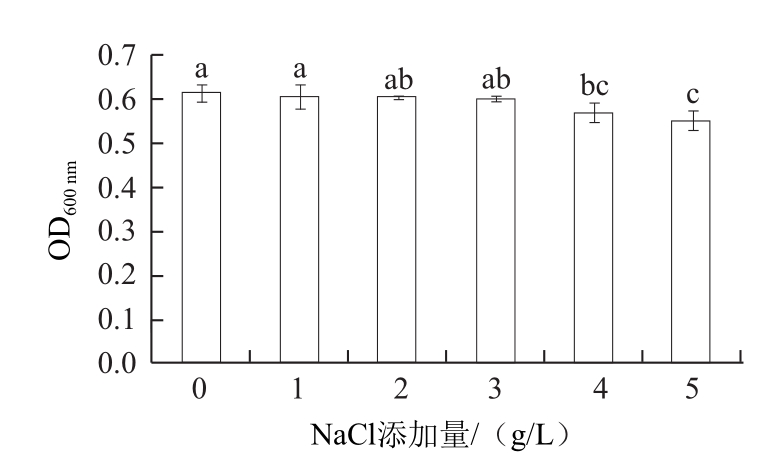
图8 NaCl对拮抗酵母菌生长的影响
Fig.8 Effect of NaCl on the growth of the antagonistic yeast
由图8可知,在NaCl添加量小于3.0 g/L时,酵母菌生长基本没有受到影响(P>0.05),当NaCl添加量大于3.0 g/L时,酵母菌生长受到抑制,生物量明显下降(P<0.05),故以此糖蜜作为碳源的酵母培养基发酵过程不需要额外添加钠离子。
2.4 糖蜜培养基优化
2.4.1 Plackett-Burman试验设计
表2 Plackett-Burman试验设计及响应值
Table 2 Plackett-Burman experimental design with Response values of CM2 biomass
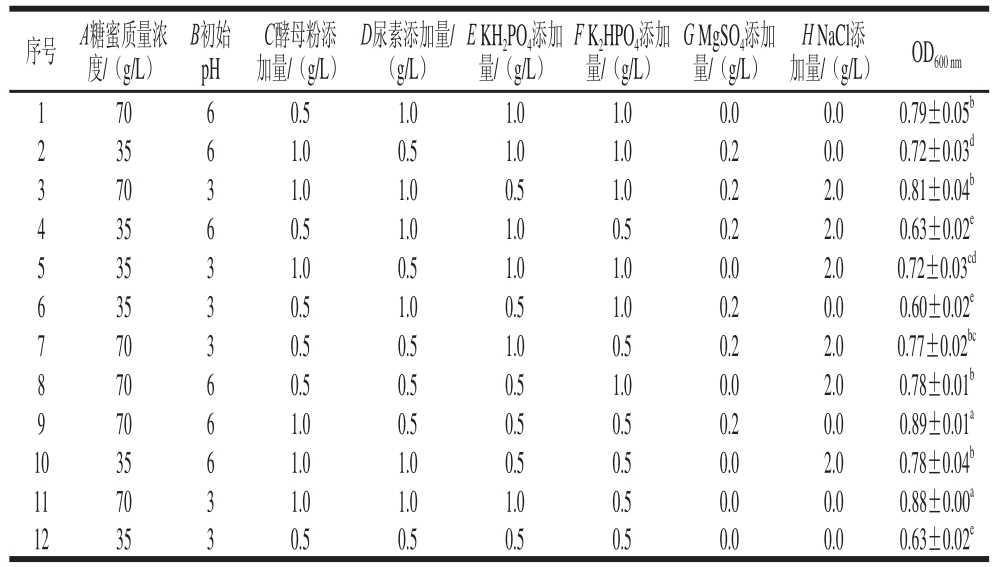
注:同列小写字母不同表示差异显著(P<0.05)。表5同。
表3 Plackett-Burman试验方差分析结果
Table 3 Analysis of variance for Response values of CM2 biomass from Plackett-Burman design
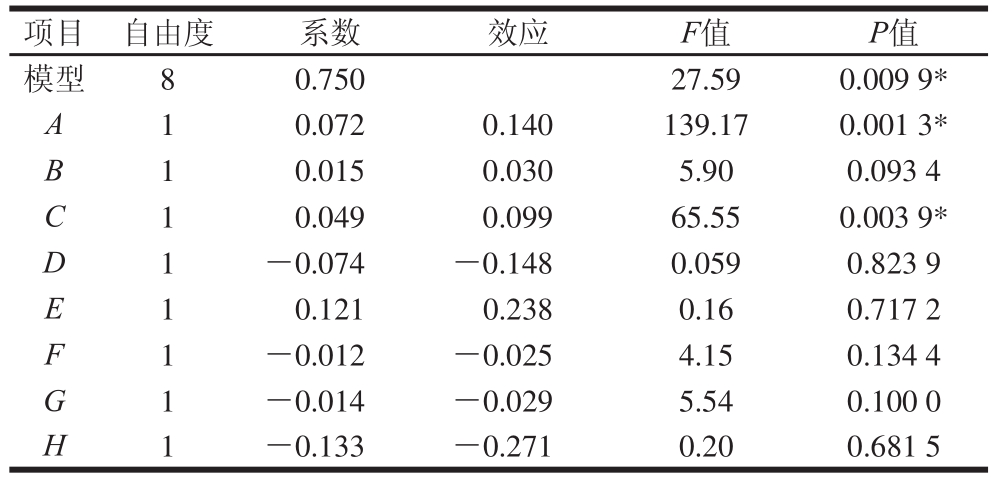
注:“*”表示该因子效应显著。
由表2、3可知,由Plackett-Burman试验设计得出糖蜜质量浓度和酵母粉添加量对CM2生物量的生成有显著影响(P<0.05),且均与CM2的生物量生成呈正相关,即随着这两个因素水平的增加,CM2生物量逐渐增加;其他各因素对结果影响并不显著(P>0.05)。通过回归分析,得到CM2的多元回归方程如下:
式中:Y为CM2生物量的预测值。该模型相关系数R2=0.986 6,R2Adj=0.950 8,说明试验中98.66%的变异可以由方程解释,模型拟合良好,具有很高的可靠性。
2.4.2 最陡爬坡试验设计
表4 最陡爬坡试验设计及结果
Table 4 Steepest ascent experimental design and results
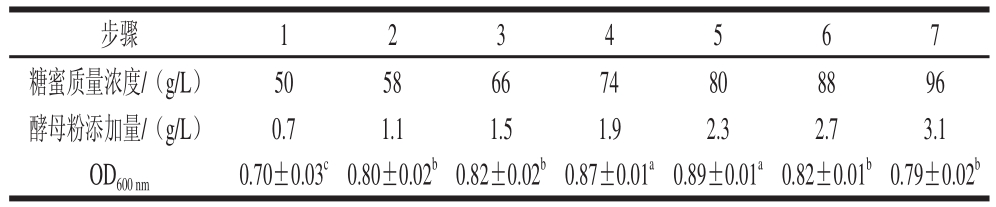
由表4可知,CM2在步骤4和步骤5的时候有最大的生物生成量,故选择这两个步骤中糖蜜质量浓度和酵母粉添加量的平均值作为中心组合试验设计的中心点。
2.4.3 中心组合试验设计
表5 中心组合试验设计及结果
Table 5 Central composite design (CCD) and results
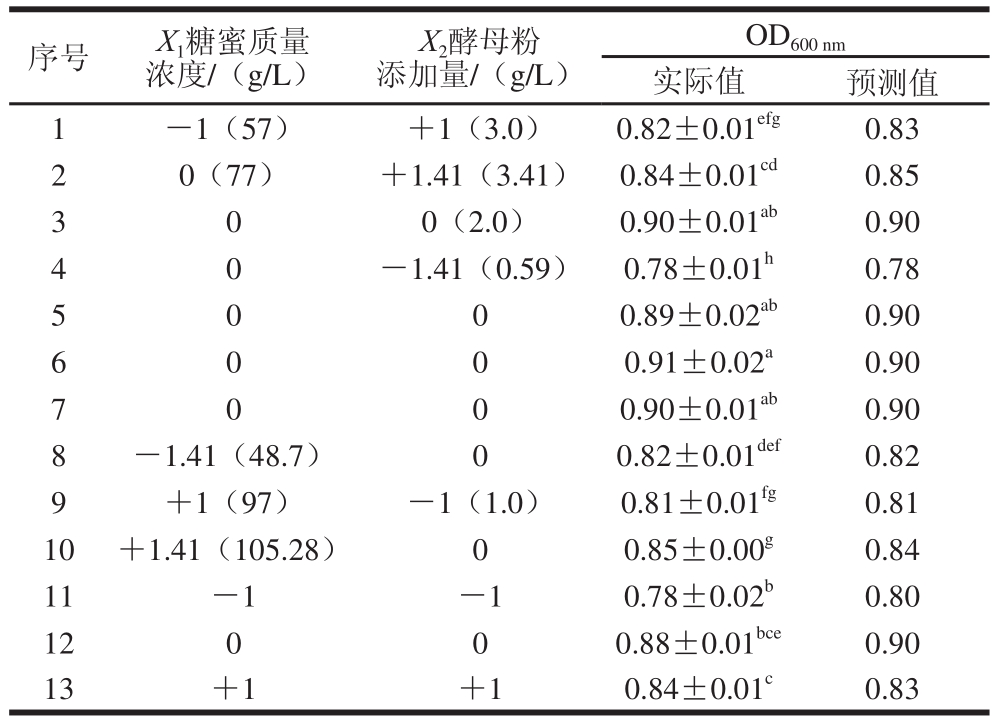
以CM2酵母生物生成量为响应值,依据表5设计中的试验结果,利用Design-Expert对结果进行二次回归分析,得到回归方程为:
由表6可知,模型达到极显著水平(P<0.01)。同时,一次项对结果影响显著(P<0.05),平方项对结果影响极显著(P<0.01),其中酵母粉添加量比糖蜜质量浓度对CM2的生物量影响更大。该模型的R2=0.968 9,R2=0.946 6,表明模型拟合度良好。
Adj
表6 中心组合试验方差分析
Table 6 Analysis of variance for the regression model
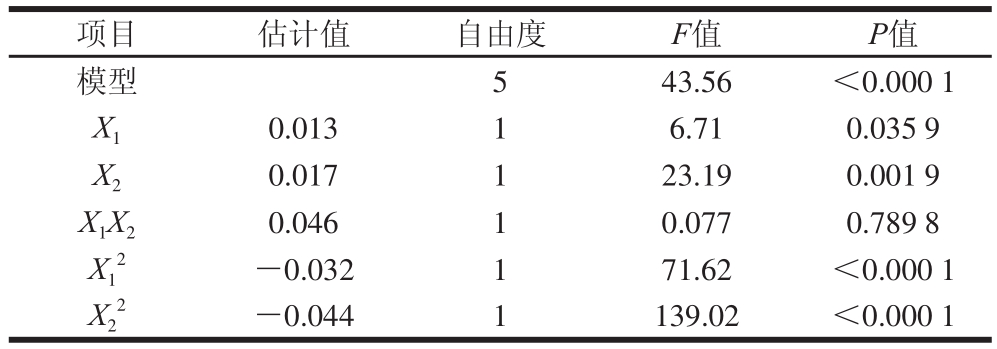
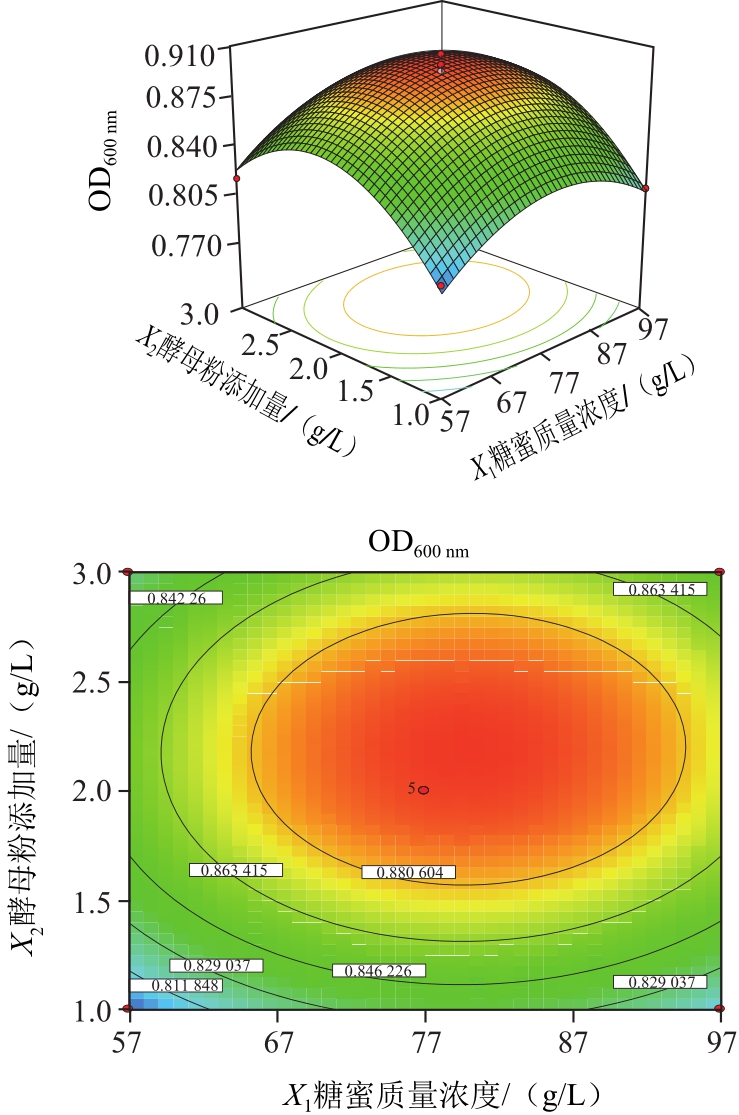
图9 响应面立体分析图和等高线图
Fig.9 Response surface and contour plots for the effect of yeast power and molasses concentration on the production of CM2 biomass
由图9可知,回归方程存在稳定点,即极大值点。通过岭嵴分析得到极大值所对应各因素(X1,X2)的编码值分别为(0.15,0.19),转化为实际条件即为糖蜜质量浓度(X1)78.9 g/L,酵母粉添加量(X2)2.2 g/L,在此条件下,CM2发酵液OD600 nm的预测值为0.90。
2.5 验证实验
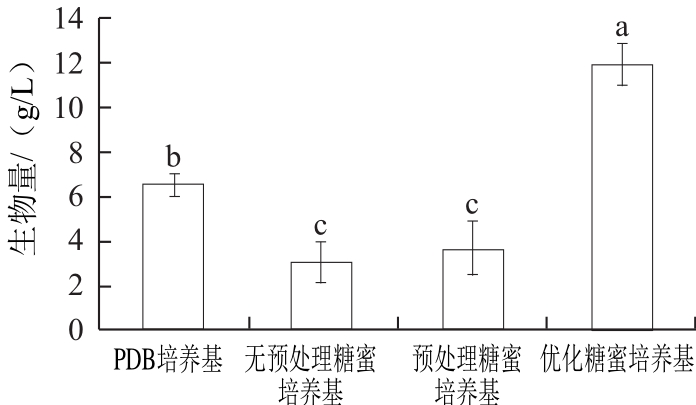
图10 不同培养基中拮抗酵母菌CM2的生物量
Fig.10 Biomass production of the antagonistic yeast in different culture media
由图10可知,优化后的糖蜜培养基大大提高了拮抗酵母菌的生物量。优化后糖蜜培养基CM2的生物量为(11.9±0.9) g/L,PDB培养基的生物量为(6.5±0.5) g/L,与PDB培养基比,优化后的糖蜜培养基使CM2生物量提高了83.1%。说明试验设计可靠,优化糖蜜培养基可作为下一步试验的基础培养基。
糖蜜作为碳源已成功应用于拮抗酵母Pichia anomala[21]、P. agglomerans[22]及Candida sake[23]的发酵生产过程。但目前还没有将糖蜜应用于拮抗酵母H. uvarum发酵生产的相关报道。在本实验中,硫酸预处理后的糖蜜作为碳源使酵母菌的生物量有了较大幅度的提升,这一结果与对Rhodosporidium paludigenum[13]及Blakeslea tripora[24]培养基优化的结果相类似。甘蔗糖蜜含氮量比较低(一般在0.4%~1.5%左右),而酵母粉中含有氨基酸、水溶性维生素、多肽及生长因子等多种营养成分,是许多微生物生长的良好氮源[25],在发酵工艺中发挥着重要的作用。本实验中,酵母粉对CM2具有良好的促进作用,并且通过响应面优化得出酵母粉的使用量均低于3 g/L,较低的酵母粉使用量也表明了其工业化生产的经济可行性。初始pH值是影响酵母菌生长的另一重要因素,本实验中单因素试验结果表明CM2对较宽pH值范围均具有良好的适应性,且在pH 6.0时生长的最好。通过响应面优化后,初始pH值的大小对CM2的生物量并未显示出显著影响,这是因为甘蔗糖蜜在用硫酸法预处理时最终的pH值是调至6.0左右的,本实验中所用的甘蔗糖蜜价格低廉,优化后的糖蜜培养基相对实验室常用的PDB培养基成本低,甘蔗糖蜜的使用不仅提高了酵母菌的生产量,同时也降低了生产成本,便于工业规模化生产。
参考文献:
[1]王美霞, 贺银凤. 与乳酸菌具有共生作用酵母菌培养基的优化[J].农产品加工: 学刊, 2013(20): 5-9.
[2]明儒成, 聂海玲, 封新平. 一种新组分酵母菌培养基的研制及应用[J].生物技术, 2008, 18(2): 49-51.
[3]汤艳, 郭亭, 杜腾飞, 等. 响应面法优化甘蔗糖蜜发酵产丁醇[J]. 生物加工过程, 2012, 10(5): 8-12.
[4]秦晓杰, 肖红梅, 罗凯, 等. 水杨酸结合拮抗酵母菌处理对冷藏草莓果实的抗性影响[J]. 食品科学, 2013, 34(18): 290-294. doi: 10.7506/spkx1002-6630-201318060.
[5]许皎姣. 拮抗酵母菌的筛选、鉴定及对葡萄冷藏品质的影响[D]. 南京: 南京农业大学, 2012: 53-58.
[6]索娜, 周海莲. 常温条件下拮抗酵母菌对葡萄果实的抗性诱导研究[J].食品工业科技, 2012, 33(22): 346-350.
[7]代志凯, 张翠, 阮征. 试验设计和优化及其在发酵培养基优化中的应用[J]. 微生物学通报, 2010, 37(6): 894-903.
[8]张广臣, 雷虹, 何欣, 等. 微生物发酵培养基优化中的现代数学统计学方法[J]. 食品与发酵工业, 2010, 36(5): 110-112.
[9]刘志祥, 曾超珍. 响应面法在发酵培养基优化中的应用[J]. 北方园艺, 2009(2): 127-129.
[10]牛春铃. 酒精酵母菌的高密度培养及其发酵性能的研究[D]. 南昌:南昌大学, 2008: 22-24.
[11]ABADIAS M, USALL J, TEIXIDÓ N, et al. Liquid formulation of the postharvest biocontrol agent Candida sake CAP-1 in isotonic solution[J]. Phytopathology, 2003, 93(4): 436-442.
[12]王友升. 酵母拮抗菌的抑病效力、规模化培养及相关机理研究[D].北京: 中国科学院, 2005: 17-19.
[13]王鹏. 海洋拮抗酵母菌Rhodosporidium paludigenum的培养基和发酵条件优化的研究[D]. 杭州: 浙江大学, 2011: 22-25.
[14]秦丹. 生防制剂在葡萄保鲜中的应用与抑菌机理研究[D]. 长沙: 湖南农业大学, 2007: 31-32.
[15]李志春. 磷酸法预处理对甘蔗糖蜜中还原糖含量的影响研究[J]. 食品科技, 2009, 34(12): 98-100.
[16]余炜, 伍时华, 代周兴, 等. 亮氨酸发酵用糖蜜预处理方法研究[J].广西工学院学报, 2005, 16(3): 16-18.
[17]张兴芳, 王荫榆. 重组大肠杆菌摇瓶发酵产环糊精葡基转移酶条件的优化[J]. 食品工业科技, 2007, 28(30): 188-193.
[18]彭景贤. 酵母菌对柑橘采后病害的生物防治及防治机理的研究[D].福州: 福建农林大学, 2006: 42-44.
[19]于景芝. 酵母生产与应用手册[M]. 北京: 中国轻工业出版社, 2005: 284-299.
[20]薛梦林. 拮抗菌对冬枣采后病害的生物防治[D]. 杨凌: 西北农林科技大学, 2006: 26-27.
[21]KAUR P, SATYANARAYANA T. Production of cell-bound phytase by Pichia anomala in an economical cane molasses medium: optimization using statistical tools[J]. Process Biochemistry, 2005, 40(9): 3095-3102.
[22]COSTA E, TEIXIDÓ N, USALL J, et al. Production of the biocontrol agent Pantoea agglomerans strain CPA-2 using commercial products and by-products[J]. Applied Microbiology and Biotechnology, 2001, 56(3/4): 367-371.
[23]ABADIAS M, TEIXIDO N, USALL J, et al. Optimization of growth conditions of the postharvest biocontrol agent Candida sake CPA-1 in a lab-scale fermenter[J]. Journal of Applied Microbiology, 2003, 95(2): 301-309.
[24]GOKSUNGUR Y, MANTZOURIDOU F, ROUKAS T. Optimization of β-carotene from molasses by Blakeslea trispora: a statistical approach[J]. Journal of Chemical Technology and Biotechnology, 2002, 77(8): 39-43.
[25]CHANDRASENA G, WALKER G M, STAINES H. Use of response surfaces to investigate metal ion interactions in yeast fermentations[J]. Journal of the American Society of Brewing Chemists, 1997, 55: 24-28.
CAI Zikang, WANG Xiaoxia, QIN Xiaojie,YANG Rong, SI Linyuan, XIAO Hongmei*
(College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Abstract: The composition of a sugarcane molasses-based medium used to culture Hanseniaspora uvarum CM2 was optimized for enhanced biomass production. The molasses was pretreated by boiling or adding phosphoric acid, sulfuric acid, potassium ferrocyanide and activated carbon, respectively. Comparing their impacts on the growth of the antagonistic yeast CM2, sulfuric acid addition was considered the method of choice. Molasses concentration, the type and concentration of nitrogen source, initial pH, phosphate, magnesium sulfate, and sodium chloride were studied for their influence on the biomass production of CM2 by single factor design. Plackett-Burman design and response surface methodology were used to optimize the medium components as pretreated molasses 78.9 g/L, yeast powder 2.2 g/L and initial pH 6.0. The optimal medium could result in an 83.1% enhancement in the biomass production of CM2.
Key words: Hanseniaspora uvarum; sugarcane molasses; Plackett-Burman experimental design; medium; biomass
doi:10.7506/spkx1002-6630-201507022
中图分类号:TS201.1
文献标志码:A
文章编号:1002-6630(2015)07-0117-07
*通信作者:肖红梅(1970—),女,副教授,博士,研究方向为农产品贮藏加工。E-mail:xhm@njau.edu.cn
作者简介:蔡子康(1989—),男,硕士研究生,研究方向为食品科学。E-mail:2013108039@njau.edu.cn
基金项目:江苏省科技计划项目(BE2010385)
收稿日期:2014-07-08