缺失ATP合酶和插入VHb基因对钝齿棒杆菌谷氨酸产量的影响
郑方亮,于 亮,牟晓丛,刘 鹏,刘宏生*
(辽宁大学生命科学院,辽宁 沈阳 110036)
摘 要:为了提高钝齿棒杆菌生产谷氨酸的产量,以谷氨酸生产菌钝齿棒杆菌(Corynebacterium crenatum)T6-13为出发菌株,利用同源重组技术使其缺失ATP合酶基因(atp)并进一步插入透明颤菌血红蛋白基因(VHb),得到两株重组菌株T6-13-Δatp和T6-13-Δatp-tac-VHb,通过检测重组菌株谷氨酸产量及生长情况可以看出,在发酵32 h后,atp基因缺失菌株较出发菌株谷氨酸产出累积量高27.76%,但atp基因缺失导致菌体生长缓慢且无法到达出发菌株稳定期浓度,而插入VHb基因的atp基因缺失菌株的谷氨酸产出累积量较出发菌株高36.91%,且菌体的生长速率及稳定期浓度与出发菌株基本一致。
关键词:钝齿棒杆菌;谷氨酸;ATP合酶;透明颤菌血红蛋白
谷氨酸是构成蛋白质的20 种常见氨基酸之一,在食品、医药、工业、农业等领域都有广泛应用,是世界上销量最大的一种重要氨基酸[1]。谷氨酸具有增香作用,可使食品味道更加浓郁、协调、圆润[2]。谷氨酸是中枢神经系统主要的兴奋性神经递质,在脑缺血造成的神经元损伤过程中发挥重要作用,其传导异常会导致精神分裂、认知障碍、运动障碍等[3-4]。在谷氨酸的工业生产中,影响其成本的关键因素是谷氨酸生产菌的生产效率。如今,关于谷氨酸发酵生产的研究主要致力于节能降耗、降低成本、改善生产及生态环境等几个方面[5];在日用品化妆品领域中,谷氨酸作为富脂剂或乳化助剂配入膏剂、漂洗剂等乳化制品中[6],而且谷氨酸及其制剂是优良的植物生长调节剂,主要用于促进禾本科植物及阔叶植物的生长[7];氨基酸铜络合物可用作杀菌剂[8]。
现代分子生物学技术的发展以及谷氨酸棒杆菌全基因组测序的完成,为构建优良的生产用谷氨酸高产菌株提供了可能。ATP合酶在生物体内用于ATP的合成,由atp基因编码,若atp基因缺失,将会阻断氧化磷酸化作用,从而导致碳和能量代谢的改变[9-10]。近年的研究表明糖酵解(glycolysis)途径中ATP合酶基因的缺失,可加速糖酵解速率,增大进入三羧酸(tricarboxylic acid,TCA)循环的碳流量,显著提高谷氨酸产量[11-12]。同时,研究发现ATP合酶的缺失虽然促进了细菌呼吸速率的增加及呼吸相关基因的表达,但菌体的生长速率有所下降[13]。
透明颤藻细菌血红蛋白(Vitreoscilla hemoglobin,VHb)是在透明颤菌中发现的[14]。透明颤菌是Tyree等[15]在20世纪70年代发现的一种专性好氧的革兰氏阴性丝状菌,能够在沼泽、腐烂植物等贫氧的环境中生长旺盛,并发现这种特性是由于该菌在贫氧的条件下能够产生一种可溶性血红蛋白,进一步的研究表明这种血红蛋白与真核生物血红蛋白具有高度的同源性和相似的生理功能。VHb是一种同源双亚基蛋白,每个亚基的相对分子质量为15 775,分别含有146 个氨基酸以及两个b型血红素辅基,其血红素上的亚铁原子能够与氧可逆性结合[16]。随着VHb基因的成功克隆,国内外对其功能的研究越来越深入,目前VHb基因已经在多种微生物和植物中得到了广泛的研究,大量实验结果表明VHb可降低宿主细胞对溶氧的敏感程度,提高细胞的呼吸强度,通过提高发酵过程中菌体的摄氧率,加快细胞的生长速率,增加其代谢产物产量[17-18]。Liu Qian等[19]将VHb基因导入谷氨酸棒杆菌中明显提高了谷氨酰胺和谷氨酸的产量,但由于VHb基因是由质粒携带,可能存在质粒不稳定现象,大大限制了工程菌的应用。
现在生产上使用的菌株大多采用传统诱变育种方法筛选得到,但该法存在盲目性高、工作量大、突变株生理失调、易 退化等局限性。因此,采用代谢工程育种方法有目的地、精确地改造菌种就成为该项研究的主要方向。本研究拟从调控谷氨酸代谢途径的角度出发,在基因组水平上对谷氨酸生产菌钝齿棒杆菌T6-13进行改造,通过缺失atp基因和插入VHb基因,研究两基因协同效应对谷氨酸生产量的影响,并研究基因改造对细菌生长代谢造成的影响,从而为构建高产谷氨酸的生产菌奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株及质粒
钝齿棒杆菌T6-13 中国工业微生物菌种保藏管理中心;大肠杆菌JM109、DH5α、质粒pMD19-T Simple 宝生物工程(大连)有限公司;质粒pK19mobsacB 德国Kalinowski教授惠赠;pK19mobsacB-ΔodhA-VHb 辽宁大学生命科学院动物资源与疫病防治实验室前期构建。
1.1.2 酶及试剂
Ex Taq酶、限制性内切酶、细菌基因组小量提取试剂盒、琼脂糖凝胶DNA纯化试剂盒、Clontech抑制性削弱杂交PCR试剂盒 宝生物工程(大连)有限公司;胰蛋白胨、酵母提取物 英国Oxoid公司;谷氨酸(色谱纯) 奥博星生物技术责任有限公司;异硫氰酸苯酯(分析纯)、甲醇(色谱纯)、乙腈(色谱纯)、三乙胺(分析纯)、正己烷(分析纯) 山东禹王实业有限公司化工分公司。
1.1.3 培养基
钝齿棒杆菌电转感受态细胞培养基为(1 L):蛋白胨10 g、酵母粉5 g、氯化钠10 g、甘氨酸30 g、吐温-80 1 mL;发酵培养基为(1 L):葡萄糖140 g、氯化铵40 g、生物素2 μg、水合硫酸锌0.01 g、水合硫酸镁0.05 g、磷酸氢二钾0.5 g、硫酸锰0.02 g、VB10.001 g、碳酸钙50 g(干热灭菌)、尿素8 g(0.45 μm滤膜过滤除菌),用KOH调节pH 7.0~7.2。固体培养基添加1.2 g/100 mL琼脂,使用前将培养基融化并冷却至55 ℃左右加入抗生素。培养大肠杆菌时添加卡那霉素至终质量浓度50 μg/mL,培养钝齿棒杆菌时添加卡那霉素至终质量浓度为25 μg/mL。
1.2 仪器与设备
MicroPulserTM电转仪、Universal HoodⅡ紫外凝胶电泳成像仪、AB 9902 PCR仪 美国Bio-Rad公司;HC-2518R冷冻离心机 安徽中科中佳科学仪器有限公司;DYY-2凝胶电泳仪 北京六一仪器厂;UV-2700紫外分光光度计 上海天河环境技术有限公司;Waters 1525 Binary HPLC液相色谱仪(配有可变波长紫外检测器和Breeze 2色谱操作系统) 美国Waters公司。
1.3 方法
1.3.1 引物设计与合成
表1 引物列表
Table 1 List of primers used in this study
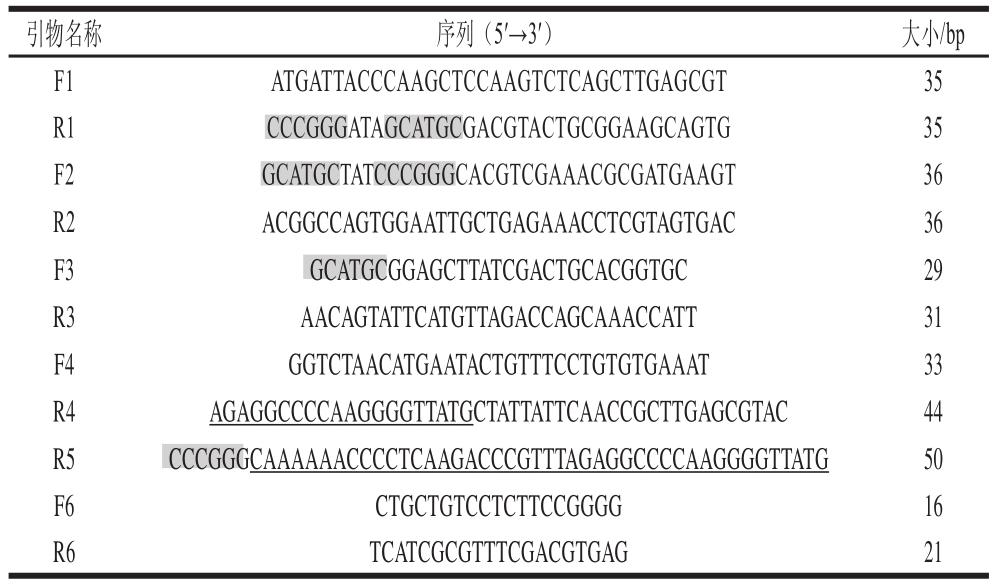
引物名称 序列(5′→3′) 大小/bp F1 ATGATTACCCAAGCTCCAAGTCTCAGCTTGAGCGT 35 R1 CCCGGGATAGCATGCGACGTACTGCGGAAGCAGTG 35 F2 GCATGCTATCCCGGGCACGTCGAAACGCGATGAAGT 36 R2 ACGGCCAGTGGAATTGCTGAGAAACCTCGTA GTGAC 36 F3 GCATGCGGAGCTTATCGACTGCACGGTGC 29 R3 AACAGTATTCATGTTAGACCAGCAAACC ATT 31 F4 GGTCTAACATGAATACTGTTTCCTGTGTGAAAT 33 R4AGAGGCCCCAAGGGGTTATGCTATTATTCAACCGCTTGAGCGTAC 44 R5CCCGGGCAAAAAACCCCTCAAGACCCGTTTAGAGGCCCCAAGGGGTTATG 50 F6 CTGCTGTCCTCTTCCGGGG 16 R6 TCATCGCGTTTCGACGTGAG 21
设计引物F1、R1用于扩增atp基因上游同源臂,引物F2、R2用于扩增atp基因下游同源臂,并在R1和F2的5’端引入SphⅠ和SmaⅠ酶切位点;设计引物F3、R3用于扩增tac启动子,F3的5’端引入SphⅠ酶切位点;设计引物F4、R4用于扩增VHb基因,F4的5’端引入一段tac启动子3’端序列;R4的5’端引入T7终止子的上半部分序列;设计引物R5用于引入T7终止子,R5的3’端为R4的重叠序列,5’端引入T7终止子的下半部分序列以及SmaⅠ酶切位点;设计引物F6,R6用于筛选缺失atp基因重组菌株。引物序列列于表1(阴影部分分别为SphⅠ和SmaⅠ酶切位点,下划线部分为T7终止子序列)。
1.3.2 重组质粒pK19mobsacB-Δatp的构建
以钝齿棒杆菌T6-13基因组DNA为模板,用引物F1/R1和F2/R2分别聚合酶链式反应(polymerase chain reaction,PCR)扩增ATP合酶基因上游同源臂atpF和下游同源臂atpR。PCR反应条件为:94 ℃预变性3 min;98 ℃变性10 s,68 ℃退火、延伸1.5 min,30 个循环;4 ℃终止反应,回收产物。使用Clontech In-FusionTMAdvantage PCR Cloning Kit将atpF和atpR与经EcoRⅠ/HindⅢ双酶切的线性质粒pK19mobsacB进行In-Fusion连接,得到重组质粒pK19mobsacB-Δatp。
1.3.3 重组质粒pK19mobsacB-Δatp-tac-VHb的构建
分别以质粒pGEX-KG和质粒pK19mobsacB-ΔodhAVHb为模板,F3/R3和F4/R4为引物,PCR扩增tac启动子和VHb基因。PCR反应条件为:98 ℃变性10 s,55 ℃退火10 s,72 ℃延伸30 s,30 个循环后,72 ℃延伸10 min,4 ℃终止反应。回收产物tac启动子和VHb基因。以回收得到的tac启动子和VHb基因片段为模板,F3/R5为引物,进行2 次PCR扩增,以拼接tac启动子、VHb基因和T7终止子,得到基因片段tac-VHb。PCR反应条件为:98 ℃变性10 s,55 ℃退火10 s,72 ℃延伸1 min,30 个循环后,72 ℃延伸10 min,4 ℃终止反应。回收目的条带tac-VHb片段后进行加“A”反应,经纯化后与pMD19-T Simple载体连接得到重组质粒pMD19-Tsimple-tac-VHb。
用SphⅠ/SmaⅠ对重组质粒pMD19-T simple-tac-VHb 和pK19mobsacB-Δatp分别进行双酶切。回收tac-VHb小片段以及pK19mobsacB-Δatp线性DNA片段,用连接酶进行连接得重组质粒pK19mobsacB-Δatp-tac-VHb。
1.3.4 重组菌株T6-13-Δatp和T6-13-Δatp-tac-VHb的构建及鉴定
挑取新鲜的钝齿棒杆菌T6-13单菌落于LB液体培养基中,30 ℃、200 r/min振荡培养12 h,按2%的接种量接种于100 mL钝齿棒杆菌电转感受态细胞培养基中,30 ℃、200 r/min振荡培养5~7 h,至细胞OD600 nm值达约0.6。冰浴20 min后,转移至预冷的50 mL离心管中,4 ℃、4 000 r/min离心5 min弃上清液,用预冷的10%甘油于冰上重悬菌体洗涤3 次,最后用预冷的10%甘油重悬细胞(每50 mL原液用200 μL甘油重悬),每管80 μL分装于1.5 mL Eppendorf管中,-80 ℃保存待用。转化时冰浴融化,加入2 μL质粒混匀,转移至预冷的1.0 mm电击杯中,于1.8 kV、4 ms条件下电击,电击后立即加入含0.5 g/10 0 mL葡萄糖的液体LB培养基1 mL,混匀并转移至1.5 mL Eppendorf管中,46 ℃热激6 min,然后30 ℃、200 r/min振荡培养1 h,离心浓缩菌体后涂布于含有25 µg/mL卡那霉素的LB平板上,30 ℃培养36~48 h。
菌落PCR筛选阳性转化子,确定自杀载体是否通过同源重组插入到钝齿棒杆菌基因组中。用F6、R6引物PCR鉴定atp基因的缺失,PCR反应条件为:98 ℃变性10 s,55 ℃退火10 s,72 ℃延伸15 s,30 个循环后,72 ℃延伸10 min,4 ℃终止反应;用F1、R2引物PCR鉴定VHb的插入。PCR反应条件为:98 ℃变性10 s,55 ℃退火10 s,72 ℃延伸1 min,30 个循环后,72 ℃延伸10 min,4 ℃终止反应。
1.3.5 CO差光谱法检测VHb活性
因为VHb可与CO形成VHb-CO复合物,该复合物在419、535、566 nm波长处呈现特征吸收峰,因此实验通过CO差光谱法检测VHb蛋白的表达。细菌培养至对数期后离心集菌,玻璃珠振荡破碎处理后,-20 ℃冻融处理4 次,加磷酸盐缓冲溶液(phosphate buffer saline,PBS)重悬,静置2 min后弃去沉淀,剩余的菌悬液中加入过量的Na2S2O4,样品端和参比端分别鼓入CO气体和空气3 min,在紫外分光光度计上检测410~500 nm波长范围内的吸光度,计算样品端和参比端差值[20]。对照组样品测定方法同上。
1.3.6 重组菌株生长曲线的测定
分别挑取T6-13、T6-13-Δatp和T6-13-Δatp-tac-VHb单菌落于200 mL新鲜的LB液体培养基中,振荡培养过夜。按1%的接种量接种于LB液体培养基中,于180 r/min转速条件下连续培养24 h,每隔2 h取样测定培养物的OD600 nm值,实验数据为3 次重复实验的平均值。以时间(h)为横坐标,OD600 nm值为纵坐标绘制细菌生长曲线。
1.3.7 谷氨酸产量的测定
谷氨酸标准曲线的绘制:分别配制质量浓度为0、100、200、500、1 000 μg/mL的谷氨酸标准品溶液,苯异硫氰酸酯(phenyl isothiocyanate,PITC)法柱前衍生后,进行高效液相色谱(high performance liquid chromatography,HPLC)分析检测。绘制谷氨酸峰面积与对应质量浓度关系曲线。
分别挑取T6-13、T6-13-Δatp和T6-13-Δatp-tac-VHb单菌落于10 mL LB液体培养基中,摇瓶培养至对数期,按1%接种量分别接种于200 mL的发酵培养基中,30 ℃、180 r/min培养48 h。从20 h起每隔4 h取样一次,取样时间分别为20、24、28、32、36、40、44、 48 h。所取样品离心收集上清液,取500 μL进行柱前衍生反应,处理后取20 μL进样,按色谱条件:色谱柱:Waters XBridge C18(4.6 mm×500 mm,5 μm);柱温:38 ℃;检测波长:254 nm;流动相:流动相A(0.1 mol/L醋酸钠溶液)和流动相B(乙腈),0.45 μm滤膜过滤、超声波脱气0.5 h后使用,按体积比97∶3进样。流动相流速:1 mL/min进行HPLC检测,根据标准品工作曲线计算相应的谷氨酸产量[21-22]。
1.3.8 重组菌株谷氨酸产量差异显著性分析
对培养32 h的3 个菌株产谷氨酸量进行比较,每个实验重复3 次,结果以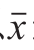 ±s表示。数据结果采用SPSS 12.0软件进行分析。
±s表示。数据结果采用SPSS 12.0软件进行分析。
2 结果与分析
2.1 重组质粒pK19mobsacB-Δatp的构建
构建重组载体pK19mobsacB-Δatp,分别用SmaⅠ和SphⅠ酶切鉴定重组质粒pK19mobsacB-Δatp,见图1。对atpF和atpR基因片段测序后进行BLAST比对,结果表明从钝齿棒杆菌T6-13中克隆的atpF和atpR片段与GenBank中登记的ATP合酶基因序列完全相同。
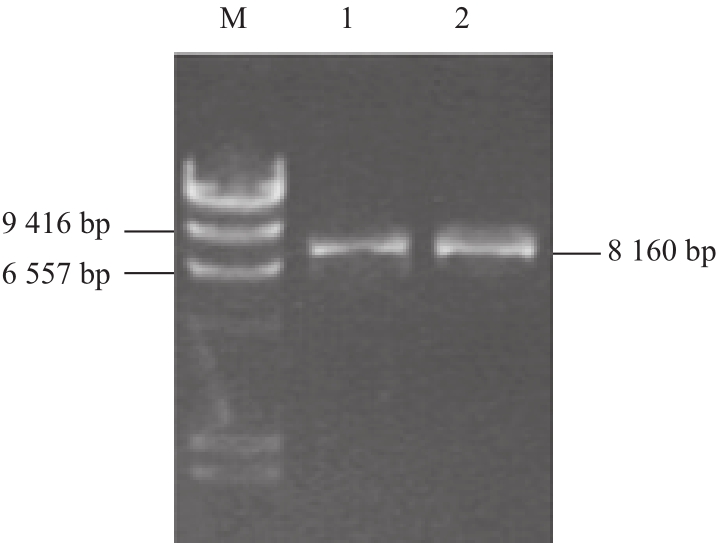
图1 重组质粒pK19mobsacB-Δaattpp的酶切鉴定
Fig.1 Identification of recombinant plasmid pK19mobsacB-Δatp by restriction enzyme digestion
M. λ-HindⅢ DNA Marker;1. SphⅠ酶切 pK19mobsacBΔatp的产物;2. SmaⅠ酶切pK19mobsacB-Δatp的产物。
2.2 重组质粒pK19mobsacB-Δatp-tac-VHb的构建
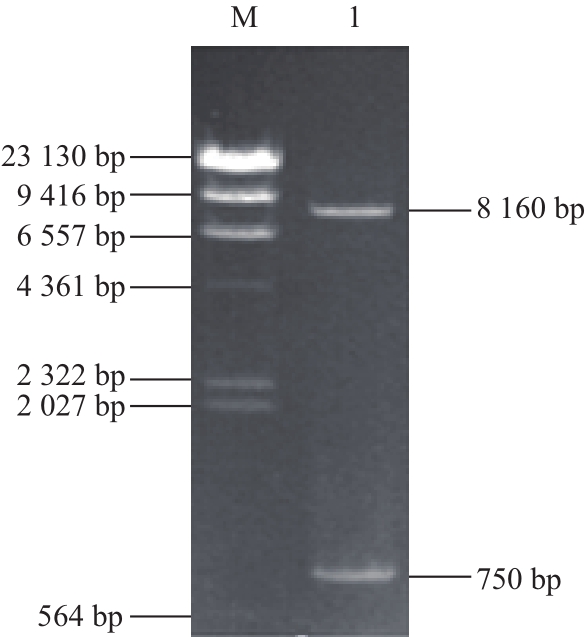
图2 重组质粒pK19mobsacB-Δaattpp-ttaacc-VVHHbb的酶切鉴定
Fig.2 Identification of recombinant plasmid pK19mobsacB-Δatp-tac-VHb by restriction enzyme digestion
M. λ-Hind Ⅲ DNA Marker;1. SmaⅠ/SphⅠ双酶切pK19mobsacB-Δatp-tac-VHb的产物。
PCR得到基因片段tac-VHb,将回收得到的拼接片段tac-VHb连接到T载体上后进行测序,进行BLAST比对分析,结果表明tac启动子和VHb片段与GenBank中登记的序列一致。将tac-VHb片段克隆到pK19mobsacB-Δatp,SmaⅠ/SphⅠ对其进行双酶切鉴定,图2结果表明片段大小与预期片段大小(大片段8 160 bp、小片段750 bp)一致。
2.3 重组菌株T6-13-Δatp和T6-13-Δatp-tac-VHb的筛选及鉴定
将上述提取的质粒p K 1 9 m o b s a c B -Δ a t p和pK19mobsacB-Δatp-tac-VHb,电转化到制备好的T6-13电转感受态细胞中,得到转化子单菌落,菌落PCR筛选阳性转化子,结果见图3和图4,表明得到重组菌株T6-13-Δatp和T6-13-Δatp-tac-VHb。
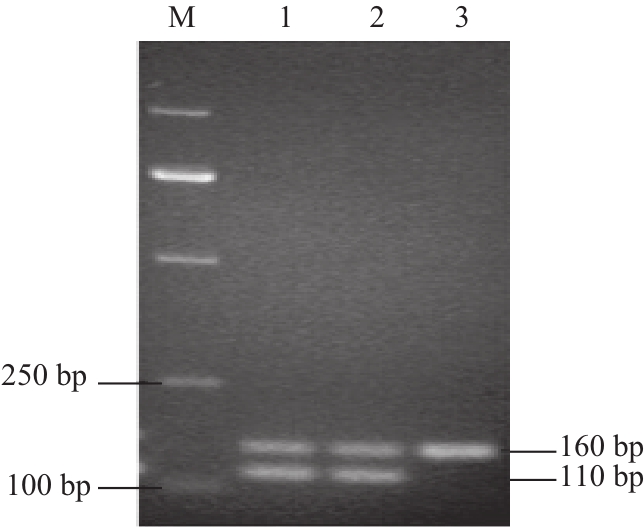
图3 菌落PCR筛选T6-13-Δaattpp阳性转化子
Fig.3 Screening of T6-13-Δatp strain by bacterial colony PCR
M. DL2000 DNA Marker;1、2. T6-13-Δatp单交换转化子;3. T6-13。
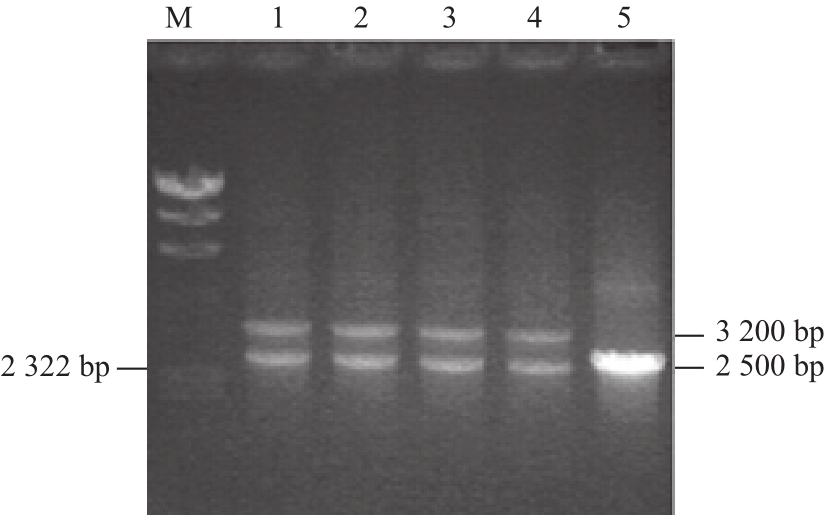
图4 菌落PCR筛选T6-13-Δaattpp-ttaacc-VVHHbb阳性转化子
Fig.4 Screening of T6-13-Δatp-tac-VHb strain by bacterial colony PCR
M. DL20000 DNA Marker;1~4. T6-13-Δatp-tac-VHb转化子;5. T6-13。
2.4 CO差光谱法检测VHb蛋白活性
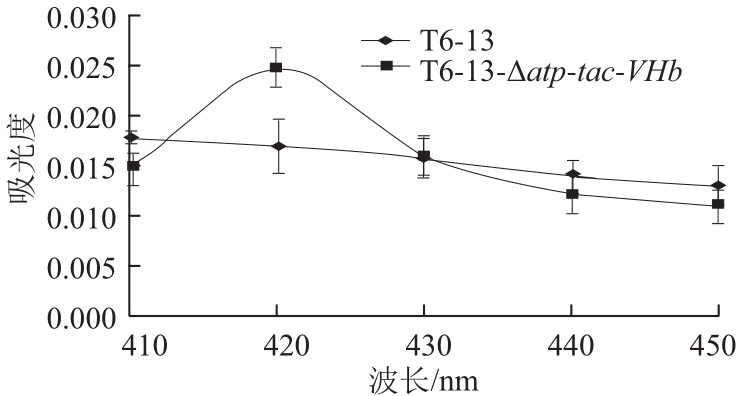
图5 VHb在T6-13-Δaattpp-ttaacc-VVHHbb中表达的CCOO差光谱
Fig.5 CO difference spectrum of VHb expressed by T6-13-Δatp-tac-VHb
CO差光谱法检测VHb蛋白活性结果见图5。实验结果表明重组菌株中的VHb基因成功表达且表达的VHb蛋白具有功能活性。
2.5 Atp基因缺失及VHb基因插入对宿主菌生长的影响

图6 出发菌株与重组菌株生长曲线
Fig.6 Growth curve of recombinant bacteria
测定T6-13、T6-13-Δatp和T6-13-Δatp-tac-VHb这3 株菌株的生长速率曲线如图6所示,atp基因缺失突变株达到稳定期后不能达到出发菌株的生长浓度。而插入了VHb基因的重组菌,其达到稳定期后的菌体浓度较缺失atp基因的突变株有明显增加,基本接近于出发菌株。
2.6 重组谷氨酸产生菌与出发菌株谷氨酸产量的比较
由图7可知,谷氨酸的出峰时间为6.217 min,谷氨酸发酵液与谷氨酸标准品出峰时间相同,说明发酵液检测到的确为发酵产物谷氨酸。由图8可知,随着发酵时间的延长,谷氨酸的积累量逐渐增多,在32 h时谷氨酸的积累量达到最大。并且atp基因缺失突变株和atp基因缺失且插入VHb基因的突变株的谷氨酸产生量明显高于出发菌株。atp基因缺失突变株T6-13-Δatp的谷氨酸平均产生量为(45.523±0.197) g/L,而出发菌株T6-13的谷氨酸平均累积量为(35.635±0.505) g/L,T6-13-Δatp比T6-13提高了27.76%。插入VHb基因的atp基因缺失突变株T6-13-Δatp-tac-VHb的谷氨酸平均产生量为(48.783±0.132) g/L,比出发菌株提高了36.91%,比atp基因缺失突变株提高了7.16%。
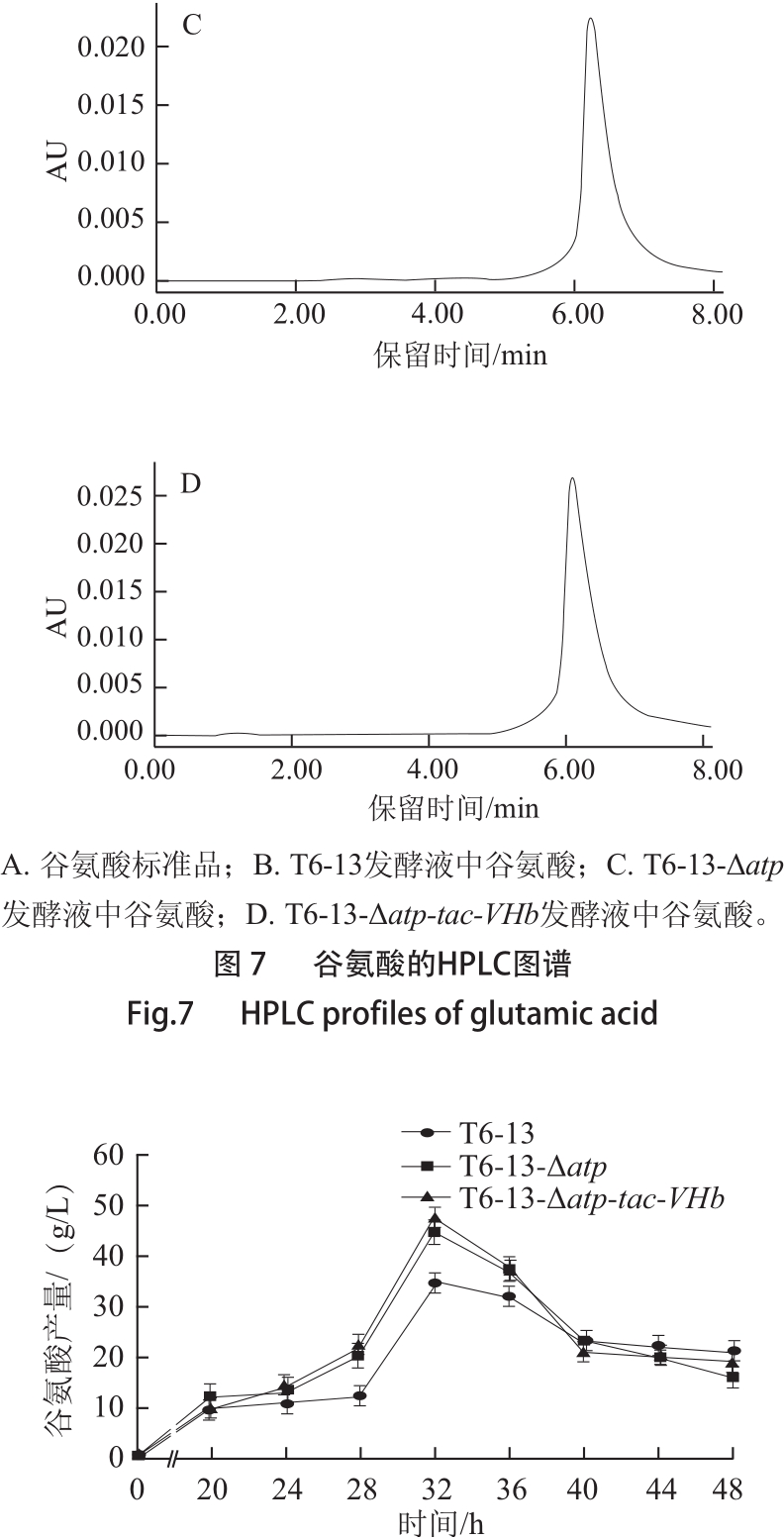
图8 出发菌株与重组菌株的谷氨酸产生动力学曲线
Fig.8 Dynamic curves of glutamic acid production by recombinant bacteria
3 讨 论
在谷氨酸的工业生产中,谷氨酸生产菌的生产效率是影响其成本的关键因素,为提高钝齿棒杆菌发酵生产谷氨酸的生产效率,本研究通过基因工程手段对钝齿棒杆菌进行了改造,以获得更高产的谷氨酸生产菌。鉴于从代谢的角度分析,ATP合酶的缺失可提高谷氨酸的产量[12],本研究通过同源重组使钝齿棒杆菌ATP合酶基因缺失,从而使谷氨酸产量提高了27.76%,但ATP合酶基因的缺失严重影响了细菌自身的生长,导致生长速率减慢且无法达到出发菌株稳定期浓度。大量实验结果表明,VHb可通过提高发酵过程中菌体的摄氧率,促进菌体生长,增加菌体代谢产物产量[23-26]。因此,本研究通过同源重组的方法向基因组中导入了VHb基因。实验证明,该基因的引入不但使重组菌株稳定期浓度达到了出发菌株的水平,而且进一步提高了谷氨酸的产量,比原始菌株提升了36.91%。
通过缺失ATP合酶基因和引入VHb基因,有效地提高了钝齿棒杆菌发酵生产谷氨酸的产量。由于涉及产权保护等原因,本实验无法以高产的工业生产用菌株作为出发菌株,因此,虽然改造后的菌种比原始菌种的生产谷氨酸产量有了很大提高,但与目前工业生产谷氨酸菌种的产量还有一定差距,然而,此研究方法可以为其他工业发酵菌株的分子育种研究提供新思路,也为进一步构建更为稳定高产的工业用菌奠定了基础。
参考文献:
[1]于信令. 味精工业手册[M]. 北京: 中国轻工业出版社, 2009: 42-46.
[2]王文新, 杨柳, 李继, 等. 新型食品添加剂谷氨酸钙[J]. 中国调味品, 2009, 34(3): 85-87.
[3]梅和珊, 王永利. 脑缺血时谷氨酸释放机制[J]. 中国药理学通报, 2005, 21(4): 393-396.
[4]汪春运. 谷氨酸与精神药理[J]. 医药导报, 2009, 28(5): 622-624.
[5]王天贵, 王诗瑜, 张引沁. 葡萄糖发酵制取谷氨酸的研究进展[J]. 平原大学学报, 2000, 17(3): 89-90.
[6]佐川幸一郎, 李焕珍. 氨基酸系表面活性剂[J]. 日用化学品科学, 1989(1): 1-5.
[7]龙翎. 植物生长调节剂专利[J]. 农药研究与应用, 2007, 11(1): 56-58.
[8]康湛莹, 韩文瑞. 混合氨基酸铜络合物杀菌作用的研究[J]. 哈尔滨电工学院学报, 1996, 19(2): 275-278.
[9]FOSTER D L, FILLINGAME R H. Energy-transducing H+-atpase of Escherichia coli: purification, reconstitution and subunit composition[J]. Biological Chemistry, 1979, 254(17): 8230-8236.
[10]AOKI R, WADA M, TAKESUE N, et al. Enhanced glutamic acid production by a H+-atpase-defective mutant of Corynebacterium glutamicum[J]. Bioscience, Biotechnology, and Biochemistry, 2005, 69(8): 1466-1472.
[11]CAUSEY T B, SHANMUGAM K T, YOMANO L P, et al. Engineering Escherichia coli for efficientconversion of glucose to pyruvate[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(8): 2235-2240.
[12]张博, 李铁民, 杨智勇, 等. 谷氨酸棒杆菌H+-ATPase基因失活提高谷氨酸产生量[J]. 中国生物工程杂志, 2011, 31(1): 35-39.
[13]SANTANA M, IONESCU M S, VERTES A, et al. Bacillus subtilis FOF1 atpase: DNA sequence of the atp operon and characterization of atp mutants[J]. Journal of Bacteriology, 1994, 176(22): 6802-6811.
[14]WAKABAYASHI S, MATSUBARA H, WEBSTER D A. Primary sequence of a dimeric bacterial haemoglobin from Vitreoscilla[J]. Nature, 1986, 322(31): 481-483.
[15]TYREE B, WEBSTER D A. The binding of cyanide and carbon monoxide to cytochrome o purified from Vitreoscilla. Evidence for subunit interaction in the reduced protein[J]. Journal of Biological Chemistry, 1978, 253(19): 6988-6991.
[16]TARRICONE C, GALIZZI A, CODA A, et al. Unusual structure of the oxygen-binding site in the dimeric bacterial hemoglobin from Vitreoscilla sp.[J]. Structure, 1997, 5(4): 497-507.
[17]FREYA D, KALLIO P T. Bacterial hemoglobins and fl avohemoglobins: versatile proteins and their impact on microbiology and biotechnology[J]. FEMS Microbiology Reviews, 2003, 27(4): 525-545.
[18]SUTHAR D H, CHATTOO B B. Expression of Vitreoscilla hemoglobin enhances growth and levels of alpha-amylase in Schwanniomyces occidentalis[J]. Applied Microbiology and Biotechnology, 2006, 72(1): 94-102.
[19]LIU Qian, ZHANG Jiao, WEI Xiaoxing, et al. Microbial production of L-glutamate and L-glutamine byrecombinant Corynebacterium glutamicum harboring Vitreoscilla hemoglobin gene VHb[J]. Applied Microbiology and Biotechnology, 2008, 77(6): 1297-1304.
[20]于慧敏, 史悦, 沈忠耀, 等. CO差光谱法分析重组大肠杆菌中的透明颤菌血红蛋白[J]. 清华大学学报: 自然科学版, 2002, 42(5): 615-618.
[21]SPINDLER M, STADLER R, TANNER H. Amino acid analysis of feedstuffs: determination of methionine and cystine after oxidation with performic acid and hydrolysis[J]. Journal of Agricultural and Food Chemistry, 1984, 32(6): 1366-1371.
[22]GEHRKE C W, REXROAD P R, SCHISLA R M, et al. Quantitative analysis of cy stine, methionine, lysine, and nine other amino acids by a single oxidation-4 hour hydrolysis method[J]. Journal of the Association of Offi cial Analytical Chemists, 1987, 70(1): 171-174.
[23]CHEN W, HUGHES D E, BAILEY J E. Intracellular expression of Vitreoscilla hemoglobin alters the aerobic metabolism of Saccharomyces cerevisiae[J]. Biotechnology Progress, 1994, 10(3): 308-313.
[24]TSAI P S, NAGELI M, BAILEY J. Intracellular expression of Vitreoscilla hemoglobin modifies microaerobic Escherichia coli metabolism through elevated concentration and specific activity of cytochrome o[J]. Biotechnology and Bioengineering, 2002, 79(5): 558-567.
[25]孟春 , 叶勤, 邱荔, 等. 透明颤菌血红蛋白基因表达对金色链霉菌生长代谢影响[J]. 微生物学报, 2002, 42(4): 418-424.
[26]裴海生, 杨光, 李春, 等. 透明颤菌血红蛋白的研究进展及其在发酵工业中的应用[J]. 中国生物工程杂志, 2008, 28(7): 133-138.
Effects of ATP Synthase Gene Deletion and VHb Gene Insertion on Production of Glutamic Acid in Corynebacterium crenatum
ZHENG Fangliang, YU Liang, MU Xiaocong, LIU Peng, LIU Hongsheng*
(Academy of Science, Liaoning University, Shenyang 110036, China)
Abstract: In order to improve the yield of glutamic acid, we deleted the ATP synthase gene and inserted Vitreoscilla hemoglobin (VHb) gene into Corynebacterium crenatum genome by homologous recombination to acquire two recombinant Corynebacterium crenatum, T6-13-△atp and T6-13-△atp-tac-VHb. The yield of glutamic acid and growth of recombinant Corynebacterium crenatum were determined. The yield of glutamic acid produced by T6-13-△atp strain after 32 h of fermentation was 27.76% higher than that obtained from the original strain, although the recombinant strain grew more slowly and could not reach the concentration of the original strain at the stationary stage. Meanwhile, the yield of glutamic acid produced by T6-13-△atp-tac-VHb strain was 36.91% higher than that of the original strain during 32 h fermentation, and its growth rate and the glutamic acid concentration at the stable stage were the same as those observed for the original strain. These results may lay the foundation for constructing high-yield and stable industrial glutamic acid-producing strains.
Key words: Corynebacterium crenatum; glutamic acid; ATP synthase; Vitreoscilla hemoglobin
doi:10.7506/spkx1002-6630-201507024
中图分类号:Q939.97
文献标志码:A
文章编号:1002-6630(2015)07-0131-06
*通信作者:刘宏生(1963—),男,教授,博士,研究方向为微生物学。E-mail:hongshengl@126.com
作者简介:郑方亮(1980—),男,副教授,博士,研究方向为微生物分子生物学。E-mail:flzheng1980@163.com
基金项目:辽宁省教育厅科学研究一般项目(2012008)
收稿日期:2014-05-13

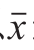 ±s表示。数据结果采用SPSS 12.0软件进行分析。
±s表示。数据结果采用SPSS 12.0软件进行分析。






