
图1 啤酒酵母出发菌株的生长曲线
Fig.1 Growth curve of S. cerevisiae
张佰清,孙栏梦
(沈阳农业大学食品学院,辽宁 沈阳 110866)
摘 要:采用脉冲强光对啤酒酵母菌种进行诱变处理,脉冲处理电压分别为1 000、1 500、2 000、2 500、3 000 V,闪照次数分别为4、8、16、32、48。测定出发菌株和筛选出的变异菌株的凝聚性、双乙酰产量、发酵速率、发酵结束理化性质等指标,比较变异菌株与出发菌株综合指标的差异。结果表明:经过初筛和复筛,筛选出10#和12#两株发酵性能较好的菌株。脉冲强光诱变处理并未对啤酒酵母的发酵度产生负面效应,而是有所提高或保持原酵母菌株的优良发酵性能。
关键词:脉冲强光;啤酒酵母;诱变;变异菌株;出发菌株
脉冲强光诱变装置是以交流电为电源,采用强光闪照的方法进行微生物诱变,它由一个动力单元和一个惰性气体灯单元组成[1-4]。脉冲强光对微生物有多种影响,脉冲强光宽谱的光能产生全面的、不可逆的破坏作用,使得菌体细胞中的DNA、细胞膜、蛋白质和其他大分子受到影响[5]。由于脉冲强光对微生物的核糖结构有影响,就有可能对微生物发生诱导产生突变。
目前国内外关于脉冲强光致死微生物的效果及机理研究较多。国内研制出了自动控制脉冲强光杀菌装置,对酿酒酵母、大肠杆菌和枯草芽孢杆菌进行了不同照射时间的研究,得出影响脉冲强光杀菌效果的主要因素是闪照次数、菌液原始浓度及输入电压,其中闪照次数的影响最大[6-7]。国外,Macgregor等[8]研究了大肠杆菌Escherichia coli O157:H7和单核细胞增生李斯特氏菌Listeria monocytogenes 4b在脉冲强光照射下的存活情况。Wekhof等[9-11]研究了脉冲强光对枯草芽孢杆菌Bacillus subtilis芽孢和黑曲霉菌Aspergillus niger孢子的杀灭效果,发现不用UV-C波段脉冲强光也可以达到杀菌的效果。还有研究者发现脉冲强光能够引起菌体细胞内蛋白质泄漏并且使照射酵母的细胞结构改变,脉冲强光和紫外光使菌体细胞受损伤的程度是不同的,脉冲强光照射对细胞膜的影响较大[12-16]。
本实验利用脉冲强光技术对啤酒酵母进行诱变,比较啤酒酵母出发菌株和变异菌株之间基本发酵性能的差异,为脉冲强光技术在提高啤酒酵母发酵性能中的应用提供理论依据。
1.1 菌种与培养基
啤酒酵母菌株,由沈阳农业大学土地与环境学院微生物实验室提供。
麦芽汁培养基:采用实验室自制麦芽汁培养基,经灭菌处理,调糖度为8~10 °Bx,自然pH值。固体麦芽汁培养基:在麦芽汁培养基中加入质量分数2%的琼脂,0.1 MPa灭菌20 min;酵母浸出粉胨葡萄糖培养基(YPD)培养基:参照文献[17]方法配制。
1.2 仪器与设备
TG16-WS型台式高速离心机 湘仪离心机仪器有限公司;生物显微镜 上海光电公司;恒温培养箱 上海精宏实验设备有限公司;pHs-3C型酸度计 上海盛磁仪器有限公司;灭菌锅 上海三申医疗器械有限公司;SZX-ZP超净工作台 上海博讯实业有限公司。
脉冲强光装置由沈阳农业大学食品学院自行设计[18],采用氙灯发出脉冲强光。光脉冲的脉冲宽度为20 μs,波长范围为200~1 100 nm,最大输出电压为5 000 V,最大输入能量为644 J。
1.3 方法
1.3.1 啤酒酵母生长曲线的绘制
采用比浊法,即测定菌液在600 nm波长处的光密度(OD600 nm)值来确定菌种数,绘制啤酒酵母生长曲线。
1.3.2 菌悬液的制备
取实验中心斜面保存的啤酒酵母菌1 环接种于YPD液体培养基中,28 ℃静置培养24 h,以体积分数10%的接种量转接于另外的YPD液体培养基中,28 ℃静置培养8 h,使细胞处于对数增殖中期,离心分离,将沉淀下来的菌体用生理盐水洗涤两次,悬浮于适量的生理盐水中,制成细胞浓度为106个/mL的菌悬液。
1.3.3 脉冲强光处理与诱变处理条件的确定
在灭菌后的培养皿中加入10 mL实验菌悬液,取下培养皿盖,放入杀菌处理室内,保证培养皿在氙灯的正下方。在脉冲强光闪照8 次、菌液厚度3.4 mm、菌液透光率100%、菌液浓度一定的条件下,分别考察输入电压为500、1 000、1 500、2 000、2 500、3 000 V时对菌体致死率的影响;以及在输入电压1 500 V、菌液厚度3.4 mm、菌液透光率100%、菌液浓度一定的条件下,分别考察脉冲强光闪照4、8、16、32、48 次时对菌体致死率的影响[19]。
1.3.4 菌株初筛
一般认为可遗传稳定变异最可能出现在致死率90%以上的区域内[20]。由此,对脉冲强光处理后从第1代到第5代致死率都在90%以上的菌株,挑取菌落呈中等大小、乳白色、表面光滑和边缘整齐的菌落12 株,接种至斜面固体YPD培养基上进行复筛。
1.3.5 菌株复筛
供复筛的菌株于恒温培养箱内28 ℃培养24 h,再保藏于冷藏室内,待用于耐受性实验,并以此作为复筛的标准[21-23]。
1.3.6 分析测定方法
菌株凝聚性的测定采用光密度法[24];双乙酰产量的测定采用分光光度法[25];酒精度的测定采用比重瓶法;发酵度的测定参照文献[26]的方法进行;发酵速率的测定参照文献[23]的方法进行。
2.1 啤酒酵母出发菌株的生长曲线

图1 啤酒酵母出发菌株的生长曲线
Fig.1 Growth curve of S. cerevisiae
由图1可知,啤酒酵母菌株的迟滞期为6 h(0~6 h),对数生长期为12 h(6~18 h),随后开始进入稳定期。因此在研究脉冲强光对啤酒酵母生理特性的影响和啤酒酵母对脉冲强光的抗性时,选择在液体培养基中培养至10~17 h的菌体进行实验。在研究脉冲强光对啤酒酵母的致死机理时,选择同步培养至18 h的菌体进行实验。
2.2 脉冲强光处理菌株的致死率曲线
在脉冲强光闪照8 次、菌液厚度3.4 mm、菌液透光率100%、菌液浓度一定的条件下,分别考察输入电压为500、1 000、1 500、2 000、2 500、3 000 V时对菌体致死率的影响。

图2 不同电压条件下的菌体致死率
Fig.2 Mortality of S. cerevisiae at different voltages
如图2所示,随着输入电压的增加,对菌体的致死率快速上升。在输入电压增加至1 500 V后对菌体的致死率上升速率开始减缓。在输入电压为1 500 V时,对菌体的致死率达到了87%;当输入电压为2 500 V时,对菌体的致死率达到了98%以上。
在输入电压1 500 V、菌液厚度3.4 mm、菌液透光率100%、菌液浓度一定的条件下,分别考察脉冲强光闪照4、8、16、32、48 次时对菌体致死率的影响。
如图3所示,随着闪照次数增加,对菌体的致死率逐渐增加。在闪照次数为8时,对菌体的致死率达到了89%;当闪照次数为32时,对菌体的致死率为99.8%,菌体几乎全部死亡。
为研究脉冲强光对啤酒酵母菌是否具有诱变作用,根据以上结果来确定抗性筛选的脉冲处理条件,筛选具有一定耐受性的菌株。

图3 不同闪照次数条件下的菌体致死率
Fig.3 Mortality of S. cerevisiae with different pulsed light cycles
2.3 初筛结果
表1 啤酒酵母菌对脉冲强光的抗性
Table 1 Mortality of S. cerevisiae treated by pulsed lightt
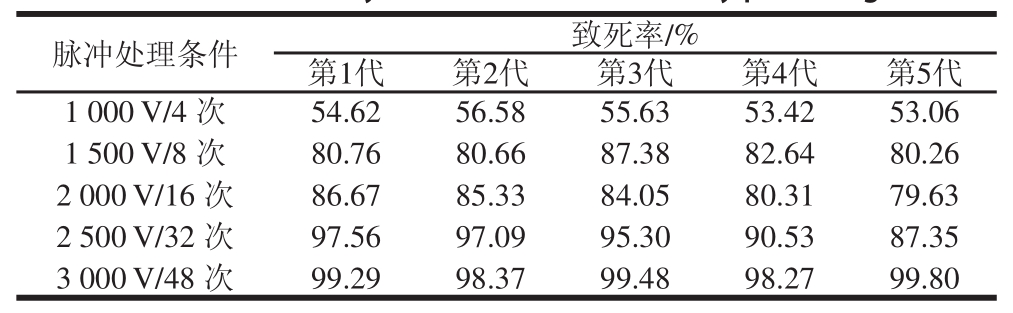
由表1可知,选择不同强度脉冲强光对啤酒酵母菌作用后,选取存活的啤酒酵母菌种进行斜面试管接种,重复刺激5 代后,脉冲条件为2 000 V/16 次和2 500 V/32 次的啤酒酵母菌的致死率有所下降。当处理强度达到3 000 V/48 次时,第5 代啤酒酵母的致死率为99.80%,此时第1~5代的致死率均达到95%以上。说明随这处理强度的提高,致死作用加强,因此菌株在低处理强度时表现出抗性,而在高处理强度时表现为大量死亡。对脉冲条件为2 000 V/16 次和2 500 V/32 次下第5代存活的啤酒酵母菌种进行筛选得到12 株菌株(编号为1#~12#),并接种到斜面试管中保存,用于研究其耐渗性和发酵性能是否发生变化。
2.4 复筛结果
2.4.1 不同杀灭温度对菌株生长的影响
表2 不同杀灭温度对菌株生长的影响
Table 2 Effect of temperature on the growth of original and variant S. cerevisiae strains
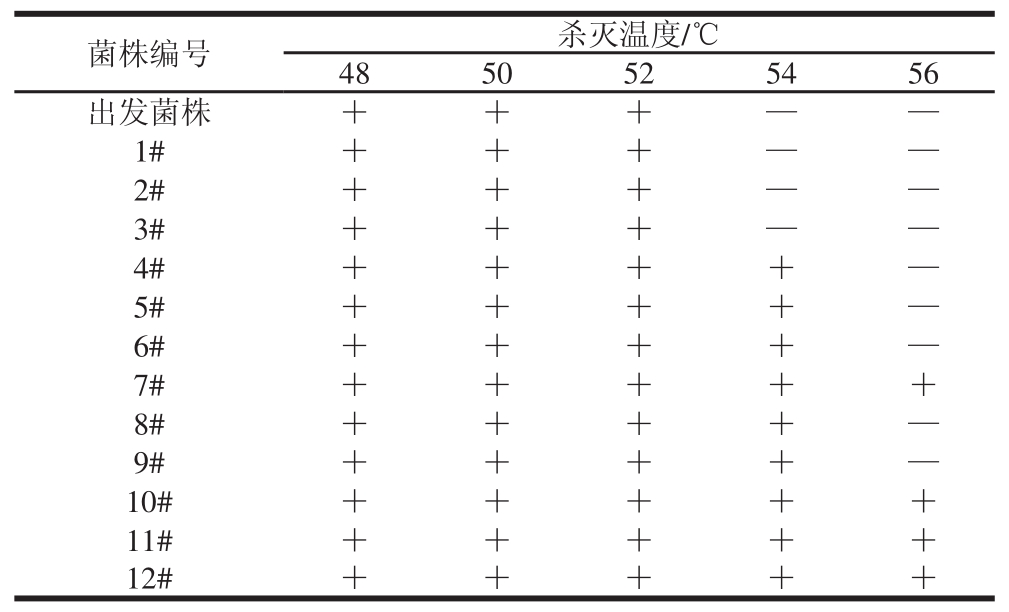
注:+. 生长;—. 不生长。下同。
由表2可知,出发菌株、1#、2#和3#菌株的杀灭温度为54 ℃,4#、5#、6#、8#和9#菌株的杀灭温度为56 ℃,而7#、10#、11#和12#菌株在56 ℃时仍然可以存活,因此选择7#、10#、11#和12#菌株进行下一步实验。
2.4.2 菌株耐糖性与耐酒精性
对7#、10#、11#和12#菌株进行耐糖性与耐酒精性实验,结果见表3、4。
表3 不同葡萄糖质量分数下各菌株产气结果
Table 3 Gas production by original and variantS. cerevisiae strains at different glucose concentrations

注:+越多表示试管中气体产生的量越多;++++表示气体满管。表4同。
每隔24 h观察试管产气情况,结果见表3。在葡萄糖质量分数为50%的条件下培养72 h后,所有菌株均产气;而在葡萄糖质量分数为60%的条件下培养72 h后,只有10#和12#菌株产气,而出发菌株不能耐受此条件下的渗透压。
表4 不同酒精度条件下各菌株产气情况
Table 4 Gas production by original and variantS. cerevisiae strains at different alcohol concentrations

由表4可知,出发菌株在酒精度为10%时就已经不产气,10#和12#菌株在酒精度为16%时依然产气。与出发菌株相比,10#和12#菌株的耐酒精性更强。
由以上结果可知,脉冲强光可以筛选出具有高耐糖性与耐酒精性的变异菌株10#和12#,用这两株菌株进行后续实验。
2.5 出发菌株和变异菌株凝聚性比较结果
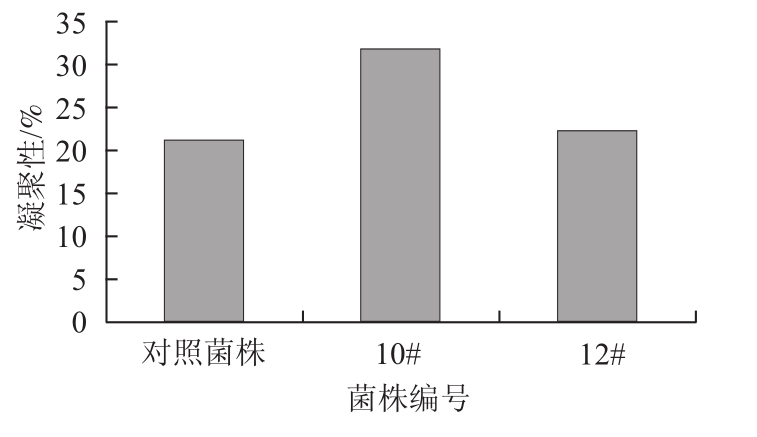
图4 出发菌株和变异菌株凝聚性的比较
Fig.4 Comparison of flocculation ability between variant and original strains
由图4可知,10#菌株的凝聚性较强,也相对适中,对照菌株和12#菌株的凝聚性相差不多。这说明10#菌株在发酵结束时沉淀速率较快,发酵液澄清速率也快。对照菌株和12#菌株发酵结束时沉淀速率慢,发酵液也不易澄清。
2.6 出发菌株和变异菌株双乙酰产量比较
双乙酰是由丙酮酸形成的,双乙酰及其相关产物都是酵母酒精发酵的副产物,其产量甚微,但对酒的风味形成有很大的影响,是评价啤酒成熟与否的主要依据,其含量多少直接影响啤酒的品质。当啤酒中双乙酰含量超过风味阈值时,会有一种不愉快的饭馊味。

图5 出发菌株和变异菌株双乙酰产量在发酵过程中的变化
Fig.5 Change in diacetyl concentration during yeast fermentation
由图5可知,对照菌株的双乙酰产量在发酵第1天出现峰值,达到0.364 mg/L,10#、12#菌株的双乙酰产量均在发酵第3天出现峰值,达到0.328、0.359 mg/L,对照菌株比10#菌株和12#菌株早2 d出现峰值,并且含量稍高,发酵完毕后,双乙酰产量分别为对照菌株0.176 mg/L、10#菌株0.136 mg/L、12#菌株0.171 mg/L。实验结果表明,10#菌株的双乙酰还原能力较对照菌株和12#菌株更加优良。
2.7 啤酒酵母的发酵速率
将出发菌株和变异菌株以1.8×107个/mL进行接种,在25 ℃条件下培养,测定其发酵速率,结果见图6。

图6 对照菌株与变异菌株发酵速率的比较
Fig.6 Comparison of fermentation rate between variant and original strains
由图6可知,10#菌株的降糖速率最快,在第5天由接种糖度10 °Bx降至5.5 °Bx,12#菌株降糖速率慢些,在第8天由接种糖度10 °Bx降至5.5 °Bx,而对照菌株降糖速率最慢,在第10天由接种糖度10 °Bx降至5.5 °Bx。经计算,对照菌株的发酵速率为0.5 °Bx/d、10#菌株的发酵速率为1.5 °Bx/d、12#菌株的发酵速率为0.64 °Bx/d。
2.8 出发菌株与变异菌株的发酵性能比较
表5 出发菌株与变异菌株最终发酵指标测定结果
Table 5 Physicochemical indexes of fermentation products from variant and original strains

注:接种时麦芽汁含量为10 g/100 mL。
由表5可知,诱变后的10#菌株的真实发酵度比出发菌株高些,双乙酰产量下降20.9%,酒精度上升。脉冲强光诱变处理并未对啤酒酵母的发酵度产生负面效应,而是有所提高或保持原酵母菌株的优良发酵性能。
本研究采用脉冲强光诱变啤酒酵母菌,并对抗性强的菌株的耐受性和发酵性进行测定,结果表明:脉冲强光可以筛选出发酵速率较高的10#和12#菌株。脉冲强光诱变处理并未对啤酒酵母的发酵度产生负面效应,而是有所提高或保持原酵母菌株的优良发酵性能。综上所述,脉冲强光筛选出的菌株具有生产出优良啤酒的能力。
参考文献:
[1]励建荣, 夏道宗. 高压脉冲电场与脉冲强光灭菌技术的研究[J]. 食品研究与开发, 2002, 23(5): 71-72.
[2]田承斌. 脉冲强光杀菌在水处理中的应用[J]. 饮料工业, 2001, 4(4): 31-32.
[3]周素梅. 脉冲光杀菌新技术在食品及包装中的应用[J]. 广州食品工业科技, 1999, 15(2): 55-57.
[4]罗志刚, 杨连生. 脉冲强光技术在食品工业中的应用[J]. 食品工业, 2002, 23(5): 44-46.
[5]李汴生, 阮征. 非热杀菌技术与应用[M]. 北京: 化学工业出版社, 2004: 209-217.
[6]周万龙, 任赛玉, 黄建军, 等. 自动控制脉冲强光杀菌装置的研制[J].食品与机械, 1997, 13(5): 12-13.
[7]周万龙, 高大维, 夏小舒. 脉冲强光杀菌技术的研究[J]. 食品科学, 1998, 19(1): 16-19.
[8]MACGREGOR S J, ROWAN N J, MCILVANEY L, et al. Light inactivation of food-related pathogenic bacteria using a pulsed power source[J]. Letters in Applied Microbiology, 1998, 27(2): 67-70.
[9]WEKHOF A, TROMPETER F J, FRANKEN O. Pulsed UV disintegration (PUVD): a new sterilisation mechanism for packaging and broad medical-hospital applications[C]//The First International Conference on Ultraviolet Technologies, Washington DC, 2001: 14-16.
[10]WEKHOF A. Pulsed UV to sterilize food packaging and to preserve food stuffs[J]. Newsletter of International UV Association, 2002, 4(5): 4-8.
[11]WEKHOF A. Sterilization of packaged pharmaceutical solutions, packaging and surgical tools with pulsed UV light[C]//Proceedings of the Second International Congress UV Technologies, Vienna, Austria, 2003: 9-11.
[12]TAKESHITA K, SHIBATO J, SAMESHIMA T, et al. Damage of yeast cells induced by pulsed light irradiation[J]. International Journal of Food Microbiology, 2003, 85(1/2): 151-158.
[13]SINTON L W, HALL C H, LYNCH P A, et al. Sunlight inactivation of fecal indicator bacteria and bacteriophages from waste stabilization pond effluent in fresh and saline waters[J]. Applied and Environmental Microbiology, 2002, 68(3): 1122-1131.
[14]WHITMAN R L, NEVERS M B, KORINEK G C, et al. Solar and temporal effects on Escherichia coli concentration at a Lake Michigan swimming beach[J]. Applied and Environmental Microbiology, 2004, 70(7): 4276-4285.
[15]WALKER D C, LEN S V, SHEEHAN B. Development and evaluation of a reflective solar disinfection pouch for treatment of drinking water[J]. Applied and Environmental Microbiology, 2004, 70(4): 2545-2550.
[16]CASLAKE L F, CONNOLLY D J, MENON V, et al. Disinfection of contaminated water by using solar irradiation[J]. Applied and Environmental Microbiology, 2004, 70(2): 1145-1151.
[17]郝林. 食品微生物学实验技术[M]. 北京: 中国农业出版社, 2001: 145.
[18]李里特. 现代食品杀菌技术的原理与特点[J]. 食品与机械, 1992, 8(6): 17-20.
[19]张佰清, 付会鹏, 陈丹. 脉冲强光对两种霉菌和两种酵母菌的杀菌效果研究[J]. 食品工业科技, 2010, 31(6): 125-126.
[20]魏甲乾, 王治业, 陆栋, 等. 重离子辐照酿酒酵母及其产酒能力初步研究[J]. 中国酿造, 2007, 26(12): 17-18.
[21]凌猛, 祖国仁, 曹磊. 高耐性优良啤酒酵母菌的选育及其高浓发酵后啤酒风味的研究[J]. 中国酿造, 2010, 29(10): 92-95.
[22]彭源德, 朱作华, 唐守伟, 等. 耐高温, 高浓度酒精酵母的选育与耐受性能初步鉴定[J]. 中国麻业科学, 2010, 32(3): 135-139.
[23]邱秀文, 郭晓燕, 吴晓玉, 等. 三种啤酒酵母菌种发酵性能的比较[J].中国酿造, 2011, 30(1): 40-43.
[24]夏雪. 酵母的凝聚性及其检测方法的探讨[J]. 啤酒科技, 2005(8): 33-34.
[25]DZWOLAK W, KATO M, SHIMIZU A, et al. Fourier-transform infrared spectroscopy study of the pressure-induced changes in the structure of the bovine α-lactalbumin: the stabilizing role of the calcium ion[J]. Biochimica et Biophysica Acta (BBA)-Protein Structure and Molecular Enzymology, 1999, 1433(1/2): 45-55.
[26]GB/T 4928—2008 啤酒分析方法[S].
ZHANG Baiqing, SUN Lanmeng
(College of Food Science, Shenyang Agricultural University, Shenyang 110866, China)
Abstract: Pulsed light irradiation treatment was applied on Saccharomyces cerevisiae (S. cerevisiae) under varying conditions of voltage (1 000, 1 500, 2 000, 2 500, and 3 000 V) and pulse number (4, 8, 16, 32, and 48). A comparative analysis between the variant and original strains was performed for differences in flocculation ability, diacetyl production, physico-chemical properties of fermentation products and fermentation rate. Mutant strains 10# and 12# with good fermentation characteristics were obtained by primary and secondary screening. Our results showed that pulsed light irradiation did not negatively affect but maintained or even enhanced the fermentation performance of S. cerevisiae.
Key words: pulsed light; Saccharomyces cerevisiae; mutagenesis; variant strain; original strain
doi:10.7506/spkx1002-6630-201507028
中图分类号:TS201.3
文献标志码:A
文章编号:1002-6630(2015)07-0153-05
作者简介:张佰清(1966—),男,教授,博士,研究方向为食品工程技术的开发和应用。E-mail:sybaiqingxl@sina.com
收稿日期:2014-05-19