表1 果蝇抗氧化基因PCR引物
Table 1 PPCR primers for the detection of mRNA expression of antioxidant genes in Drosophila melanogaster

赵 江1,陈 纯1,韩晓东2,刘素稳3,马 娜1,4,王 浩1,*
(1.天津科技大学食品工程与生物技术学院,天津 300457;2.天津津酒集团,天津 300131;
3.河北科技师范学院食品科技学院,河北 秦皇岛 066600;4.天津科技大学生物工程学院,天津 300457)
摘 要:目的:研究根皮苷(phloridzin)对雌性果蝇寿命的影响并探究其延缓果蝇衰老的分子机制。方法:在果蝇寿命实验中,采用2 日龄雌性果蝇作为研究对象,在其培养基中分别加入0、0.5、2.0、5.0 mg/mL根皮苷进行培养,直至果蝇全部死亡, 计算果蝇的平均寿命和最长寿命; 通过白草枯和双氧水急性实验测定根皮苷对果蝇氧化应激损伤的影响;试剂盒法测定果蝇体内抗氧化酶活力;实时荧光定量聚合酶链式反应(real-time polymerase chain reaction,real-time PCR)检测抗氧化基因表达水平。结果:2.0、5.0 mg/mL根皮苷可以显著延长果蝇的平均寿命和最长寿命(P<0.05);根皮苷能够对百草枯和双氧水造成的雌性果蝇氧化应激损伤起到有效保护作用;添加 5.0 mg/mL根皮苷 可以极显著提高Cu/Zn-超氧化物歧化酶(superoxide dism utase,SOD)和过氧化氢酶(catalase,CAT)活力(P<0.01),极显著降低丙二醛(malonaldehyde,MDA)含量(P<0.01);添加5.0 mg/mL根皮苷可以极显著上调Cu/Zn-SOD及CAT mRNA表达水平(P<0.01)。结论:根皮苷能够延缓雌性果蝇衰老,且具有抗氧化作用,这可能与其调控抗氧化基因的表达水平相关。
关键词:果蝇;根皮苷;寿命;抗氧化;酶活力;基因表达
根皮苷(phlorizin)属于二氢查尔酮根皮素的糖苷衍生物[1-2],在苹果树的根、皮、嫩叶以及多穗柯甜茶中含量比较丰富[3-4]。冯天艳等[5]研究发现根皮苷能显著抑制由四氯化碳(CCl4)引起的小鼠自由基和脂质过氧化物的产生,显著提高机体的抗氧化能力。Rezk等[6]研究发现根皮素能有效清除过氧亚硝基阴离子和抑制脂质过氧化。Vasantha Rupasinghe等[7]研究发现根皮苷的抗氧化活性强于VE,可以抑制多元不饱和脂肪酸的氧化。根皮苷具有抗氧化性,能够显著延长酵母菌的寿命,其在延缓衰老及研究抗衰老药物方面引起了广泛关注[8]。
果蝇(Drosoph ila melanogaster)具有与人类十分相似的衰老基因[9-10],因此常被用作衰老生物模型。根皮苷具有多种生物活性,如调 节血压、保护心脏、降血脂[11]、清除自由基[6-7]等,是药用植物中主要活性成分之一,因而已广泛运用于医药、化妆品、食品、植物组织培养等领域。然而,国内对于根皮苷抗氧化性的研究较少,其作用机理尚不明确。本实验以雌性黑腹果蝇为模式生物,研究根皮苷对果蝇寿命、氧化应激损伤、体内抗氧化酶活力及丙二醛(malonaldehyde,MDA)含量的影响,并从分子水平研究根皮苷对抗氧化相关基因超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)及methuselah(MTH,一种长寿基因)mRNA表达水平的影响。
1.1 材料、动物与试剂
根皮苷(纯度95%),由天津尖峰天然产物研究开发有限公司提供。
Oregon K野生型雌性黑腹果蝇,由天津科技大学食品添加剂与营养调控研究室提供。
分型SOD(Cu/Zn-SOD、Mn-SOD、总SOD)试剂盒、CAT试剂盒、MDA试剂盒 南京建成生物工程研究所;Trizol试剂、cDNA合成试剂盒、SYBR Green日本TaKaRa公司。
1.2 仪器与设备
UVmini-1240紫外-可见分光光度计 日本岛津公司;MyiQ2实时荧光定量聚合酶链式反应(real-time polymerase chain reaction,real-time PCR)仪 美国Bio-Rad公司;HWS-850智能恒温恒湿培养箱 宁波海曙赛福实验仪器厂。
1.3 方法
1.3.1 果蝇培养基的配制
基础培养基:蒸馏水750 mL、玉米粉72 g、葡萄糖72 g、酵母粉10 g、琼脂粉6 g、防腐剂(含质量分数为1%对羟基苯甲酸乙酯的75%乙醇溶液)40 mL,小火加热并充分搅拌混匀至琼脂完全溶化,停火后立即分装到洁净的果蝇培养试管中,培养基厚度约为1.0 cm。
给药培养基:在基础培养基中分别添加0.5、2.0、5.0 mg/mL根皮苷。
1.3.2 果蝇寿命实验
收集2 日龄Oregon K野生型雌性黑腹果蝇800 只,随机分为4 组,每组10 管,每管20 只,培养在温度(25±1)℃,相对湿度50%~60%的恒温恒湿培养箱内。果蝇管内注入定量培养基,对照组果蝇饲喂基础培养基,给药组果蝇饲喂给药培养基。保鲜膜封口培养果蝇,并留呼吸孔,每3 d更换一次新鲜培养基,同时观察果蝇的生存状况,记录果蝇死亡数量,直至果蝇全部死亡。最后统计果蝇的平均寿命和最长寿命(每组最后存活的20 只果蝇的平均寿命)。
果蝇体质量的测定:收集40 日龄果蝇,禁食2 h后,CO2麻醉放于EP管中,每管20 只,称质量,分别计算各组果蝇的平均体质量。
1.3.3 果蝇急性氧化应激损伤实验
饲喂方法同寿命实验,收集给药25 日龄果蝇,禁食2 h,CO2麻醉导入干净无培养基的果蝇培养试管内,用滤纸条沾少许含30% H2O2的6%葡萄糖水溶液插入果蝇管内,保证滤纸全部浸润且不会有液滴流下,每2 h记录果蝇死亡数,直至果蝇全部死亡,期间每隔4 h用注射器补给适量的H2O2液体保证滤纸条湿润。同样用20 mmol/L百草枯的6%葡萄糖水溶液替代滤纸条沾取的H2O2溶液,其余操作步骤相同,研究根皮苷对H2O2和百草枯所造成的果蝇急性氧化应激损伤的影响。
1.3.4 果蝇抗氧化酶活力和抗氧化基因表达水平的测定
果蝇培养同寿命实验方法,收集40 日龄果蝇,禁食2 h后,CO2麻醉放于EP管中,每管20 只,称质量,并进行平均体质量的计算,存放于-80 ℃进行后续酶活力和基因表达的测定。冰浴条件下,按照m(果蝇体质量)∶m(生理盐水)=1∶49注入生理盐水并用玻璃匀浆器匀浆,4 ℃、2 500 r/min离心20 min,收集上清液测定SOD酶活力(黄嘌呤氧化酶法)、CAT酶活力(可见 光法)、蛋白质含量(考马斯亮蓝法)及MDA含量(硫代巴比妥酸法)。加入Trizol液氮研磨果蝇,离心得到RNA,并反转录得到cDNA。Real-time PCR法检测抗氧化相关基因mRNA的表达水平,引物序列见表1。
表1 果蝇抗氧化基因PCR引物
Table 1 PPCR primers for the detection of mRNA expression of antioxidant genes in Drosophila melanogaster

1.4 数据处理
采用SPSS Statistics 17.0软件进行分析,通过方差分析进行统计学显著性检验,以P<0.05为差异具有统计学意义。数据表示为±s。
2.1 根皮苷对雌性果蝇寿命的影响
如表2和图1所示,根皮苷对果蝇体质量无明显影响,各组间差异不显著(P>0.05)。给药组果蝇的平均寿命及最长寿命均高于对照组,且呈剂量依赖关系。其中5.0 mg/mL根皮苷组雌性果蝇的平均寿命延长了16.3% (P<0.05),最长寿命延长了12.4%(P<0.01)。
表2 根皮苷对雌性果蝇体质量和寿命的影响( ±s,n=220000)
±s,n=220000)
Table 2 Effect of phlorizin on body weight and lifespan in female Drosophila melanogaster (( ±s, n = 20000))
±s, n = 20000))

注:*.与对照组相比,差异显著(P<0.05);**.与对照组相比,差异极显著(P<0.01)。

图1 雌性果蝇寿命曲线
Fig.1 Lifespan curves of female Drosophila melanogaster
2.2 根皮苷对双氧水和百草枯所致雌性果蝇急性氧化应激损伤的影响

图2 根皮苷对急性氧化应激损伤雌性果蝇的影响
Fig.2 Effect of phlorizin on oxidative stress-induced damage in female Drosophila melanogaster
a. H2O2氧化应激损伤;b. 百草枯氧化应激损伤。
如图2a所示,饲喂根皮苷的雌性果蝇体内清除H2O2自由基的能力显著提高,0.5、2.0、5.0 mg/mL根皮苷组果蝇的平均存活时间较对照组分别延长了4.0%、17.4%和
23.9 %,最高存活时间延长了3.9%、13.6%和18.7%。饲喂根皮苷的雌性果蝇抵抗百草枯氧化应激损伤的能力亦显著提高(图2b),0.5、2.0、5.0 mg/mL根皮苷组雌性果蝇的平均存活时间较对照组分别延长了3.5%、10.7%和17.2%,最高存活时间延长了4.2%、12.7%和18.9%。
2.3 根皮苷对雌性果蝇体内SOD、CAT酶活力和mRNA表达及MDA含量的影响
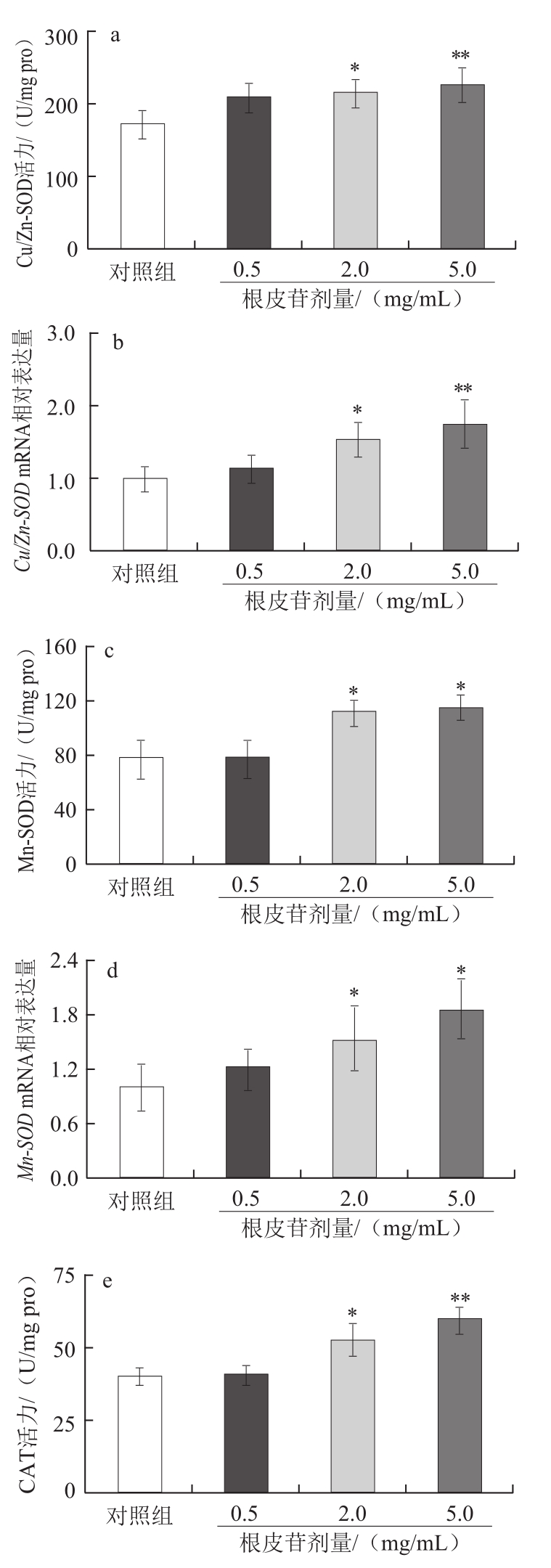

图3 根皮苷对雌性果蝇体内Cu/Zn-SOD、Mn-SOD、CAT酶活力和mRNA表达以及MDA含量的影响
Fig.3 Effect of phlorizin on Cu/Zn-SOD, Mn-SOD and CAT activities, mRNA expression and MDA content in female Drosophila melanogaster
*. 与对照组相比,差异显著(P<0.05);**. 与对照组相比,差异极显著(P<0.01)。
如图3所示,与对照组相比,2.0 mg/mL根皮苷组雌性果蝇体内Cu/Zn-SOD、Mn-SOD、CAT酶活力显著升高(P<0.05),5.0 mg/mL根皮苷组Cu/Zn-SOD、CAT酶活力极显著升高(P<0.01);2.0 mg/mL和5.0 mg/mL根皮苷组雌性果蝇体内MDA水平极显著降低(P<0.01),且效果呈剂量依赖关系。与对照组相比,2.0 mg/mL根皮苷组雌性果蝇体内Cu/Zn-SOD、Mn-SOD、CAT mRNA 表达水平显著上调(P<0.05),5.0 mg/mL根皮苷组Cu/Zn-SOD、CAT mRNA 表达水平极显著上调(P<0.01)。给药组雌性果蝇体内MTH mRNA表达水平随根皮苷剂量增加呈下调趋势,其中5.0 mg/mL根皮苷组较对照组显著下调(P<0.05)。
饲喂根皮苷后,雌性果蝇的平均寿命和最长寿命均高于对照组,其中2.0、5.0 mg/mL根皮苷组较对照组雌性果蝇平均寿命及最长寿命均显著延长(P<0.05);百草枯在细胞内活化产生的超氧阴离子自由基(O2-·)与H2O2产生的羟自由基(•OH)会诱导雌性果蝇产生急性氧化应激损伤。结果表明,根皮苷可以有效延长雌性果蝇的寿命以及减弱由H2O2和百草枯引起的急性氧化应激损伤。
抗氧化酶活力测定结果显示,给药组雌性果蝇体内SOD、CAT酶活力比对照组明显提高,MDA含量较对照组明显降低。SOD和CAT是生物体内清除活性氧的主要酶,这两种酶相偶联可以清除体内O2-·和•OH等活性氧,因此SOD和CAT的活力水平间接反映机体清除氧自由基的能力[12-13],而MDA是自由基作用于不饱和脂肪酸而产生的脂质过氧化产物,通常作为机体脂质过氧化程度的指标[14-15]。Cui Xiaojing等[16]通过组织培养的方法研究发现根皮苷能够有效改善西府海棠根系保护酶的活性,包括SOD、过氧化物酶(peroxidase,POD)、CAT等,并显著降低MDA含量。董华强等[11]从甜茶多穗柯中制备并分离得到根皮苷,并证明用根皮苷灌胃糖尿病模型小鼠可以有效地降低小鼠血糖水平和提高抗氧化能力。根皮苷可以淬灭自由基和单线态氧[15,17],防止脂质过氧化和DNA氧化损伤。根皮苷也可以有效减少大鼠肝细胞线粒体体外脂质过氧化,有效清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS+·)等过量自由基[18-19]。
Real-time PCR测定结果显示,雌性果蝇体内抗氧化相关基因SOD、CAT等mRNA的表达水平显著上调(P<0.05),这与果蝇体内酶活力升高的趋势相一致。Tolmasoff等[20]报道了SOD的活性与灵长类动物的寿命相关,研究表明超表达Cu/Zn-SOD和CAT的转基因果蝇寿命比野生型长34%[21],而单独超表达CAT也能延长鼠科动物的寿命[22]。MTH mRNA表达水平呈下调趋势,Baldal等[23]的研究表明敲除MTH内源性配体基因或者过表达MTH受体的肽类拮抗剂均能延长果蝇的寿命。这与Rezk[6]和Lee[19]等研究发现苹果多酚和茶黄素等可以有效提高果蝇体内SOD、CAT等抗氧化酶相关基因表达水平、下调MTH表达水平,增强果蝇体内抗氧化酶活力,有效延长果蝇寿命的结果相一致。
根皮苷是苹果含有的特征酚类物质,多以糖苷的形式存在[24-25],现代药理学研究表明根皮苷具有抗氧化[1]等生理功效。自由基学说是目前公认的衰老学说之一,自由基对细胞的各种成分和结构都可产生损伤效应,这些效应的累积势必造成细胞功能的减退,可以说衰老是自由基损伤性效应的综合结果。机体的抗氧化作用可保持自由基的产生与消除的平衡,对预防疾病与抗衰老等有重要意义。根皮苷具有较强的抗氧化活性,能够显著提高雌性果蝇的抗氧化能力,其机制很可能与根皮苷清除自由基、提高机体内抗氧化酶活性以及调控抗氧化基因mRNA的表达水平有关,但其具体的分子机制还需进一步深入研究。
参考文献:
[1]GOSCH C, HALBWIRTH H, STICH K. Phloridzin: biosynthesis, distribution and physiological relevance in plants[J]. Phytochemistry, 2010, 71(8/9): 838-843.
[2]EHRENKRANZ J R L, LEWIS N G, RONALD KAHN C, et al. Phlorizin: a review[J]. Diabetes/Metabolism Research and Reviews, 2005, 21(1): 31-38.
[3]FENG Tao, CHEN Xuesen, ZHANG Yanmin, et al. Antioxidation and phenolic constituents in Xinjiang wild apple [Malus sieversii (Lebed.) Roem.]leaf[J]. Scientia Agricultura Sinica, 2008, 41(8): 2386-2391.
[4]GONZÁLEZ-GALLEGO J, GARCÍA-MEDIAVILLA M, SÁNCHEZCAMPOS S, et al. Fruit polyphenols, immunity and infl ammation[J]. British Journal of Nutrition, 2010, 104(Suppl 3): 15-27.
[5]冯天艳, 方荣, 邓改改, 等. 根皮苷对小鼠CCl4急性肝损伤的保护作用[J]. 中药药理与临床, 2010, 26(5): 47-50.
[6]REZK B M, HAENEN G R M M, van der VIJGH W J F, et al. The antioxidant activity of phloretin: the disclosure of a new antioxidant pharmacophore in flavonoids[J]. Biochemical and Biophysical Research Communications, 2002, 295(1): 9-13.
[7]VASANTHA RUPASINGHE H P, YASMIN A. Inhibition of oxidation of aqueous emulsions of omega-3 fatty acids and fi sh oil by phloretin and phloridzin[J]. Molecules, 2010, 15(1): 251-257.
[8]XIANG Lan, SUN Kaiyue, LU Jun, et al. Anti-aging effects of phloridzin, an apple polyphenol, on yeast via the SOD and Sir2 genes[J]. Bioscience, Biotechnology, and Biochemistry, 2011, 75(5): 854-858.
[9]HARMAN D. The aging process[J]. Proceedings of the National Academy of Sciences, 1981, 78(11): 7124-7128.
[10]JI L L. Antioxidant enzyme response to exercise and aging[J]. Medicine and Science in Sports and Exercise, 1993, 25(2): 225-231.
[11]董华强, 宁正祥, 于立静, 等. 多穗柯黄酮根皮苷对糖尿病小鼠的降血糖血脂效果[J]. 食品科学, 2007, 28(12): 714-718.
[12]BEAL M F. Aging, energy, and oxidative stress in neurodegenerative diseases[J]. Annals of Neurology, 1995, 38(3): 357-366.
[13]GUPTA S C, SIDDIQUE H R, SAXENA D K, et al. Hazardous effect of organophosphate compound, dichlorvos in transgenic Drosophila melanogaster (hsp70-lacZ): induction of hsp70, anti-oxidant enzymes and inhibition of acetylcholinesterase[J]. Biochimica et Biophysica Acta (BBA)-General Subjects, 2005, 1725(1): 81-92.
[14]NIELSEN F, MIKKELSEN B B, NIELSEN J B, et al. Plasma malondialdehyde as biomarker for oxidative stress: reference interval and effects of life-style factors[J]. Clinical Chemistry, 1997, 43(7): 1209-1214.
[15]善利, 刘林德. 遗传学实验教程[M]. 北京: 科学出版社, 2004: 36-38.
[16]CUI Xiaojing, WANG Yanan, ZHEN Wenchao. The effects of phlorizin stress on the protective enzyme and metabolic regulation substances in the root of M. micromalus[J]. Frontiers of Agriculture in China, 2010, 4(3): 323-327.
[17]NIELSEN F, MIKKELSEN B B, NIELSEN J B, et al. Plasma malondialdehyde as biomarker for oxidative stress: reference interval and effects of life-style factors[J]. Clinical Chemistry, 1997, 43(7): 1209-1214.
[18]ZUO Airen, YU Yanying, SHU Qinglong, et al. Hepatoprotective effects and antioxidant, antityrosinase activities of phloretin and phloretin isonicotinyl hydrazone[J]. Journal of the Chinese Medical Association, 2014, 77(6): 290-301.
[19]LEE K W, KIM Y J, KIM D O, et al. Major phenolics in apple and their contribution to the total antioxidant capacity[J]. Journal of Agricultural and Food Chemistry, 2003, 51(22): 6516-6520.
[20]TOLMASOFF J M, ONO T, CUTLER R G. Superoxide dismutase: correlation with life-span and specific metabolic rate in primate species[J]. Proceedings of the National Academy of Sciences, 1980, 77(5): 2777-2781.
[21]ORR W C, SOHAL R S. Extension of life-span by overexpression of superoxide dismutase and catalase in Drosophila melanogaster[J]. Science, 1994, 263: 1128-1130.
[22]SCHRINER S E, LINFORD N J, MARTIN G M, et al. Extension of murine life span by overexpression of catalase targeted to mitochondria[J]. Science, 2005, 308: 1909-1911.
[23]BALDAL E A, BAKTAWAR W, BRAKEFIELD P M, et al. Methuselah life history in a variety of conditions, implications for the use of mutants in longevity research[J]. Experimental Gerontology, 2006, 41(11): 1126-1135.
[24]SEMBRIES S, DONGOWSKI G, MEHRLÄNDER K, et al. Physiological effects of extraction juices from apple, grape, and red beet pomaces in rats[J]. Journal of Agricultural and Food Chemistry, 2006, 54(26): 10269-10280.
[25]POHL C, WILL F, DIETRICH H, et al. Cytochrome P450 1A1 expression and activity in Caco-2 cells: modulation by apple juice extract and certain apple polyphenols[J]. Journal of Agricultural and Food Chemistry, 2006, 54(26): 10262-10268.
ZHAO Jiang1, CHEN Chun1, HAN Xiaodong2, LIU Suwen3, MA Na1,4, WANG Hao1,*
(1. School of Food Engineering and Biological Technology, Tianjin University of Science and Technology, Tianjin 300457; 2. Tianjin Jinjiu Group Co. Ltd., Tianjin 300131, China; 3. College of Food Science and Technology, Hebei Normal University of Science and Technology, Qinhuangdao 066600; 4. College of Biotechnology, Tianjin University of Science and Technology, Tianjin 300457)
Abstract: Objective: To explore the effect of phlorizin on lifespan in female Drosophila melanogaster and its underlying mechanism. Methods: Two-day-old flies were reared in media containing 0, 0.5, 2.0 and 5.0 mg/mL phlorizin until they all died, and then the longest lifespan and mean lifespan were calculated. By paraquat and hydrogen peroxide acute experiments, the effect of phlorizin on oxidative stress injury in Drosophila melanogaster was determined. The antioxidant capacity of phlorizin was evaluated by the activities of superoxide dismutase (T-SOD and Cu/Zn-SOD), catalase (CAT) and malondialdehyde (MDA) content in fruit flies. Re al-time PCR was used to detect the expression of antioxidant genes. Results: Dietary addition of phlorizin could prolong the lifespan of Drosophila melanogaster (especially at 2.0, 5.0 mg/mL, P < 0.05). The Cu/Zn-SOD and CAT activities were significantly increased and MDA content was significantly decreased by dietary supplementation of 5.0 mg/mL phlorizin (P < 0.01). Moreover, a significant increa se in Cu/Zn-SOD and CAT mRNA expression (P < 0.01) was found. Conclusion: The anti-aging and antioxidant acti v ity of phlorizin is most likely related to the regulation of antioxidant gene expression.
Key words: Drosophila melanogaste; phlorizin; lifespan; antioxidant; enzyme activity; gene expression
doi:10.7506/spkx1002-6630-201507031
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2015)07-0167-05
*通信作者:王浩(1979—),男,副教授,博士,主要从事食品营养学研究。E-mail:wanghao@tust.edu.cn
作者简介:赵江(1963—),男,研究员,硕士,主要从事食品营养学研究。E-mail:tozjmail@163.com
基金项目:国家自然科学基金青年科学基金项目(31201322);“十二五”国家科技支撑计划项目(2012BAD33B05);天津市高等学校科技发展基金计划项目(20100609);天津科技大学行业卓越人才实验班专项(1314A216)
收稿日期:2014-05-30