表1 KGM和CMK的基本理化性质( ±s)
±s)
Table 1 Physicochemical properties of KGM and CMK ( ±s)
±s)
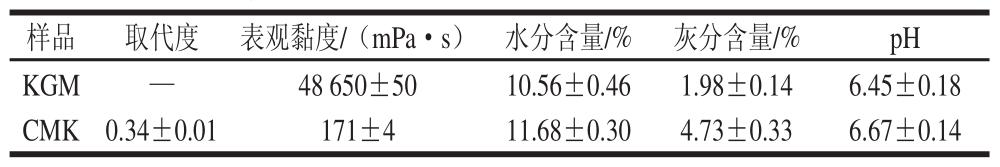
注:—. 无测定值。
徐小青1,秦清娟1,吴 雨1,钟 耕1,2,*
(1.西南大学食品科学学院,重庆 400715;2.重庆市特色食品工程技术研究中心,重庆 400715)
摘 要:为深入了解羧甲基魔芋葡甘聚糖(carboxymethyl konjac glucomannan,CMK)的性能,本实验对其基本理化性质进行测定,并分析其对肠道发酵环境的影响,初步判定其是否会对肠道健康产生危害。结果表明:CMK的表观特性与魔芋葡甘聚糖(konjac glucomannan,KGM)较为相似,仍呈粉状,无臭无味,易溶于水,不溶于乙醇、乙醚等有机溶剂,但黏度显著降低,灰分含量显著增加。此外,通过体外发酵实验发现,与空白组相比,CMK对发酵产气量和短链脂肪酸含量均无显著影响(P>0.05),且对NH3-N含量有显著的降低作用,对大肠杆菌、双歧杆菌既无促生作用也无抑制作用,而对乳酸菌则显示了一定的促生作用。总之,相较KGM对肠道健康潜在的促进作用,CMK则对肠道健康无损害作用,也可说明它对肠道发酵环境是安全的。
关键词:羧甲基魔芋葡甘聚糖;理化性质;体外发酵;短链脂肪酸;微生物
据统计,食品包装材料约占包装产业的70%左右[1]。在破坏环境的垃圾中以塑料包装材质污染最为严重,其中有很大一部分来源于食品塑料包装废弃物,面对如此严峻的包装污染现状,已使得开发天然生物材料可食性包装材料成为食品包装领域研究的一大热点。
魔芋葡甘聚糖(konjac glucomannan,KGM)因其特殊的流变学性能、成膜性能以及生物活性,已得到广泛应用[2],1994年欧美国家相继立法批准其为健康食品及食品添加剂[3],同时,它也是目前所发现的自然界中黏度最高的多糖,但因其溶胀时间长,水溶胶稳定性差等特点,阻碍了其在很多领域的应用。羧甲基魔芋葡甘聚糖(carboxymethyl konjac glucomannan,CMK)是由KGM经化学醚化改性而得,并且因其引入了亲水的羧甲基基团,其溶解性、成膜性、抑菌性能大大提高[4],可以应用于包装、印染等方面[5]。并且相较于KGM,制成的膜溶解性较好,在热水中可完全溶解[6],用其制成热敏性可食膜,可用于奶粉、速溶咖啡的包装,是符合环境友好的天然生物材料。KGM已有很长的食用史,但其改性后所得CMK的食用性还有待研究,本实验研究其对肠道发酵环境的影响。
大量研究表明,肠道的健康与短链脂肪酸(shortchain fatty acid,SCFA)产量、肠道pH值、肠道中氨含量以及细菌活性等方面密切相关[7],用动物肠道内容物作为接种物进行体外发酵则是评价发酵底物对上述几项指标的一种经济、简捷的方法,并已广泛用于消化道微生物的发酵特性研究[8]。本研究利用KGM羧甲基化改性所制得的CMK作为原料,检测其基本理化性质,分析其对肠道发酵环境的影响,为CMK的安全应用提供一定的理论指导。
1.1 材料、试剂、培养基与动物
CMK由本实验室自制,制备方法参照夏玉红等[9]的微波制备法,实验结果以改性前的KGM为对照。
乙酸、丙酸、丁酸、戊酸 阿拉丁试剂(上海)有限公司;所用化学试剂除注明外,均为分析纯。
选择性培养基:BBL培养基(双歧杆菌) 青岛高科园海博生物技术有限公司;MRS培养基(乳酸菌) 杭州微生物试剂有限公司;EMB培养基(大肠杆菌) 北京奥博星生物技术有限责任公司;发酵培养基[10-11]:1 g胰蛋白胨,1 g酵母浸粉,微量元素0.1 mL(132 g/L CaCl2·2H2O、100 g/L MnSO4·4H2O、80 g/L FeC13·6H2O),常量元素200 mL(9.45 g/L Na2HPO4、6.2 g/L KH2PO4、0.6 g/L MgSO4·7H2O),缓冲溶液200 mL(4 g/L (NH4)HCO3、35 g/L NaHCO3),纯水500 mL。
实验动物为昆明种(Kunming mice,KM)小鼠(SCXK(渝)2012-0003),由重庆市实验动物中心提供,肠道内容物在无菌条件下从健康成年KM小鼠盲肠中取出。
1.2 仪器与设备
HH-6数显恒温水浴锅 金坛市富华仪器有限公司;NDJ-5S数字式黏度计 上海精天电子仪器有限公司;HunterLab色差计 美国UltraScan公司;Spectrum 100红外光谱分析仪 美国Perkin Elmer公司;PHS-3C pH计 上海盛磁仪器有限公司;FA 1004电子天平上海精科天平厂;Sepctrumlab22可见分光光度计上海棱光技术有限公司;ES-315高压蒸汽灭菌锅 日本Kagoshima Seisakusyo公司;厌氧培养箱 美国Sheldon Manufacturing股份有限公司;ZWY-1112B恒温摇床培养箱 上海智城仪器制造有限公司;DHP-9082电热恒温培养箱 上海齐欣科学仪器有限公司;GC-2010气相色谱仪 日本岛津公司;单人双面净化工作台 苏净集团安泰公司。
1.3 方法
1.3.1 理化指标测定方法
1.3.1.1 取代度(degree of substitution,DS)测定
采用酸洗法[12-13]测定取代度。
1.3.1.2 表观黏度测定
参照NY/T 494—2010《魔芋粉》的方法[14]测定表观黏度。
1.3.1.3 色度和白度值测定
参考Benjakul等[15]和GB/T 22427.6—2008《淀粉白度测定》方法[16],采用HunterLab UltraScan Pro色差仪进行测定。
1.3.1.4 水分含量测定
参照GB 5009.3—2010《食品中水分的测定》[17]。
1.3.1.5 灰分的测定
参照GB/T 5009.4—2010《食品中灰分的测定》[18]。
1.3.1.6 pH值测定
参照GB/T 10468—89《水果和蔬菜产品pH值的测定方法》[19]。
1.3.1.7 傅里叶红外光谱分析
将待测样于105 ℃干燥后,冷却,采用KBr压片法,样品与KBr按1∶100的比例充分研磨、混匀、压片,在4 000~450 cm-1区间扫描,得到红外吸收光谱,分析所含基团的异同[20-22]。
1.3.2 CMK对肠道发酵环境的影响性评价
无菌条件下取出健康成年KM小鼠盲肠内容物,装入预先灭菌的50 mL带盖离心管中,称质量后,以9 倍生理盐水稀释,迅速混匀后过滤。发酵液培养:设置CMK添加量为1%(CMK组),KGM添加量为1% (KGM组),同时设定0.5% CMK+0.5%葡萄糖(Glu)底物组(CMK+Glu组),1% Glu阳性对照组(Glu组),以及不含碳源(即不含CMK和Glu)的阴性对照组(空白组),接种体积分数10%的粪悬液至发酵培养基,摇匀,于密闭培养管(专用注射器)中37 ℃厌氧振荡培养24 h。取适量进行微生物分离鉴定,然后以20 g/L CuSO475 μL终止发酵。
1.3.2.1 产气量测定[23]
向培养管加入发酵培养液50 mL,放置到恒温培养振荡器中培养计时,在2、4、6、8、12、14、16、24 h各时间点取出培养管并快速读数记录。当到某一时间点读数超过100 mL时,在读数后及时排气并记录排气后的刻度值。
1.3.2.2 pH值测定
取终止发酵后的发酵液样品5 mL测pH值。
1.3.2.3 游离氨(NH3-N)含量测定[24-25]
标准曲线的测定:分别取NH4Cl溶液0、16、32、48、64、80 μL,不足80 μL以水补足,加入2.5 mL苯酚显色剂,再加入2 mL次氯酸盐试剂,37 ℃水浴15 min,室温保存30 min,于625 nm波长处测定吸光度,制作标准曲线。
发酵液样品于4 000 r/min条件下离心5 min,吸取上清液80 μL至试管中,依次加入2.5 mL苯酚显色剂及2 mL次氯酸盐试剂,振荡均匀,37 ℃水浴15 min,室温保存30 min,于625 nm波长处测定吸光度。利用标准曲线计算NH3-N含量。
1.3.2.4 短链脂肪酸含量测定[26]
取5 mL发酵培养液,3 500 r/min离心5 min,将上清液经0.22 μm超滤膜过滤后,取2 mL滤液于5 mL离心管中,再加入200 μL体积分数50%的硫酸,1 mL无水乙醚,充分振荡,于4 ℃冰箱中保存1 h,取上层有机溶剂经气相色谱测定。
气相色谱条件:Rtx-wax柱(30 m×0.25 mm,0.25 µm);进样口温度220 ℃;压力74.5 kPa;总流量10.7 mL/min;柱流量0.77 mL/min,线速率22.9 cm/s,柱温90.0 ℃,平衡时间0.5 min,5 ℃/min升温至150 ℃,保留时间7 min;进样量1 μL;吹扫流量3.0 mL/min;分流比8∶9;检测器温度230 ℃,尾吹流量40.0 mL/min,氢气流量40.0 mL/min,空气流量400.0 mL/min。
1.3.2.5 微生物分离鉴定
取发酵培养液1 mL于装有9 mL无菌生理盐水的试管内,依次10 倍稀释至10-7。取10-5、10-6、10-73 个稀释度,进行平板培养,接种量为100 μL。大肠杆菌培养选用EMB培养基,37 ℃条件下恒温培养箱中培养24 h计数。双歧杆菌和乳酸杆菌分别选用BBL培养基和MRS培养基,在厌氧培养箱37 ℃条件下厌氧培养48 h计数。结果以lg(CFU/g)表示。
1.4 数据统计分析
采用SPSS 18及Excel 2010对实验数据进行计算统计,方差及显著性水平分析采用One way ANVOA。
2.1 理化指标
2.1.1 基本性质分析
表1 KGM和CMK的基本理化性质( ±s)
±s)
Table 1 Physicochemical properties of KGM and CMK ( ±s)
±s)

注:—. 无测定值。
制备所得C MK外观呈粉状,无臭无味,易溶于水,不溶于乙醇、乙醚等有机溶剂。由表1可知,KGM 的表观黏度为48 650 mPa·s,而经改性后所得的CMK表观黏度仅有171 mPa·s,降低了200多倍,这可能是由于反应过程中,在碱和醚化剂的作用下,KGM 的分子链发生部分断裂,分子质量减小的缘故。并且因其黏度降低,制成热敏性可食膜后,随着产品一起冲泡溶解后,对产品的口感影响就比较小,不会增大产品的黏度,而且其本身无臭无味,对产品的气味也不会产生影响。此外,改性后CMK的灰分含量与KGM相比,也有显著提高,这可能与改性所加入的化学物质有关,改性加入的氢氧化钠和氯乙酸,会生成很多氯化钠,便造成了CMK中的无机盐偏多,而导致灰分增大。
2.1.2 色度值和白度值
表2 CMK和KGM的色度值和白度值( ±s)
±s)
Table 2 Color parameters and whiteness of CMK and KGM (( ±s)
±s)
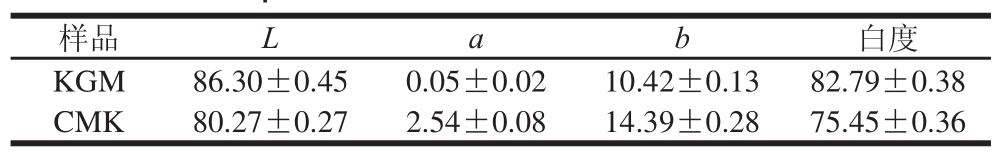
由表2可知,KGM的L、a、b值与改性后的样品CMK差异显著,说明两者的亮度、红度、黄度值在改性的过程中都受到了一定的变化。其中,CMK的亮度值虽然略有降低,但两者的亮度值都比较大,即改性前后亮度都很高;KGM的a值只有0.05,说明其红度极低;CMK的b值高于KGM,说明其黄度较高。在白度方面,虽然CMK的白度不及KGM,但相差并不是特别大,可见CMK在色度和白度方面并不逊色,制成包装膜后,CMK膜的透明度并不会比KGM膜差。
2.1.3 红外光谱分析
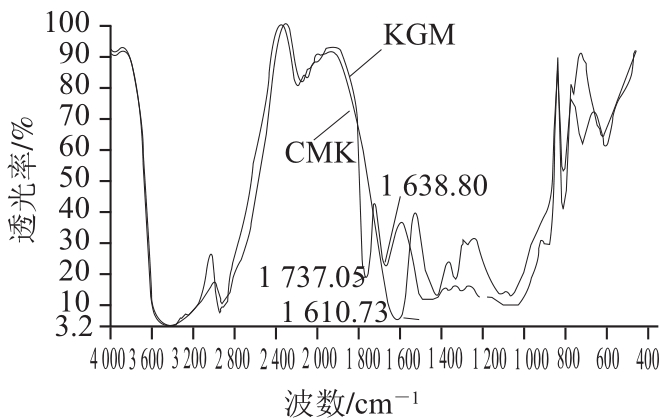
图1 CMK和KGM的红外光谱图
Fig.1 FT-IR spectra of KGM and CMK
由图1可知,KGM与CMK的结构有较大的差异,1 737.05 cm-1处吸收峰为KGM乙酰基中C=O基团的伸缩振动特征吸收,而CMK光谱在该处无峰,表明其乙酰基已被脱除,CMK在1 610.73 cm-1处明显增强的吸收峰,则表明羧甲基基团已经连接到KGM分子上。
2.2 CMK对肠道微生态的影响
2.2.1 发酵产气量变化趋势

图2 不同样品对小鼠肠道内容物体外发酵产气量的影响
Fig.2 Effects of different samples on gas production during in vitro fermentation
由图2可知,CMK组的发酵产气量与空白组无显著差异,CMK+Glu组的产气量则介于空白组与Glu组之间,说明CMK可能无法被肠道微生物分解,因而对肠道健康不会产生任何影响。相较于CMK,1% KGM在前12 h内几乎不产气,后期产气量迅速增加,而Glu组的产气量在后期基本不变,这可能是因为KGM分子质量大,分解利用需要一定的反应时间,也显示了其一定的肠道益生潜能。
2.2.2 发酵液pH值和NH3-N含量

图3 不同样品对发酵液pH值的影响
Fig.3 Effects of different samples on pH in f ermented products
小写字母不同表示差异显著(P<0.05)。下同。

图4 不同样品对发酵液NH3-N含量的影响
Fig.4 Effects of different samples on NH3-N contents in fermented products
发酵液pH值的变化主要受发酵过程中所产生的有机酸和NH3-N含量的影响,其值的升降表明有机酸含量或NH3-N含量可能发生了显著的变化[26]。各发酵液的初始pH值为7.84,由图3可知, CMK组与空白组pH值无显著差异(P>0.05),CMK+Glu组的pH值则与Glu组无显著差异(P>0.05),这说明CMK对肠道微生物的干扰很小,几乎可以忽略,而KGM组相较于空白组,pH值显著降低(P<0.05)。对比图3、4,可见相较于空白组,各组pH值与NH3-N含量的升降趋势是相对应的。
2.2.3 发酵液短链脂肪酸含量变化趋势

图5 不同样品对发酵液短链脂肪酸含量的影响
Fig.5 Effects of different samples on the contents of acetic acid, propanic acid, butyric acid and pentanoic acid in fermented products
从图5可知,相比于空白组,KGM组的发酵液中乙酸、丙酸、丁酸、戊酸含量均显著增加,而CM K组则与空白组无显著差异(P>0.05)。此外,CMK+Glu组也与Glu组基本无显著差异(P>0.05),并与空白组相比有所提高。此结果表明,KGM经改性后得到的CMK,由于结构的改变,部分功能性也发生了变化,肠道益生性能降低,但与空白组相比并无显著差异,也说明CMK不会影响到肠道菌群的正常生长。
2.2.4 发酵液微生物数量变化趋势

图6 不同样品对发酵液中微生物组成的影响
Fig.6 Effects of different samples on Lactobacillus, Bifi dobacterium and Enterobacter in fermented products
由图6可知,在本实验设计的几种肠道菌中,CMK组的大肠杆菌数和双歧杆菌数均与空白组无显著差异(P>0.05),添加CMK+Glu组与Glu组亦无显著差异(P>0.05),再次说明了CMK对肠道菌群的影响很小。相较于空白组,1% CMK显示出一定的乳酸菌增殖作用,说明CMK可能会对乳酸菌有一定的促生作用,并不会损害肠道健康。而相较于空白组,1% KGM则显著增加了双歧杆菌和乳酸菌的数量,显示了其潜在的益生性能。
本研究结果 表明,KGM经化学醚化改性后所得CMK表观性能与KGM较为接近,但黏度有大幅度的降低。此外,CMK对 盲肠内容物发酵液中有益菌(双歧杆菌、乳酸菌)和有害菌(大肠杆菌)的影响较小,产气量及pH值都与空白组无显著差异(P>0.05),NH3-N含量略有降低,几乎不会对肠道微生态产生负面影响,而KGM则可以显著提高有益菌的数量,提高短链脂肪酸浓度,降低NH3-N浓度及pH值。而CMK+Glu组在有益菌与有害菌的数量、pH值、NH3-N浓度以及短链脂肪酸的浓度上,与Glu组皆无显著差异,仅产气量约为Glu组的一半,进一步证明CMK对肠道健康的影响甚微。因而,将CMK作为可食性膜的原料对肠道发酵环境是安全的。从实验结果也可看出,相比于KGM,CMK对肠道益生菌的促生性能减弱,但因其溶解度的加强,使之更适合做热敏性膜的原料,黏度的降低则减小了包装膜对食品感官性能的影响,更适合作为可食膜的原料。
参考文献:
[1]侯汉学, 董海洲, 王兆升, 等. 国内外可食性与全降解食品包装材料发展现状与趋势[J]. 中国农业科技导报, 2011, 13(5): 79-81.
[2]徐焱春. 魔芋葡甘聚糖: 羧甲基淀粉复配胶的性质及应用研究[D].荆州: 长江大学, 2013: 9-17.
[3]MIN H Y, HYO G L. Physical properties of the films prepared with glucomannan extracted from Amorphophallus konjac[J]. Journal of Food Science and Technology, 1997, 29(2): 255-260.
[4]董佳. 羧甲基魔芋葡甘聚糖的抑菌性能和应用研究[D]. 重庆: 西南大学, 2011: 41-42.
[5]BIAWAS A, SHOGREN R L, SELLING G, et al. Rapid and environmentally friendly preparation of starch esters[J]. Carbohydrate Polymers, 2008, 74(1): 137-141.
[6]邓利玲, 吴雨, 秦清娟, 等. 热敏性珠芽魔芋葡甘聚糖可食膜配方优化[J]. 食品科学, 2013, 34(16): 113-119. doi: 10.7506/spkx1002-6630-201316023.
[7]TAN J, MCKENZIE C, POTAMITIS M, et al. Chapter three: the role of short-chain fatty acids in health and disease[J]. Advances in Immunology, 2014, 121: 91-119.
[8]MAURICIO R M, MOULD F L, DHANOA M S, et al. A semi-automated in vitro gas production technique for ruminant feed stuff evaluation[J]. Animal Feed Science and Technology, 1999, 79: 321-330.
[9]夏玉红, 律冉, 钟耕, 等. 微波法制备羧甲基魔芋葡甘聚糖的工艺及产物性能研究[J]. 食品科学, 2010, 31(14): 47-52.
[10]贺晋艳. 鹰嘴豆α-低聚半乳糖的制备、性质及其生理功能研究[D].南京: 南京农业大学, 2010.
[11]GOÑI I, MARTIN-CARRÓN NURIA M C. in vitro Fermentation and hydration properties of commercial dietary fiber-rich supplements[J]. Nutrition Research, 1998, 18(6): 1077-1089.
[12]姚献平, 郑丽萍. 淀粉衍生物及其在造纸中的应用技术[M]. 北京:中国轻工业出版社, 1999: 61-62.
[13]张小菊, 姜发堂. 羧甲基魔芋葡甘聚糖的制备及应用于空心胶囊的研究[J]. 食品科学, 2004, 25(10): 201-203.
[14]中华人民共和国农业部. NY/T 494—2010 魔芋粉[S]. 北京: 中国标准出版社, 2010.
[15]BENJAKUL S, VISESSANGUAN W, SRIBILAI C. Porcine plasma protein as proteinase inhibitor in bigeye snapper (Priacanthus tayenus) muscle and surimi[J]. Journal of the Science of Food and Agriculture, 2001, 81(10): 1039-1046.
[16]中华人民共和国国家质量监督检验检疫总局. GB/T 22427.6—2008淀粉白度测定[S]. 北京: 中国标准出版社, 2008.
[17]中华人民共和国卫生部. GB/T 5009.3—2010 食品中水分的测定[S].北京: 中国标准出版社, 2010.
[18]中华人民共和国卫生部. GB/T 5009.4—2010 食品中灰分的测定[S].北京: 中国标准出版社, 2010.
[19]中华人民共和国商业部. GB/T 10468—1989 水果和蔬菜产品pH值的测定方法[S]. 北京: 中国标准出版社, 1989.
[20]侯占伟. 魔芋葡甘聚糖的化学改性及其性质研究[D]. 武汉: 武汉理工大学, 2008: 51-52.
[21]何晋浙, 邵平, 倪慧东, 等. 灵芝多糖结构及其组成研究[J]. 光谱学与光谱分析, 2010, 30(1): 123-127.
[22]DU Shuangkui, ZHU Xinna, WANG Hua, et al. High pressure assistalkali pretreatment of cotton stalk and physiochemical characterization of biomass[J]. Bioresource Technology, 2013, 148: 494-500.
[23]崔占鸿, 郝力壮, 刘书杰, 等. 体外产气法评价青海高原燕麦青干草与天然牧草组合效应[J]. 草业学报, 2012, 21(3): 250-257.
[24]WEATHERBURN M W. Phenol-hypochlorite reaction for determination of ammonia[J]. Analytical Chemistry, 1967, 39(8): 971-973.
[25]周笑犁. 大豆寡糖对肠道微生态与免疫功能的调控作用及机制研究[D]. 南昌: 南昌大学, 2013: 33-63.
[26]吕娇, 苏昕峰, 方国珊, 等. 果胶改善辣椒素对肠道发酵环境的影响[J].食品科学, 2013, 34(17): 273-277. doi: 10.7506/spkx1002-6630-201317058.
XU Xiaoqing1, QIN Qingjuan1, WU Yu1, ZHONG Geng1,2,*
(1. College of Food Science, Southwest University, Chongqing 400715, China; 2. Chongqing Special Food Programme and Technology Research Center, Chongqing 400715, China)
Abstract: Carboxymethyl konjac glucomanna n (CMK) made from konjac glucomannan (KGM) from Amorphophallus bulbifer shows a good film-forming property. CMK-KGM blend membrane has a better strength of extension and elongation at break and a similar clarity when compared to the film made from simplex KGM. However, there has been no published report regarding the intestinal health effect of CMK. For better understanding CMK, we investigated its physico-chemical properties and fermentation characteristics in vitro. The results showed similar apparent properties between KGM and CMK. Both of them were odorless, soluble in water and insoluble in ethanol, ether and other organic solvents, but CMK had significantly higher ash content and significantly lower viscosity. Moreover, results of in vitro fermentation showed that CMK showed very slight effect on gas production or the content of short-chain fatty acid (SCFA) but resulted in a significant reduction in NH3-N con tent. CMK neither promoted nor inhibited the growth of Bifi dobacterium or E. coli, but had a promoting effect on the growth of Lactobacillus. To conclude, while the potential role of KGM in promoting intestinal health, CMK has no adverse effect on intestinal health.
Key words: carboxymethyl konjac glucomannan (CMK); physico-chemical properties; in vitro fermentation characteristics; short-chain fatty acid (SCFA); microbe
doi:10.7506/spkx1002-6630-201507032
中图分类号:TS202.1
文献标志码:A
文章编号:1002-6630(2015)07-0172-05
*通信作者:钟耕(1964—),男,教授,博士后,研究方向为粮食、油脂与植物蛋白。E-mail:zhongdg@126.com
作者简介:徐小青(1990—),女,硕士研究生,研究方向为农产品加工及贮藏工程。E-mail:xqing2008@126.com
基金项目:重庆市“121”科技创新工程项目(cstc2014zktjccxyyB0022)
收稿日期:2014-06-04