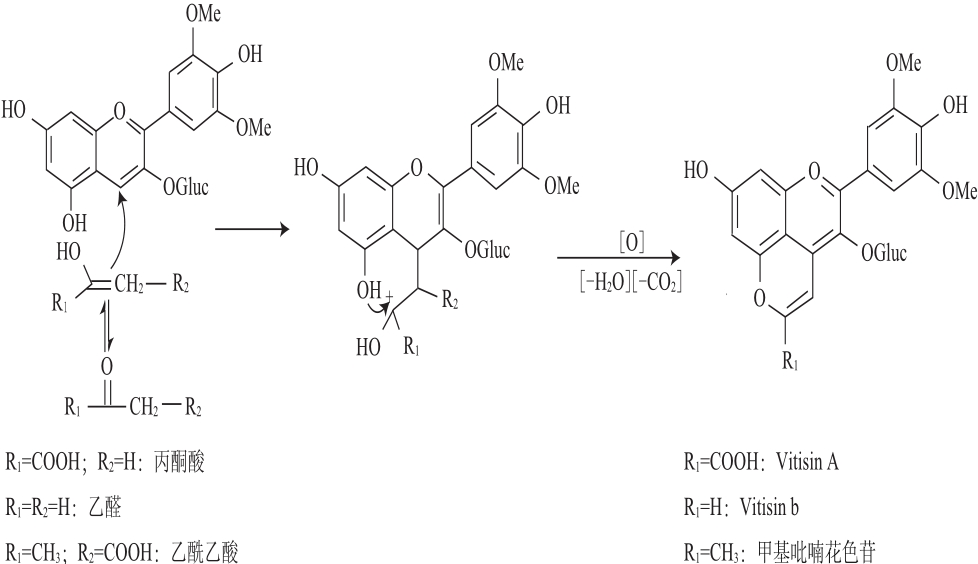
图1 Vitisins型吡喃花色苷及甲基吡喃花色苷的形成机制
Fig.1 Proposed formation mechanisms of vitisin-type pyranoanthocyanins and methyl pyranoanthocyanins
何静仁1,2,邝敏杰1,齐敏玉1,刘 刚1,2,李书艺1,吴 闹1,祝振洲1,郭 莹1,梁 征1
(1.武汉轻工大学食品科学与工程学院,湖北省农产品加工与转化重点实验室,湖北 武汉 430023;2.武汉轻工大学,农产品加工湖北省协同创新中心,湖北 武汉 430023)
摘 要:吡喃花色苷是近些年发现于果酒(如红葡萄酒)中的新型花色苷衍生物,是酒体最重要的呈色物质之一。吡喃花色苷家族具有第四个吡喃环的基本特征,是在发酵、陈酿过程中由浆果花色苷与葡萄糖发酵代谢的中间产物及(或)浆果中其他酚类成分经环加合反应形成的一系列天然色素物质。本文将系统介绍吡喃花色苷家族及其第二代衍生物家族的种类、分子结构、形成机制、稳定性与色度特征、抗氧化及抗肿瘤等生物活性。多种不同类型的吡喃花色苷家族不仅是重要呈色物质,而且具有较高的稳定性、良好的色泽特征及较强的功能活性,本文为进一步开展吡喃花色苷类衍生物的结构与其稳定性、色泽和功能性质关系的研究及其在葡萄酒产业和食品加工业中的应用提供有益的参考。
关键词:花色苷;吡喃花色苷家族;第二代花色苷衍生物;陈酿果酒
花色苷(anthocyanins)是一类广泛存在于果蔬类植物中的水溶性天然色素,属类黄酮多酚化合物,且是红葡萄酒或樱桃、草莓等发酵果酒中最重要的呈色物质,具有重要生物活性和生理功能。在发酵和陈酿过程中,酒体颜色的逐步变化主要是由浆果花色苷与葡萄糖发酵代谢的中间产物及浆果中的其他多酚类成分发生环化、加成或浓缩、聚合等多种反应,形成更为稳定的呈色物质(花色苷衍生物)造成的[1]。不同类型、不同色调的花色苷衍生物家族的形成对葡萄酒体颜色的重要性已越来越引起葡萄与葡萄酒产业科研人员的兴趣和重视。
吡喃花色苷[2](pyranoanthocyanins)是葡萄酒体重要呈色物质中的一种新型花色苷衍生物,它的基本结构是在原花色苷结构的基础上,在花色苷的C4位与C5位的羟基之间经环加合反应形成另外的第四个吡喃环D[3-4]。到目前为止,在葡萄酒类发酵果酒或果汁饮料中已分离和鉴定了许多家族的吡喃花色苷类化合物。不同种类吡喃花色苷家族及其第二代衍生物鉴定方法、呈色特征和光谱特征等如表1所示,主要有Vitisins型吡喃花色苷、甲基吡喃花色苷、酚基吡喃花色苷、黄烷醇-吡喃花色苷、Portisins型吡喃花色苷、吡喃花色苷二聚体和Oxovitisins型吡喃花色苷。吡喃花色苷与花色苷在许多理化性质方面存在差异,相比于红色的花色苷,羧基吡喃花色苷、酚基吡喃花色苷、黄烷醇-吡喃花色苷等的最大吸收波长发生部分蓝移[5-6],它们的颜色多为橙红色,其中甲基吡喃花色苷吸收波长偏移较大,显示为橙黄色;而第二代吡喃花色苷衍生物的最大吸收波长则发生红移,大部分显示更深的蓝色[7-9]。
国内在涉及花色苷衍生物方面的研究还相对较少,可能与我国葡萄酒工业发展的历史背景及葡萄酒化学的研究现状有关。由于吡喃花色苷类衍生物具有较高的稳定性及良好的色泽特性,因而它对天然花色苷本身存在的结构稳定性问题研究及其发展应用于葡萄酒类果酒加工业等均具有重要意义。本文结合作者在国外对葡萄酒化学研究领域中葡萄酒色素的多年研究工作积累,重点阐述吡喃花色苷衍生物家族的种类、结构表征、形成机制、理化性质及功能性质,为花色苷的反应活性研究以提高其在食品与农产品加工、贮藏和应用中色泽或功能的稳定性提供参考依据。
1.1 吡喃花色苷的形成机制
在葡萄酒酿造过程中,浆果花色苷与糖代谢的许多中间产物(如丙酮酸、乙醛、乙酰乙酸)发生一系列的反应生成许多吡喃花色苷[5,10-11]。羧基吡喃花色苷是其中最重要的一类,由烯醇化的丙酮酸与花色苷反应生成[5],Vitisin B是由乙醛和锦葵花色苷形成的化学加合物,甲基吡喃花色苷则是由浆果花色苷和酵母发酵的代谢产物乙酰乙酸反应形成。它们的形成机制相似,以羧基吡喃花色苷的形成机制为例(图1),在一定的酸性条件下,丙酮酸的羰基可烯醇化,随后具有电负性的甲基与花色苷的C4位(具正电性)发生加成缩合,而后经脱水和氧化形成另外的一个吡喃环[12]。甲基吡喃花色苷的不同之处则是要再经过脱羧才能形成。

图1 Vitisins型吡喃花色苷及甲基吡喃花色苷的形成机制
Fig.1 Proposed formation mechanisms of vitisin-type pyranoanthocyanins and methyl pyranoanthocyanins
酚基吡喃花色苷[13]是在1996年从红酒中经错流微滤聚合膜分离得到的最早被确认的第一个吡喃花色苷,并通过模拟实验表明该化合物是葡萄锦葵花色苷与乙烯酚的反应产物,而乙烯酚是香豆酸的脱羧产物,可通过酿酒酵母的肉桂酸脱羧酶形成[14]。黄烷醇-吡喃花色苷是葡萄酒中发现的另一家族吡喃花色苷,Francia-Aricha等[6]于
表1 吡喃花色苷家族的类型、鉴定方法、衍生对象、光谱表征及呈色特征
Table 1 Classification and identification, derived object, spectral and chromatic properties of pyranoanthocyanins
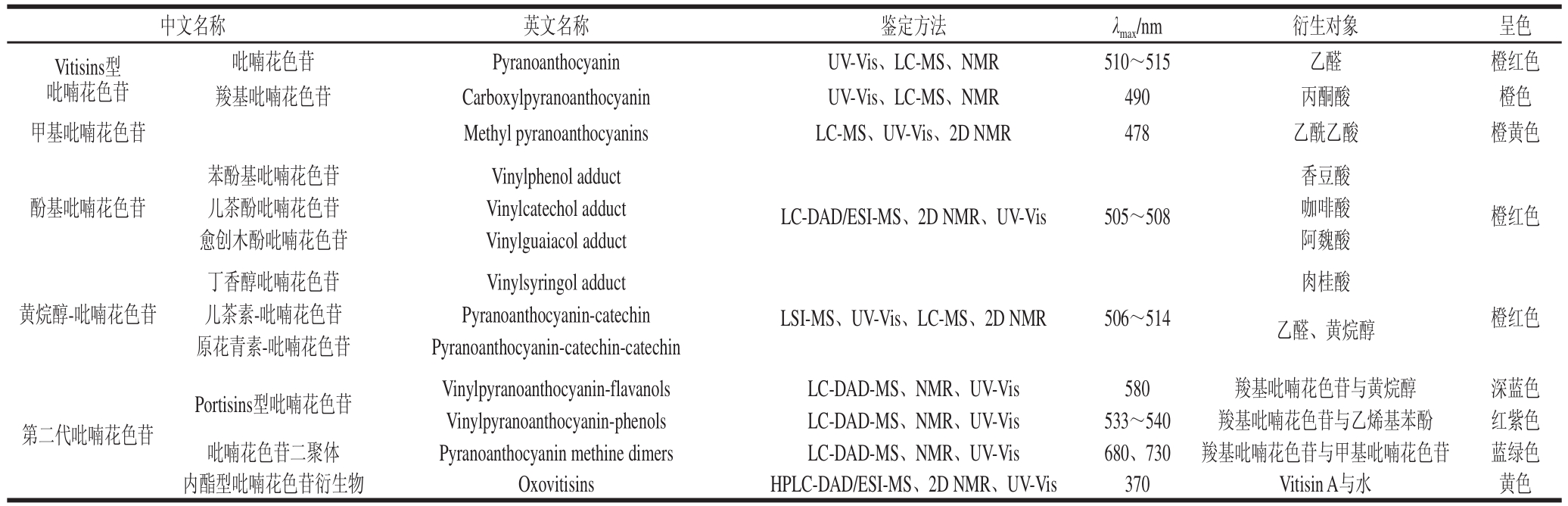
注:LC-MS. 高效液相色谱-质谱联用(liquid chromatography-mass spectrometry);NMR. 核磁共振(nuclear magnetic resonance);UV-Vis. 紫外-可见光谱(ultraviolet-visible);HRFAB-MS. 高分辨率快原子轰击质谱;LC-DAD/ESI-MS. 高效液相色谱-二极管阵列检测/电喷雾-质谱;2D NMR. 二维核磁共振;LSI-MS. 液体二次离子-质谱。
1997 年首次在模拟酒溶液中发现花色苷与儿茶素、表儿茶素、原花青素B2的环加合反应产物。黄烷醇-吡喃花色苷衍生物在酒中的形成来源于花色苷与乙烯基黄烷醇的环加合反应[15-16],而乙烯基黄烷醇可能来自于已被证实存在于酒中的黄烷醇-烷基-黄烷醇聚合物的断裂,亦可能来自于黄烷醇和乙醛在酸性条件下加成并脱水反应形成的中间产物[17]。酚基吡喃花色苷与黄烷醇-吡喃花色苷衍生物的形成机制相似(如图2所示,以黄烷醇-吡喃花色苷为例),乙烯酚上的乙烯基与锦葵花色苷的C4位和C5位上的羟基之间发生环加合反应,随后经氧化生成第四个芳香环[14]。
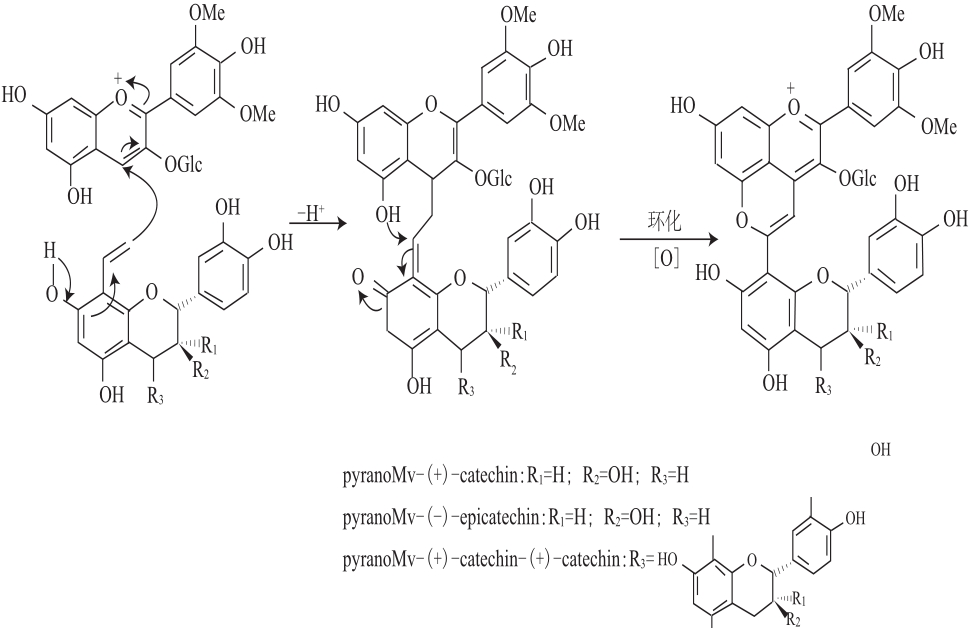
图2 黄烷醇-吡喃花色苷的形成过程
Fig.2 Proposed formation mechanism of pyranoanthocyanin-flavanols
1.2 第二代吡喃花色苷
第一代吡喃花色苷是在果酒发酵陈酿过程中由花色苷与小分子反应衍生形成,如Vitisins型吡喃花色苷、酚基吡喃花色苷和黄烷醇-吡喃花色苷,而在陈酿后期,由花色苷形成的第一代吡喃花色苷会继续与小分子反应生成更为复杂的衍生物,这些复杂的衍生物称为第二代吡喃花色苷衍生物,如Portisins型吡喃花色苷、吡喃花色苷二聚体和Oxovitisins型吡喃花色苷。
1.2.1 Portisins型吡喃花色苷衍生物
Mateus等[18]于2003年在Port葡萄酒中发现了一类新的吡喃花色苷的衍生物家族并命名为Portisins。Portisins型吡喃花色苷又可分为两种类型:乙烯黄烷醇基-吡喃花色苷(Portisins A)和乙烯酚基-吡喃花色苷(Portisins B),它们的结构是吡喃花色苷单体与黄烷醇或羟基酚中间以乙烯键桥连接组成的[19]。Portisins A是由羧基吡喃花色苷(如Vitisin A)与乙烯基黄烷醇反应形成的,后者可能是由中间以乙基键桥连接的黄烷醇寡聚物裂解形成或者由乙基键连接的花色苷-黄烷醇的衍生物裂解形成的,这是首次发现葡萄酒中花色苷和黄烷醇单体不直接充当前体物质的反应,其形成机理如图3所示。烯醇化的乙烯基黄烷醇与Vitisin A上的C10发生亲核反应,经去甲酸基、氧化形成乙烯基键连接的Portisins A衍生物[20]。通过LC-DAD-MS和NMR分析可以得出Portisins的结构特征[20](表1),这种色素具有独特的光谱学特征,它的最大吸收波长(λmax在580 nm左右)与其他花色苷相比发生红移,在酸性环境下呈现蓝色[21]。
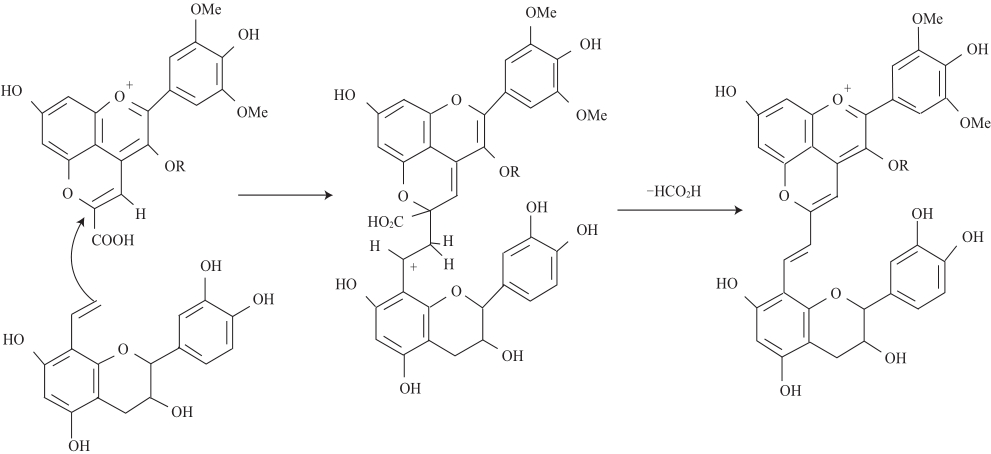
图3 Portisins A型吡喃花色苷在陈酿Port红酒中的形成机制
Fig.3 Formation of vinylpyranoanthocyanin-flavanols (portisins A) in aged Port red wine
Portisins B是在陈酿Port葡萄酒中发现的另一种类型的吡喃花色苷衍生物,其结构和形成机制见图4,它们是由羧基吡喃花色苷与乙烯基苯酚或葡萄中的羟基肉桂酸类化合物经多步反应缩合而成,与Portisins A型形成机制相似,不同的是最后脱去羧基[22]。Portisins B型的呈色特征与Portisins A型不同,其最大可见吸收波长在533~540 nm,呈现红紫色[22]。Portisins B型色素溶液(酸性条件下)在结冰过程中能呈现出特殊的从红色到蓝色的改变,这可能是由于它的电子及振动特性使其发生可逆的物理与化学之间的转变[23]。
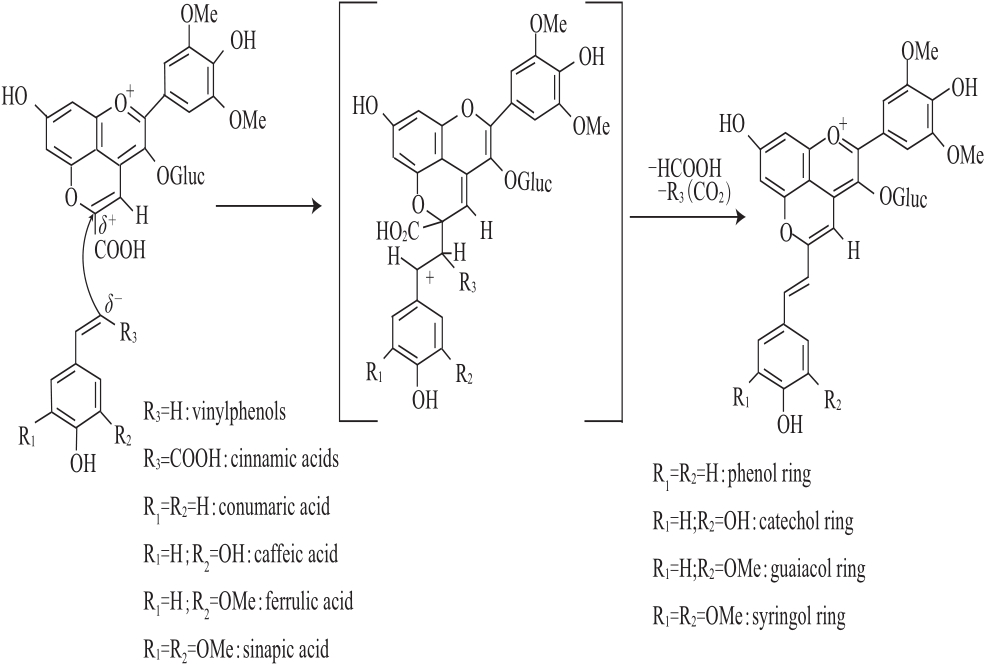
图4 Portisins B型吡喃花色苷在陈酿Port红酒中的形成机制
Fig.4 Formation of vinylpyranoanthocyaninphenols (portisins B) in aged Port red wine
1.2.2 吡喃花色苷二聚体
Oliveira等[7]于2010年在Port红葡萄酒及其酒渣中发现了一种新的吡喃花色苷衍生物,即吡喃花色苷二聚体。这种色素的结构是两个吡喃花色苷单体之间以甲基-次甲基键桥连接构成,经LC-DAD-MS和1H和13C NMR确认了吡喃花色苷二聚体的正确结构,其最大可见吸收波长在680、730 nm附近,分子离子峰m/z为1 059,主要碎片离子峰的m/z为897和735(糖苷配基),在酸性条件下呈现天蓝色[24]。吡喃花色苷二聚体在葡萄酒中的形成来源于羧基吡喃花色苷和甲基吡喃花色苷的反应,其形成机制有两种途径(图5):1)甲基吡喃花色苷上的甲基经去质子化在C10位形成以双键连 接的亚甲基结构,然后对羧基吡喃花色苷上的C10位进行亲核攻击,再经去甲酸基形成以甲基-次甲基键桥连接的吡喃花色苷二聚体。2)甲基吡喃花色苷与羧基吡喃花色苷的芳香环之间经复杂的电子转移形成稳定的π-π共轭体系,随后经离子或自由基反应在两者之间形成甲基-次甲基键桥,最后经去甲酸基形成吡喃花色苷二聚体。研究表明第2种反应机制更可能发生,因为经NMR测定甲基吡喃花色苷中的质子转移反应发生在pH>11的溶液中而非pH≈3.6的葡萄酒中[7]。
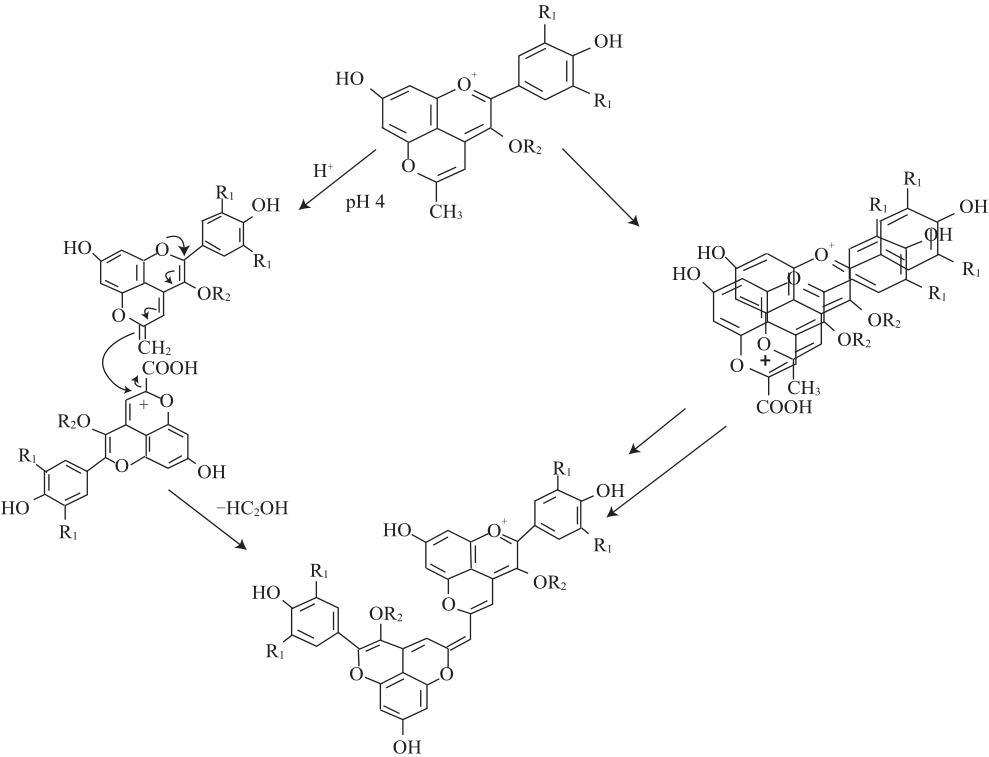
图5 吡喃花色苷二聚体在陈酿Port酒中的两种形成机制
Fig.5 Two putative pathways for the formation of pyranoanthocyanin dimers in aged Port red wine
右上角重叠部分代表π-π共轭体系。
1.2.3 吡喃花色苷衍生物Oxovitisins
作者与所在团队于2010年在陈酿的葡萄酒中首次发现了一类新的吡喃花色苷的衍生物家族并命名为Oxovitisins[25],经LC-DAD-MS和1H和13C NMR对其结构进行鉴定,确认了Oxovitisins为具有2-吡喃酮结构(内酯型)的非氧鎓离子衍生物,并证实了该类化合物由羧基吡喃花色苷经水合和微氧化反应形成的机制。这是由红色花色苷(鎓盐)衍生转化而成非氧鎓离子的中性化合物的首次报道。Oxovitisins最大可见吸收波长在酸性条件下为373 nm(pH 2),连同黄酮类可以代表一类对陈酿葡萄酒中黄色色调具有重要贡献的化合物[26]。Oxovitisins在葡萄酒中的形成来源于Vitisin A与水的反应,其机制见图6,首先水对Vitisin A上的C 10进行亲核攻击形成半缩醛形式,随后经脱羧、氧化和脱水,生成一个具有吡喃酮结构的花色苷衍生物。该亲核攻击发生的很缓慢,是由Vitisins碳正离子不可逆形成中性吡喃花色苷的第一步[27]。Oxovitisins的形成机制为以羧基吡喃花色苷为前体物质形成其他衍生物色素提供了新的途径。
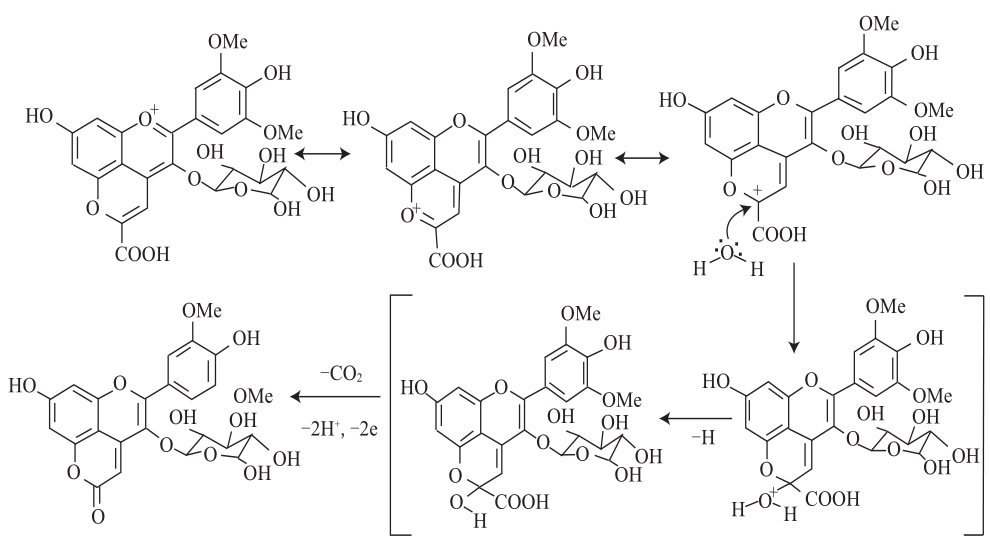
图6 Oxovitisins的形成机理
Fig.6 Proposed mechanisms for the formation of pyranoneanthocyanins (oxovitisins)
2.1 吡喃花色苷的稳定性
由吡喃花色苷衍生物的结构特征可知,它们具有比原花色苷更稳定的特性。针对吡喃花色苷类衍生物的稳定性研究已有报道,作者研究了pH值、SO2和贮藏时间对黄烷醇-吡喃花色苷稳定性的影响[28],结果表明:相同pH值条件下,黄烷醇-吡喃花色苷的稳定性比原花色苷高(图7),且对SO2有很强的抵抗作用(图8),在贮藏6个月后,黄烷醇-吡喃花色苷的稳定性比原花色苷要高很多。Bakker等[5]证实了Vitis ins类型花色苷衍生物比花色苷具有更强的抵抗SO2漂白的作用,并且在弱酸性至中性pH值环境下表现出比花色苷类色素更深的颜色。另外,Oliveira等[9]针对pH值和SO2等因素对Portisins的影响进行了研究,结果证明它具有很强的抵抗水和酸性亚硫酸盐亲核攻击的能力,特别是与锦葵花色苷相比,在不同pH值溶液中具有很强的色泽稳定性,在pH 3.6和pH 1.0的溶液中色泽几乎相同。另外,锦葵花色苷在弱酸性或中性条件下色度明显降低,这是因为发生水化平衡,使花色苷形成无色的半缩醛结构[29-30],而吡喃花色苷能抵抗水的亲核攻击避免形成无色的半缩醛结构[27]。在果酒的发酵或陈酿过程中,原花色苷的含量逐渐降低,形成更加稳定的衍生色素和聚合色素,并与其他酚类成分一起赋予酒体持久而稳定的颜色。
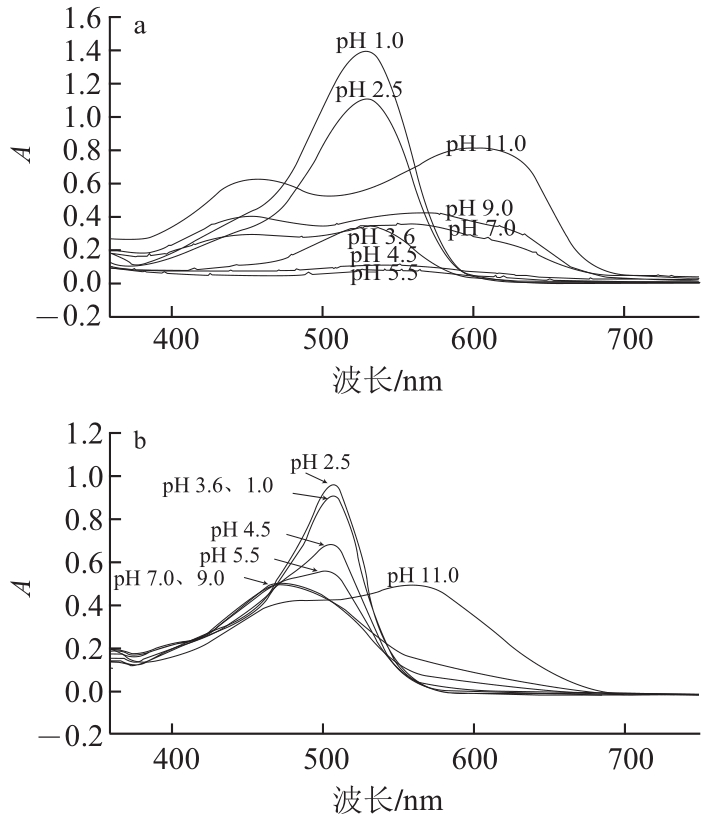
图7 锦葵花色苷与儿茶素-吡喃锦葵花色苷在不同pH值(1.0~11.0)条件下的紫外-可见吸收光谱
Fig. 7 Absorption spectra of malvidin-3-glucoside (Mv) and pyranoMv-(+)-catechin at different pH values (1.0–11.0)
a. 锦葵花色苷;b. 儿茶素-吡喃锦葵花色苷。图8同。
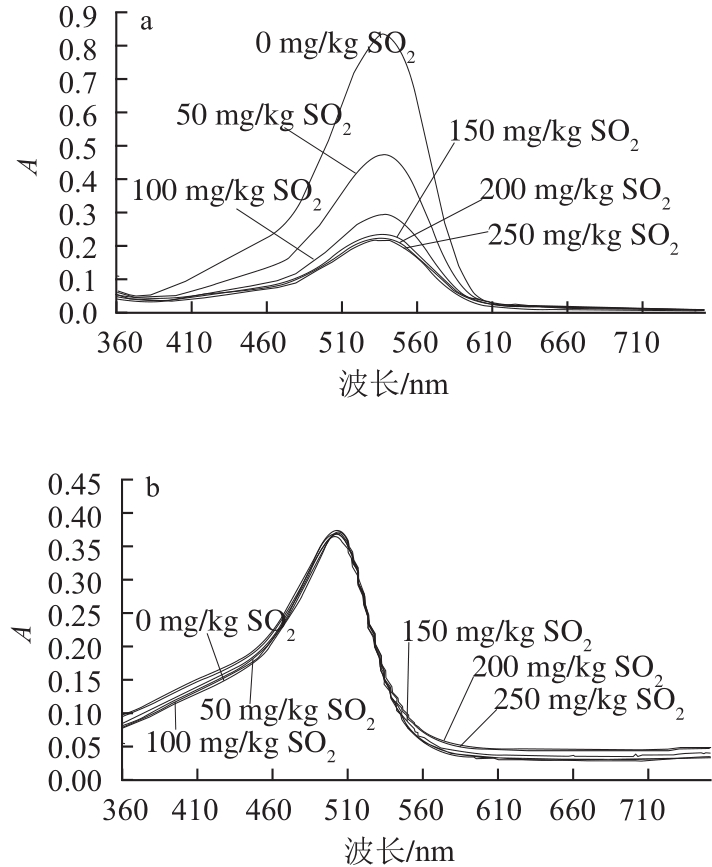
图8 锦葵花色苷和儿茶素-吡喃锦葵花色苷在不同SO2含量模拟酒溶液(pH 3.6)中的紫外-可见吸收光谱
Fig.8 Effect of bisulfite on the visible spectra of malvidin-3-glucoside (Mv) and pyranoMv-(+)-catechin in model wine (pH 3.6)
2.2 吡喃花色苷的色度特征
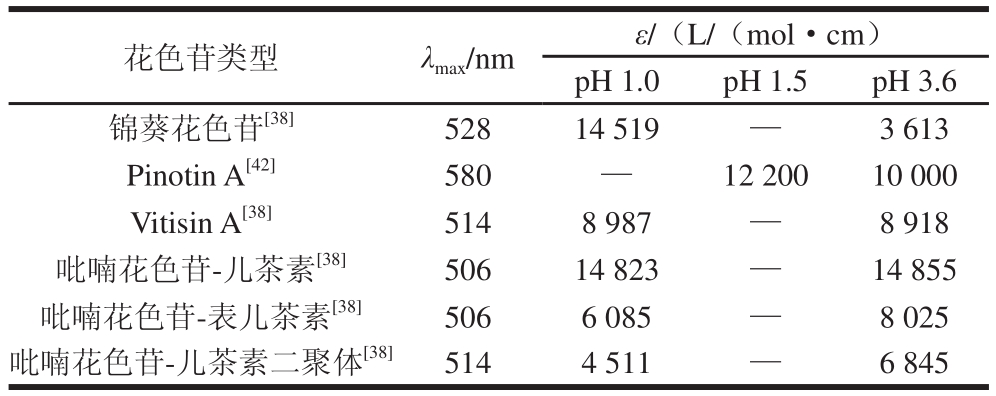
吡喃花色苷对葡萄酒酿造中酒体颜色的改变起着很重要的作用,大部分吡喃花色苷比原花色苷更显橙红色调,因此使酒体的颜色发生从新酿酒的紫红色到陈酿酒的砖红色转变[31]。在葡萄酒溶液中吡喃花色苷的色泽稳定性比原花色苷要高很多,当溶液的pH值从1.5增加到3.6时,锦葵花色苷的摩尔消光系数有大幅度降低,而吡喃花色苷衍生物的摩尔消光系数则变化很小或者有小幅度升高[28,32](表2)。有研究表明寡聚黄烷醇-吡喃花色苷衍生物在pH 3.6的酒体中最大吸光度比在pH 1.0时要高30%~50%,这种在弱酸性条件下的增色效应是黄烷醇-吡喃花色苷分子内辅助成色使其摩尔消光系数增大造成的,对酒体色泽起重要作用[28]。
表2 模拟葡萄酒溶液酸性pH值条件下锦葵花色苷及吡喃花色苷的最大吸收波长及摩尔消光系数
Table 2 Wavelengths of maximum absorbance (λmax) and molar extinction coefficients (ε) for malvidin 3-glucoside and pyranoanthocyanins in model wine with acidic pH
注:—. 文献中未提及。
吡喃花色苷衍生物比原花色苷具有抗变色特性的最主要原因是在它们的分子结构C4位上增加了吡喃环,可以保护分子不受水的亲核攻击(被水亲核攻击的位置一般在C2和C4位)。在不同pH值水溶液中吡喃花色苷经质子转移反应能快速达到平衡形成醌式碱形式,pH值在3~12之间的酸碱平衡能形成3 种醌式碱形式(以黄烷醇-吡喃花色苷为例,如图9所示):中性A、阴离子A-、二价阴离子A2-,有 研究表明不同的吡喃花色苷酸度系数pKa值:pKa1为4.20~5.35;pKa2为7.82~8.34;pKa3为9.49~10.28[27,33]。含有酰基化基团的吡喃花色苷的pKa值比非酰基化的稍微高,可能是由于酰基化基团形成的空间位阻使质子很难转移造成的。
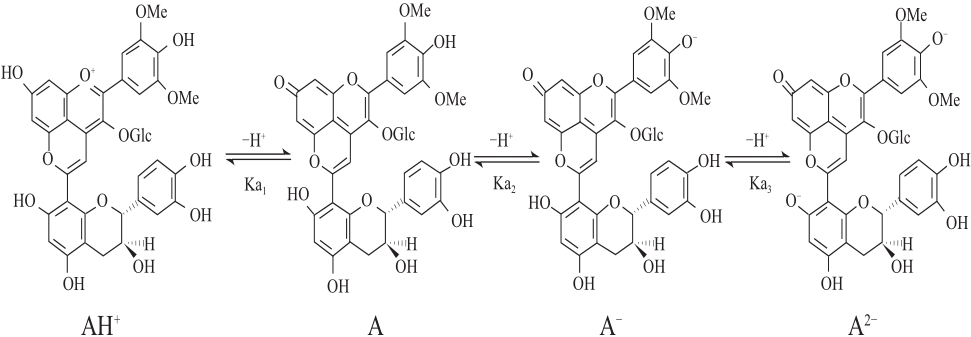
图9 pH 3~12的水溶液中黄烷醇-吡喃花色苷的平衡形式
Fig.9 Equilibrium forms of pyranoanthocyanin and flavanols in aqueous solutions in the pH range of 3–12
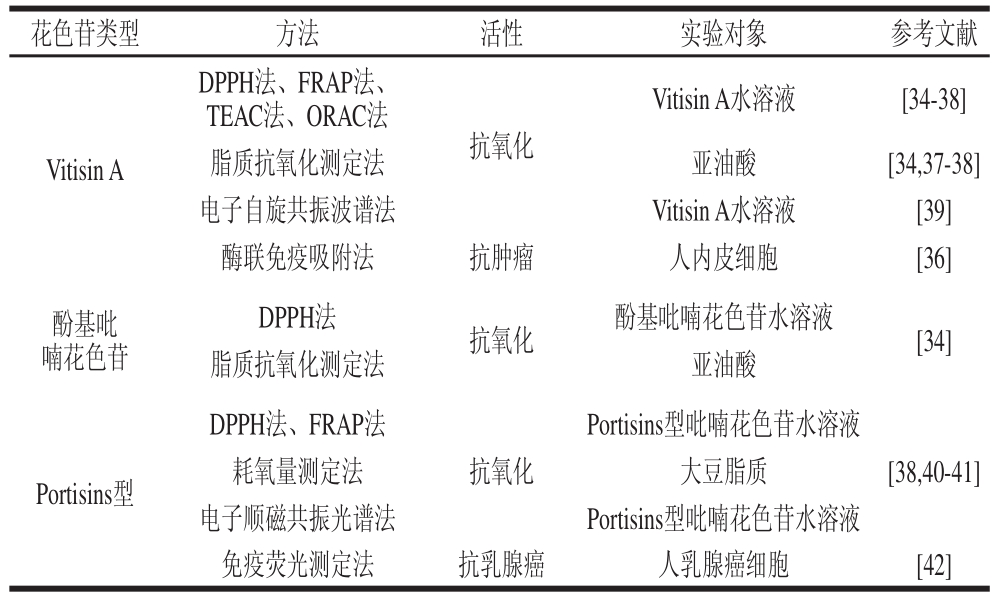
随着吡喃花色苷类衍生物的发现,它们的功能活性研究也相继被报道。表3总结了几种吡喃花色苷类衍生物在清除自由基、抗氧化、抗乳腺癌和抗肿瘤方面的生物活性及其功能评价方法与体系。Gou py等[34]研究了酚基吡喃花色苷和Vitisin A对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhyd razyl,DPPH)自由基的清除能力和抑制亚铁血红素诱导亚油酸过氧化反应,结果表明:Vitisin A和由锦葵花色苷形成的酚基吡 喃花色苷对DPPH自由基的清除能力都高于原锦葵花色苷,而由矢车菊花色苷形成的酚基吡喃花色苷对DPPH自由基的清除能力则低于原矢车菊花色苷,酚基吡喃花色苷对亚油酸过氧化反应的 抑制作用高于原花色苷,而Vitisin A则略低于原花色苷。采用铁离子还原法(ferric reducing antioxidant power,FRAP)、总抗氧化能力(trolox equivalent antioxidant capacity,TEAC)法和氧自由基吸收能力(oxygen radical absorbance capacity,ORAC)法对Vitisin A的抗 氧化活性测定,结果表明Vitisin A具有很强的抗氧化能力[35-38],采用电子自旋共振波谱法对Vitisin A的抗氧化活性进行测定,结果表明其对超氧阴离子自由基有很强的清除能力,而对羟自由基不起作用[39]。另外,Garcia-Alonso等[36]采用酶联免疫吸附法研究了Vitisin A对肿瘤坏死因子的抑制作用,结果表明Vitisin A在一定程度上能抑制肿瘤。有研究采用DPPH法和FRAP法测定Portisins的抗氧化活性及Portisins对大豆脂质过氧化的抑制作用[38,40],发现Portisins具有很强的清除DPPH自由基及还原铁离子的能力,而由飞燕草花色苷形成的Portisins的抗氧化能力略小于原飞燕草花色苷,由锦葵花色苷形成的Portisins的铁离子还原能力最强,Portisins具有很好的抵制大豆脂质过氧化反应的效果,特别是由矢车菊花色苷形成的Portisins型吡喃花色苷。采用电子顺磁共振光谱法对Portisins进行测定,结果表明Portisins具有很强的抗氧化能力[41]。另有研究表明Portisins具有抵抗人乳腺癌细胞增殖的作用[42]。
表3 不同吡喃花色苷功能活性的测定方法及实验对象
Table 3 Methods and test objects for functional ac tivity assay of different pyranoanthocyanins
吡喃花色苷类衍生物是红葡萄酒中最重要的呈色物质,明确它们的形成机理、呈色特征、理化稳定性及生物活性和生理功能对稳定红葡萄酒色泽有关的果酒酿造工艺技术研究,以及深入理解果酒陈酿过程中化学成分的变化与酒体色泽的关系及陈酿果酒的健康作用具有重要意义。花色苷可与果酒酿造中糖代谢的许多中间产物以及浆果中含有的其他酚类物质(如羟基肉桂酸类,黄烷醇类等)反应形成不同家族的吡喃花色苷类衍生物。由于大部分吡喃花色苷是在酵母发酵过程中形成的,因此,酵母的种类及菌株、温度、pH值、发酵过程中SO2的浓度等因素对吡喃花色苷的形成有很大的影响。尽管在葡萄酒中检测到的一些吡喃花色苷类色素是微量的,但由于其家族结构多样性及独特的光谱特性,在一定条件下它们对葡萄酒整体色泽同样起到至关重要的作用。
相对于花色苷,吡喃花色苷衍生物具有更高的稳定性、良好的色泽特征及较强的抗氧化活性,作为天然着色剂和膳食功能成分在食品行业具有广阔应用前景。然而,对吡喃花色苷衍生物的发现和结构确认及其形成机制的认识较晚,有关吡喃花色苷的高效制备、理化性质、功能评价及其在食品与农产品加工中应用的相关研究还很缺乏,随着色谱、质谱和光谱技术及其他分析程序的建立,吡喃花色苷类衍生物的相关评价数据将更加充实。作为一类特殊的多酚类化合物,吡喃花色苷类衍生物与葡萄酒类果酒中的其他成分对葡萄酒口感、风味的影响还有待探索,这是深入认识花色苷的化学活性和进一步研究花色苷衍生物的变化及其对陈酿果酒品质影响 的主要方向。
参考文献:
[1]GARCIA-PUENTE E R, ALCALDE-EON C, SANTOS-BUELGA C, et al. Behaviour and characterization of the colour during red wine making and maturation[J]. Analytica Chimica Acta, 2006, 563(1/2): 215-222.
[2]Wikipedia. Pyranoanthocyanin[DB/OL]. [2014-02-17]. http://en.wikipedia.org/wiki/Pyranoanthocyanin.
[3]de FREITAS V, MATEUS N. Formation of pyranoanthocyanins in red wines: a new and diverse class of anthocyanin derivatives[J]. Analytical and Bioanalytical Chemistry, 2011, 401(5): 1463-1473.
[4]RENTZSCH M, SCHWARZ M, WINTERHALTER P. Pyranoanthocyanins-an overview on structures, occurrence, and pathways of formation[J]. Trends in Food Science & Technology, 2007, 18(10): 526-534.
[5]BAKKER J, TIMBERLAKE C F. Isolatio n, identification and characterization of new color-stable anthocyanins occurring in some red wines[J]. Journal of Agricultural and Food Chemistry, 1997, 45(1): 35-43.
[6]FRANCIA-ARICHA E M, GUERRA M T, RIVAS-GONZALO J C, et al. New anthocyanin pigments formed after condensation with flavanols[J]. Journal of Agricultural and Food Chemistry, 1997, 45(6): 2262-2266.
[7]OLIVEIRA J, AZEVEDO J, SILVA A M S, et al. Pyranoanthocyanin dimers: a new family of turquoise blue anthocyanin-derived pigments found in port wine[J]. Journal of Agricultural and Food Chemistry, 2010, 58(8): 5154-5159.
[8]MATEUS N, OLIVEIRA J, HAETTICH-MOTTA M, et al. New family of bluish pyranoanthocyanins[J/OL]. Journal of Biomedicine and Biotechnology, 2004. http://dx.doi.org/10.1155/S1110724304404033.
[9]OLIVEIRA J, SANTOS-BUELGA C, SILVA A M S, et al. Chromatic and structural features of blu e anthocyanin-derived pigments present in port wine[J]. Analytica Chimica Acta, 2006, 563(1/2): 2-9.
[10]HE Jingren, SANTOS-BUELGA C, SILVA A M S, et al. Isolation and structural characterization of new anthocyanin-derived yellow pigments in aged red wines[J]. Journal of Agricultural and Food Chemistry, 2006, 54(25): 9598-9603.
[11]HAVASAKA Y, ASENSTORFER R E. Screening for potential pigments derived from anthocyanins in red wine using nanoelectrospray tandem mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2002, 50(4): 756-761.
[12]FULCRAND H, BENABDELJALIL C, RIGAUD J, et al. A new class of wine pigments generated by reaction between pyruvic acid and grape anthocyanins[J]. Phytochemistry, 1998, 47(7): 1401-1407.
[13]CAMEIRA-dos-SANTOS P J, BRILLOUET J M, CHEYNIER V, et al. Detection and partial characterisation of new anthocyaninderived pigments in wine[J]. Journal of the Science of Food and Agriculture, 1996, 70(2): 204-208.
[14]FULCRAND H, CAMEIRA DOS SANTOS P J, SAMI-MANCHADO P, et al. Structure of new anthocyanin-derived wine pigments[J]. Journal of the Chemical Society Perkin Transactions, 1996. doi: 10.1039/P19960000735.
[15]MATEUS N, SILVA A M, SANTOS-BUELGA C, et al. Identification of anthocyanin-flavanol pigments in red wines by NMR and mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2002, 50(7): 2110-2116.
[16]MATEUS N, CARVALHO E, CARVALHO A R, et al. Isolation and structural characterization of new acylated anthocyanin-vinylflavanol pigments occurring in aging red wines[J]. Journal of Agricultural and Food Chemistry, 2003, 51(1): 277-282.
[17]CRUZ L, TEIXEIRA N, SILVA A, et al. The role of vinylcatechin in the formation of pyranomalvidin-3-glucoside-(+)-catechin[J]. Journal of Agricultural and Food Chemistry, 2008, 56(22): 10980-10987.
[18]MATEUS N, SILVA A M, RIVAS-GONZALO J C, et al. A new class of blue anthocyanin-derived pigments isolated from red wines[J]. Journal of Agricultural and Food Chemistry, 2003, 51(7): 1919-1923.
[19]MATEUS N, OLIVEIRA J, SANTOS-BUELGA C, et al. NMR structure characterization of a new vinylpyrano anthocyanincatechin pigment (a portisin)[J]. Tetrahedron Letters, 2004, 45(17): 3455-3457.
[20]MATEUS N, OLIVEIRA J, PISSARRA J, et al. A new vinylpyranoanthocyanin pigment occurring in aged red wine[J]. Food Chemistry, 2006, 97(4): 689-695.
[21]CARVALNO A R F, OLIVEIRA J, de FREITAS V, et al. A computational study of vinylpyranoanthocyanin-phenolic pigments (portisins)[J]. Journal of Molecular Structure: THEOCHEM, 2010, 946(1/3): 113-118.
[22]OLIVEIRA J, de FREITAS V, SILVA A, et al. Reaction between hydroxycinnamic acids and anthocyanin-pyruvic acid adducts yielding new portisins[J]. Journal of Agricultural and Food Chemistry, 2007, 55(15): 6349-6356.
[23]CARVALHO A, OLIVEIRA J, de FREITAS V, et al. Unusual color change of vinylpyranoanthocyanin-phenolic pigments[J]. Journal of Agricultural and Food Chemistry, 2010, 58(7): 4292-4297.
[24]OLIVEIRA J, MATEUS N, RODRIGUEZ-BORGES J E, et al. Synthesis of a new pyranoanthocyanin dimer linked through a methylmethine bridge[J]. Tetrahedron Letters, 2011, 52(23): 2957-2960.
[25]Wikipedia. Oxovitisin[DB/OL]. [2014-03-12]. http://en.wikipedia.org/wiki/Oxovitisin.
[26]HE Jingren, OLIVEIRA J, SILVA A M S, et al. Oxovitisins: a new class of neutral pyranone-anthocyanin derivatives in red wines[J]. Journal of Agricultural and Food Chemistry, 2010, 58(15): 8814-8819.
[27]OLIVEIRA J, MATEUS N, SILVA A M S, et al. Equilibrium forms of vitisin B pigments in an aqueous system studied by NMR and visible spectroscopy[J]. Journal of Physical Chemistry B, 2009, 113(32): 11352-11358.
[28]HE Jingren, CARVALHO A, MATEUS N, et al. Spectral features and stability of oligomeric pyranoanthocyanin-flavanol pigments isolated from red wines[J]. Journal of Agricultural and Food Chemistry, 2010, 58(16): 9249-9258.
[29]ASENSTORFER R E, JONES G P. Charge equilibria and pK values of 5-carboxypyranomalvidin-3-glucoside (vitisin A) by electrophoresis and absorption spectroscopy[J]. Tetrahedron Letters, 2007, 63(22): 4788-4792.
[30]SCHWARZ M, WINTERHALTER P, A novel synthetic route to substituted pyranoanthocyanins with unique colour properties[J]. Tetrahedron Letters, 2003, 44(41): 7583-7587.
[31]CARVALHO A, OLIVEIRA J, de FREITAS V, et al. A theoretical interpretation of the color of two classes of pyranoanthocyanins[J]. Journal of Molecular Structure: THEOCHEM, 2010, 948(1/3): 61-64.
[32]HAKANSSON A E, PARDON K, HAYASAKA Y, et al. Structures and colour properties of new red wine pigments[J]. Tetrahedron Letters, 2003, 44(26): 4887-4891.
[33]CRUZ L, PETROV V, TEIXEIRA N, et al. Establishment of the chemical equilibria of different types of pyranoanthocyanins in aqueous solutions: evidence for the formation of aggregation in pyranomalvidin-3-O-coumaroylglucoside-(+)-catechin[J]. Journal of Physical Chemistry B, 2010, 114(41): 13232-13240.
[34]GOUPY P, BAUTISTA-ORTIN A B, FULCRAND H, et al. Antioxidant activity of wine pigments derived from anthocyanins: hydrogen transfer reactions to the DPPH radical and inhibition of the heme-induced peroxidation of linoleic acid[J]. Journal of Agricultural and Food Chemistry, 2009, 57(13): 5762-5770.
[35]JORDHEIM M, AABY K, FOSSEN T, et al. Molar absorptivities and reducing capacity of pyranoanthocyanins and other anthocyanins[J]. Journal of Agricultural and Food Chemistry, 2007, 55(26): 10591-10598.
[36]GARCIA-ALONSO M, RIMBACH G, RIVAS-GONZALO J C, et al. Antioxidant and cellular activities of anthocyanins and their corresponding vitisins A-studies in platelets, monocytes, and human endothelial cells[J]. Journal of Agricultural and Food Chemistry, 2004, 52(11): 3378-3384.
[37]MUSELIK J, GARCIA-ALONSO M, MARTIN-LOPEZ M P, et al. Measurement of antioxidant activity of wine catechins, procyanidins, anthocyanins and pyranoanthocyanins[J]. International Journal of Molecular Sciences, 2007, 8(8): 797-809.
[38]FARIA A, OLIVEIRA J, NEVES P, et al. Antioxidant properties of prepared blueberry (Vaccinium myrtillus) extracts[J]. Journal of Agricu ltural and Food Chemistry, 2005, 53(17): 6896-6902.
[39]GARCIA-ALONSO M, RIMBACH G, SASAI M, et al. Electron spin resonance spectroscopy studies on the free radical scavenging activity of wine anthocyanins and pyranoanthocyanins[J]. Molecular Nutrition & Food Research, 2005, 49(12): 1112-1119.
[40]AZEVEDO J, FERNANDES I, FARIA A, et al. Antioxidant properties of anthocyanidins, anthocyanidin-3-glucosides and respective portisins[J]. Food Chemistry, 2010, 119(2): 518-523.
[41]PIRKER K P, OLIVEIRA J, FREITAS V, et al. Antiradical properties of red wine portisins[J]. Journal of Agricultural and Food Chemistry, 2011, 59(21): 118 33-11837.
[42]FERNANDES I, FARIA A, AZEVEDO J, et al. Influence of anthocyanins, derivative pigments and other catechol and pyrogalloltype phenolics on breast cancer cell proliferation[J]. Journal of Agricultural and Food Chemistry, 2010, 58(6): 3785-3792.
HE Jingren1,2, KUANG Minjie1, QI Minyu1, LIU Gang1,2, LI Shuyi1, WU Nao1, ZHU Zhenzhou1, GUO Ying1, LIANG Zheng1
(1. Hubei Key Laboratory for Processing and Transformation of Agricultural Products, College of Food Science and Engineering, Wuhan Polytechnic University, Wuhan 430023, China; 2. Hubei Collaborative Innovation Center for Processing of Agricultural Products, Wuhan Polytechnic University, Wuhan 430023, China)
Abstract: Pyranoanthocyanins are new anthocyanin-derived pigments found in fruit wines such as red wine in recent years, and they are one class of important coloring substances in grape wine. The pyranoanthocyanin family possesses an additional fourth pyran ring attached to anthocyanins. They consist of a series of natural pigment formed by cycloaddition reaction between berry anthocyanins and intermediates produced from glucose metabolization during fermentation and aging, and other phenolic compounds in fruits. The present paper summarizes the classification, molecular structural properities, formation mechanism, stability, chromatic features and functional bioactivities including antioxidation and antitumor of pyranoanthocyanins and second generation derivatives. Many different types of pyranoanthocyanins are not only important coloration substances, but also have high stability, good color characteristics and a strong functional activity, which will offer beneficial references for further investigating the relationships between the structures of pyranoanthocyanin derivatives and stability, coloring and functional properties for their applications in grape wine and food procesing industries.Key words: anthocyanins; pyranoanthocyanin family; second-generation anthocyanin derivatives; aged fruit wines
中图分类号:TS202.3
文献标志码:A
文章编号:1002-6630(2015)07-0228-07
doi:10.7506/spkx1002-6630-201507042
作者简介:何静仁(1974—),男,教授,博士,研究方向为膳食功效物质基础与分子营养。E-mail:jingrenh@yahoo.com
基金项目:国家国际科技合作专项(2014DFG32310);国家自然科学基金面上项目(31371727);湖北省教育厅科学技术研究重点项目(D20121803);武汉市科技人才培育晨光计划项目(2013070104010023)
收稿日期:2014-04-29