周家萍 1,张文涛 2,孟 梦 2,王跃猛 2,刘安军 2,郑 捷 2
(1.天津科技大学现代分析技术研究中心,天津 300457;2.天津科技大学食品工程与生物技术学院,天津 300457)
摘 要:以鲐鱼为原料,通过单因素试验和响应面试验,确定鲐鱼水溶性蛋白的最佳提取工艺条件为料液比1∶6.6(g/mL)、提取温度27.7 ℃、提取时间3.8 h,得到的水溶性蛋白提取率为76.12%。将鲐鱼原料和水溶解后样品采用气相色谱-质谱仪进行挥发性成分分析,结果表明,水溶性蛋白挥发性成分醇类物质含量降低,酮类、醛类、呋喃类物质含量都有了明显提高。样品经过冷冻干燥后,呈淡黄色或黄色粉末,蓬松柔软,易吸湿,易溶于水,水溶液性质稳定,略有鱼香味。
关键词:鲐鱼;水溶性蛋白;气相色谱-质谱法
鲐鱼(Pneumatophorus japonicas),鲈形目,属于鲭科,鲐属。别名鲐鲅鱼、青花鱼、鲭鱼等,为远洋暖水性中上、层高产量的洄游性鱼类,是我国目前近海主要捕捞的经济鱼种之一 [1-4]。鲐鱼分布广、生长快、产量高,具有食物链较低、生命周期短、繁殖能力强、生长迅速、资源恢复能力强的特点,是城乡群众喜食的鱼类 [5]。鲐鱼鱼肉厚实,鱼刺少,非常适合进行深加工。同时,研究表明,鲐鱼是一种营养丰富的鱼类,每100 g鲐鱼肉中,含蛋白21.4 g、脂肪7.4 g、碳水化合物0.1 g、灰分1.1 g、钙20 mg、磷226 mg、烟酸9.7 mg [6],由此可见,鲐鱼具有较高的营养价值。鲐鱼体内还含有两种营养价值很高的不饱和脂肪酸:二十碳五烯酸(eicosapntemacnioc acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)。EPA和DHA具有促进婴幼儿和青少年智力发育、抗血小板凝聚、延缓血栓形成、预防心血管疾病、降血脂、抗动脉硬化、抑制肿瘤生长、减少癌症发病率等保健作用。因此,研究和开发利用经济价值较低的鲐鱼资源,对其进行深加工,提高其附加值,具有明显的经济效益和社会效益 [7-9]。
鱼品加工过程中会产生大量富含蛋白的有机废水,其蛋白质量浓度可达到5~30 mg/mL(鲜牛奶的蛋白提取量约为28 mg/mL),直接排放不仅严重污染水体,同时造成极大的资源浪费 [10-12]。漂洗作为鱼品加工的重要环节,可去除鱼肉中的有色物质、腥臭成分、脂肪、血液、水溶性蛋白等 [13]。然而,漂洗液中大量的水溶性蛋白如何回收利用,一直是人们非常关注的议题。目前,漂洗液中蛋白的回收方法研究尚处于起步阶段,主要有膜分离法 [14]、离子交换法 [15]、絮凝法 [16]、调节pH值法 [17]、电阻加热法 [18]等,其中大部分方法成本较高,实际生产中较难实现。
本研究以鲐鱼为试材,采用低成本的调pH值法回收漂洗过程中流失的水溶性蛋白,旨在全面开发饴鱼营养价值,制备具有高效生物活性的蛋白物并开发系列保健食品,对鲐鱼乃至水产品深加工具有重要指导意义。
1.1 材料与试剂
鲐鱼购于华海批发有限公司,-20 ℃冷藏。
盐酸、硫酸、无水葡萄糖、无水乙醇、磷酸氢二钾(分析纯) 天津江天化工技术有限公司;考马斯亮蓝G-250 美国Sigma公司。
1.2 仪器与设备
Sp-2120型紫外-可见分光光度计、RE-52A旋转蒸发器 上海光谱仪器有限公司;HW·SY系列电热恒温水浴锅 北京市长风仪器仪表公司;752紫外-可见分光光度计 上海光学仪器厂;凯氏定氮仪 上海新嘉电子有限公司;LD4-40型台式离心机 北京医用离心机厂;4000MS气相色谱-质谱(gas chromatography-mass spectrometer,GC-MS)联用仪 美国瓦里安技术有限公司。
1.3 方法
1.3.1 原料预处理
取冰鲜的鲐鱼进行解冻后宰杀,去头部、内脏及鱼尾后,将鱼身冷藏于-20 ℃冰箱中备用,实验时常温自然解冻。每个单因素试验都采用同一批原料。
1.3.2 鲐鱼水溶性蛋白的提取 [19]
鲐鱼解冻,切块,按一定的料液比与蒸馏水进行混合,混合物于均质机中均质5 min,于25 ℃浸提24 h,室温4 390×g离心10 min取上清液,所得蛋白溶液置于-20 ℃冰箱冷冻,待冷冻干燥后,即得水溶性蛋白粉。
1.3.3 鲐鱼水溶性蛋白成分测定
取冻干后的水溶性蛋白粉进行成分测定,采用105 ℃干燥质量恒定法测定水分含量,索氏抽提法测定粗脂肪的含量,微量凯氏定氮法测定粗蛋白的含量,马弗炉灰化法测定灰分的含量。
1.3.3.1 水分含量测定
根据GB 5009.3—2010《食品中水分的测定》 [20],采用直接干燥法进行测定。
1.3.3.2 灰分含量测定
根据GB 5009.4—2010《食品中灰分的测定》 [21]方法进行测定。
1.3.3.3 蛋白含量测定
根据GB 5009.5—2010《食品中蛋白质的测定》 [22],采用半微量凯氏定氮法进行测定。
1.3.3.4 脂肪含量测定
根据GB 5009.6—2010《食品中脂肪的测定》 [23],采用索氏提取法进行测定。
1.3.3.5 多糖含量测定
多糖含量的测定采用苯酚-硫酸法 [24]。
1.3.3.6 粗纤维含量测定
根据GB/T 5009.10—2003《植物类食品中粗纤维的测定》 [25],采用质量法进行测定。
1.3.4 鲐鱼水溶性蛋白提取率的测定
水溶性蛋白提取率的测定采用Bradford法 [26]。
1.3.4.1 牛血清蛋白标准曲线的制作
取11 支试管,编号为0、1、2、3、4、5、6、7、8、9、10,分别吸取牛血清蛋白标准液0.0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 mL,于10 mL具塞试管中,各管加水至1.0 mL,加入5.0 mL预冷的考马斯亮蓝G-250染色液,混匀后静置2 min,以0号管作空白对照,测定各管595 nm波长处的吸光度,以吸光度为纵坐标,蛋白质量浓度为横坐标作曲线,得到标准曲线方程。
1.3.4.2 水溶性蛋白提取率的测定
取未知质量浓度的蛋白液(通过适当稀释,使其质量浓度控制在0.01~0.1 mg/mL范围内),加1 mL到试管内,再加入G-250染色液5 mL混匀,测其595 nm波长处的吸光度,同时做3 个平行实验,根据标准曲线,求出未知蛋白液的质量浓度。
1.3.5 蛋白提取率的计算 [27]
式中:X为样品中蛋白提取率/%;V 1为试剂消耗硫酸或盐酸标准滴定液的体积/mL;V 2为试剂空白消耗硫酸或盐酸标准滴定液的体积/mL;V 3为吸取消化液的体积/mL;c为硫酸或盐酸标准滴定溶液浓度/(mol/L);m为试样的质量/g;F为氮换算为蛋白的系数,计算采用6.25。
1.3.6 单因素试验
1.3.6.1 料液比对水溶性蛋白提取率的影响
准确称取10 g鲐鱼,分别按料液比1∶2、1∶4、1∶6、1∶8、1∶10(g/mL)加入蒸馏水20、40、60、80、100 mL,调节pH值到7.0,在30℃条件的水浴锅中保温6 h,过滤,取滤液,滤渣重复提取2 次,将3 次滤液收集,利用考马斯亮蓝G-250法测定其水溶性蛋白提取率,进行3 次平行试验。
1.3.6.2 提取温度对水溶性蛋白提取率的影响
准确称取10 g鲐鱼,按料液比1∶6(g/mL)加入蒸馏水60 mL,调节pH值到7.0,分别在20、30、40、50、60 ℃条件的水浴锅中保温6 h,过滤,取滤液,滤渣重复提取2 次,将3 次滤液收集,利用考马斯亮蓝G-250法测定其水溶性蛋白提取率,进行3 次平行试验。
1.3.6.3 提取时间对水溶性蛋白提取率的影响
准确称取10 g鲐鱼,按料液比1∶6(g/mL)加入蒸馏水60 mL,调节pH值到7.0,在30℃条件的水浴锅中,分别保温2、4、6、8、10 h,过滤,取滤液,滤渣重复提取2 次,将3 次滤液收集,利用考马斯亮蓝G-250法测定其水溶性蛋白提取率,进行3 次平行试验。
1.3.6.4 提取次数对水溶性蛋白提取率的影响
准确称取10 g鲐鱼,按料液比1∶6(g/mL)加入蒸馏水,调节pH值到7.0,在30 ℃条件的水浴锅中保温6 h,过滤,取滤液,将滤渣分别进行重复提取1、2、3、4、5 次,将重复提取的滤液进行分别收集,利用考马斯亮蓝G-250法测定其水溶性蛋白提取率,进行3 次平行试验。
1.3.7 响应面试验
根据单因素试验结果显示的提取过程中各因素最佳水平,选取料液比、提取时间、提取温度3 个对水溶性蛋白提取率影响较大的因素,在最佳水平附近选择3 个水平,采用三因素三水平共17 个试验点的响应分析试验,零点试验重复5 次,用以提高试验误差估计的灵敏度和准确度。采用Box-Behnken设计和响应面分析法优化水溶性蛋白的提取条件 [28]。
1.3.8 鲐鱼水溶性蛋白挥发性成分测定
1.3.8.1 固相微萃取(solid phase microextraction,SPME)
将65 μm PDMS/DVB萃取头于50 ℃条件下老化30 min。取5.0 mL样品液,于15 mL顶空瓶中,立即旋盖封口并固定于恒温水浴锅中,在设定温度条件下加热平衡30 min后将SPME针管穿透隔垫插入顶空瓶中,调整并固定在顶空瓶中的位置,推出已老化好的萃取头以顶空方式萃取30 min,再将萃取头缩回针管内并立即插入气相色谱进样口中,解吸10 min后取出萃取装置。
1.3.8.2 检测条件
气相色谱条件:色谱柱VF-5MS气相毛细管柱(30 m×0.25 mm,0.25 μm);初始温度40℃,保持1.5 min后,以5.0 ℃/min升至200 ℃,再以10 ℃/min升至300 ℃,保持5 min;分流进样,分流比1∶5,进样口温度250 ℃;载气为高纯度氦气(99.999%),流速1 mL/min。质谱条件:电离源为电子轰击离子源;离子阱温度150 ℃;GC-MS传输线温度280 ℃;电子轰击离子源电子能量为70 eV;溶剂延迟时间2 min。
1.3.8.3 挥发性风味物质的鉴定
根据Willey谱图库对GC-MS分析鉴定的挥发性成分进行解析,将所有分析数据通过计算机检索,并与有关文献比较,再结合保留时间、质谱等参数和方法确定挥发性成分的化学组成。利用谱图库工作站数据处理系统按峰面积归一化法,求得各化学成分在挥发性风味物质中的相对含量。
2.1 鲐鱼水溶性蛋白营养成分分析
取鲐鱼水溶液提取浸出物经冻干后的样品,对其进行成分分析,结果表明:样品水分含量为1.02%,灰分含量为5.20%,蛋白含量为75.06%,脂肪含量为4.60%,多糖含量为10.92%,粗纤维含量为3.20%。主要成分为蛋白,故以下简称为水溶性蛋白,进行成分分析得到水溶性蛋白经冻干后,呈淡黄色或黄色粉末,蓬松柔软,易吸湿,易溶于水,水溶液性质稳定,略有鱼香味。
2.2 鲐鱼水溶性蛋白的提取条件优化
2.2.1 单因素试验结果
2.2.1.1 料液比对鲐鱼水溶性蛋白提取率的影响
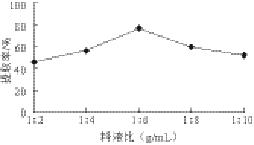
图 1 料液比对鲐鱼水溶性蛋白提取率的影响
Fig.1 Effects of material-to-solvent ratio on the yield of water-soluble protein
由图1可知,随着溶剂用量增大,水溶性蛋白提取率也随之增大;但在料液比1∶6之后,溶剂用量增加使提取率减小,溶剂用量过大会造成溶剂和能源的浪费,且会给浓缩过程带来负担,所以确定料液比为1∶6。
2.2.1.2 提取温度对鲐鱼水溶性蛋白提取率的影响
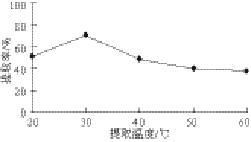
图 2 提取温度对鲐鱼水溶性蛋白提取率的影响
Fig.2 Effects of extraction temperature on the yield of water-soluble protein
提取温度是影响提取效率的重要因素之一。随着提取温度的升高,鲐鱼水溶性蛋白获得相对高的提取率,原因可能是高温溶剂容易促进细胞壁上的多糖物质分散到溶剂体系,弱化或者破环细胞壁的完整性,使得溶剂更加容易和水溶性蛋白接触,从而提高提取率。但是温度过高,提取率反而下降,可能是由于温度过高,使得蛋白变性,因而提取率下降。
由图2可知,随着提取温度的升高,蛋白提取率也随之增大;但温度升高到30 ℃之后,再继续上升,水溶性蛋白提取率反而下降,这可能是由于蛋白的结构被破坏,特别是水溶性蛋白中的活性蛋白。
2.2.1.3 提取时间对鲐鱼水溶性蛋白提取率的影响
提取时间越长,溶剂越能够充分渗透到鲐鱼组织的各个部位,与蛋白物质充分接触并溶解,从而可以提高提取率,但是提取时间过长,可能会引起水溶性蛋白的变性。
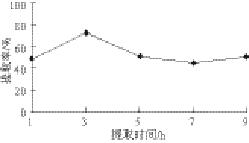
图 3 提取时间对鲐鱼水溶性蛋白提取率的影响
Fig.3 Effects of extraction time on the yield of water-soluble protein
由图3可知,随着提取时间的延长,水溶性蛋白提取率不断提高,但3 h之后,提取率呈现微下降趋势,因此确定提取时间为3 h。
2.2.1.4 提取次数对鲐鱼水溶性蛋白提取率的影响

图 4 提取次数对鲐鱼水溶性蛋白提取率的影响
Fig.4 Effects of extraction number on the yield of water-soluble protein
多次浸提可以提高鲐鱼中水溶性蛋白的提取率。由图4可知,水溶性蛋白提取率随着提取次数的增加而增加,3 次浸提的蛋白提取率显著高于2 次浸提的蛋白提取率,但4 次浸提的蛋白提取率与3 次浸提的蛋白提取率没有明显差异,故选用3 次浸提作为最终提取方案。
2.2.2 响应面试验优化鲐鱼水溶性蛋白的提取条件
2.2.2.1 响应面试验设计与结果
鲐鱼水溶性蛋白的提取受到很多因素的影响,而且各个因素之间往往又相互影响相互作用,根据Box-Behnken试验设计原理,以3 个重要影响因素料液比(A)、提取温度(B)、提取时间(C)为自变量,以水溶性蛋白提取率为响应值,进行三因素三水平试验,将17个试验点的响应值进行回归分析,响应面分析试验设计与结果见表1。
表 1 鲐鱼水溶性蛋白提取响应面分析方案及结果
Table 1 Experimental scheme and results for reponse surface methodology
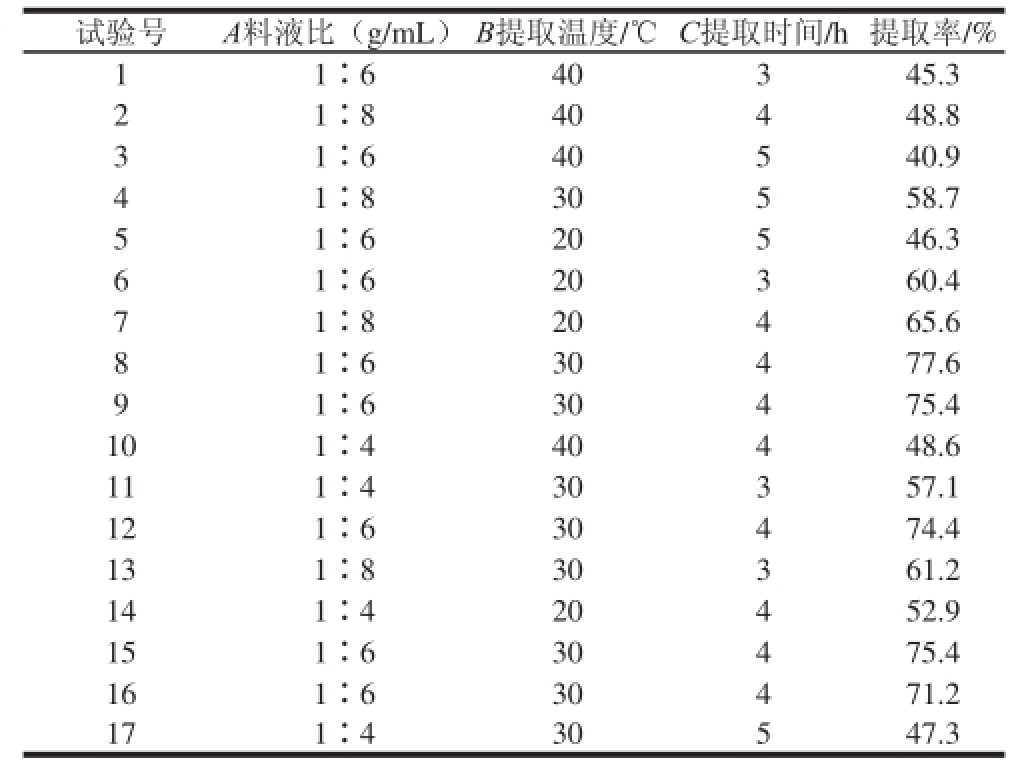
试验号A料液比(g/mL)B提取温度/℃C提取时间/h提取率/% 1 1∶640345.3 2 1∶840448.8 3 1∶640540.9 4 1∶830558.7 5 1∶620546.3 6 1∶620360.4 7 1∶820465.6 8 1∶630477.6 9 1∶630475.4 101∶440448.6 111∶430357.1 121∶630474.4 131∶830361.2 141∶420452.9 151∶630475.4 161∶630471.2 171∶430547.3
对试验结果进行回归分析,以鲐鱼水溶性蛋白提取率为响应值,经回归拟和后,各试验因素对响应值的影响可通过如下回归方程表示:提取率/%=74.80+3.55A-5.20B-3.85C-3.13AB+1.83AC+2.43BC-6.49A 2-14.34B 2-12.24C 2。
2.2.2.2 模型方差分析
对模型进行方差分析,用模型对水溶性蛋白提取率进行分析和预测,探讨3 个因素对蛋白提取的影响,结果见表2。
表 2 鲐鱼水溶性蛋白提取回归方程的方差分析结果
Table 2 Analysis of variance of regression equation
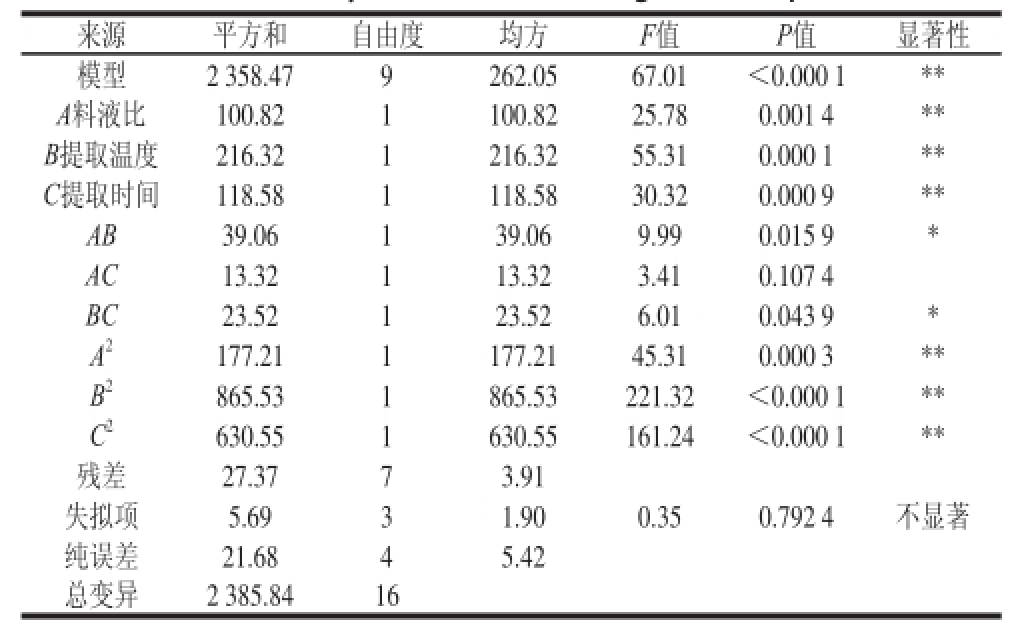
注:**.差异极显著,P<0.01;*.差异显著,P<0.05。R 2=0.988 5。
来源平方和自由度均方F值P值显著性模型2 358.479262.0567.01<0.000 1** A料液比100.821100.8225.780.001 4** B提取温度216.321216.3255.310.000 1** C提取时间118.581118.5830.320.000 9** AB39.06139.069.990.015 9* AC13.32 113.323.410.107 4 BC23.52123.526.010.043 9* A 2177.211177.2145.310.000 3** B 2865.531865.53221.32<0.000 1** C 2630.551630.55161.24<0.000 1**残差27.3773.91失拟项5.6931.900.350.792 4不显著纯误差21.6845.42总变异2 385.8416
由表2可知,对水溶性蛋白提取率所建立的回归模型极显著(P<0.01),失拟项不显著(P>0.05),该模型的复相关系数R 2为0.988 5,表明该模型与实际情况拟合较好。在所选的各因素水平范围内,各因素对水溶性蛋白提取率的影响顺序为:提取温度>提取时间>料液比。表2显示,一次项A、B、C,二次项A 2、B 2、C 2对水溶性蛋白提取率的影响极为显著(P<0.01),交互项AB、BC对水溶性蛋白提取率的影响为显著(P<0.05),交互项AC对水溶性蛋白提取率的影响不显著。
2.2.2.3 鲐鱼水溶性蛋白提取因素间的交互作用
响应面分析见图5~7。响应面三维图能直观地反映出各因素对响应值的影响程度及因素间交互作用的强弱。三维图在平面上的投影即为等高线图,等高线形状反映了交互影响的强弱,圆形等高线表明两因素的交互作用相对较弱;椭圆形等高线两因素的交互作用相对较强 [29]。

图 5 料液比与提取温度对鲐鱼水溶性蛋白提取率的交互影响
Fig.5 Effects of material-to-solvent ratio and extraction temperature on the yield of water-soluble protein

图 6 料液比与提取时间对鲐鱼水溶性蛋白提取率的交互影响
Fig.6 Effects of material-to-solvent ratio and extraction time on the yield of water-soluble protein
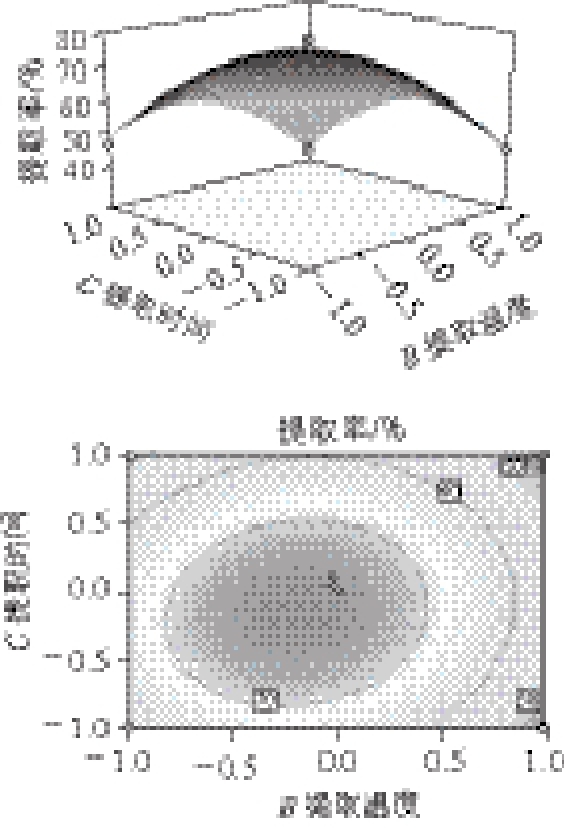
图 7 提取时间与提取温度对鲐鱼水溶性蛋白提取率的交互影响
Fig.7 Effects of extraction time and temperature on the yield of water-soluble protein
从图5可以看出,当料液比一定时,提取温度对鲐鱼水溶性蛋白提取率的影响比较小,但是当提取温度一定时,水溶性蛋白提取率随溶剂用量的增大先增大后减少。从图6可以看出,在料液比一定时,随着提取时间的延长,水溶性蛋白的提取率先是逐渐增大,当达一定的提取时间时,水溶性蛋白提取率又开始逐渐减小。但是当提取时间一定时,水溶性蛋白提取率随溶剂用量的增大先升高后降低。从图7可以看出,当提取时间一定时,提取温度对鲐鱼水溶性蛋白提取率的影响比较小。但当提取温度一定时,随着提取时间的延长水溶性蛋白提取率先增大后减小。分析其原因可能是由于蛋白变性,发生凝集,实验测得水溶性蛋白的量减少。
根据软件分析结果结合实际得最优化提取条件为料液比1∶6.612、提取温度27.73℃、提取时间3.84 h,提取的水溶性蛋白提取率为76.24%。为了验证模型的有效性,固定提取条件在优化条件下进行验证实验。料液比1∶6.6、提取温度27.7 ℃、提取时间3.8 h,实验结果显示,水溶性蛋白提取率为76.12%。验证实验的实测值与预测值非常接近。
2.3 鲐鱼水溶性蛋白挥发性成分分析
2.3.1 鲐鱼水溶性蛋白挥发性成分的GC-MS总离子色谱图

表 3 鲐鱼水溶性蛋白的挥发性成分的GC-MS 分析
Table 3 Volatile compounds identified from mackerel meat, water-soluble protein extract and extraction residue

保留时间/min鉴定化合物名称挥发性物质相对含量/%原料鱼提取后鱼块水溶性蛋白液原料鱼提取后鱼块水溶性蛋白液3.7903.7473.7271,5-己二烯醇 1,5-hexadien-3-ol1.1260.5870.942 4.0283.9603.9812-乙基呋喃 2-ethylfuran2.0761.2793.428 6.5936.5536.553反-2-甲基环戊醇 trans-2-methylcyclopentanol21.21 2.3114.29 9.7259.6932-庚酮 2-heptanone0.0560.372 10.17810.1454-甲基环己醇 4-methylcyclohexanol7.0393.336 12.65712.684苯甲醛 benzaldehyde0.5090.324 12.86312.83912.844反式-1,2-二甲基环戊烷 trans-1,2-dimethylcyclopentane0.7991.7250.276 12.98312.94712.9542-辛烯醛(E)-2-octenal(E)-3.3191.8572.607 13.21913.20013.2001-辛烯-3-醇 1-octen-3-ol9.7896.02810.290 13.41613.39013.4012(3H)-呋喃酮 2(3H)-furanone3.1825.8724.917 13.57013.54613.5522-正戊基呋喃 2-pentylfuran1.0581.0532.594 13.94413.91013.922顺式-2 -(2-戊烯基)呋喃 cis-2-(2-pentenyl)furan0.9521.4783.985 14.14514.11214.127顺-5-辛烯-1-醇 cis-5-octen-1-ol6.40115.164.243 14.582(E,E)-2,4-壬二烯醛 2,4-nonadienal-(E,E)2.438 15.27515.2503-环己烯-1-甲醛,4-甲基 -3-cyclohexene-1-carboxaldehyde,4-methyl-0.9560.437 16.37916.35016.3792 -辛烯醛(E)-2-octenal(E)-0.8440.7981.340 16.643顺-5-辛烯-1-醇 5-octen-1-ol0.454 16.79016.76316.7962-壬烯-1-醇 2-nonyn-1-ol9.2717.4127.612 17.25917.25217.246桃金娘醇 (-)-myrtenol1.2141.1940.938 17.53817.52917.5392-壬酮 2-nonanone0.1060.7520.705 17.718(3E,5E)-3,5-辛二烯-2-酮 (3E,5E)-3,5-octadien-2-one0.523 18.07518.05418.0583-壬烯-1-醇,(3E)-3-nonen-1-ol,(3E)-25.95029.7216.69 18.34918.32518.347顺式-3-叔丁基-4-乙烯基-环 cis-3-butyl-4-vinyl-cyclopentene2.6971.7660.858 21.85921.83421.836顺-4-癸烯-1-醇 cis-4-decen-1-ol2.5381.7479.135 23.8702-癸炔-1-醇 2-decyn-1-ol0.544 26.514异胡薄荷醇 isopulegol0.667 26.507丁香醛A lilac aldehyde A 9.321 27.9752-壬烯-4-酮-1,2-甲基 2-nonen-4-one-,2-methyl4.679 26.569丁香碳醛 lilac aldehyde C1.345 28.50928.48128.482桃金娘醇 (-)-myrtenol0.7540.4960.828

图 8 鲐鱼水溶解前后挥发性物质的GC-MS分析总离子色谱图
Fig.8 GC-MS chromatograms of volatile compounds of mackerel meat, water-soluble protein extract and extraction residue
将鲐鱼进行水溶性蛋白提取,并分别对原料鲐鱼、水溶性蛋白溶液、提取水溶性蛋白后的鲐鱼鱼块进行GC-MS分析,得到的总离子流色谱图如图8所示。
2.3.2 鲐鱼水溶性蛋白的挥发性成分鉴定
对总离子色谱图进行分析表明,水溶解后的样品挥发性成分发生了变化。通过计算机标准质谱图库检索、各组分的质谱图分析及与文献报道的质谱数据分析,并通过归一化定量,其结果见表3。
表3结果表明,原料鲐鱼在26.569 min产生的丁香碳醛,水溶解后不再含有。鲐鱼原料中含有的苯甲醛进入溶液中,水溶解后的鲐鱼鱼肉中也不再含有;而且,在14.582 min产生了(E,E)-2,4-壬二烯醛。16.643 min产生了顺-5-辛烯-1-醇。17.718 min产生了(3E,5E)-3,5-辛二烯-2-酮。23.870 min产生了2-癸炔-1-醇。26.514 min产生了异胡薄荷醇。水溶解后的溶液中产生了2 种新物质,分别是在26.507 min产生了丁香醛A,在27.975 min产生了2-壬烯-4-酮-1,2-甲基。
原料鲐鱼共含有23 种挥发性成分,其中醇类有10 种,醛类有5 种,呋喃类3 种,酮类占3 种,烷烃、芳香烃各1 种,相对含量分别为醇类占85.28%,醛类含量占6.97%,呋喃含量占4.09%,酮类含量占0.16%,烷烃、芳香烃含量占3.50%。
提取水溶性蛋白后的鲐鱼鱼块含挥发性成分26 种,其中主要的挥发性风味物质仍为醇类,共含有13种,另外,还含有酮类4 种,醛类4 种,呋喃3 种,烷烃、芳香烃2 种,新产生3 种醇类,1 种酮类,1 种醛类。醇类含量有所下降,为79.65%,酮类含量有了提高,为7.52%,呋喃类、醛类、烃类含量都没有明显变化,分别为3.81%,醛类为5.53%,烷烃、芳香烃为3.49%。
水溶性蛋白溶液中挥发性成分物质种类较少,为21 种,其中醇类9 种,醛类4 种,呋喃3 种,酮类3 种,烷烃、芳香烃各1 种。含量醇类为64.97%,醛类为13.59%,呋喃类为10.00%,酮类为10.30%,烷烃、芳香烃为1.14%。
鲐鱼水溶性蛋白的最佳提取工艺条件为料液比1∶6.6、提取温度27.7 ℃、提取时间3.8 h,提取的水溶性蛋白提取率为76.12%。将鲐鱼原料和水溶解后样品的挥发性成分进行分析,结果表明,水溶性蛋白挥发性成分醇类物质含量降低,酮类、醛类、呋喃类物质含量都有了明显提高。样品经过冷冻干燥后,呈淡黄色或黄色粉末,蓬松柔软,易吸湿,易溶于水,水溶液性质稳定,略有鱼香味。
参考文献:
[1] 王晓龙. 鲐鱼鱼油提取精制及抗氧化活性研究[D]. 舟山: 浙江海洋学院, 2014.
[2] 郑平安, 孙静, 全晶晶, 等. 贮藏温度对鲐鱼品质的影响研究[J]. 核农学报, 2013, 27(1): 75-80.
[3] 王雪芹, 邢荣娥, 刘松, 等. 鲐鱼蛋白酶解工艺优化及酶解物的抗氧化活性测定[J]. 现代食品科技, 2013, 29(5): 1023-1028.
[4] 欧阳杰, 蔡淑君, 林蔚, 等. 鲐鱼与鱼糜脱脂方法的筛选研究[J]. 食品工业科技, 2011, 32(2): 211-216.
[5] 欧阳杰, 蔡淑君, 林蔚, 等. 多脂红身鱼鱼糜脱脂方法的对比实验研究[J]. 食品科学, 2009, 30(24): 179-182.
[6] 郑平安. 鲐鱼储藏期品质的变化及加工过程中风味的研究[D]. 宁波: 宁波大学, 2013.
[7] TSYBINA T A, DUNAEVSKY Y E, BELOZERSKY M A, et al. Digestive proteinases of yellow mealworm (Tenebrio molitor) larvae: purification and characterization of a trypsin-like proteinase[J]. Biochemistry (Moscow), 2005, 3(3): 300-305.
[8] KUMAR N S S, NAZEER R A. Functional properties of protein hydrolysates from different body parts of horse mackerel (Magalaspis cordyla) and croaker (Otolithes ruber)[J]. Mediterranean Journal of Nutrition and Metabolism, 2012, 5(2): 111.
[9] 曹万新, 孟橘, 田玉霞. DHA的生理功能及应用研究进展[J]. 中国油脂, 2011, 36(3): 1-4.
[10] 施亚芳. 鱼糜漂洗液蛋白质回收研究[D]. 杭州: 浙江大学, 2012.
[11] 逯慎杰, 梅术文, 刘秀河, 等. 鱼糜废水中蛋白质等电沉淀的规律研究[J]. 食品工业科技, 2012, 33(18): 93-95.
[12] 卫生部. GB 19301—2010 食品安全国家标准: 生乳[S]. 北京: 中国标准出版社, 2010.
[13] 吴正奇, 李佳文, 石勇, 等. 淡水鱼糜漂洗水中水溶性蛋白质回收的研究[J]. 食品工业, 2011, 32(1): 81-84.
[14] 李鹏. 漂洗次数对鲶鱼鱼糜品质的影响及漂洗液中肌浆蛋白的回收与利用[D]. 天津: 天津农学院, 2014.
[15] 徐明生, 陈锦屏, 上官新晨. 鲤鱼抗菌精蛋白的分离纯化及鉴定[J].食品工业科技, 2004, 25(10): 51-54.
[16] 张宗恩, 杨波. 用三氯化铁回收鱼糜漂洗液中的水溶性蛋白[J]. 水产科技情报, 1997(5): 207-209.
[17] 徐律, 杨津生, 丁迎燕, 等. 鱼糜漂洗水中蛋白质的提取研究[J]. 饲料工业, 2010, 31(16): 38-41.
[18] 许燕顺, 高琪, 姜启兴, 等. 鲢鱼糜漂洗液中蛋白质分析与回收[J].食品与机械, 2012, 28(6): 89-92.
[19] 陈建旭. 灵芝水溶性蛋白与碱溶性多糖的提取和抗氧化性研究及灵芝浆的研制[D]. 广州: 华南理工大学, 2010.
[20] 卫生部. GB 5009.3—2010 食品中水分的测定[S]. 北京: 中国标准出版社, 2010.
[21] 卫生部. GB 5009.4—2010 食品中灰分的测定[S]. 北京: 中国标准出版社, 2010.
[22] 卫生部. GB 5009.5—2010 食品中蛋白质的测定[S]. 北京: 中国标准出版社, 2010.
[23] 卫生部. GB 5009.6—2010 食品中脂肪的测定[S]. 北京: 中国标准出版社, 2010.
[24] IMAM H, LIAN S, KASIMU R, et al. Extraction of an antidiabetic polysaccharide from seeds of Ocimum basilicum and determination of the monosaccharide composition by precolumn high-efficiency capillary electrophoresisa[J]. Chemistry of Natural Compounds, 2012, 48(4): 653-654.
[25] 卫生部. GB/T 5009.10—2003 植物类食品中粗纤维的测定[S]. 北京: 中国标准出版社, 2003.
[26] 陈毓荃. 生物化学实验方法和技术[M]. 北京: 科学出版社, 2002.
[27] 穆华荣. 食品分析[M]. 2版. 北京: 化学工业出版社, 2009: 221-223.
[28] REDDY L V A, JOSHI V K, REDDY O V S. Utilization of tropical fruits for wine production with special emphasis on mango (Mangifera indica L.) wine[J]. Microorganisms in Sustainable Agriculture and Biotechnology, 2012, 13: 679-710.
[29] 王梅英, 陈慧斌, 陈军. 响应面法优化超声波辅助提取岩茶总黄酮工艺研究[J]. 食品工业科技, 2011, 32(12): 327-330.
Extraction and Volatile Components of Mackerel Water-Soluble Proteins
ZHOU Jiaping
1, ZHANG Wentao
2, MENG Meng
2, WANG Yuemeng
2, LIU Anjun
2, ZHENG Jie
2
(1. Research Center for Modern Analysis Techniques, Tianjin University of Science and Technology, Tianjin 300457, China;2. College of Food and Biotechnology, Tianjin University of Science and Te chnology, Tianjin 300457, China)
Abstract:By using a combination of one-factor-at-a-time method and response surface methodology, the optimal conditions for the extraction of water-soluble proteins from mackerel meat were determined as solid-liquid ratio of 1:6.6, extraction temperature of 27.7 ℃, and extraction time of 3.8 h. Experiments conducted under these conditions led to an extraction yield of 76.12%. Solid phase microextraction combined with GC-MS was used to analyze the volatile components of mackerel meat and the protein extract. The results showed that the content of alcohols decreased, whereas the contents of ketones, aldehydes, and furans in the extract markedly increased as compared to mackerel meat. The water-soluble proteins after freeze-drying were light yellow or yellow, fluffy and soft, could easily absorb moisture, and had good solubility and stability in water with a slight fishy flavor.
Key words:mackerel; water-soluble proteins; gas chromatography-mass spectrometry (GC-MS)
中图分类号:TS254
文献标志码:A
文章编号:1002-6630(2015)08-0012-07
doi:10.7506/spkx1002-6630-201508003
收稿日期:2014-07-03
基金项目:国家自然科学基金青年科学基金项目(30471225);国家高技术研究发展计划(863计划)项目(2013AA102204)
作者简介:周家萍(1987—),女,助理实验师,硕士,研究方向为营养与食品卫生。E-mail:zhoujiaping@tust.edu.cn