李坚斌,陈小云,张 帆,陆登俊,廖文敏
(广西大学轻工与食品工程学院,广西 南宁 5300 04)
摘 要:采用Na 2HPO 4与NaH 2PO 4质量比为2∶1的混合盐为酯化剂对葡甘露聚糖(konjac glucomannan,KGM)进行磷酸酯化改性,以酯化取代度为指标,微波 法改 性的最佳工艺条件为反应温度60 ℃、微波辐射 时间7 min、pH4.0、磷酸盐的质量分数30%、微波功率 800 W,获到酯化取代度为0.055 4的葡甘露聚糖磷酸单酯(konjac glucomannan phosphate,KGMP)。红外光谱表明,KGM主链分子上引入磷酸基团,得到KGMP。电镜扫描显示,KGMP颗粒体积大,结构更紧密。
关键词:葡甘露聚糖;磷酸酯化;微波改性
葡甘露聚糖(konjac glucomannan,KGM)是一种可再生的农业初级产品,也是天然的多糖聚合物,来源稳定丰富,性能优势明显,被大量用作工业原材料,广泛用于食品、医药、造纸、纺织等领域 [1-2]。由于KGM分子质量大、水溶性差、水溶胶不稳定,尤其是在高温和冷冻条件下稳定性极差 [3],使其应用受到限制,为了改善其性能,扩大应用范围,不少人对其进行过化学改性研究 [4-11],但对KGM磷酸改性的研究比较少。
微波作为一种频率非常高的电磁波,具有高效、节能、清洁等加热特点,将给酯化反应带来积极的影响,工艺过程得到简化,显著地减少了能耗,环保节能 [12-13]。KGM易与磷酸盐反应生成葡甘露聚糖磷酸酯 [14-16],改性后的产物各项性能都得到了明显改善,产物质量得到提高,为扩大KGM的应用范围开辟了新的途径。本实验研究KGM的微波法磷酸酯化改性工艺,并对改性前后的产品进行了结构表征,为KGM的进一步开发和应用提供理论依据。
1.1 材料与仪器
魔芋精粉(编号NUKON-M,纯度95.4%) 北海多环保健品有限公司。
UV-2802H型紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;78HW-1型恒温磁力搅拌器 杭州仪表电机厂;pHS-3C型酸度计 上海雷磁仪器厂;Nexus470红外光谱仪 美国HP公司;S-3400N扫描电子显微镜 日本Hitachi公司;XH-100A型微波催化合成/萃取仪(控温) 北京祥鹄科技发展有限公司。
1.2 方法
1.2.1 KGM微波磷酸酯化改性
称取一定量的KGM,分散于Na 2HPO 4与NaH 2PO 4的质量比为2∶1的磷酸盐水溶液中浸泡,充分搅拌,过滤,滤饼在50℃以下干燥至含水量10%。然后,在微波中进行固相酯化反应,用多次乙醇溶液洗涤后,得到葡甘露聚糖磷酸单酯(konjac glucomannan phosphate,KGMP)。
1.2.2 取代度(degree of substitution,DS)测定
KGMP的磷酸酯化DS的测定主要依据结合磷的含量 [17],结合磷的含量是由总磷减去游离磷的含量得到的。产物总磷含量采用GB/T 12092—1989《淀粉及其衍生物磷总含量测定方法》 [18]方法进行测定,游离磷测定是用盐酸溶解试样,过滤后取滤液进行钼酸铵显色反应,查标准曲线计算得到。DS的计算公式为 [18]:
1.2.3 单因素试验
固定试验条件,KGM的质量为10.0 g,选取反应温度(40.0、50.0、60.0、70.0、80.0、90.0 ℃)、反应时间(1.0、1.5、2.0、2.5、3.0、3.5、4.0 h)、pH值(3、4、5、6、7、8、9)、酯化剂用量(以正磷酸盐与KGM干质量的比表示,分别为0%、10%、20%、30%、40%、50%、60%、70%)、催化剂用量(与KGM的干质量比分别为0%、2%、4%、6%、8%、10%)、微波功率(400、500、600、700、800、900、1 000 W)和微波辐射时间(1.0、3.0、5.0、7.0、9.0、11.0 min)7 个主要影响因素为研究对象,以KGMP的DS为指标,固定其中6个因素的数值不变,考察单一因素对DS的影响。
1.2.4 正交试验
选择反应温度、pH值、磷酸盐用量、微波功率和微波辐射时间5 个主要影响因素,依据单因素结果列出正交试验因素水平表,以KGMP的DS为指标,进行L 16(4 5)正交试验。
1.2.5 红外光谱
采用KBr压片法,按比例分别取一定量干燥后的KGM、KGMP粉末,在玛瑙研钵中,与KBr研磨混合,置于配有ATR附件的傅里叶红外光谱仪上测试,扫描波数范围为650~4 000 cm -1,分辨率为4 cm -1,扫描累加32次。
1.2.6 电镜扫描
在红外灯照射下将干燥后的样品粉末固定在双面导电胶上,在真空下对样品进行离子溅射喷金处理,用扫描电子显微镜观察样品表面形貌。
2.1 单因素试验结果
2.1.1 反应温度对产物DS的影响

图 1 反应温度对DS的影响
Fig.1 Effect of reaction temperature on DS
由图1可知,随着温度的升高,DS先增加后降低。因为温度升高有利于KGM分子间氢键的断裂,使反应正向进行。温度为60.0 ℃时,DS达到最大。继续加热,溶胶开始变稀,产物糊化分解,DS下降。在酯化反应中温度直接影响着产物的DS,因此,将反应温度选择为60.0 ℃。
2.1.2 反应时间对产物DS的影响
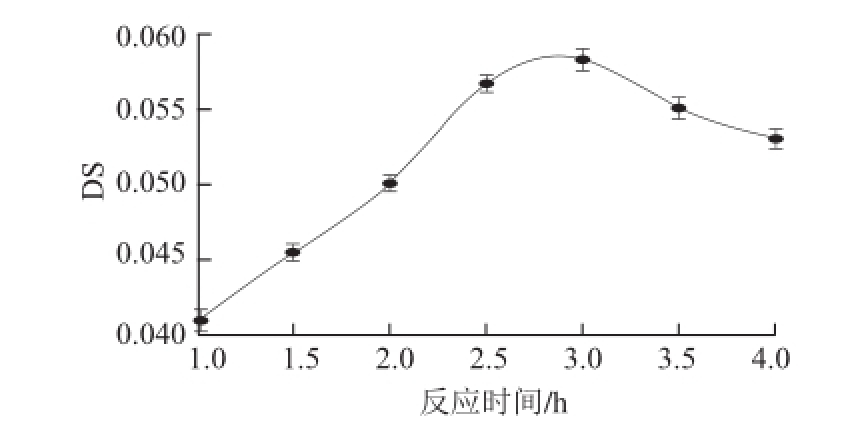
图 2 反应时间对DS的影响
Fig.2 Effect of reaction time on DS
由图2可知,随着反应时间的延长,DS先增加后降低。当反应时间为3.0 h,DS最大。随着反应时间的延长,DS下降,因为反应时间较长时,产物会发生糊化褐变,DS下降。酯化反应时间同样影响着产物的DS,故反应时间控制在2.5~3.0 h较适宜。
2.1.3 pH值对产物DS的影响

图 3 pH值对DS的影响
Fig.3 Effect of pH on DS
由图3可知,DS随着pH值的增加先升后降,当pH值较低时,KGM水解为单糖,减弱KGM分子间的相互作用力,有利于酯化反应,故酯化反应在酸性条件下比较稳定。随着pH值的增大,磷酸盐的分布和存在形式不同,不利于酯化反应的进行,DS降低。因此,选择pH值为5.0。
2.1.4 酯化剂用量对产物DS的影响

图 4 磷酸盐用量对DS的影响
Fig.4 Effect of phosphate dosage on DS
由图4可知,随着酯化剂磷酸盐的增加,DS增大。因为KGM分子的羟基基团是固定不变的,其活性取决于接近羟基的磷酸盐的量,当酯化剂的加入量达到40%时,产物DS的增加平缓,反应基本趋于平衡。如果继续增加磷酸盐的加入量,会使产物中游离磷含量增多,给洗涤过程带来困难,从而影响产品质量。故反应中磷酸盐用量为40%~50%合适。
2.1.5 催化剂用量对产物DS的影响
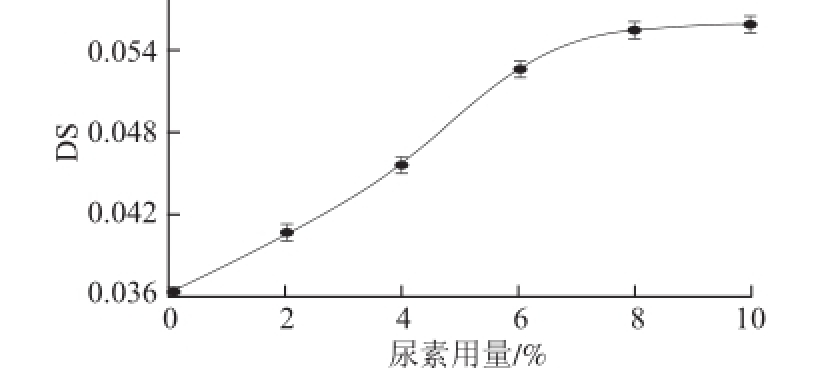
图 5 尿素用量对DS的影响
Fig.5 Effect of urea dosage on DS
由图5可知,DS随着尿素用量的增加而增加。当尿素用量达到6%时,产物DS增加缓慢,酯化反应达到饱和。尿素在KGM酯化反应中起到催化作用,能促使KGM分子中的葡萄糖残基打开氢键,游离出羟基,提高了KGM和磷酸盐间的反应效率 [18]。故在酯化反应中,催化剂尿素的适宜用量为6%。
2.1.6 微波功率对微波改性DS的影响
由图6可知,DS随微波功率的增加而增大,因为KGM高分子对微波具有吸收作用,微波能量可使分子运动由原来杂乱无章运动变成有序的高频振动 [19],促进酯化反应正向进行,从而提高了产品的DS。当功率达到800 W时,继续增大微波功率,DS增加缓慢,反应达到饱和。因此,选择反应的微波功率为800 W。
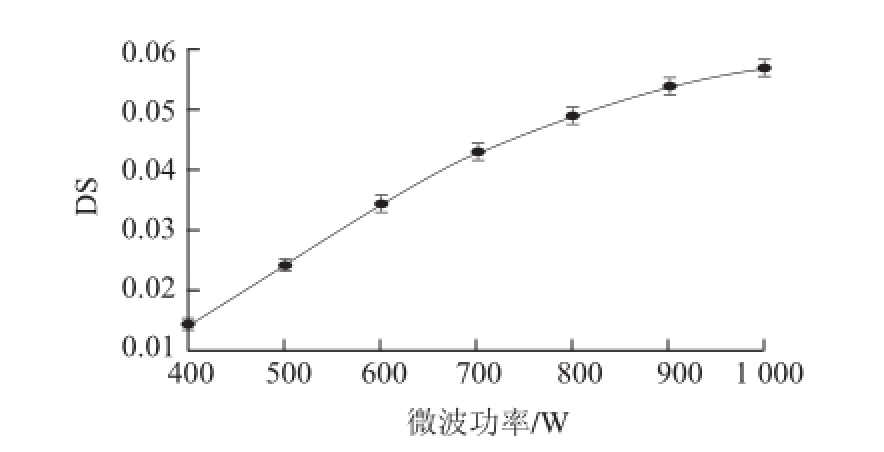
图 6 微波功率对DS的影响
Fig.6 Effect of microwave power on DS
2.1.7 微波辐射时间对微波改性DS的影响

图 7 微波辐射时间对DS的影响
Fig.7 Effect of microwave radiate time on DS
由图7可知,DS随微波辐射时间的延长先升后降。当微波辐射时间较短时,DS随辐射时间的延长而增大,因为在酯化反应中,微波辐射属于“无温度梯度”的加热方式 [20],可以提高分子的热能,降低反应的活化能,加速反应向正方向进行,因此DS增大。当微波辐射时间为7.0 min时,DS达到最大。继续延长微波辐射时间,DS随之降低,可能是因为微波辐射时间过长时,会引起KGM自身的降解,不利于反应的进行。因此,选择微波辐射的时间为7.0 min。
2.2 正交试验结果
选择反应时间为3 h,催化剂尿素的用量为6%,结果如表1所示。
由表1和表2可知,微波改性的最优组合A 2B 3C 1D 1E 3,即反应温度60 ℃、微波辐射时间7 min、pH 4.0、磷酸盐用量30%、微波功率800 W;各因素对DS影响的主次顺序反应温度(A)>微波辐射时间(B)>微波功率(E)>pH值(C)>磷酸盐用量(D)。按照此最佳工艺条件进行验证实验,最终所得的KGMP,DS为0.055 4,由此可以确定制备KGMP的最佳工艺。
表 1 L
16(4
5)微波改性的正交试验设计及结果
Table 1 L
16(4
5) orthogonal array design and experimental results for microwave-assisted modification of KGM
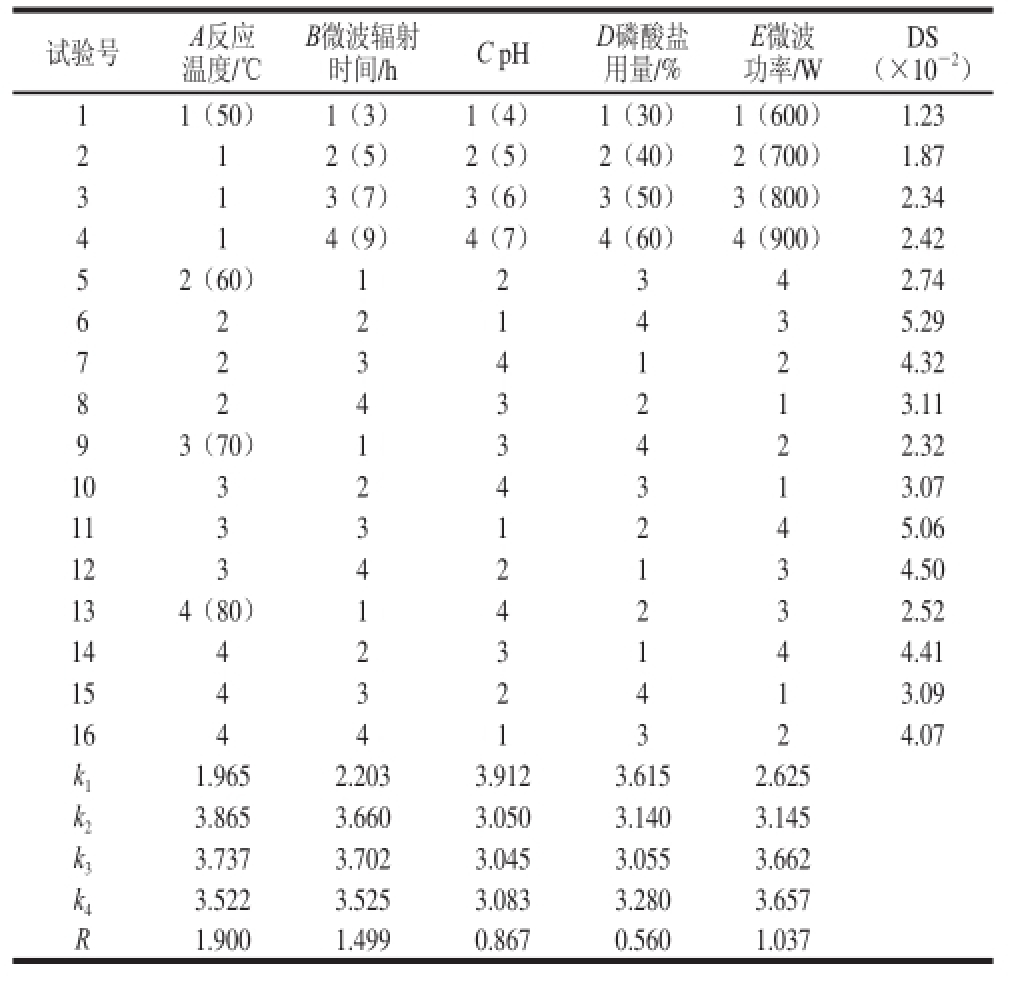
试验号A反应温度/℃E微波功率/W B微波辐射时间/hC pHD磷酸盐用量/% DS(×10 -2)11(50)1(3)1(4)1(30)1(600)1.23 212(5)2(5)2(40)2(700)1.87 313(7)3(6)3(50)3(800)2.34 414(9)4(7)4(60)4(900)2.42 52(60)12342.74 6221435.29 7234124.32 8243213.11 93(70)13422.32 10324313.07 11331245.06 12342134.50 134(80)14232.52 14423144.41 15432413.09 16441324.07 k 11.9652.2033.9123.6152.625 k 23.8653.6603.0503.1403.145 k 33.7373.7023.0453.0553.662 k 43.5223.5253.0833.2803.657 R1.9001.4990.8670.5601.037
表 2 微波改性方差分析表Table 2 Analysis of variance of microwave-assisted modification
Table 2 Analysis of variance of microwave-assisted modification
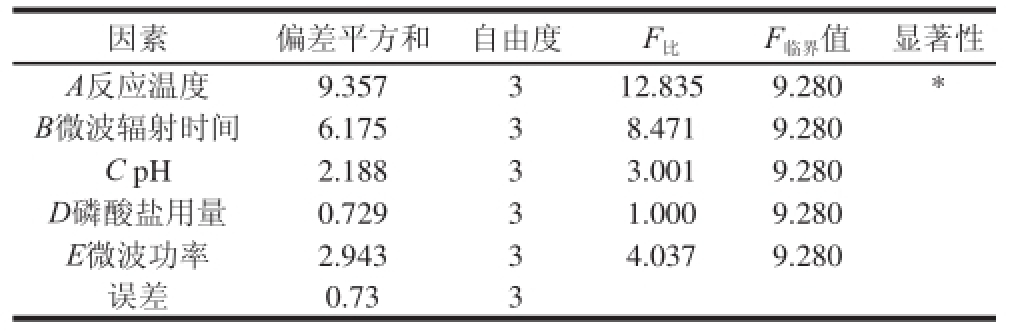
注:*.差异显著(P<0.05)。
因素偏差平方和自由度F 比F 临界值显著性A反应温度9.357312.8359.280* B微波辐射时间6.17538.4719.280 C pH2.18833.0019.280 D磷酸盐用量0.72931.0009.280 E微波功率2.94334.0379.280误差0.733
2.3 KGMP的红外光谱表征

图 8 KGM红外谱图
Fig.8 Infra-red spectrum of KGM
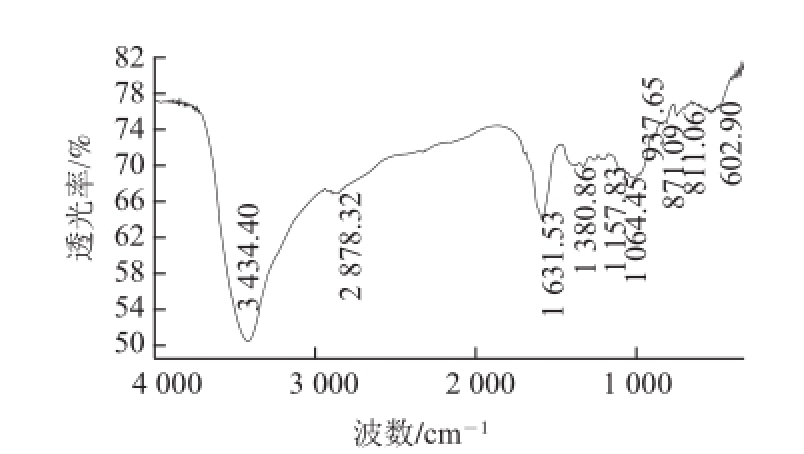
图 9 KGMP红外谱图
Fig.9 Infrared spectrum of KGMP
KGM和在上述最优条件下获得的KGMP(DS为0.055 4)的红外光谱图如图8、9所示。
由图8和图9可知,KGM的红外光谱图中3 428 cm -1左右处是羟基的伸缩振动峰,2 887 cm -1左右是C—H伸缩振动吸收峰,1 728 cm -1左右处是羰基C=O伸缩振动峰,说明KGM多糖链上存在乙酰基,1 643 cm -1处为KGM多糖分子内氢键的吸收峰,1 024 cm -1左右处是C—O的振动吸收峰,876 cm -1左右为甘露糖C 2和C 4处的C—H变角振动峰,808 cm -1左右是吡喃甘露糖的特征吸收峰 [21]。
KGMP的谱图中保留了876 cm -1和808 cm -1左右的两个吸收峰,说明改性过程中未改变多糖主链的一级结构,2 9 29 cm -1附近的O—H伸缩振动峰消失,说明KGM的羟基发生反应 [13]。1 630 cm -1左右的吸收峰加强,是磷酰基P=O的伸缩振动吸收带 [14],P=O在不同结构的化合物中位置分布很宽,在1 630 cm -1附近出现,说明反应引入了磷酸基团。因此,在酯化反应的过程中,KGM主链分子上引入了磷酸基团,得到KGMP。
2.4 KGMP的表面形貌

图 10 KGM(A)和KGMP(B)的电镜扫描图(×5 000)
Fig.10 SEM photographs of KGM and KGMP (× 5 000)
由图10可见,KGM粉末含有大颗粒,表面结构无序、松散;KGMP粉末表面结构比KGM的更紧密、平整、均匀。可能是因为KGM大分子与磷酸基团发生了部分的酯化取代作用,分子内部作用力增大,结合更紧密,从而使分子排列更紧密整齐。
以Na 2HPO 4和NaH 2PO 4混合盐为改性试剂对KGM进行了磷酸酯化改性,通过微波改性获得了高DS的KGMP粉末。微波法改性反应时间短,显著地提高了产品的DS,工艺过程得到简化,大大减少了能耗,具有高效、节能、环保等特点,将给酯化反应带来积极的影响,微波改性新方法具备非常明显的优势。
微波法改性的最佳工艺条件为反应温度60 ℃、微波辐射时间7 min、pH 4.0、磷酸盐用量30%、微波功率800 W、催化剂用量6%,获得酯化DS为0.055 4的KGMP。红外光谱研究表明,KGM主链分子上引入磷酸基团,得到KGMP。电镜扫描显示,KGMP结构更紧密。
参考文献:
[1] 罗清楠, 赵国华, 庞杰, 等. 魔芋葡甘聚糖研究进展[J]. 食品与发酵工业, 2011, 37(6): 137-140.
[2] CHUA M, BALDWIN T C, HOCKING T J, et al. Tradtional uses and potential health benefits of Amorphophallus konjac K. Koch ex N. E. Br[J]. Journal of Ethnopharmacology, 2010, 128(2): 268-278.
[3] 吴绍艳, 张升晖, 吴亮. 魔芋葡甘聚糖酯化交联改性研究[J]. 食品研究与开发, 2005, 26(3): 116-118.
[4] 王丽霞, 姚闽娜, 王芹, 等. 魔芋葡甘聚糖结构的研究进展[J]. 食品与机械, 2011, 27(3): 143-146.
[5] FITZSIMONS S M, TOBIN J T, MORRIS E R. Synergistic binding of konjac glucomannan to xanthan on mixing at room temperature[J]. Food Hydrocolloids, 2008, 22(10): 36-46.
[6] CHEN Ligui, LIU Zhilan, ZHUO Renxi. Synthesis and properties of degradable hydrogels of konjac glucomannan grafted acrylic acid for colon specific drug delivery[J]. Polymer, 2005, 46(16): 6274- 6281.
[7] YU Huiqun, XIAO Chaobo. Synthesis and properties of novel hydrogels from oxidized konjac glucomannan crosslinked gelatin for in vitro drug delivery[J]. Carbohydrate Polymers, 2008, 72(3): 479-489.
[8] TIAN Dating, XIE Hongquan. Synthesis and flocculation charateristics of konjac glucomannan-g-polyacrylamide[J]. Polymer Bulletin, 2008, 61(3): 277-285.
[9] CHEN Zhigang, ZONG Minhua, GU Zhenxin, et al. Effect of ultrasourd on enzymatic acylation of koujac glucomannan[J]. Process Biochemistry, 2006, 41: 1514-1520.
[10] KOROSKENYI B, MCCARTHY S P. Synthesis of acetylated konjac glucomannan and effect of degree of acetylation on water absorbency[J]. Biomacromolecules, 2001, 2(3): 824-826.
[11] ZHAO Xiaona, HU Yuanling, WANG Deyun, et al. Optimization of sulfated modification conditions of tremella polysaccharide and effects of modifiers on cellular infectivity of NDV[J]. International Journal of Biological Macromolecules, 2011, 49: 44-49.
[12] 曾晓漫, 刘倍毓, 钟耕, 等. 硬脂酸-羧甲基魔芋葡甘聚糖酯的微波法制备工艺及其性能研究[J]. 食品与发酵工业, 2011, 37(2): 82-86.
[13] 夏玉红, 律冉, 钟耕, 等. 微波法制备羧甲基魔芋葡甘聚糖的工艺及产物性能研究[J]. 食品科学, 2010, 31(14): 47-52.
[14] LIU Meimei, FAN Jiangyang, WANG Kang. Synthesis, characterization, and evaluation of phosphated cross-linked konjac glucomannan hydrogels for colon-targeted drug Delivery[J]. Informa Healthcare, 2007, 14(6): 397-402.
[15] CUÑA M, ALONSO-SANDE M, REMUÑÁN-LÓPEZ, et al. Development of phosphorylated glucomannan-coated chitosan nanoparticles as nanocarriers for protein delivery[J]. Journal of Nanoscience and Nanotechnology, 2006, 6(9/10): 2887-2895.
[16] XIE Chenxin, FENG Yujun, CAO Weiping, et a1. Novel biodegradable flocculating agents prepared by phosphate modification of konjac[J]. Carbohydrate Polymers, 2007, 4: 566-571.
[17] 姜元荣, 倪巧儿. 淀粉磷酸酯取代度的分析方法[J]. 无锡轻工业大学学报, 1999, 18(3): 70-73.
[18] 上海淀粉技术研究所. GB/T 12092—1989 淀粉及其衍生物磷总含量测定方法[S]. 北京: 中国标准出版社, 1989: 488-490.
[19] CHENG Lihu, KARIM A A, SEOW C C. Effects of acid modification on physical properties of konjac glucomannan (KGM) films[J]. Food Chemistry, 2007, 103: 994-1002.
[20] ZENG Xiaoman, LIU Beiyu, ZHONG Geng, et al. Studies on stearatecarboxymethyl konjac glucomannan preparation by microwave heating and its properties[J]. Food and Fermentation Industries, 2011, 37(2): 82-86.
[21] 张瑜. 魔芋胶和羧甲基魔芋胶作为结肠定位给药系统载体材料的应用研究[D]. 成都: 四川大学, 2006: 19.
Microwave-Assisted Modification of Konjac Glucomannan by Phosphoric Acid Esterification
LI Jianbin, CHEN Xiaoyun, ZHANG Fan, LU Dengjun, LIAO Wenmin
(Institute of Light Industry and Food Engineering, Guangxi University, Nanning 530004, China)
Abstract:Using a mixture (2:1, by mass) of Na 2HPO 4and NaH 2PO 4as the esterifying agent, konjac glucomannan (KGM) was esterified with phosphate. Based on degree of substitution (DS), the optimum conditions for microwave-assisted modification of konjac glucomannan were determined as follows: temperature, 60 ℃; microwave radiation time, 7 min; pH, 4.0; phosphate dosage, 30%, and microwave power, 800 W. Glucomannan phosphate monoester with a degree of substitution of 0.055 4 was acquired. Infrared spectroscopic studies showed that phosphate groups were introduced onto the main chain of the KGM molecules, confirming the formation of KGMP. Scanning electron microscopic (SEM) examination displayed that the particle size of KGMP was bigger and its structure was more compact.
Key words:konjac glucomannan; phosphoric acid esterification; microwave-assisted modification
中图分类号:TQ423.24
文献标志码:A
文章编号:1002-6630(2015)08-0019-05
doi:10.7506/spkx1002-6630-201508004
收稿日期:2014-06-22
基金项目:国家自然科学基金地区科学基金项目(31160326);广西自然科学基金项目(2011GXNSFA018058)
作者简介:李坚斌(1970—),女,教授,博士,研究方向为糖类物质的生物利用及污染控制。E-mail:lijb0771@126.com