赵慧霞 1,刘 昆 1,赵泽龙 1,何帼英 1,张丽萍 1,2,*
(1.黑龙江八一农垦大学食品学院,黑龙江 大庆 163319;2.国家杂粮工程技术研究中心,黑龙江 大庆 163319)
摘 要:以燕麦麸皮为原料,多糖得率和蛋白质残留率为考察指标,比较了磁化水和纯净水对燕麦麸皮中多糖的提取效果,并采用响应面法对磁化水提取燕麦麸皮多糖工艺进行优化。结果表明,磁化水对麸皮多糖的提取效果优于纯净水,其最优提取条件为提取温度68 ℃、液料比18∶1(mL/g)、提取pH 8.7、提取时间105 min,多糖得率为(13.92±0.07)%,蛋白质残留率为(30.14±0.18)%,与纯净水提取相比,多糖得率提高了37.55%。对纯化后的多糖采用气相色谱法检测分析,其单糖含量为葡萄糖(60.9±1.3)%、木糖(21.1±1.1)%、阿拉伯糖(16.7±1.4)%,同时含有半乳糖(1.0±0.8)%和鼠李糖(0.3±0.1)%。
关键词:燕麦麸皮;多糖;磁化水;响应面法;单糖组成
燕麦多糖是一种存在于燕麦中的可溶性膳食纤维,其主要成分是β-葡聚糖,此外还含有一定量的戊聚糖 [1-2]。燕麦多糖是重要的生理活性物质,已被证实具有降血脂、防治糖尿病、防龋齿、提高免疫力、改善肠道系统中微生物群落组成及预防结肠癌等多种生理功效 [3-4]。燕麦多糖主要分布于燕麦粒糊粉层细胞壁及胚乳中,尤其在籽粒的亚糊粉层中大量富集 [5],因此利用燕麦加工产生的副产物燕麦麸皮提取燕麦多糖具有重要意义。燕麦多糖的提取一般采用水浸提法,研究显示,水经磁化后具有扩散、溶解和渗透能力强的特点 [6-7],因此本研究通过使用纯净水与磁化水提取燕麦多糖实验,比较出磁化水的提取效果。
磁化水的pH值高,水的缔合度减低,较大的水分子团转变为较小的水分子团,甚至为单一的水分子 [6],表面张力系数增大,黏度变小,扩散系数增加,溶解度增加和渗透压提高 [7]。近年来,磁场在工业、农业、医药和生物工程等方面都有重要的应用 [8-9]。随着磁学理论和新型磁性材料的发展,磁场的应用更加广泛。陆耀青等 [10]对比普通水,发现磁化水对小麦种子发芽率及幼苗生长都有促进作用。初兰娜等 [11]研究表明将磁化水运用于提取地黄水苏糖时能显著提高其提取率。本研究将磁化水应用于燕麦麸皮多糖的提取,以探讨其对多糖提取得率的影响。
1.1 材料与试剂
燕麦麸皮(产自内蒙) 中国农业科学院品种资源研究所;耐高温α-淀粉酶(酶活力20 000 U/mL)、糖化酶(酶活力200 000 U/mL) 阿拉丁试剂(上海)有限公司;考马斯亮兰G-250 武汉大风生物技术有限公司;牛血清白蛋白 国药集团化学试剂有限公司。
1.2 仪器与设备
Farm power磁化水机 韩国Safe Good株式会社;HJ-3型数显恒温磁力加热搅拌器、HH-2型数显恒温水浴锅 金坛市科兴仪器厂;TD5A-WS型台式低速离心机 厦门东星电子仪器厂;RE-52A型旋转蒸发器 上海亚荣生化仪器厂;SKD-800型自动凯氏定氮仪 上海沛欧分析仪器有限公司;VIS-7220型分光光度计 郑州创宇科技有限公司;GC-14A气相色谱(gas chromatography,GC) 日本岛津公司。
1.3 方法
1.3.1 原料成分含量测定
水分含量测定:采用直接干燥法 [12];灰分含量测定:采用550 ℃灼烧法;脂类物质含量测定:采用索氏提取法 [13];淀粉含量测定:采用酶水解法 [14];蛋白质含量测定:采用半微量凯氏定氮法 [15];总膳食纤维含量测定:采用酶-质量法 [16]。
1.3.2 燕麦麸皮多糖的提取工艺
将纯净水置于磁化水机中,在室温(25 ℃)条件下磁化处理24 h,即得实验用磁化水。准确称取脱脂灭酶的燕麦麸皮(50 目)10 g;加入150 mL、pH 10的磁化水或纯净水(通过NaCO 3溶液和HCl溶液调节两者的pH值),65 ℃搅拌浸提60 min,离心;沉淀重复提取1次,离心;收集2次上清液;加热到75 ℃,调pH值至6.4,加入适量耐热α-淀粉酶,作用至碘液不变蓝为止;冷却至60 ℃,调节pH 4.5,加液体糖化酶作用30 min;离心收集上清液;分别测定磁化水和纯净水提取时上清液中的多糖及蛋白质含量。
1.3.3 多糖含量的测定及得率计算
采用硫酸-苯酚法测定提取液中多糖含量,参考文献[17],以葡萄糖为标准品制作标准曲线。按式(1)计算燕麦麸皮多糖得率。
1.3.4 蛋白质含量的测定及残留率计算
采用考马斯亮蓝法进行提取液中蛋白质含量的测定,参照王艾平等 [18]的实验方法,以牛血清蛋白为标准样品制作标准曲线。按式(2)计算燕麦麸皮蛋白质残留率。
1.3.5 单因素试验
以提取液中多糖得率及蛋白质残留率为指标,以1.3.2节所描述的提取条件(提取温度65 ℃、液料比15∶1(mL/g)、提取pH 10、提取时间60min)为基础条件,在此条件下,分别考察提取温度(45、55、65、75、85 ℃)、液料比(5∶1、10∶1、15∶1、20∶1、25∶1(mL/g))、提取pH值(7、8、9、10、11)和提取时间(30、60、90、120、150 min)对磁化水和纯净水提取燕麦麸皮多糖效果的影响。
1.3.6 响应面试验
在单因素试验基础上,采用Box-Behnken设计方法进行响应面法试验设计,试验设计方案见表1。
表 1 响应面法试验因素与水平
Table 1 Factors and levels used in response surface methodology

因素水平-101 X 1提取温度/℃606570 X 2液料比(mL/g)12∶115∶118∶1 X 3提取pH8.59.09.5 X 4提取时间/min105120135
1.3.7 化学成分和单糖组分的测定
磁化水提取的燕麦麸皮多糖采用Sevag法脱蛋白质、透析袋透析后得到精制的燕麦麸皮多糖,其多糖和蛋白质含量分别采用硫酸-苯酚法 [17]和考马斯亮蓝法 [18]测定。单糖组分采用GC测定,其色谱条件为:HP-5MS毛细管柱(30 m×0.25 mm,0.25 μm),氦气作为载体,流速为1.2 mL/min。工作参数为:柱箱升温程序160~210 ℃(10 min之内),10 min后再升温到240 ℃,进口温度保持在250 ℃,进样量1 μL。
1.4 数据处理
实验数据采用±s表示,应用Design-Expert 8.0.6软件进行数据处理和回归分析。
2.1 原料成分分析Frey [19]、Doehlert [20]等早在1999年就发现,燕麦中脂类物质含量比较高,为3.1%~10.9%,最高的含量可达15%。分析表2可知,本研究所用原料中脂类物质含量高达10.28%,油脂包裹导致多糖不易溶出,同时在热水提取的过程中会有一部分油脂溶出,给后续纯化带来困难,因此在多糖提取之前需要对原料进行脱脂处理。在饲料工业脂类物质分析方法中,主要采用乙醚浸提处理,但由于乙醚有毒,且加热回流时容易发生爆炸,危险性较无水乙醇大,因此本实验采用75%乙醇溶液,85 ℃回流对原料进行脱脂。董吉林等 [21]对我国山西和河北两个产地的燕麦麸皮进行研究发现其中淀粉含量分别为37.07%、40.11%,本实验所用原料的淀粉含量为39.53%,由于淀粉在多糖加热浸提过程发生糊化,导致它和多糖一起被提取出来,因此本研究采用酶法在提取过程中除去淀粉。实验也选择耐高温α-淀粉酶结合糖化酶除去淀粉。原料中蛋白质含量为17.76%,其中大部分蛋白质易溶于水,在多糖提取过程中会有蛋白质溶出,影响多糖的纯度,增加了后续脱蛋白质的过程中多糖的损失,因此在多糖提取过程中同时检测蛋白质残留率,以期得到多糖含量高而蛋白质含量低的多糖提取液。
表 2 燕麦麸皮成分分析
Table 2 Proximate composition analysis of oat bran

测定项目含量/%水分8.36±0.03灰分2.62±0. 02淀粉39.53±0.18粗脂肪10.28±0.07粗蛋白17.76±0.09总膳食纤维21.42±0.11
2.2 不同处理水不同提取温度对燕麦麸皮多糖提取效果的影响
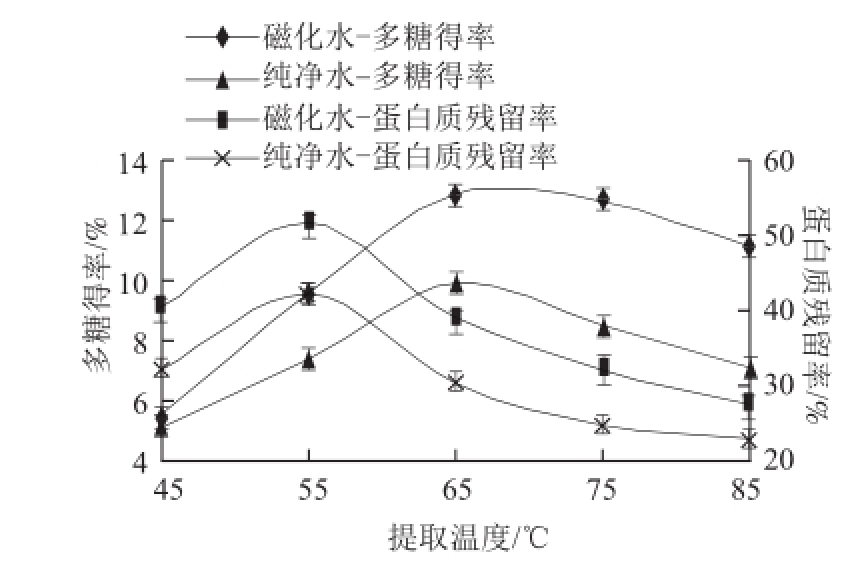
图 1 不同处理水不同提取温度对燕麦麸皮多糖提取效果的影响
Fig.1 Effect of water types and extraction temperature on the extraction efficiency of oat bran polysaccharides
从图1可看出,在设定的提取温度范围内,纯净水提取燕麦麸皮多糖时,其多糖得率以及蛋白质残留率随温度变化趋势和磁化水提取的变化趋势一样,但相应的多糖得率小于磁化水提取。仅对磁化水提取时的结果进行描述分析,多糖得率和蛋白质的残留率随提取温度的升高均呈现先升高后下降的趋势。蛋白质在55 ℃时残留率到达最大,之后温度升高其得率开始下降,而多糖在55~70 ℃时其得率仍处于上升阶段。分析其原因,主要是因为温度升高,分子运动加剧,溶剂的扩散加快,有利于多糖及蛋白质的溶出。但是,温度过高蛋白质发生变性,因此其在55 ℃以后残留率开始下降。而对于燕麦麸皮多糖来说,由于其中的主要物质是β-葡聚糖,而其是一种亲和胶,温度过高,增加了提取液的黏度,引起溶剂扩散速率的减慢,不利于溶质的溶出,因此当温度超过65 ℃时,其得率增加缓慢之后反而下降。综合考虑在响应面优化试验中,选择65 ℃左右的温度进行优化。
2.3 不同处理水不同液料比对燕麦麸皮多糖提取效果的影响
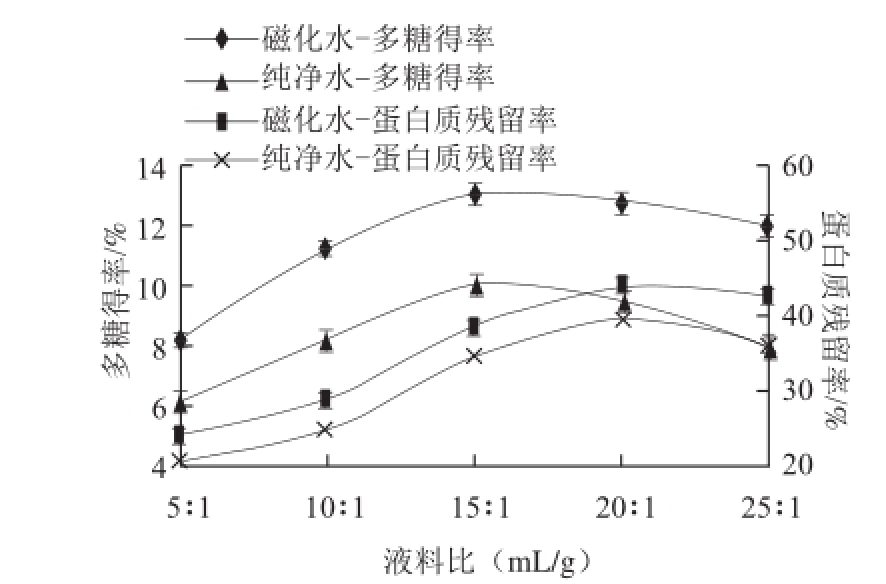
图 2 不同处理水不同液料比对燕麦麸皮多糖提取效果的影响
Fig.2 Effect of water types and liquid-to-solid ratio on the extraction efficiency of oat bran polysaccharides
从图2可看出,纯净水提取燕麦麸皮多糖时,其多糖得率及蛋白残留率随液料比变化趋势和磁化水提取的变化趋势一样,但相应的多糖得率小于磁化水提取,以下仅对磁化水提取时的结果进行描述分析。液料比在5∶1~15∶1之间燕麦麸皮多糖得率急剧增加,之后增加缓慢,在液料比20∶1之后,多糖得率有显著下降的趋势。在液料比20∶1之前蛋白质残留率一直呈上升趋势。根据液固萃取基本理论,溶剂的增多,有利于溶质的析出,然而过大的液料比对实际生产过程来说没有意义,不仅增加了水的消耗及后续的浓缩成本,而且容易导致处理过程中溶质的丢失,从而使其得率有所下降。同时过大的液料比也增加了蛋白质的溶出率,从汪海波等 [22]的研究结果也可以看出,液料比增大,对蛋白质的急剧溶出有较大影响。因此同时考虑到后续操作中多糖浓缩的需要及处理杂质过程中溶质的损失,液料比不宜过大,选择15∶1左右的液料比进行优化。
2.4 不同处理水不同提取pH值对燕麦麸皮多糖提取效果的影响
由图3可看出,纯净水提取的燕麦麸皮多糖得率及蛋白质残留率随提取pH值变化趋势和磁化水提取的变化趋势一样,但相应的得率小于磁化水提取的得率,以下仅对磁化水提取时的结果进行描述分析。随pH值的升高,燕麦麸皮多糖得率呈现先升高后降低的趋势,pH 9时其增加变得缓慢,pH 10时得率达到最大。而磁化水提取时蛋白质的残留率随pH值的升高一直呈现增加的状态,且在pH 10之后显著增加。分析造成这种现象的原因,可能是由于燕麦麸皮中的多糖主要成分是β-葡聚糖,而β-葡聚糖呈碱溶性,所以刚开始随着pH值的升高,多糖得率升高,但是,当pH值大于10之后,发生美拉德反应,造成在多糖测定时其得率有所下降。而蛋白质残留率呈现图中的变化趋势是与其本身的等电点有关系,一般蛋白质等电点在4.6左右,此时蛋白质呈沉淀状态,未能被提取出来,然而随着pH值的升高,蛋白质的溶出率持续增加,因此提取液中蛋白质含量显著增加。综合考虑选择pH 9进行优化。

图 3 不同处理水不同提取pH值对燕麦麸皮多糖提取效果的影响
Fig.3 Effect of water types and pH on the extraction efficiency of oat bran polysaccharides
2.5 不同处理水不同提取时间对燕麦麸皮多糖提取效果的影响

图 4 不同处理水不同提取时间对燕麦麸皮多糖提取效果的影响
Fig.4 Effect of water types and extraction time on the extraction efficiency of oat bran polysaccharides
由图4可看出,纯净水提取燕麦麸皮多糖得率及蛋白质残留率随提取时间变化趋势和磁化水提取的两者的变化趋势一样,但相应的多糖得率小于磁化水提取的得率,以下仅对磁化水提取时的结果进行描述分析。燕麦麸皮多糖得率开始时随提取时间的延长不断提高,90 min后,随时间的延长而趋于平缓。而蛋白质残留率随时间的延长先升高,在提取60 min时,残留率最高,之后开始急速下降,在120 min后下降变得缓慢。分析提取时出现这种结果的主要原因是提取开始时,可溶性燕麦麸皮多糖不断溶出,随着时间的进一步延长,麸皮中可提取的多糖量减少。同时提取液中的多糖质量浓度升高,体系黏度变大,因而未溶出的多糖的传质过程受到阻碍,溶出速率减慢,使得多糖得率的升高变得平缓。而对于蛋白质来说由于长时间在高温条件下进行提取,发生变性进而出现图中60 min后残留率下降的情况。结合杂质蛋白质的提取得率,考虑节约成本,提高仪器利用率,缩短每个处理的周期。做优化试验时,选取120 min左右的提取时间为宜。
分析单因素试验结果可知,磁化水提取燕麦麸皮中的多糖,其多糖得率高于纯净水提取,各因素的基本参数为:提取温度65 ℃、液料比15∶1、提取pH 9、提取时间120 min。此条件下,蛋白质残留率为37.16%~39.24%,磁化水提取效果优于纯净水,接下来对磁化水提取技术参数进行优化以得到磁化水提取的最佳条件。
2.6 磁化水提取燕麦麸皮多糖响应面试验优化结果
根据1.3.6节设计方案,以多糖得率为指标,采用Box-Behnken设计方法,对磁化水提取燕麦麸皮多糖条件进行优化,结果见表3。
表 3 响应面法优化试验设计及结果
Table 3 Experimental design and results of response surface methodology

试验号X 1提取温度X 2液料比X 3提取pHX 4提取时间多糖得率/% 1-1-10012.01 2 1-10010.97 3-110010.56 4 1 1 0 012.43 5 0-1-112.01 6 0 0 1-19.55 0 7 0-118.31 8 0 0 1 112.79 0 9-100-19.55 10100-112.29 11-100111.92 1210019.87 130-1-109.21 1401-1011.79 150-11012.61 16011011.17 17-10-108.91 1810-108.63 19-10108.97 20101011.31 210-10-110.56 22010-112.73 230-10111.62 24010112.29 25000013.06 26000012.93 27000012.54 28000012.71 29000013.01
2.6.1 回归方程的建立与方差分析
利用Design-Expert 8.0.6软件对表3中的试验数据进行回归分析,得到二次回归模型为:Y=-614.18+6.26X
1+4.32X
2+87.96X
3-0.22X
4+0.049X
1X
2+0.26X
1X
3-0.016X
1X
4-0.67X
2X
3-8.33×10
-3X
2X
4+0.23X
3X
4-0.06
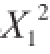 -0.01
-0.01
 -6.75
-6.75
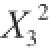 -2.92×10
-3
-2.92×10
-3
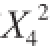 。
。
表 4 回归模型显著性检验结果
Table 4 Significance test for regression model

注:*.差异显著,P<0.05;**.差异极显著,P<0.01。
项目平方和自由度均方F值P值显著性模型61.31144.389.41<0.000 1** X 1提取温度1.0711.073.270.035 3* X 2液料比1.3311.332.120.021 1* X 3提取pH4.7414.743.640.000 2** X 4提取时间1.008×10 -311.008×10 -35.125×10 -30.943 9 X 1X 22.1212.1210.760.005 5** X 1X 31.7211.728.720.010 5* X 1X 45.7415.7429.15<0.000 1** X 2X 34.0414.0420.530.000 5** X 2X 40.5610.562.860.113 0 X 3X 412.04112.0461.20<0.000 1** X 113.02113.0266.17<0.000 1** X2 2 0.06510.0650.330.573 4 X3 2 2.8112.8114.270.002 0**残差2.75140.20失拟2.56100.265.340.060 2纯差0.1940.048总和64.0628 18.45118.4593.79<0.000 1** X4 22
对该模型及系数进行显著性分析,其结果见表4。从表4可知,用上述回归方程描述各因素与响应值间的关系时,因变量与各自变量间的线性关系显著,回归方程模型极显著(P<0.01),且方程失拟项不显著(P>0.05),复相关系数R 2=0.957 0,说明未控制因素对试验结果影响很小(4.30%),表明该方程对试验的拟合情况良好。预测值和真实值之间有较好的相关性,试验误差小,因此可用该方程对燕麦麸皮多糖得率进行预测。从所建回归方程的偏回归系数绝对值大小可以判断各因素对试验结果影响的大小程度,同时系数正负表示影响的作用方向 [23]。因此根据回归方程可得到各因素对多糖得率从大到小的影响顺序依次是:X 3(提取pH值)>X 2(液料比)>X 1(提取温度)>X 4(提取时间),其中X 1、X 2和X 3是正效应,X 4是负效应。
2.6.2 响应面分析
响应面图是响应值在各试验因素交互作用下得到的结果构成的一个三维空间曲面 [24]。回归方程中X 2X 4交互作用不显著(P>0.05),因此只对X 1X 2、X 1X 3、X 1X 4、X 2X 3和X 3X 4的交互作用进行分析,根据回归方程绘制相应的响应面图,如图5所示。由5 组图可知,提取pH值(X 3)曲线最陡,说明该因素对多糖得率的影响最显著;提取温度(X 1)和液料比(X 2)曲线相对较平缓,说明这两个因素对多糖得率的影响程度较弱;而提取时间(X 4)曲线最平滑,响应值变化随其数值的变化较小,因此对多糖得率的影响最小,这与方差分析的结果一致。等高线的形状也可以反映交互效应的强弱,椭圆形表示交互作用显著,圆形则表示交互作用不显著。分析5 组响应面图可知,提取温度(X 1)和提取时间(X 4)的交互作用最显著,其后交互作用的显著性从大到小的顺序为:提取pH值(X 3)和提取时间(X 4)、液料比(X 2)和提取pH值(X 3)、提取温度(X 1)和液料比(X 2)、提取温度(X 1)和提取pH值(X 3)。

图 5 各因素交互作用的响应面
Fig.5 Response surface and contour plots showing the interactive effects of extraction parameters on the yield of polysaccharides
由图5A可知,提取温度60~64 ℃、液料比12∶1~18∶1范围内时,两者存在显著的增效作用,燕麦麸皮多糖得率随着提取温度和液料比的升高和增加而增加;而当提取温度在64~70 ℃范围内时,燕麦麸皮多糖得率反而开始降低。由图5B可知,提取温度60~64 ℃、提取pH 8.5~9.1范围内时,两者存在着显著的增效作用,燕麦麸皮多糖得率随着温度和pH值的升高而升高;而当提取温度在64~70 ℃范围内,提取pH 9.1~9.5,燕麦麸皮多糖得率反而随着两个因素的升高开始降低。由图5C可知,在试验范围内,提取温度和提取时间之间的交互作用极显著,燕麦麸皮多糖得率随着两个因素的升高和延长而增加。由图5D可知,液料比12∶1~18∶1、提取pH 8.5~9.1范围内时,燕麦麸皮多糖得率随着两者的增加和升高而增加;而当提取pH 9.1~9.5范围内时,燕麦麸皮多糖得率随着两个因素的增加和升高反而开始降低。由图5E可知,提取时间在试验条件内,提取pH 8.5~8.9范围内时,燕麦麸皮多糖得率随两个因素的延长和升高而升高;而当提取pH 8.9~9.5,燕麦麸皮多糖得率随着两个因素的延长和升高开始降低。
2.6.3 验证实验结果
结合回归模型和响应面图分析得出磁化水提取燕麦麸皮多糖的最佳工艺参数是:提取温度68.36 ℃、液料比18∶1、提取pH 8.75、提取时间105 min,在此条件下预测多糖得率可达14.058 4%。为检验预测值与实际值是否一致,进行验证实验。考虑到实际操作条件,将最佳工艺参数修定为:提取温度68 ℃、液料比18∶1、提取pH 8.7、提取时间105 min,进行5 次平行实验,最终得到磁化水提取燕麦麸皮多糖得率为(13.92±0.07)%。与预测值比较可知,响应面分析所得的优化模型是可靠的。此时测得蛋白质残留率为(30.14±0.18)%,相同条件下对比纯净水提取燕麦麸皮多糖(其多糖得率为(10.12±0.03)%),多糖得率提高了37.55%。
2.7 燕麦麸皮多糖化学成分和单糖组成检测分析
表 5 燕麦麸皮多糖的化学成分和单糖组成分析
Table 5 Chemical composition and monosaccharide composition of oat bran polysaccharides %
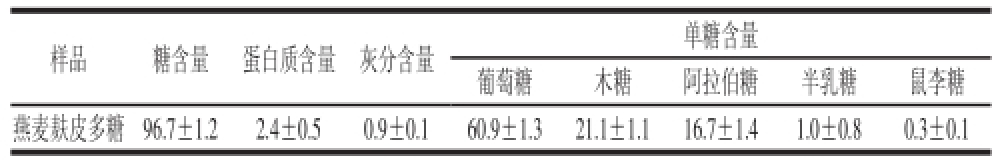
样品糖含量蛋白质含量灰分含量单糖含量葡萄糖木糖阿拉伯糖半乳糖鼠李糖燕麦麸皮多糖96.7±1.22.4±0.50.9±0.160.9±1.321.1±1.116.7±1.41.0±0.80.3±0.1
经脱蛋白质、透析的精制燕麦麸皮多糖测得其多糖和蛋白质含量如表5所示,分别为(96.7±1.2)%和(2.4±0.5)%,可见此燕麦麸皮多糖的纯度较高。燕麦麸皮多糖和单糖标准品分别经过水解还原后进行乙酰化,利用GC进行单糖组成分析。标准单糖和燕麦麸皮多糖的GC图分别如图6、7所示,对比分析两组图谱的主峰保留时间,可得到燕麦麸皮多糖的单糖组成,结果见表5。从表5可知,该燕麦麸皮多糖由葡萄糖、木糖和阿拉伯糖组成,此外还含有少量的半乳糖和鼠李糖。其单糖组成的物质的量比为:c(鼠李糖)∶c(半乳糖)∶c(阿拉伯糖)∶c(木糖)∶c(葡萄糖)=0.3∶1.0∶16.7∶21.1∶60.9。

图 6 标准单糖的GGCC图
Fig.6 Gas chromatogram of polysaccharide standards

图 7 燕麦麸皮多糖GGCC图
Fig.7 Gas chromatogram of oat bran polysaccharides
本实验以燕麦麸皮为原料,分别以磁化水、纯净水为溶剂,提取燕麦麸皮中的多糖,在单因素试验的基础上,比较得磁化水提取效果优化纯净水。应用响应面法优化磁化水提取多糖的工艺参数,优化的最佳技术参数为:提取温度68 ℃、液料比18∶1、提取pH 8.7、提取时间105 min。在此条件下燕麦麸皮多糖的得率可达(13.92±0.07)%,此时蛋白质残留率为(30.14±0.18)%。采用磁化水提取燕麦麸皮多糖,多糖的得率比纯净水提取提高了37.55%,说明磁化水对于提高燕麦麸皮多糖的得率极其有效。单糖组成GC测定结果显示:用磁化水从燕麦麸皮中提取的多糖,其单糖组成为葡萄糖(60.9±1.3)%、木糖(21.1±1.1)%、阿拉伯糖(16.7±1.4)%,同时还含有少量的半乳糖(1.0±0.8)%和鼠李糖(0.3±0.1)%。
参考文献:
[1] TEMELLI F. Extraction and functional properties of barley β-glucan as affected by temperature and pH[J]. Journal of Food Science, 1997, 62(6): 1194-1197.
[2] 申瑞玲, 姚惠源. 谷物β-葡聚糖提取和纯化[J]. 粮食与油脂, 2003(7): 19-21.
[3] 杨卫东, 吴晖, 赖富饶, 等. 燕麦β-葡聚糖的物理特性和生理功能研究进展[J]. 现代食品科技, 2007, 23(8): 90-93.
[4] 申瑞玲, 程珊珊. 燕麦β-葡聚糖生理功能研究进展[J]. 食品与机械, 2007, 23(6): 126-129.
[5] 顾尧臣. 小宗粮食加工: 一[J]. 粮食与饲料工业, 1999(4): 12-16.
[6] 任宇航, 许祝安, 田涛, 等. 水表面张力的磁化效应[J]. 浙江大学学报: 自然科学版, 1997(2): 13-17.
[7] 胡爱军, 丘泰球. 物理场强化萃取新技术及应用[J]. 安徽化工, 2002, 28(1): 26-29.
[8] GONCHARUK V V, BAGRII V A, BASHTAN S Y, et al. Crystalization of calcium carbonate in magnetized water in the presence of ions of iron and manganese[J]. Journal of Water Chemistry and Technology, 2011, 33(3): 160-163.
[9] VLASOV V S, KOTOV L N, SHAVROV V G, et al. Nonlinear dynamics of the magnetization in a ferrite plate with magnetoelastic properties under the conditions for orientational transition[J]. Journal of Communications Technology and Electronics, 2010, 55(6): 645-656.
[10] 陆耀青, 黄英姿. 磁化水对小麦种子发芽率及幼苗生长效应的研究[J].生物学教学, 2005(2): 28-30.
[11] 初兰娜, 卢家炯, 马森, 等. 磁化技术提取地黄水苏糖的研究[J]. 现代食品科技, 2009, 25(10): 1186-1189.
[12] 卫生部. GB/T 5009.3—2003 食品中水分的测定[S]. 北京: 中国标准出版社, 2003.
[13] 谢音, 屈小英. 食品分析[M]. 北京: 科学技术文献出版社, 2006: 99-113.
[14] 卫生部. GB/T 5009.9—2003 食品中淀粉的测定[S]. 北京: 中国标准出版社, 2003.
[15] 卫生部. GB/T 5009.5—2003 食品中蛋白质的测定[S]. 北京: 中国标准出版社, 2003.
[16] 郑建仙, 丁霄霖. 香菇膳食纤维的研究(Ⅰ): 纤维的分离与结构鉴定[J].食品与发酵工业, 1995, 21(3): 1; 21; 3-10.
[17] 姜琼, 谢妤. 苯酚-硫酸法测定多糖方法的改进[J]. 江苏农业科学, 2013(12): 316-318.
[18] 王艾平, 周丽明. 考马斯亮蓝法测定茶籽多糖中蛋白质含量条件的优化[J]. 河南农业科学, 2014(3): 150-153.
[19] FREY K J, HOLLAND J B. Nine cycles of recurrent selection for increased groat-oil content in oat[J]. Crop Science, 1999, 39(6): 1636-1641.
[20] DOEHLERT D C, MCMULLEN M S, HAMMOND J J. Genotypic and environmental effects on grain yield and quality of oat grown in North Dakota[J]. Crop Science, 2001, 41(4): 1066-1072.
[21] 董吉林, 申瑞玲. 裸燕麦麸皮的营养组成分析及β-葡聚糖的提取[J].山西农业大学学报: 自然科学版, 2005, 25(1): 70-73.
[22] 汪海波, 刘大川, 谢笔钧. 燕麦中β-葡聚糖的提取及分离纯化工艺研究[J]. 食品科学, 2004, 25(5): 143-147.
[23] 唐启义, 冯明光. 实用统计分析及其数据处理系统[M]. 北京: 科学出版社, 2002: 159-163.
[24] 姚笛, 马萍, 王颖, 等. 响应面法优化玉米芯中木聚糖的提取工艺[J].食品科学, 2011, 32(8): 111-115.
Optimization of Extraction for Oat Bran Polysaccharides Using Magnetized Water by Response Surface Methodology
ZHAO Huixia
1, LIU Kun
1, ZHAO Zelong
1, HE Guoying
1, ZHANG Liping
1,2,*
(1. College of Food Science, Heilongjiang Bayi Agricultural University, Daqing 163319, China;2. National Coarse Cereals Engineering Research Center, Daqing 163319, China)
Abstract:The extraction efficiencies of oat bran polysaccharides using magnetized water and purified water were compared with respect to polysaccharide yield and the residue ratio of protein. The extraction process with magnetized water was optimized using response surface methodology. The results showed that magnetized water was a better solvent for the extraction of oat bran polysaccharides than pure water. The optimum extraction conditions were found to be extraction at 68 ℃for 105 min with a water-to-oat bran ratio of 18:1 (mL/g) at pH 8.7. Under these conditions, the polysaccharide yield was (13.92 ± 0.07)%, representing a 37.55% increase over that obtained with pure water, with a residue ratio of protein of (30.14 ± 0.18)%. The monosaccharide composition of the purified polysaccharide consisted of glucose (60.9 ± 1.3)%, xylose (21.1 ± 1.1)%, arabinose (16.7 ± 1.4)%, and a small amount of galactose (1.0 ± 0.8) and rhamnose (0.3 ± 0.1)%, as indicated by gas chromatography (GC) analysis.
Key words:oat bran; polysaccharides; magnetized water; response surface methodology; monosaccharide composition
中图分类号:TS218
文献标志码:A
文章编号:1002-6630(2015)08-0037-07
doi:10.7506/spkx1002-6630-201508007
收稿日期:2014-08-18
基金项目:公益性行业(农业)科研专项(201303069)
作者简介:赵慧霞(1988—),女,硕士研究生,研究方向为食品科学。E-mail:zhaohuixia1989@126.com
*通信作者:张丽萍(1957—),女,教授,博士,研究方向为食品科学。E-mail:50752305@qq.com