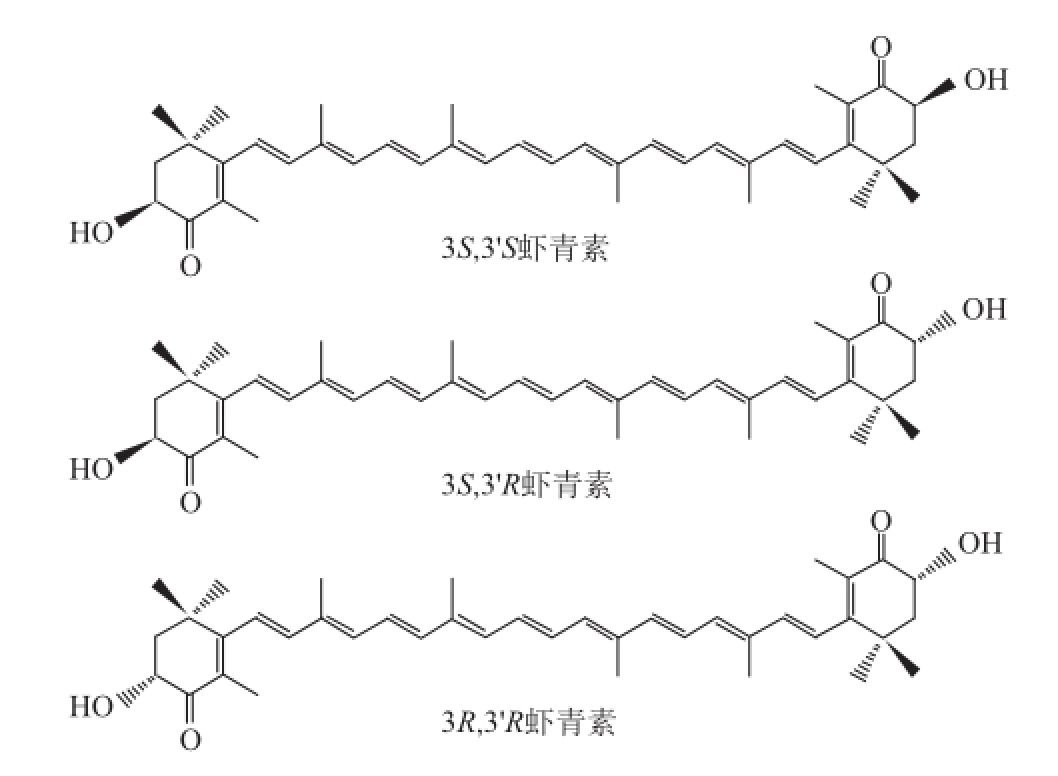
图 1 虾青素光学异构体结构图
Fig.1 Stru ctures of astaxanthin stereoisomers
杨 澍,张 婷,徐 杰,李学敏,周庆新,薛长湖*
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
摘 要:建立一种高效液相色谱手性拆分法分析不同生物中3 种虾青素光学异构体含量的方法。以Chiralpak IC色谱柱(4.6 mm×250 mm,5 μm)为固定相,以甲基叔丁基醚-乙腈(95∶5,V/V)为流动相,采用等度洗脱,流速1.0 mL/min,二极管阵列检测器检测波长为476 nm,选用雨生红球藻、红法夫酵母、南美白对虾、中国对虾、日本对虾、三文鱼、梭子蟹7 种生物样品为研究对象,分析其虾青素光学异构体,线性范围为0.1~50 mg/L,相关系数为0.999 9,回收率为86.2%~98.3%,方法稳定性良好。结果表明,该方法可行、快速简便、准确可靠。
关键词:虾青素;光学异构体;手性分析;高效液相色谱
虾青素是一种天然的类胡萝卜素,化学名称为3,3’-二羟基-β,β-胡萝卜素-4,4’-二酮,分子式为C 40H 52O 4,相对分子质量为596.86 [1],广泛存在于海洋动植物体内,如虾 [2]、蟹 [3]、野生三文鱼 [4]、微藻 [5]等。它是由4 个异戊二烯单位以共轭双键形式连接,其2 个手性中心分别位于两端环结构中的C-3和C-3’处,并都能以右旋R或左旋S的形式存在,产生3 种光学异构体:一对外消旋型虾青素(左旋型3S,3’S和右旋型3R,3’R)和内消旋型虾青素(3S,3’R)(图1) [1]。人工合成虾青素主要为3 种结构虾青素的混合物(3S,3’S占25%、3R,3’R占25%,3S,3’R占50%左右) [6],抗氧化活性较弱,而红法夫酵母中的虾青素是以3R,3’R为主,具有部分活性 [7]。已知藻源虾青素是以3S,3’S为主,具有极强的抗氧化活性 [6]。近年来许多研究表明,3S,3’S虾青素具有重要的生物学功能,如抗氧化 [8]、抗肿瘤 [9]、免疫调节 [10]以及增强机体免疫力 [ 11]等。
虾青素光学异构体的分离及定量采用较多的为化学衍生高效液相色谱(high performance liquid chromatography,HPLC)法,主要通过将虾青素与4,7,7-三甲基-3-氧代-2-氧杂双环[2.2.1]庚烷-1-甲酸在一定条件下反应形成虾青素非对映体衍生物,然后采用Spherisorb S-5CN作为固定相,以正己烷-醋酸异丙基酯-丙酮作为流动相进行分离 [12]。这种方法存在步骤复杂、耗时较长等缺点,并只能对游离虾青素的光学异构体进行测定。有报道直接通过HPLC法对虾青素进行拆分。Abu-Lafi等 [13]采用Pirkle L-亮胺酸手性柱,正己烷-异丙醇-水作流动相对虾青素洗脱分离。Grewe等 [14]采用反相手性柱Chiralcel OD-RH对虾青素进行分离。但是采用上述方法对虾青素3 种光学异构体的拆分很难达到基线分离。

图 1 虾青素光学异构体结构图
Fig.1 Stru ctures of astaxanthin stereoisomers
近年来,有研究通过测定的虾青素光学异构体比例对野生和养殖三文鱼进行鉴别 [15]。研究显示,不同生物体内虾青素的光学异构体组成可能具有显著差异 [2,16],并可通过弄清虾青素光学异构体的组成鉴别其生物来源。对于虾、蟹、三文鱼等海洋水产品中虾青素光学异构体的比例及含量并不十分清楚。由于天然虾青素主要以虾青素酯的形式存在于虾、蟹、藻等水产品中,多数已报道的分离方法也无法直接应用于生物体中虾青素的分析,需要先进行酯水解的预处理。虾青素酯的水解研究 [17],主要围绕皂化 [18-19]和酶解 [20]。常用的皂化法会导致副产物虾红素及半虾红素的产生 [21],又造成定量困难。
本实验采用胆固醇酯酶使虾青素酯完全水解,再通过HPLC法对不同样品中虾青素光学异构体进行手性拆分和含量测定,为后续生物体内虾青素的综合利用与开发提供方法基础,对研究及鉴别不同生物来源的虾青素提供理论依据。
1.1 材料与试剂
南美白对虾、中国对虾、日本对虾、三文鱼、梭子蟹 青岛南山水产市场;雨生红球藻 云南爱尔发生物技术有限公司;红法夫酵母 通派(上海)生物科技有限公司;人工合成虾青素标准品(纯度为(97.3±0.5)%;3S,3’S、3S,3’R及3R,3’R虾青素比例为1∶2∶1) 德国Dr. Ehrenstorfer公司;胆固醇酯酶(1 000 U,037-11221) 日本和光纯药株式会社;丙酮(色谱纯)、甲基叔丁基醚 美国Muskegon公司;甲醇(色谱纯) 德国Merck公司;乙酸乙酯、丙酮、正己烷等均为国产分析纯。
1.2 仪器与设备
LABOROTA 4000旋转蒸发仪 德国Heidolph公司;ab135-S精密分析天平 瑞士Mettler Toledo公司;KQ-300E超声波清洗机 昆山市超声仪器有限公司;Q超纯水器 美国Millipore公司;DTU-1C氮吹仪 日本Taitec公司;HH-6恒温数显水浴锅 常州润华电器有限公司;UV-2100紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;1100系列高效液相色谱仪(配自动进样器和二极管阵列检测器) 美国Agilent公司。
1.3 方法
1.3.1 样品溶液配制
雨生红球藻和红法夫酵母样品溶液:称取新鲜藻粉或新鲜酵母粉0.1 g(±5%),加入3 mL甲醇-乙酸乙酯-石油醚(1∶1∶1,V/V),研磨5 min,倒入10 mL具塞离心管中,4 ℃离心,3 500 r/min,5 min,收集上清液。重复提取3 次,直至藻粉无色。收集提取液,氮气吹干,再加入3 mL丙酮溶液复溶。
虾、蟹、鱼等样品溶液:将新鲜南美白对虾、中国对虾、日本对虾、三文鱼、梭子蟹分别均质匀浆,称取每种样品0.3 g(±5%),加入3 mL甲醇-乙酸乙酯-石油醚超声浸提,收集上层相,抽滤,反复浸提3 次直至样品无色。上述收集液氮气吹干,再加入3mL丙酮溶液复溶。
上述复溶样品以丙酮作为空白对照,在波长476 nm处读取吸光度,吸光度应介于0.2~0.8之间,如不在其间,进行稀释处理,即得到样品溶液。
1.3.2 样品溶液酶解
准确量取样品溶液1.0 mL置于10 mL具塞离心管中,加入2 mL丙酮溶液及2mL 0.1 mol/L pH 7.0磷酸钾缓冲液后加盖混匀,于37 ℃水浴锅中保温2 min后取出。加入1 mL胆固醇酯酶溶液(4 U/mL)振荡混匀后,于37 ℃条件下保温反应2 h,每隔15 min振荡1 次。
酶解后加入0.5 g十水硫酸钠及2.0 mL石油醚,剧烈振荡后,于冷冻离心机中离心3 000 r/min,3 min,收集上层有色溶液。之后再加入2.0 mL石油醚,重复提取3 次,直至下层水相无色。收集液在低温避光环境中氮气吹干,1 mL乙腈-甲基叔丁基醚(1∶1,V/V)复溶,待HPLC分析。
1.3.3 色谱条件
色谱柱:Chiralpak AD-H(4.6 mm×250 mm,5 μm);流速1.0 mL/min;进样体积20 μL;流动相:甲基叔丁基醚-乙腈(95∶5,V/V)等度洗脱;柱温35 ℃;检测波长476 nm。
1.3.4 方法学考察
1.3.4.1 线性关系测定
精密称取虾青素标准品适量,加入丙酮溶解、定容,配制成50 mg/L标准品储备液。吸取储备液,用丙酮稀释成0.05、0.1、0.5、1、2、5、10、20、50 mg/L的标准品使用液,进行HPLC分析。记录色谱峰3S,3’S、3S,3’R以及3R,3’R的峰面积为S 1、S 2及S 3。以拆分后相应峰的峰面积S x为纵坐标,以标准品质量为横坐标,绘制标准曲线。计算各虾青素光学异构体的线性范围、回归方程及相关系数,并以R SN为3对应的质量浓度确定各虾青素光学异构体的检出限。
1.3.4.2 回收率实验
取同一批样品,以日本对虾为例,按1.3.1节和1.3.2节的前处理方法,分别制备供试品3 份,按1.3.3节色谱条件进行测定,以检测该前处理方法的重复性。以丙酮和日本对虾样品作为基质,分别向0.3 g的2 种基质中加入低、中、高3 个含量水平的虾青素对照品(即加入折合质量为1.2、2.4、3.6 μg的3S,3’S虾青素,1.2、2.4、3.6 μg的3S,3’R虾青素和0.5、1.0、1.5 μg的3R,3’R虾青素,相当于日本对虾样品中相应物质含量的50%、100%、150%),按1.3.1节和1.3.2节中方法处理样品后,通过HPLC测定虾青素异构体的含量,考察样品的回收率;每组做3 个平行。
1.3.4.3 仪器精密度实验
取10 mg/L的虾青素标准品溶液,连续进样6 次,测定峰面积,并求算出峰面积的标准偏差和平均值,再计算相对标准偏差(relative standard deviation,RSD)。
1.3.4.4 稳定性实验
取同一份样品溶液,于0、1、2、4、6 h测得其拆分后各虾青素异构体峰面积,并计算得RSD。
2.1 色谱条件的优化
2.1.1 色谱柱的选择
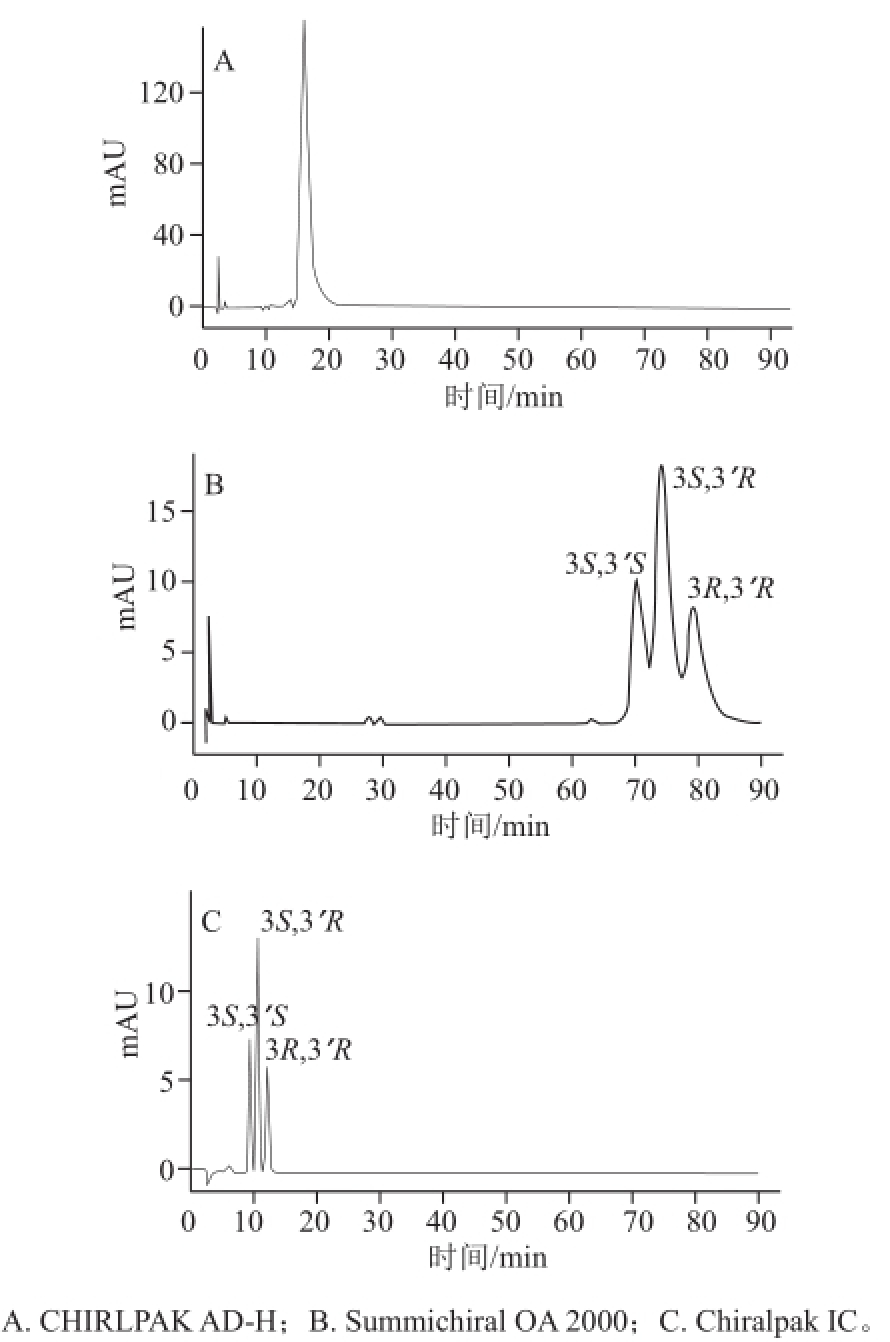
图 2 固定相对虾青素光学异构体的拆分效果影响
Fig.2 Effect of different stationary phases on the separation of astaxanthin stereoisomers
由于所研究的虾青素为弱极性化合物,通过查阅相关资料,正相方法更适合进行分析。本实验筛选了3 种手性固定相,分别为纤维素型CHIRLPAK AD-H(4.6 mm×250 mm,5 μm)、Pickle型Summichiral OA 2000(4.6 mm×250 mm,5 μm)及化学键合型Chiralpak IC(4.6 mm×250 mm,5 μm)。由图2可知,采用CHIRLPAK AD-H,以正己烷-异丙醇为流动相,分析虾青素标准品发现只有一个峰,未能实现光学异构体的分离。而采用Summichiral OA 2000,并以正己烷-氯仿-无水乙醇为流动相,可以观察到虾青素分成三连峰,然而不能达到基线分离(分离度R=1.3),同时保留时间过长。与前两者比较,采用Chiralpak IC,以甲基叔丁基醚-乙腈为流动相,虾青素三连峰可实现完全分离(R>1.5)。由此,确定出基线平稳、分离效果最佳的Chiralpak IC柱作为分析用柱。
2.1.2 流动相溶剂系统的优化
在Chiralpak IC固定相条件下,选择4 种不同溶剂系统组成的流动相对虾青素标准品进行分析,即正己烷-乙醇(溶剂系统Ⅰ)、正己烷-乙醇-四氢呋喃(溶剂系统Ⅱ)、甲基叔丁基醚-乙醇(溶剂系统Ⅲ)、甲基叔丁基醚-乙腈(溶剂系统Ⅳ),从而优化出最佳的流动相组成。使用溶剂系统Ⅰ时,前2 个色谱峰未能完全分离,并且分析时间较长(图3);而使用溶剂系统Ⅱ时,3 个色谱峰均不能达到基线分离;溶剂系统Ⅲ也无法实现良好的分离;只有采用甲基叔丁基醚-乙腈为流动相时符合分离要求,因此本实验选用溶剂系统Ⅳ作为流动相。
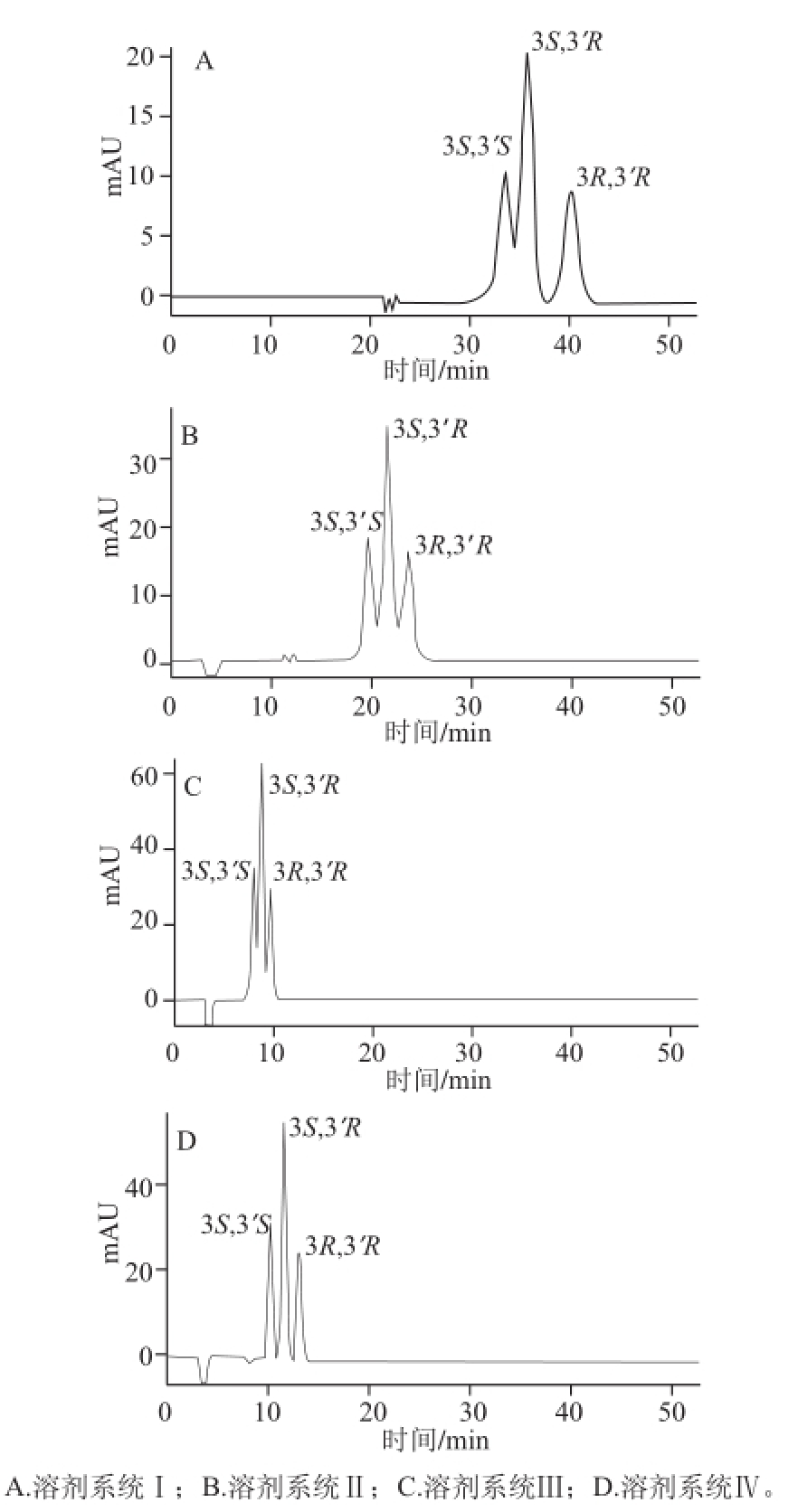
图 3 不同溶剂系统对虾青素光学异构体拆分效果的影响
Fig.3 Effect of different solvent systems on the separation of astaxanthin stereoisomers
2.2 方法学考察结果
2.2.1 定量线性范围及检出限
按1.3.4.1节评价该方法对标准品的线性范围、回归方程、检出限及定量限进行测定。结果见表1。
表 1 虾青素标准品的线性方程、回归方程、检出限及定量限结果
Table 1 Regression equations and detection limits of astaxanthin stereoisomers
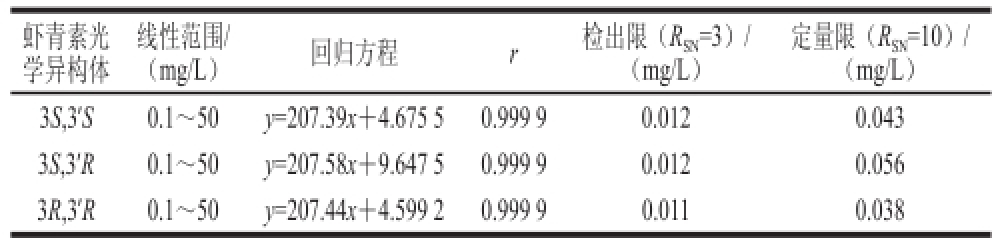
虾青素光学异构体定量限(R SN=10)/(mg/L)3S,3’S0.1~50y=207.39x+4.675 50.999 90.0120.043 3S,3’R0.1~50y=207.58x+9.647 50.999 90.0120.056 3R,3’R0.1~50y=207.44x+4.599 20.999 90.0110.038线性范围/(mg/L)回归方程r检出限(R SN=3)/(mg/L)
2.2.2 回收率
按1.3.4.2节方法测定,3 个加标水平的虾青素光学异构体平均回收率结果见表2。3 种虾青素光学异构体的加标回收率均在86.2%~98.3%之间,回收率较好,满足定量要求。
表 2 方法平均回收率实验结果
Table 2 Recoveries for astaxanthin stereoisomers spiked in biological samples
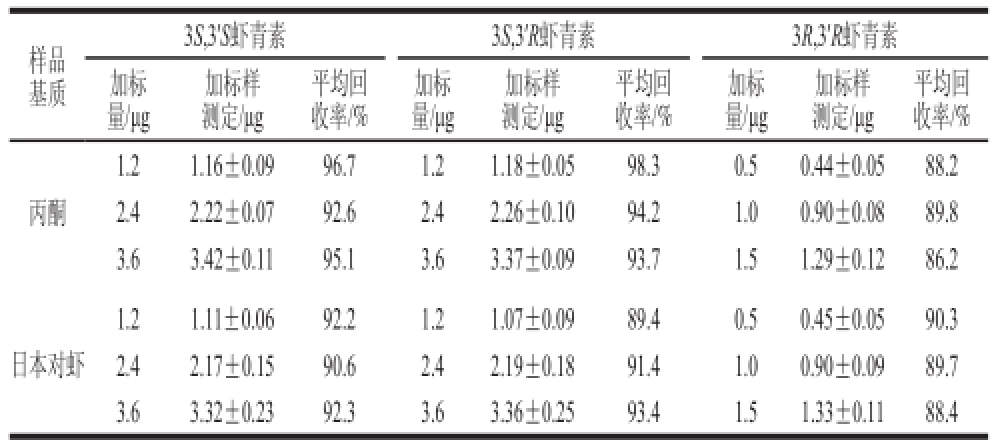
样品基质3S,3’S虾青素3S,3’R虾青素3R,3’R虾青素加标量/μg加标样测定/μg平均回收率/%加标量/μg加标样测定/μg平均回收率/%加标量/μg加标样测定/μg平均回收率/%丙酮1.21.16±0.0996.71.21.18±0.0598.30.50.44±0.0588.2 2.42.22±0.0792.62.42.26±0.1094.21.00.90±0.0889.8 3.63.42±0.1195.13.63.37±0.0993.71.51.29±0.1286.2日本对虾1.21.11±0.0692.21.21.07±0.0989.40.50.45±0.0590.3 2.42.17±0.1590.62.42.19±0.1891.41.00.90±0.0989.7 3.63.32±0.2392.33.63.36±0.2593.41.51.33±0.1188.4
2.2.3 仪器精密度
按1.3.4.3节方法考察精密度,取虾青素标准品溶液,连续进样6 次,测定拆分后虾青素光学异构体3S,3’S、3S,3’R及3R,3’R峰面积的RSD分别为3.25%、3.33%及3.07%,表明仪器精密度良好,满足分析要求。
2.2.4 稳定性
取同一份样品溶液,于0、1、2、4、6 h测得其拆分后虾青素异构体3S,3’S、3S,3’R及3R,3’R峰面积的RSD分别为2.46%、2.92%及2.90%。结果表明样品在6 h内稳定。
2.3 样品中虾青素光学异构体含量
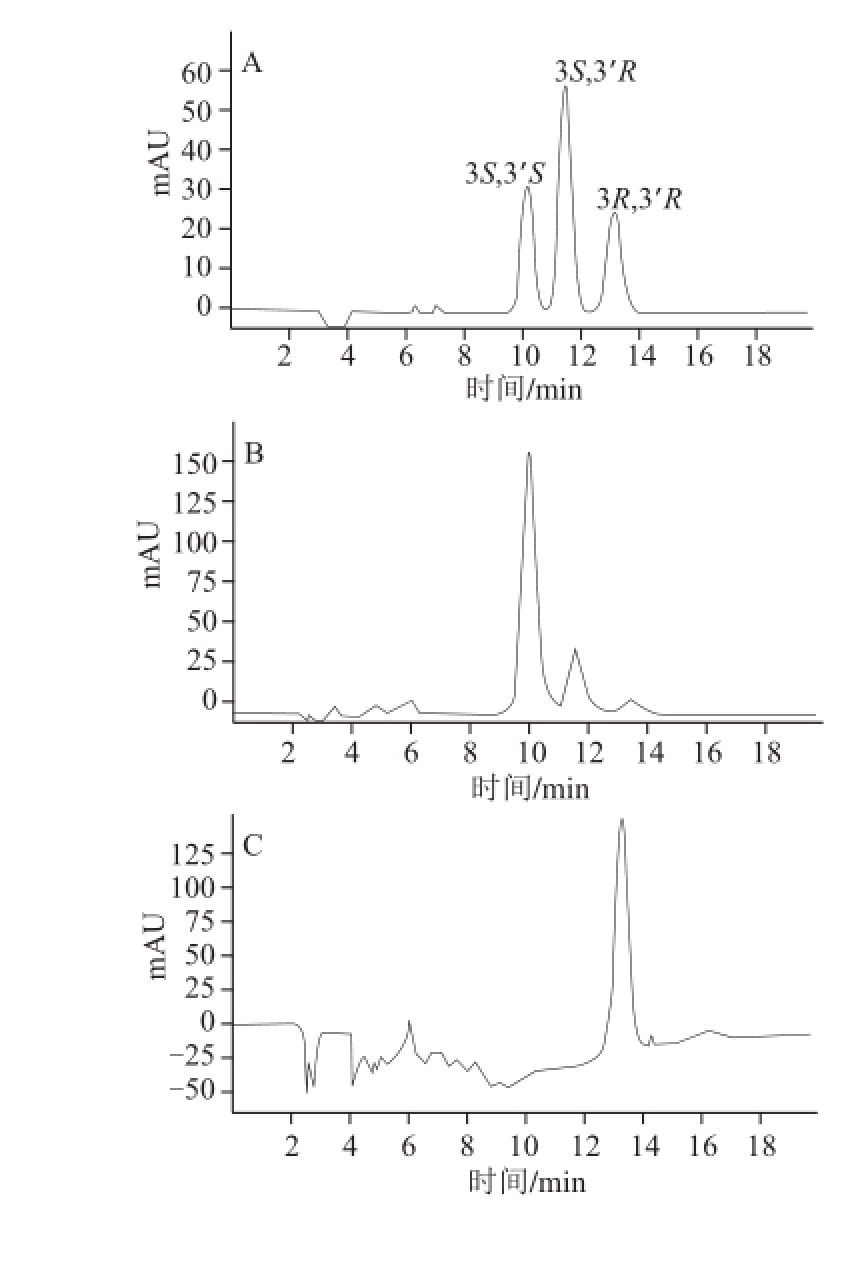

图 4 不同生物样品中虾青素光学异构体HPLC图谱
Fig.4 HPLC chromatograms of several biological samples
表 3 不同生物样品中虾青素光学异构体含量
Table 3 The contents of astaxanthin stereoisomers in biological samples determined by the developed HPLC method μg/g

注:—.未检出。
虾青素光学异构体雨生红球藻红法夫酵母三文鱼日本对虾中国对虾南美白对虾梭子蟹3S,3’S689.78±0.87—3.40±0.327.80±0.313.29±0.843.28±0.452.27±0.14 3S,3’R 181.03±0.52——9.42±0.384.36±0.923.67±0.372.67±0.23 3R,3’R 25.47±0.63337.35±0.48—3.47±0.142.41±0.691.70±0.510.89±0.19
按1.3节方法测定分析不同生物样品中虾青素光学异构体,结果见图4。采用外标法以峰面积计算,结果见表3。由图4可知,不同生物体内的虾青素光学异构体组成具有较大差异。雨生红球藻及三文鱼中的3S,3’S虾青素所占比例较高,而红法夫酵母中主要以3R,3’R虾青素为主。中国对虾、日本对虾及梭子蟹中虾青素光学异构体组成比例较为相似。由表3可以看出,不同种类生物所含虾青素的光学异构体含量差异较大。其中,梭子蟹的虾青素3 种光学异构体含量均最低;而雨生红球藻中3 种异构体含量最高。虾蟹类中,日本对虾所含虾青素总含量最为丰富;而虾青素光学异构体组成上,虾蟹类略有相似,主要以3S,3’S及3S,3’R含量较多。红法夫酵母虾青素只有3R,3’R构象。雨生红球藻中3S,3’S虾青素含量丰富,是虾蟹类生物的100 倍以上,可作为良好的左旋虾青素来源。从表3可看出,不同种类生物所含虾青素光学异构体组成及含量都具有特征性。
本实验所建立的HPLC手性拆分法分析不同生物中虾青素光学异构体含量的方法快速、简便。筛选出
Chiralpak IC柱作为手性分离柱,确立等度洗脱的甲基叔丁基醚-乙腈溶剂系统。采用所建立的方法,对7 种生物样品中的虾青素光学异构体组成及含量进行了检测,在所测样品中,雨生红球藻3S,3’S虾青素含量最高为
689.78 μg/g,红法夫酵母3R,3’R虾青素含量为337.35 μg/g。本实验实现了虾青素光学异构体的分离及定量,为虾青素光学异构体的开发和虾蟹下脚料的利用提供了数据参考,为后续虾青素光学异构体的活性研究提供了方法学基础。本研究结果表明该方法可行、快速简便、准确,前处理步骤较为简单,回收率较高,可以应用于大部分含虾青素生物样品中虾青素光学异构体含量分析。
参考文献:
[1] 胡金金, 靳远祥, 傅正伟. 虾青素结构修饰的研究进展[J]. 食品科学, 2008, 29(12): 531-534.
[2] AMBATI R R, PHANG S M, RAVI S, et al. Astaxanthin: sources, extraction, stability, biological activities and its commercial applications: a review[J]. Marine Drugs, 2014, 12(1): 128-152.
[3] DALY B, SWINGLE J S, ECKERT G L. Dietary astaxanthin supplementation for hatchery-cultured red king crab, Paralithodes camtschaticus, juveniles[J]. Aquaculture Nutrition, 2013, 19(3): 312-320.
[4] BIEKENG B, FELLING M, LAGOCKI S, et al. Bioavailability of all-E-astaxanthin and Z-isomers of astaxanthin in rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 1997, 157(1): 63-82.
[5] HIGUERA-CIAPARA I, FELIX-VALENZUELA L, GOYCOOLEA F M. Astaxanthin: a review of its chemistry and applications[J]. Critical Reviews in Food Science and Nutrition, 2006, 46(2): 185-196.
[6] LORENZ R T, CYSEWSKI G R. Commercial potential forHaematococcus microalgae as a natural source of astaxanthin[J]. Trends in Biotechnology, 2000, 18(4): 160-167.
[7] TANGERAS A, SLINDE E. Coloring of salmonids in aquaculture: the yeast Phaffia rhodozyma as a source of astaxanthin[M]. New York: Springer US, 1994: 391-431.
[8] FASSETT R G, COOMBES J S. Astaxanthin: a potential therapeutic agent in cardiovascular disease[J]. Marine Drugs, 2011, 9(3): 447-465.
[9] TANAKA T, SHNIMIZU M, MORIWAKI H. Cancer chemoprevention by carotenoids[J]. Molecules, 2012, 17(3): 3202-3242.
[10] PARK J S, CHYUM J H, KIM Y K, et al. Astaxanthin decreased oxidative stress and infl ammation and enhanced immune response in humans[J]. Nutrition and Metabolism, 2010, 7(18): 1-10.
[11] CHEW B P, PARK J S. Carotenoid action on the immune response[J]. The Journal of Nutrition, 2004, 134(1): 257-261.
[12] VECCI M, MULLER R K. Separation of (3S,3′S)-,(3R,3′R)-and (3S,3′R)-astaxanthin via (−)-camphanic acid esters[J]. Journal of High Resolution Chromatography, 1979, 2(4): 195-196.
[13] ABU-LAFI S, TURUIMAN S A. Reproducibility of the separation of astaxanthin stereoisomers on Pirkle covalent L-leucine and d-phenylglycine columns[J]. Journal of Chromatography A, 1999, 855(1): 157-170.
[14] GREWE C, MENGE S, GRIEHL C. Enantioselective separation of all-E-astaxanthin and its determination in microbial sources[J]. Journal of Chromatography A, 2007, 1166(1): 97-100.
[15] 牟志春, 张明, 张艺兵, 等. 高效液相色谱法快速鉴别人工合成虾青素养殖的三文鱼[J]. 食品科学, 2010, 31(22): 318-320.
[16] OSTERLIE M, BIEKENG B, LIAAEN-JENSEN S. Accumulation of astaxanthin all-E, 9Z and 13Z geometrical isomers and 3 and 3′,RS optical isomers in rainbow trout (Oncorhynchus mykiss) is selective[J]. The Journal of nutrition, 1999, 129(2): 391-398.
[17] 肖素荣, 李京东. 虾青素生产方法研究进展[J]. 中国食物与营养, 2011, 17(4): 27-29.
[18] 孙来娣, 冷凯良, 孙伟红, 等. 固相萃取-C 30-RPLC法测定南极磷虾油中的虾青素[J]. 食品科学, 2013, 34(8): 157-160.
[19] 姜启兴, 宋素梅, 夏文水, 等. 南极磷虾壳中虾青素酯的皂化工艺研究[J]. 食品工业科技, 2014, 35(8): 233-236.
[20] NAGAO T, FUKAMI T, HORITA Y, et al. Enzymatic enrichment of astaxanthin from Haematococcus pluvialis cell extracts[J]. Journal of the American Oil Chemists’ Society, 2003, 80(10): 975-981.
[21] 胡婷婷, 王茵, 吴成业. 虾类加工副产物制备虾青素的研究进展[J].福建水产, 2013, 35(5): 407-412.
Chiral Separation and Analysis of Astaxanthin Stereoisomers in Biological Organisms by High-Performance Liquid Chromatography
YANG Shu, ZHANG Ting, XU Jie, LI Xuemin, ZHOU Qingxin, XUE Changhu*
(College of Food Science and Engineering, Ocean University of China, Qingdao 266003, China)
Abstract:A high performance liquid chromatography (HPLC) method for chiral separation and analysis of astaxanthin stereoisomers in several biological organisms was developed. The separation was performed on a Chiralpak IC column (4.6 mm × 250 mm, 5 μm) by using methyl tert-butyl ether (MTBE)-acetonitrile as the mobile phase at a fl ow rate of 1.0 mL/min. The detection wavelength of diode array detector (DAD) was 476 nm. This method was applied to analyze astaxanthin stereoisomers in Haematococcus pluvialis, Phaffia yeast, Penaeus vannamei, Penacus orientalis, Japanese tiger prawn, salmon and crab. The results showed that the linear range of the calibration curve for astaxanthin stereoisomers was 0.1–50 mg/L with a correlation coeffi cient of 0.999 9. The average recovery rates for astaxantin stereoisomers were in the range of 86.2%–98.3%. These results demonstrate that the proposed method is feasible, rapid, simple and accurate.
Key words:astaxanthin; stereoisomers; chiral analysis; high-performance liquid chromatography (HPLC)
中图分类号:TS254.1
文献标志码:A
文章编号:1002-6630(2015)08-0139-06
doi:10.7506/spkx1002-6630-201508025
收稿日期:2014-07-25
基金项目:“十二五”国家科技支撑计划项目(2012BAD33B07);长江学者和创新团队发展计划项目(IRT1188);山东省自主创新专项(2012CX80201)
作者简介:杨澍(1989—),女,硕士研究生,研究方向为水产化学。E-mail:yangshu12@163.com
*通信作者:薛长湖(1964—),男,教授,博士,研究方向为水产化学及水产品加工。E-mail:xuech@ouc.edu.cn