表 1 流动相梯度
Table 1 Program of gradient elution

时间/min流动相体积分数/% A B 1090 123070 161090 0
吕慧超,彭增起*,刘森轩,MUNEER Jamali,李君珂,王复龙,惠 腾,崔保威,刘世欣
(国家肉品质量安全控制工程技术研究中心,食品安全与营养协同创新中心,南京农业大学食品科技学院,江苏 南京 210095)
摘 要:以美拉德模型体系葡萄糖-肌酸酐-氨基酸(丙氨酸、苏氨酸、甘氨酸)为研究对象,探索3 个体系在130 ℃条件下反应3 h后风味物质及杂环胺的形成。采用固相微萃取-气相色谱-质谱联用方法检测表明,3 种模型均产生烧烤风味物质,主要为烷基吡嗪类。高效液相色谱分析表明,丙氨酸模型(Ⅰ)和甘氨酸模型(Ⅲ)均检测到2-氨基-3,4-二甲基咪唑并[4,5-f]喹啉、2-氨基-3,4,8-三甲基咪唑并[4,5-f]喹喔啉和2-氨基-3,7,8-三甲基咪唑并[4,5-f]喹喔啉3 种杂环胺,苏氨酸模型(Ⅱ)检测到了2-氨基-3,4-二甲基咪唑并[4,5-f]喹啉和2-氨基-3,4,8-三甲基咪唑并[4,5-f]喹喔啉2 种杂环胺;3 种模型体系均未检测到2-氨基-3-甲基咪唑并[4,5-f]喹啉和2-氨基-3,8-二甲基咪唑并[4,5-f]喹喔啉。130 ℃温和条件下,1.5 h内各模型体系中杂环胺的生成量很少,1.5 h后杂环胺总量随着加热时间的延长逐渐增多,3 h时模型Ⅰ、Ⅱ、Ⅲ中杂环胺总量分别为(375.50±15.80)、(414.00±18.40)、(363.50±12.20) ng/mL。本研究为肉制品加工尤其是烤肉制品加工如何控制加工条件,从而实现美拉德反应定向控制、减少杂环胺的产生提供一定参考。
关键词:美拉德模型;温和条件;烧烤风味;杂环胺
美味、营养与安全是保证肉制品可持续消费的重要因素 [1]。烧烤肉制品因其独特的风味而备受欢迎,其烧烤风味的形成机理主要是由肉中的天然组分在加热条件下发生美拉德反应而产生的。由于烧烤通常是在高温(180~300 ℃)条件下进行,很容易导致杂环胺的形成。杂环胺发现于20世纪70年代末期,是畜禽肉和鱼类等蛋白质含量丰富的食物在热加工过程中产生的一类具有致癌、致突变作用的多环芳香族结构化合物。已发现的杂环胺有20多种,2-氨基-3-甲基咪唑并[4,5-f]喹啉(2-amino-3-methylimidazo[4,5-f] quinoline,IQ)、2-氨基-3,4-二甲基咪唑并[4,5-f]喹喔啉(2-amino-3,4-dimethylimidazo[4,5-f]quinoline,MeIQ)、2-氨基-3,8-二甲基咪唑并[4,5-f]喹喔啉(2-amino-3,8-dimethylimidazo[4,5-f]quinoxaline,MeIQx)、2-氨基-3,4,8-三甲基咪唑并[4,5-f]喹喔啉(2-amino-3,4,8-trimethylimidazo[4,5-f]quinoxaline,4,8-DiMeIQx)和2-氨基-3,7,8-三甲基咪唑并[4,5-f]喹喔啉(2-amino-3,7,8-trimethylimidazo[4,5-f]quinoxaline,7,8-DiMeIQx)均属于极性杂环胺。目前对杂环胺的形成因素如前体物质、加工方式、加工温度和加工时间等有大量研究 [2-4]。Puangsombat等 [5]研究了油煎、炉烤、炉烘对牛肉、鸡肉、猪肉和鱼肉加工时喹喔啉类(quinoxaline,IQx)杂环胺产生的影响,表明杂环胺的类型和含量与加工条件密切相关。Polak等 [6]在烤猪肉中检测到MeIQx达2.45 ng/g;类似的还有Kim [7]、Chung [8]等对烤猪肉和烤牛肉的研究。
鉴于肉类在高温条件下加热能产生杂环胺,人们开始考虑低温加工方式,以期减少有害物质的生成 [9]。因此,温和条件下美拉德反应安全性受到高度重视 [10-12]。Tsai等 [13]使用肌酸酐、单糖、苏氨酸作为模型,发现喹啉类(quinoline,IQ)杂环胺可以在较低温度条件下形成(128 ℃,2 h)。Kinae等 [14]研究葡萄糖、氨基酸(甲硫氨酸、脯氨酸、苏氨酸、甘氨酸)和肌酐在37、50、128 ℃条件下反应12~30 d也能形成4,8-DiMeIQx和7,8-DiMeIQx,说明温和条件下长时间加热也能导致IQ及IQx类杂环胺的形成。尽管这些模型为肉制品在温和条件下加工提供了一定参考,但大多数研究仅集中于杂环胺的形成。如今人们关注的热点是如何实现美拉德反应定向控制,即利用美拉德反应产生所需要的色泽香气,同时又最大限度降低有害物质的生成。基于这一基本思想,本实验采用葡萄糖-肌酸酐-氨基酸(丙氨酸、苏氨酸、甘氨酸)3 个模型体系,探索在温和条件下加热一定时间,其挥发性风味物质及IQ和IQx类杂环胺的形成,研究简单模型体系中美拉德反应的定向控制。
1.1 材料与试剂
12 种杂环胺标准品:IQ、MeIQ、MeIQx、4,8-DiMeIQx、7,8-DiMeIQx 加拿大Toronto Research Chemicals公司;生化纯肌酸酐、葡萄糖、丙氨酸 上海楷洋生物技术有限公司;醋酸、醋酸铵(均为分析纯)国药集团化学试剂有限公司;二甘醇(二乙二醇,CAS 111-46-6,色谱纯) 上海阿拉丁试剂有限公司;甲醇(色谱纯) 美国Tedia公司;乙腈(色谱纯) 美国ROE公司。
1.2 仪器与设备
2695型高效液相色谱仪、2487紫外检测器 美国Waters公司;TSK gel ODS-80 TM色谱柱(25 cm×4.6 mm,5 μm,80 Å) 日本Tokyo公司;75 μm碳分子筛/聚二甲基硅氧烷(carboxen/polydimethylsiloxane,CAR/PDMS)萃取头 美国Supelco公司;SR-Ⅱ振荡器 日本大洋科学公司;微量注射器SGC 日本岛津公司;4610B气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用仪 美国Finnigan MAT公司;AL104型电子天平 瑞士Mettler Toledo公司;DGG-9240型电热干燥箱 上海森信仪器厂。
1.3 方法
1.3.1 模型体系的建立
准确称取相应前体物于50 mL小烧杯中,加入体积分数80%二甘醇溶液20 mL,以盐酸和氢氧化钠溶液调节pH值为7.5,建立丙氨酸-肌酸酐-葡萄糖模型(Ⅰ)、苏氨酸-肌酸酐-葡萄糖模型(Ⅱ)、甘氨酸-肌酸酐-葡萄糖模型(Ⅲ),其中氨基酸浓度0.1 mol/L、肌酸酐浓度0.1 mol/L、葡萄糖浓度0.2 mol/L。将各模型体系用铝箔纸密封严实后,置于130 ℃烘箱中分别反应0.5、1.0、1.5、2、2.5、3 h,反应结束后立即将小烧杯置于碎冰中以终止反应。以上每组实验做2 个平行,2 次重复。
1.3.2 风味物质的测定
按照曾茂茂等 [15]的测定方法,具体为:取8 mL反应3 h的美拉德反应液于15 mL的顶空瓶中,立即封盖,在50 ℃水浴中恒温35 min后,插入萃取头,探头置于样品的上部,萃取时间40 min,将萃取好的探头从顶空瓶中取出,立即在GC-MS联用仪上直接热解吸,热解吸温度250 ℃,解吸时间3 min,同时启动仪器采集数据。
GC条件:DB-WAX毛细管柱(30 m×0.25 mm,0.25 μm);进样口温度250 ℃;载气为氦气;流速1.2 mL/min;分流比为10∶1;升温程序:40 ℃保持2 min,然后以3 ℃/min升至200 ℃,接着以5 ℃/min升至250 ℃,保持5 min。
MS条件:电子电离源;电子能量70 eV;灯丝发射电流20 μA;离子源温度200 ℃;接口温度250 ℃;全扫描;质量扫描范围m/z 33~495。
利用计算机将样品未知化合物与NIST谱库(107 000 种化合物)和Wiley谱库(320 000种化合物)相匹配以相似指数和反相似指数均大于900(最大值为1 000)作为定性依据。
1.3.3 杂环胺含量的测定
参照万可慧等 [16]方法,标准溶液配制过程为:分别称取5 种杂环胺标准品约5.00 mg,用甲醇溶解并定容至50 mL,配成质量浓度约为100 μg/mL的单标储备液。按实际检测要求,再用甲醇将5 种杂环胺标准储备液进行适当稀释,配成1、10、20、50、100、200、500、1 000 ng/mL的混合标准工作液。
样品前处理过程:取将上述1.3.1节中的反应液0.1 mL,用甲醇溶液稀释适当倍数后,将稀释液过0.22 μm有机滤膜,装于进样瓶。待测样品和标准品均于4 ℃冰箱保存备用。色谱条件:采用二元流动相体系,A为乙腈,B为0.05 mol/L醋酸-醋酸铵缓冲溶液(pH 3.3),梯度洗脱程序如表1所示。柱温30 ℃;进样量20 μL;流速1 mL/min。紫外检测器检测波长设为263 nm。
混合标准工作液按照质量浓度由低到高进样,并绘制标准曲线;相同条件下对样品进行测定,根据保留时间定性,标准曲线定量。
表 1 流动相梯度
Table 1 Program of gradient elution

时间/min流动相体积分数/% A B 1090 123070 161090 0
2.1 模型体系中风味物质的产生
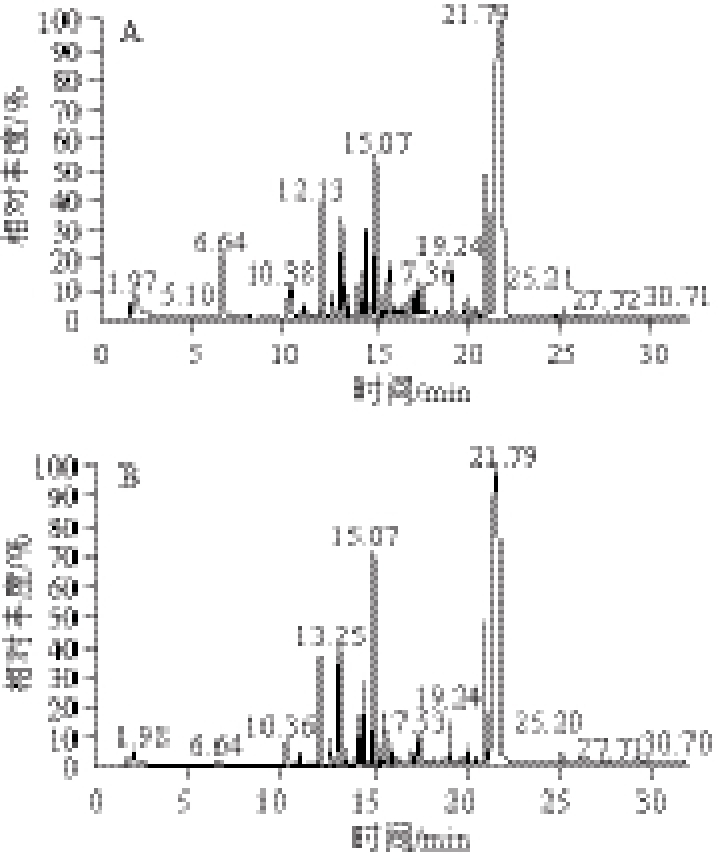
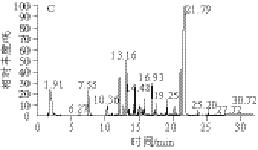
图 1 模型Ⅰ(A)、Ⅱ(B)、Ⅲ(C)的SPME-GC-MS风味物质测定图
Fig.1 Volatile compounds of models Ⅰ, Ⅱ, and Ⅲ determined by SPME-GC-MS
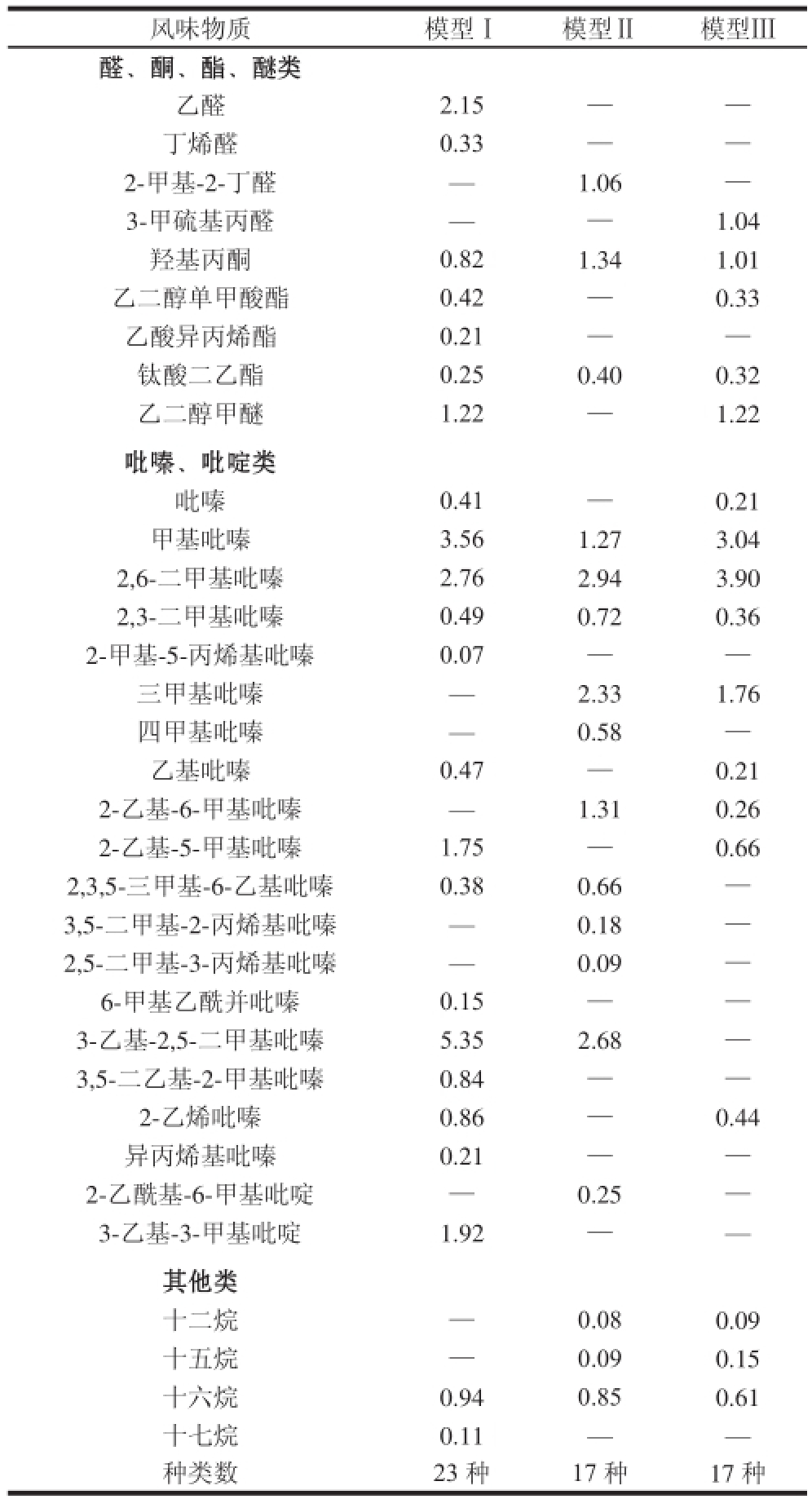
表 2 3 种模型体系反应3 h风味物质的形成(峰面积)
Table 2 Aroma volatiles formed in three model systems (peak area) %
注:—.未检出。下同。
风味物质模型Ⅰ模型Ⅱ模型Ⅲ醛、酮、酯、醚类乙醛2.15——丁烯醛0.33——2-甲基-2-丁醛—1.06—3-甲硫基丙醛——1.04羟基丙酮0.821.341.01乙二醇单甲酸酯0.42—0.33乙酸异丙烯酯0.21——钛酸二乙酯0.250.400.32乙二醇甲醚1.22—1.22吡嗪、吡啶类吡嗪0.41—0.21甲基吡嗪3.561.273.04 2,6-二甲基吡嗪2.762.943.90 2,3-二甲基吡嗪0.490.720.36 2-甲基-5-丙烯基吡嗪0.07——三甲基吡嗪—2.331.76四甲基吡嗪—0.58—乙基吡嗪0.47—0.21 2-乙基-6-甲基吡嗪—1.310.26 2-乙基-5-甲基吡嗪1.75—0.66 2,3,5-三甲基-6-乙基吡嗪0.380.66—3,5-二甲基-2-丙烯基吡嗪—0.18—2,5-二甲基-3-丙烯基吡嗪—0.09—6-甲基乙酰并吡嗪0.15——3-乙基-2,5-二甲基吡嗪5.352.68—3,5-二乙基-2-甲基吡嗪0.84——2-乙烯吡嗪0.86—0.44异丙烯基吡嗪0.21——2-乙酰基-6-甲基吡啶—0.25—3-乙基-3-甲基吡啶1.92——其他类十二烷—0.080.09十五烷—0.090.15十六烷0.940.850.61十七烷0.11——种类数23 种17 种17 种
模型Ⅰ、Ⅱ、Ⅲ的SPME-GC-MS风味物质测定图见图1,具体风味物质见表2。由表2可以看出,3 种模型中都能检测到一定的挥发性物质,主要包括3 大类:醛、酮、酯、醚(非杂环化合物)、吡嗪和吡啶(含氮杂环化合物),以及烃类化合物。3 种模型中共检测到的物质种类分别为23、17 种和17 种。
2.1.1 醛、酮、酯、醚类
模型Ⅰ中该类物质共检测到7 种物质,包括2 种醛类、1 种酮类、3种酯类和1 种醚类;模型Ⅱ共检测到3 种物质,包括1 种醛类、1 种酮类和1 种酯类;模型Ⅲ共检测出5 种物质,包括1 种醛类、1 种酮类、2 种酯类和1 种醚类。按含量来比较,生成醛类和酯类最多的模型为模型Ⅰ,峰面积分别为2.48%和0.88%;生成酮类最多的为模型Ⅱ,峰面积为1.34%。所有模型均没有检测到醇类物质。这些模型体系中的氨基酸在美拉德反应中具有较高的活性,容易与葡萄糖和肌酸酐的中间产物形成羰基化合物,并进一步形成非杂环化合物 [17-18]。醛类、酮类、酯类化合物以及其他芳香族化合物在肉中的阈值很高,对烤肉风味有一定贡献,但在加工过程中这些化合物的变化无规律。
2.1.2 吡嗪和吡啶类
碱性条件有利于含氮、硫、氧等杂环化合物的形成 [19-21]。本实验反应体系的pH值为7.5,在此碱性条件下形成了大量含氮杂环化合物,包括吡嗪和吡啶。模型Ⅰ中包含13 种吡嗪和1 种吡啶,峰面积分别为17.3%和1.92%;模型Ⅱ中包含10 种吡嗪和1 种吡啶,峰面积分别为12.76%和0.25%;模型Ⅲ中包含9 种吡嗪,峰面积为10.84%。其中,甲基吡嗪、2,6-二甲基吡嗪、2,3-二甲基吡嗪均大量存在于3 种模型体系中,其他如三甲基吡嗪、3-乙基-2,5-二甲基吡嗪等生成量也较多。Mottram [22]也分离鉴定了烧烤猪肉的风味物质,其中包含66 种杂环类物质,吡嗪占其中的80%左右。秦刚 [23]在烤猪肉中检测到了大量吡嗪类化合物,其中对产品整体风味贡献最大的嗅感物质包括2,3-二甲基吡嗪、2,5-二甲基吡嗪、三甲基吡嗪、2-乙基-6-甲基吡嗪等。除吡嗪外,吡啶也对烤肉风味有一定的贡献,本实验中模型Ⅰ和模型Ⅱ检测到了吡啶,分别为3-乙基-3-甲基吡啶和2-乙酰基-6-甲基吡啶,甘氨酸模型中没有检测到。
2.1.3 其他类
主要为烷类物质,不同模型体系下虽然产量不同,但含量均比较低。烷烃类物质是美拉德反应的中间产物,其本身没有明显的风味,但随着反应程度的加深会逐渐消失,有理由怀疑其与风味化合物的形成有密切关系。
2.2 模型体系中杂环胺测定结果
模型体系已成为研究杂环胺形成及其影响因素的有效工具,与肉的复杂体系相比,许多副反应大大减少,同时感兴趣的反应被简化。本实验杂环胺最终检测结果如表3所示,可以看出3 个模型体系中,加热时间为0.5 h和1 h时均没有检测到杂环胺,加热1.5 h时有少量杂环胺生成。模型Ⅰ在1.5 h时开始产生MeIQ,含量为(13.90±0.40) ng/mL,2.0、2.5、3.0 h时分别增加6、14 倍和19 倍;2.5 h开始有4,8-DiMeIQx生成,而7,8-DiMeIQx在3 h开始生成,且含量较低,为(2.50±0.08) ng/mL。总体上来说,随着加热时间的延长,模型Ⅰ中杂环胺的含量和种类随加热时间的延长而增多,其总含量从0.5 h的(13.90±0.40) ng/mL增加到3 h时的(375.50±15.80) ng/mL,约增加了26 倍。但在该模型中始终未检出IQ和MeIQx。模型Ⅱ中,1.5 h即开始生成4,8-DiMeIQx,含量为(12.50±0.33) ng/mL;2 h开始生成MeIQ,含量为(52.40±3.20) ng/mL,两者的生成量均随加热时间的延长而增加;至3 h时两者含量分别达到(308.80±16.20) ng/mL和(105.20±3.55) ng/mL,分别增加了5 倍和7 倍。本模型加热3 h内未检测到IQx、MeIQx和7,8-DiMeIQx。在模型Ⅲ中,1.5 h检测到MeIQ,含量为(1 9.80±0.80) ng/mL,2 h开始生成7,8-DiMeIQx,2.5 h开始生成4,8-DiMeIQx,3 h时杂环胺总量达(363.50±12.20) ng/mL,未检测到IQ和MeIQ。由此可见,3 种模型中,MeIQ更容易生成,其次是4,8-DiMeIQx和7,8-DiMeIQx,2 h时杂环胺总量从多到少排序为模型Ⅲ>模型Ⅰ>模型Ⅱ;2.5 h时排序为模型Ⅱ>模型Ⅰ>模型Ⅲ;3 h时排序为模型Ⅱ>模型Ⅰ>模型Ⅲ。
表 3 3 种模型体系在130 ℃加热不同时间形成杂环胺含量
Table 3 Formation of HCAs after heating at 130 ℃ for 0.5–3 h in three model systems ems ng/mL
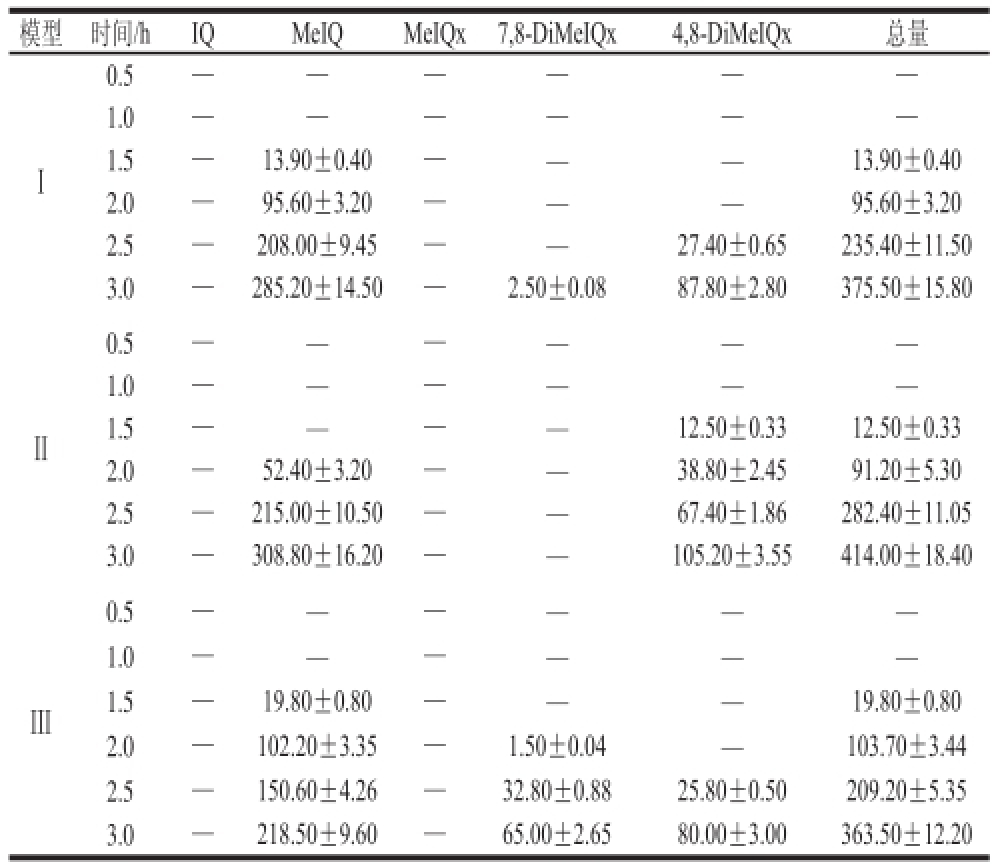
模型时间/hIQMeIQMeIQx7,8-DiMeIQx4,8-DiMeIQx总量Ⅰ0.5——1.0——1.5—13.90±0.40——13.90±0.40 2.0—95.60±3.20——95.60±3.20 2.5—208.00±9.45——27.40±0.65235.40±11.50 3.0—285.20±14.50—2.50±0.0887.80±2.80375.50±15.80Ⅱ0.5——1.0——1.5——12.50±0.3312.50±0.33 2.0—52.40±3.20——38.80±2.4591.20±5.30 2.5—215.00±10.50——67.40±1.86282.40±11.05 3.0—308.80±16.20——105.20±3.55414.00±18.40Ⅲ0.5——1.0——1.5—19.80±0.80——19.80±0.80 2.0—102.20±3.35—1.50±0.04—103.70±3.44 2.5—150.60±4.26—32.80±0.8825.80±0.50209.20±5.35 3.0—218.50±9.60—65.00±2.6580.00±3.00363.50±12.20
3 种模型体系在温和条件下加热3 h后,对其挥发性风味物质进行分析,可以看出模型Ⅰ相对另外2 种模型来说,其风味物质的种类和含量更多,也更接近烧烤风味。而实际肉类烧烤过程中,其烧烤风味的产生更为复杂,不是由单一物质通过单一化学反应产生。除美拉德反应外,还涉及硫胺素降解、类脂物质降解、氨基酸和肽类降解、糖降解和核苷酸类降解等 [19,24]。其风味物质除了主体成分吡嗪类外,主要还有噻唑、噻吩、硫化物等的综合作用 [17]。因此,本实验仅讨论单一的美拉德前体物质的反应,所获得的风味是比较单一的,而且不够柔和、丰富。
对于杂环胺化合物来说,3 种模型体系中IQ和IQx类杂环胺的种类和含量不同。Jägerstad等 [25]率先提出了IQ-型杂环胺的形成假说:肌肉中天然存在的前体物质,即肌酸、氨基酸和糖,与杂环胺的形成有关。当温度高于100 ℃时,肌酸可通过自发的环化和脱水而形成2-氨基咪唑部分,而喹啉或者喹喔啉部分则通过美拉德反应中间产物吡嗪或者吡啶和乙醛缩合而形成,这个反应机制被后来的一些研究所证实 [26-29]。Grivas等 [30]发现丙氨酸-果糖-肌酐在二甘醇水溶液中130 ℃加热回流2 h便产生MeIQ和4,8-DiMeIQx。Skog等 [31]将丙(苏)氨酸-葡萄糖-肌酐酸模型体系在200 ℃加热15 min后,检测MeIQx、4,8-DiMeIQx和4,7,8-TrimeIQx。Kikugawa等 [32]则概括了影响杂环胺形成的多种因素,包括温度、时间、水分含量、糖浓度以及抗氧化物,这对模型体系中如何减少杂环胺的形成有一定参考意义。本实验中3 个模型主要检测到了MeIQ、4,8-DiMeIQx和7,8-DiMeIQx,没有检测到IQ和MeIQx。这些杂环胺得以生成的主要原因是由于其美拉德反应的中间产物如吡嗪、吡啶、羰基自由基含量及其他中间产物的种类不同,而这些产物与杂环胺的形成密切相关。有关形成机制在其他研究 [33-34]中也有报道。Arvidsson [35]在水模型体系中研究了杂环胺形成中温度与时间的关系,表明225 ℃条件下加热5~10 min,MeIQx和4,8-DiMeIQx的生成量在达到高峰后出现明显的下降。本实验加热3 h,未观察到杂环胺的降低趋势,可能是温度较低,即使延长加热时间,也不足以使杂环胺发生分解或其他副反应。另外,杂环胺的形成量可能与形成杂环胺的中间产物的挥发有关,或者与杂环胺的挥发有关。尽管杂环胺挥发性不是很强,在香气成分中也有少量MeIQx和Di-MeIQx被检测到了 [36-37]。从表2可以看出,本研究中挥发性成分中均没有检测到挥发性喹喔啉。
鉴于模型体系中挥发性风味物质的产生和杂环胺的形成均与美拉德反应有关,因此有理由猜测其两者的形成有一定的关联。但目前的研究或仅集中于风味物质的研究,或仅限于对有害物质杂环胺的研究,而同时对两者的研究并未见报道。因此,在控制反应温度和反应时间的条件下,最大限度获得预期风味的同时,又减少有害物质杂环胺,将对烤肉制品加工乃至整个肉品加工都具有重要意义。
采用SPMC-GC-MC方法分析鉴定了葡萄糖-肌酸酐-氨基酸(丙氨酸、苏氨酸、甘氨酸)3 个简单模型体系的风味物质。模型Ⅰ共检测到23 种挥发性风味成分,模型Ⅱ和模型Ⅲ各检测到17 种风味成分,其中以模型Ⅰ中吡嗪类含量最多,共13 种,峰面积17.30%,为烧烤风味的主体物质,而模型Ⅱ和模型Ⅲ中吡嗪类种类分别为10 种和9 种,峰面积12.76%和10.84%。3 个模型体系挥发性成分中均未检测到挥发性喹喔啉类杂环胺。
采用高效液相色谱方法对3 个模型体系中的杂环胺进行检测,模型Ⅰ检测到3种杂环胺,即MeIQx、4,8-DiMeIQx和7,8-DiMeIQx,1.5 h开始生产MeIQ,含量为(13.90±0.40) ng/mL,3h时杂环胺总量增至(375.50±15.80) ng/mL;模型Ⅱ检测到2 种杂环胺MeIQx和4,8-DiMeIQx,1.5 h开始生成4,8-DiMeIQx,含量为(12.50±0.33) ng/mL,3 h时杂环胺总量增至(414.00±18.40) ng/mL;模型(Ⅲ)检测到3 种杂环胺,即MeIQx、4,8-DiMeIQx 和7,8-DiMeIQx,1.5 h开始生产MeIQ,含量为(19.80±0.80) ng/mL,3 h时杂环胺总量增至(363.50±12.20) ng/mL。3 种模型体系中均未检出IQ和MeIQx类杂环胺。
本实验对3 个简单模型体系进行研究,初步认为丙氨酸-肌酸酐-葡萄糖模型相比其他2 个模型而言,更容易产生烧烤风味,且有害物质杂环胺的形成相对较少。有关肉类中其他前体物质模型的建立,或关于复杂模型体系有待进一步深入研究。
参考文献:
[1] JOO S T, KIM G D, HWANG Y H, et al. Control of fresh meat quality through manipulation of muscle fi ber characteristics[J]. Meat Science, 2013, 95(4): 828-836.
[2] AHN J, GRÜN I U. Heterocyclic amines: kinetics of formation of polar and nonpolar heterocyclic amines as a function of time and temperature[J]. Journal of Food Science, 2005, 70(2): 173-179.
[3] GAŠ PERLIN L, LUKAN B, Ž LENDER B, et al. Effects of skin and grilling method on formation of heterocyclic amines in chicken pectoralis superficialis muscle[J]. Food Science and Technology, 2009, 42(8): 1313-1319.
[4] SKOG K, SOLYAKOV A. Heterocyclic amines in poultry products: a literature review[J]. Food and Chemical Toxicology, 2002, 40(8): 1213-1221.
[5] PUANGSOMBAT K, GADGIL P, HOUSER T A, et al. Occurrence of heterocyclic amines in cooked meat products[J]. Meat Science, 2012, 90(3): 739-746.
[6] POLAK T, DOŠLER D, ŽLENDER B, et al. Heterocyclic amines in aged and thermally treated pork longissimus dorsi muscle of normal and PSE quality[J]. Food Science and Technology, 2009, 42(2): 504-513.
[7] KIM S, LEE K G. Effects of cooking variables on formation of heterocyclic amines (HCA) in grilled pork and mackerel[J]. Journal of Toxicology and Environmental Health, 2010, 73(21): 1599-1609.
[8] CHUNG S Y, YETTELLA R R, KIM J S, et al. Effects of grilling and roasting on the levels of polycyclic aromatic hydrocarbons in beef and pork[J]. Food Chemistry, 2011, 129(4): 1420-1426.
[9] 彭增起, 吕慧超. 绿色制造技术: 肉类工业面临的挑战与机遇[J]. 食品科学, 2013, 34(7): 345-348.
[10] O’ BRIEN J, MORRISSEY P A, AMES J M. Nutritional and toxicological aspects of the Maillard browning reaction in foods[J]. 1989, 28(3): 211-248.
[11] SOLYAKOY A, SKOG K. Screening for heterocyclic amines in chicken cooked in various ways[J]. Food and Chemical Toxicology, 2002, 40(8): 1205-1211.
[12] YAO Y, PENG Z Q, WAN K H, et al. Determination of heterocyclic amines in braised sauce beef[J]. Food Chemistry, 2013, 141(3): 1847-1853.
[13] TSAI S J, JENQ S N, LEE H. Naturally occurring diallyl disulfide inhibits the formation of carcinogenic heterocyclic aromatic amines in boiled pork juice[J]. Mutagenesis, 1996, 11(3): 235-240.
[14] KINAE N, MORI C, KUJIRAI K, et al. Formation of mutagenic/ carcinogenic heterocyclic amines under moderate conditions[J]. Annals New York Academy of Sciences, 2005, 1043(1): 80-84.
[15] 曾茂茂, 李伶俐, 何志勇, 等. 甘氨酸对美拉德反应体系及产生肉香风味物质的影响[J]. 食品科学, 2012, 33(7): 32-36.
[16] 万可慧, 彭增起, 邵斌, 等. 高效液相色谱法测定牛肉干制品中10 种杂环胺[J]. 色谱, 2011, 3(3): 285-291.
[17] MACLEOD G, SHAHIDI F. Flavor of meat, meat products and seafoods[M]. New York: Blackic Academic Professional, 1998: 62-81.
[18] MOTTRAM D S. Flavor formation in meat and meat products: a review[J]. Food Chemistry, 1998, 62(4): 415-424.
[19] MEYNIER A, MOTTRAM D S. The effect of pH on the formation of volatile compounds in meat-related model systems[J]. Food Chemistry, 1995, 52(4): 361-366.
[20] LEAHY M M, GARY A R. Kinetics of the formation of alkylpyrazines[M]. Washington D. C.: ACS Symposium System, 1989: 196-208.
[21] 侯亚龙, 陈正行, 罗昌荣. pH对阿拉伯糖-半胱氨酸模型体系挥发性风味物质形成的影响[J]. 食品科学, 2007, 28(4): 87-91.
[22] MOTTRAM D S. The effect of cooking conditions on the formation of volatile heterocyclic compounds in pork[J]. Journal of Science and Food Agriculture, 1985, 6(5): 377-382.
[23] 秦刚. 荣昌猪肉在不同烤制温度中挥发性风味物质的研究[D]. 重庆: 西南大学, 2011: 35-46.
[24] SHIBAMOTO T. Formation of sulfur-and nitrogen-containing compounds from the reaction of furfural with hydrogen sulfide and ammonia[J]. Journal of Agricultural and Food Chemistry, 1977, 25(1): 206-208.
[25] JÄ GERSTAD M, REUTERSWÄ RD A, OLSSON R, et al. Creatinine and Maillard reaction products as precursors of mutagenic compounds: effects of various acids[J]. Food Chemistry, 1983, 12(4): 255-264.
[26] NYHAMMAR T, GRIVAS S, OLSSON K, et al. Isolation and identification of beef mutagens (IQ compounds) from heated model systems of creatinine, fructose and glycine or alanine[M]. Elsevier Amsterdam, 1986: 324.
[27] NES I F. Formation of mutagens in an amino acid-glucose model system and the effect of creatine[J]. Food Chemistry, 1987, 24(2): 137-146.
[28] NEGISHI C, WAKABAYASHI K, YAMAIZUMI J, et al. Identifi cation of 4,8-DiMeIQx, a new mutagen[J]. Mutation Research/Environmental Mutagenesis and Related Subjects, 1985, 147(5): 267-268.
[29] NAMIKI M, HAYASHI H. Development of novel free radicals during the amino-carbonyl reaction of sugars with amino acids[J]. Journal of Agricultural and Food Chemistry, 1975, 23(3): 487-491.
[30] GRIVAS S, NYHAMMAR T, OLSSON K, et al. Formation of a new mutagenic DiMeIQx compound in a model system by heating creatinine, alanine and fructose[J]. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 1985, 151(2): 177-183.
[31] SKOG K, KNIZE M G, FELTON J S, et al. Formation of new heterocyclic amine mutagens by heating creatinine, alanine, threonine and glucose[J]. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 1992, 268(2): 191-197.
[32] KIKUGAVA K. Prevention of mutagen formation in heated meats and model systems[J]. Mutagenesis, 2004, 19(6): 431-439.
[33] KIKUGAWA K. Involvement of free radicals in the formation of heterocyclic amines and prevention by antioxidants[J]. Cancer Letters, 1999, 143(2): 123-126.
[34] PERSON A M, CHEN C, GRAY J I, et al. Mechanisms involved in meat mutagen formation and inhibition (hypothesis paper)[J]. Free Radical Biology and Medicine, 1992, 13(2): 161-167.
[35] ARVIDSSON P, BOEKEL M, SKOG K, et al. Kinetics of formation of polar heterocyclic amines in a meat model system[J]. Journal of Food Science, 1997, 62(5): 911-916.
[36] THIÉ BAUD H P, KNIZE M G, KUZMICKY P A, et al. Airborne mutagens produced by frying beef, pork and soy-based food[J]. Food and Chemical Toxicology, 1995, 33(10): 821-828.
[37] VAINIOTALO S, MATVEINEN K, REUNANEN A. GC/MC determination of the mutagenic heterocyclic amines MeIQx and DiMeIQx in cooking fumes[J]. Fresenius’ Journal of Analytical Chemistry, 1993, 345(6): 462-466.
Formation of Heterocyclic Aromatic Amines in Model System Approximating Roast Flavor under Moderate Conditions
LÜ Huichao, PENG Zengqi*, LIU Senxuan, MUNEER Jamali, LI Junke, WANG Fulong, HUI Teng, CUI Baowei, LIU Shixin
(National Center of Meat Quality and Safety Control, Synergetic Innovation Center of Food Safety and Nutrition, College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Abstract:Three model systems consisting of glucose, creatinine and amino acid (alamine, threonine or glycine) were used to study the formation of roast flavor and five heterocyclic aromatic amines (HCAs), namely, 2-amino-3-methylimidazo-[4,5-f]quinoline (IQ), 2-amino-3,4-dimethylimidazo[4,5-f]quinoline (MeIQ), 2-amino-3,8-dimethylimidazo-[4,5-f]quinoxaline (MeIQx), 2-amino-3,4,8-trimethylimidazo[4,5-f]quinoxaline (4,8-DiMeIQx) and 2-amino-3,7,8-trimethylimidazo[4,5-f]quinoxaline (7,8-DiMeIQx). The volatile compounds and HCAs were determined by solid phase micro extraction-gas chromatography-mass spectrometry (SPME-GC-MS) and high performance liquid chromatography (HPLC), respectively. Results showed that after heating at 130 ℃ for 3 h, the volatile compounds were dominated by alkyl pyrazines, which are typical components of roast flavor. MeIQ, 4,8-DiMeIQx and 7,8-DiMeIQx were detected in models Ⅰ and Ⅲ, while only MeIQ and 4,8-DiMeIQx were detected in model Ⅱ. An upward trend in the overall amount of HCAs was observed for all model systems with increasing heating time though only a small amount of HCAs were detected within 1.5 h. The total amounts of HCAs in three models were (375.50 ± 15.80), (414.00 ± 18.40), and (363.50 ± 12.20) ng/mL, respectively after heating for 3 h. The present study will hopefully provide a reference for meat processing, especially for roast meat, by optimizing the desired fl avor while reducing the hazardous chemicals of HCAs as much as possible.
Key words:Maillard model system; moderate temperature; roast fl avor; heterocyclic aromatic amines (HCAs)
中图分类号:TS251.5
文献标志码:A
文章编号:1002-6630(2015)08-0150-06
doi:10.7506/spkx1002-6630-201508027
收稿日期:2014-09-20
基金项目:国家现代农业产业技术体系建设专项(nYcYtx-38)
作者简介:吕慧超(1990—),女,硕士研究生,研究方向为肉制品加工与质量控制。E-mail:2012108046@njau.edu.cn
*通信作者:彭增起(1956—),男,教授,博士,研究方向为肉品加工与质量控制。E-mail:zqpeng@njau.edu.cn