
赵小伟,杨永新,黄冬维,赵辉玲,程广龙*
(安徽省农业科学院畜牧兽医研究所,安徽 合肥 230031)
摘 要:目的:研究牛乳中体细胞数(somatic cell count,SCC)对乳脂肪酸含量的影响。方法:采集474 头处于泌乳早期(30~100 d)的中国荷斯坦奶牛乳样,测定乳中SCC及各种脂肪酸单体的含量,分析乳中SCC对脂肪酸相对含量的影响及相关性。结果:SCC极显著影响乳中C 4∶0、C 16∶1、cis9, trans11-CLA和C 18∶3 n3脂肪酸单体的含量(P<0.01)。同时,随着乳中 SCC的升高,多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)的相对含量也显著增加(P<0.05)。相关性分析显示乳中SCC与PUFA含量呈极显著正相关(P<0.01),与短链脂 肪酸含量呈显著负相关(P<0.05)。结论:研究结果初步揭示了乳中SCC与乳脂肪酸相对含量的关系,为进一步揭示SCC对牛乳品质的影响提供了依据。
关键词:体细胞数;脂肪酸;相关性;牛乳
体细胞数(somatic cell count,SCC)是指每毫升牛奶中的细胞数量,主要由白细胞(巨噬细胞、淋巴细胞、多形核嗜中性白细胞)和少量的乳腺组织上皮脱落的细胞组成。牛乳中SCC的高低可直接反映奶牛乳房的健康状况 [1]。通常牛乳中SCC的增加主要是血液中的中性粒细胞进入感染泌乳,其中90%是多形核嗜中性白细胞,SCC越高,牛乳受病原菌污染的风险就越大 [2]。一般当牛乳中SCC含量超过2×10 5个/mL时,奶牛乳房组织将疑似受到细菌感染 [3],而当SCC超过5×10 5个/mL时,奶牛乳房炎的发病率将会大大增加 [4-5]。
SCC的高低与牛乳产量及品质密切相关。已有研究表明,乳中SCC与牛乳产量呈显著负相关 [6-10]。乳成分也发生显著变化,如酪蛋白、乳脂肪等含量下降 [11],乳清蛋白、血清白蛋白、免疫球蛋白 [12-13]及氧化代谢产物丙二醛 [14-15]等含量升高。同时,伴随着乳中SCC的升高,乳及乳制品的贮存时间也显著降低 [16-17]。脂肪酸是乳脂肪的重要组成部分,主要来源于乳腺组织的内源从头合成和从血液中的直接摄取 [18],奶牛乳腺组织健康与否将会间接影响乳脂肪酸的含量及组成 [19]。已有研究证实,奶牛亚临床 [20-21]或临床 [22]型乳房炎对牛乳中脂肪酸含量及组成有一定的影响。而关于不同SCC条件下与乳脂肪酸相对含量的相关性研究仍然比较少。为此,开展SCC与乳脂肪酸相对含量的相关性分析,旨在进一步揭示SCC与牛乳品质的关系。
1.1 材料与试剂
牛奶样品采集:选择 体况相近、胎次为1~4 胎、无临床乳房炎、处于泌乳早期(30~100 d)的中国荷斯坦奶牛474 头(来源于安徽合肥、蚌埠、滁州等地区的奶牛场,奶牛 养殖规模均在400 头以上),根 据不同采样地区奶牛场的挤奶次数,取全天混合乳样(按早、中、晚4∶3∶3或早、晚5∶5体积比例混合)80 mL,其中50 mL加入防腐剂后4 ℃冷藏待测体细胞数,另一份30 mL分装于3 只10 mL离心管内冻存于-20 ℃待测乳脂肪酸组成。
1.2 仪器与设备
Matic 5000体细胞测定仪 丹麦Foss公司;6890Ⅱ气相色谱仪 美国安捷伦公司。
1.3 方法
1.3.1 SCC分析
取出冷藏在4 ℃条件下的乳样,38 ℃水浴约20 min后,测定牛乳中 的体细胞数。
1.3.2 乳脂肪酸含量测定
取出冻存在-20 ℃条件下的乳样,室内常温条件下解冻,取2 mL奶样,利用正己烷与异丙醇的混合液提取牛乳上清液中的脂肪,然后对溶有脂肪的正己烷液体进行酸碱甲酯化处理(重复1 次),分析方法参照Bu Dengpan等 [23]。
脂肪酸甲酯利用气相色谱仪进行检测,使用C 17∶0为内标 物。采用SP-2560毛细管柱(100 m×0.25 mm,0.2 μm)结合二阶程序升温分离检测:初始炉温170 ℃维持30 min,随后以1.5 ℃/min升温至200 ℃,维持20 min,继续以5 ℃/min升温到220 ℃,维持20 min。注射和检测温度维持在240 ℃。所有脂肪酸根据已知脂肪酸标准物的保留时间来确定。总脂肪酸甲酯含量和单一脂肪酸甲酯含量按公式(1)~(3)计算:

式(2)、(3)中:i为外标第i种脂肪酸;A i为第i种脂肪酸的峰面积;F i为第i种脂肪酸的相对校正因子。1.4 数据统计分析
本实验的原始数据用Excel 2010软件进行初步的整理,然后使用SAS 9.0统计软件包中的PROC MIXED、CORR等程序进行相应的统计分析,显著水平为P<0.05,极显著水平为P<0.01。
2.1 SCC测定结果及其区间确定
表 1 不同SCC条件下样品分布及平均值
Table 1 The distribution and average values of SCC in different groups of milk samples
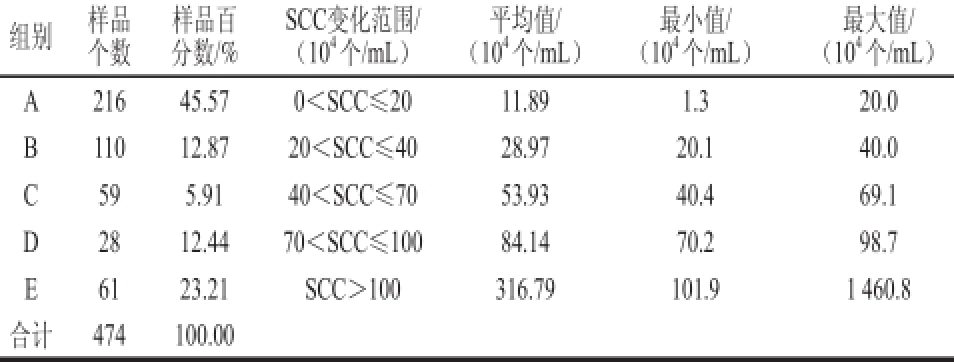
组别样品个数样品百分数/% SCC变化范围/(10 4个/mL)平均值/(10 4个/mL)最小值/(10 4个/mL)最大值/(10 4个/mL)A21645.570<SCC≤2011.891.320.0 B11012.8720<SCC≤4028.9720.140.0 C595.9140<SCC≤7053.9340.469.1 D2812.4470<SCC≤10084.1470.298.7 E6123.21SCC>100316.79101.91 460.8合计474100.00
参考欧盟、美国、澳大利亚等奶业发达国家对收购生鲜乳中SCC的限定,本研究依据乳中SCC的高低划分为A、B、C、D和E 5 个组,各组的样本个数、样品百分比、SCC变化范围及SCC平均数等统计指标见表1。样品比例最大的是A组,其次是E、B、D组和C组。由此可见,乳中SCC小于2×10 5个/mL的奶牛占45.57%,表明奶牛健康状况良好,乳房没有受到病原菌的感染;乳中SCC大于4×10 5个/mL的奶牛占41.56%,表明这部分奶牛疑似为隐性乳房炎,存在健康隐患。
2.2 SCC对牛乳中脂肪酸含量的影响
表 2 不同SCC对牛乳中脂肪酸单体含量的影响
Table 2 Effects of SCC on the contents of milk fatty acids
Table 2 Effects of SCC on the contents of milk fatty acids
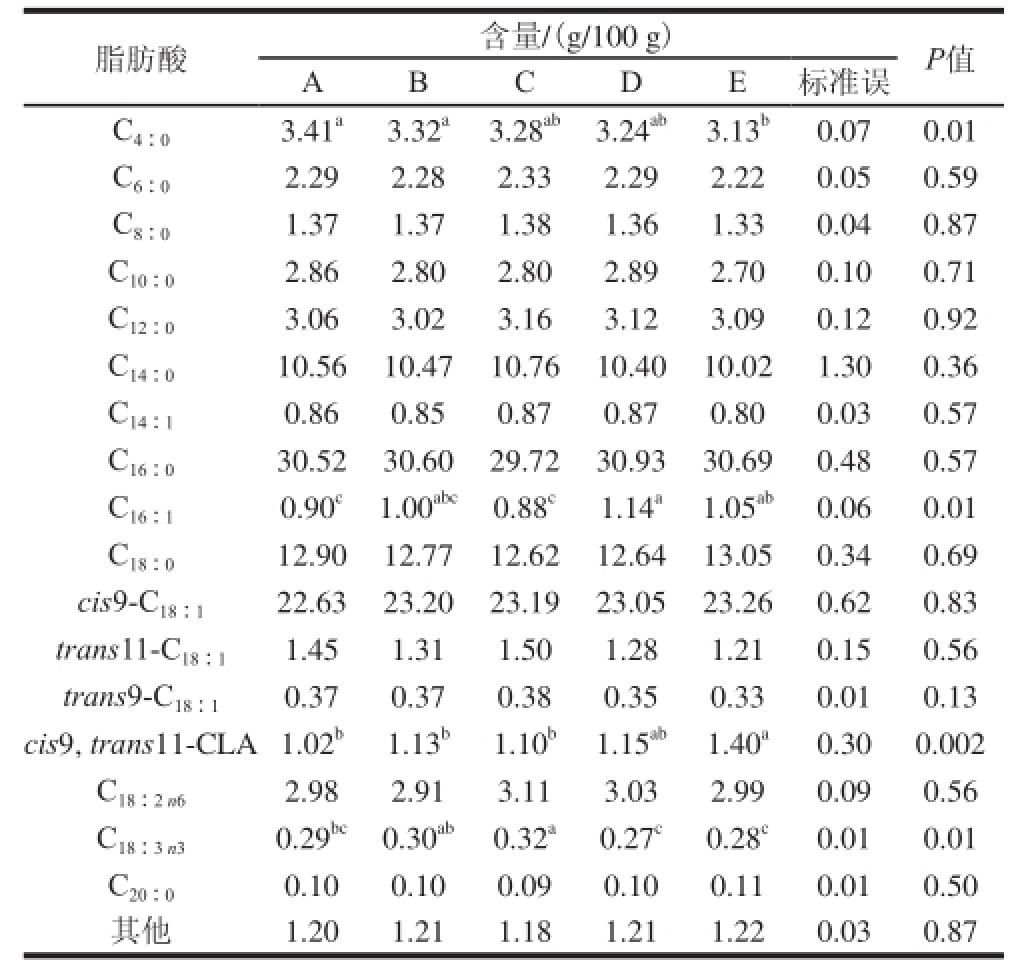
注:同行肩标不同小写字母表示不同处理间差异显著(P<0.05);同行无字母表示差异不显著(P>0.05)。下表同。
脂肪酸含量/(g/100 g)P值ABCDE标准误C 4∶03.41 a3.32 a3.28 ab3.24 ab3.13 b0.070.01 C 6∶02.292.282.332.292.220.050.59 C 8∶01.371.371.381.361.330.040.87 C 10∶02.862.802.802.892.700.100.71 C 12∶03.063.023.163.123.090.120.92 C 14∶010.5610.4710.7610.4010.021.300.36 C 14∶10.860.850.870.870.800.030.57 C 16∶030.5230.6029.7230.9330.690.480.57 C 16∶10.90 c1.00 abc0.88 c1.14 a1.05 ab0.060.01 C 18∶012.9012.7712.6212.6413.050.340.69 cis9-C 18∶122.6323.2023.1923.0523.260.620.83 trans11-C 18∶11.451.311.501.281.210.150.56 trans9-C 18∶10.370.370.380.350.330.010.13 cis9, trans11-CLA1.02 b1.13 b1.10 b1.15 ab1.40 a0.300.002 C 18∶2 n62.982.913.113.032.990.090.56 C 18∶3 n30.29 bc0.30 ab0.32 a0.27 c0.28 c0.010.01 C 20∶00.100.100.090.100.110.010.50其他1.201.211.181.211.220.030.87
由表2可知,乳中脂肪酸单体C 4∶0相对含量在A组和B组极显著高于E组(P<0.01),即随着乳中SCC的增加C 4∶0含量呈现降低趋势。C 16∶1相对含量在D组和E组中极显著高于A组和C组(P<0.01),而与B组无显著差异。cis9, trans11-CLA相对含量在E组中极显著高于A、B组和C组(P<0.01),即随着乳中SCC的增加cis9, trans11-CLA含量呈现升高趋势;另外,C 18∶3 n3相对含量在C组中极显著高于A、D组和E组(P<0.01),在B组 中极显著高于D组和E组(P<0.01)。乳中SCC对乳中其他脂肪酸单体的相对含量没有显著的影响。
表 3 不同SCC对牛乳中不同类型脂肪酸含量的影响
Table 3 Effects of SCC on the contents of different types of fatty acids in milk
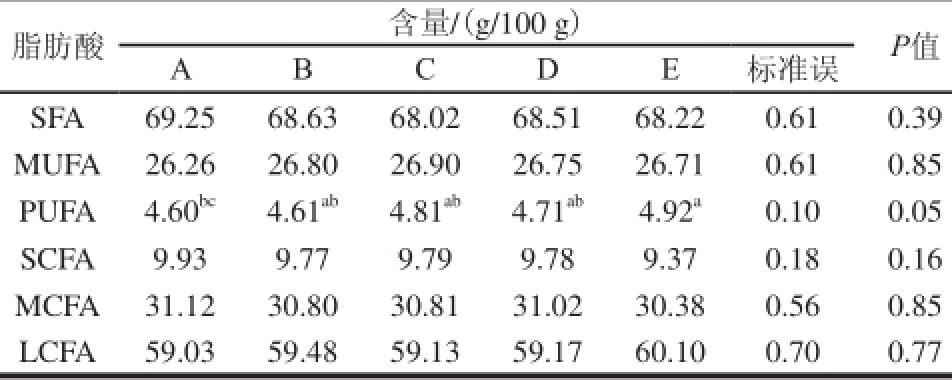
脂肪酸含量/(g/100 g)P值ABCDE标准误SFA69.2568.6368.0268.5168.220.610.39 MUFA26.2626.8026.9026.7526.710.610.85 PUFA4.60 bc4.61 ab4.81 ab4.71 ab4.92 a0.100.05 SCFA9.939.779.799.789.370.180.16 MCFA31.1230.8030.8131.0230.380.560.85 LCFA59.0359.4859.1359.1760.100.700.77
由表3可知,SCC可显著影响乳中多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)(P<0.05)的相对含量,PUFA在E组含量最高,在A组含量最低,即随着乳中SCC的增加PUFA含量也相应的增加。乳中SCC对乳中饱和脂肪酸(saturated fatty acid,SFA)、单不饱和脂肪酸(monounsaturated fatty acid,MUFA)、短链脂肪酸(short chain fatty acid,SCFA)(C 4~C 10)、中链脂肪酸(medium chain fatty acid,MCFA)(C 11~C 15,50% C 16)和长链脂肪酸(long chain fatty acid,LCFA)(50% C 16,C 17~C 24)的相对含量没有显著的影响。
2.3 SCC与各种类型脂肪酸含量间的相关性分析
表 4 SCC与各种类型脂肪酸含量间的相关性分析
Table 4 Correlation analysis between milk SCC and fatty acids
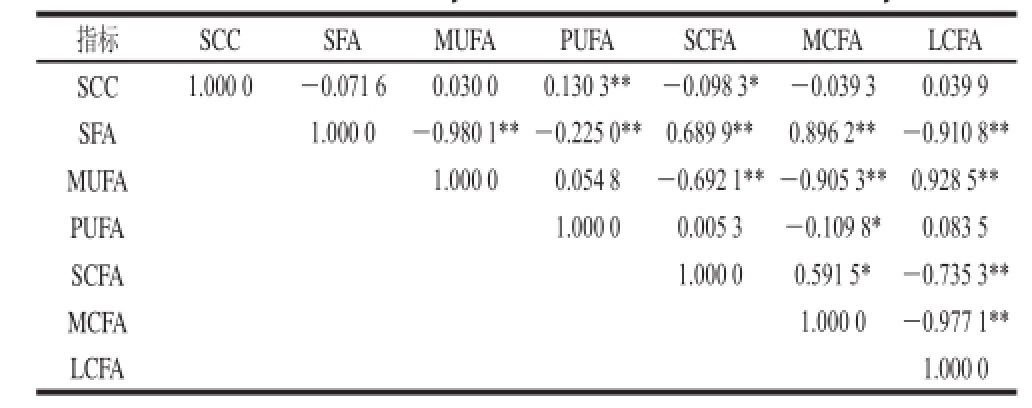
注:*.差异显著(P<0.05);**.差异极显著(P<0.01)。
指标SCCSFAMUFAPUFASCFAMCFALCFA SCC1.000 0-0.071 60.030 00.130 3**-0.098 3*-0.039 30.039 9 SFA1.000 0-0.980 1**-0.225 0**0.689 9**0.896 2**-0.910 8** MUFA1.000 00.054 8-0.692 1**-0.905 3**0.928 5** PUFA1.000 00.005 3-0.109 8*0.083 5 SCFA1.000 00.591 5*-0.735 3** MCFA1.000 0-0.977 1** LCFA1.000 0
由表4可知,SCC与SFA含量呈负相关,但差异不显著,与MUFA和PUFA含量呈正相关,仅PUFA达到了极显著水平(P<0.01)。另外,SCC与SCFA、MCFA含量呈负相关,只有SCFA达到了显著水平(P<0.05),与LCFA含量呈正相关,但差异均不显著。
3.1 SCC对乳中不同脂肪酸含量的影响
牛乳中的脂肪酸源于2 条途径,短链及部分中链脂肪酸由瘤胃发酵产物乙酸、β-羟丁酸等在乳腺组织内的从头合成,其余的脂肪酸来自乳腺组织从血液中的摄取 [18]。日粮种类、泌乳日龄、胎次等因素都会影响牛乳脂肪酸组成,但是奶牛机体自身健康与否也会对乳脂肪酸组成及含量产生影响。常玲玲等 [20]研究发现,健康奶牛与乳房炎奶牛乳中脂肪酸差异较大,乳房炎乳中脂肪酸总含量低于正常乳,只有C 16∶1含量高于正常乳,其他脂肪酸含量均低于正常乳。这可能是奶牛乳房发生炎症反应时,奶牛乳腺组织上皮细胞的数量和活性降低,进而可能会影响脂肪酸的合成、碳链的延长等生物学功能 [19]。
牛乳中SCC的高低可以用来反映奶牛乳腺是否有炎症反应,同时乳中高SCC可造成乳脂率降低 [24]。进一步研究发现,SCC可显著影响乳中C 4∶0、C 16∶1、C 18∶3 n3和PUFA的相对含量,C 4∶0的相对含量表现下降趋势,C 16∶1和PUFA相对含量表现出一定的升高趋势。毛永江等 [25]研究表明,体细胞计数可显著影响乳中C 11∶0、C 20∶0、C 20∶3和C 22∶6的相对含量,对乳中其他脂肪酸单体及SFA、MUFA、PUFA、SCFA和MCFA相对含量不产生影响。Miller等 [22]研究发现,患有隐性乳房炎的奶牛乳中PUFA相对含量低于正常奶牛,而SFA和MUFA相对含量高于正常奶牛。研究结果不同的原因可能与奶牛采食的日粮及个体遗传差异有关,所以这方面有待于进一步的深入探讨。
3.2 SCC与各种类型脂肪酸含量间的相关性分析
乳中SFA、MUFA、PUFA的含量可用于反映牛乳的营养价值。不饱和脂肪酸主要来源于奶牛采食的日粮和长链饱和脂肪酸经过乳腺组织内的去饱和酶的脱饱和作用2 条途径。本研究结果经过相关性分析表明,SCC与SFA呈负相关,与MUFA和PUFA含量呈正相关, PUFA含量达到了 显著水平,这与毛 永江等 [25]的研究 结果类似。出现这种结果的原因可能是当SCC逐渐升高时,乳腺组织内的从头合成或去饱和酶的活性增强,使得PUFA含量逐渐增加,SFA含量表现下降趋势,这方面还需要进一步的研究证实。
不同碳链长度 脂肪酸是牛乳中的重要营养成分,在天然的食品中,低于14碳的脂肪酸主要存在于反刍动物乳中。本研究发现,随着乳中SCC升高,MCFA和LCFA相对含量有一定的增加,SCFA的相对含量减少,这与Randolph等 [21]的研究结果相似。牛乳中的SCFA全部来自乳腺组织上皮细胞以瘤胃发酵产物为前体物的从头合成,而LCFA则主要取决于奶牛采食的日粮,当牛乳中SCC升高时,反映奶牛乳腺组织有了一定的炎症反应,乳腺组织上皮细胞的功能及活性受到了影响,所以会引起内源合成的脂肪酸减少,乳中SCFA相对含量降低,间接导致了LCFA相对含量升高。
综上所述,牛乳中C 4∶0的相对含量随着SCC的升高而降低,乳中PUFA的相对含量随着SCC的升高而增加;SCC与SCFA相对含量呈显著负相关,与PUFA相对含量呈显著正相关。研究结果初步阐述了乳中SCC与不同脂肪酸之间的关系,为进一步揭示SCC对牛乳品质的影响提供了依据。
参考文献:
[1] AKERS R M, NICKERSON S C. Mastitis and its impact on structure and function in the ruminant mammary gland[J]. Journal of Mammary Gland Biology and Neoplasia, 2011, 16(4): 275-289.
[2] JONES G M. Understanding the basics of mastitis[N]. Virginia Cooperative Extension, 2006-05-01(1-7).
[3] SHARMA N, SINGH N K, BHADWAL M S. Relationship of somatic cell count and mastitis: an overview[J]. Asian-Australasian Journal of Animal Sciences, 2011, 24(3): 429-438.
[4] 郭秀兰, 王康宁. 乳中体细胞数在牛奶生产中的监控作用[J]. 中国饲料, 2003(20): 33-34.
[5] 杨德英, 曹随忠, 余树民, 等. 奶牛隐性乳房炎对牛奶品质的影响[J].湖北农业科学, 2009, 48(1): 132-134.
[6] KUKOVICS S, MOLNAR A, ABRAHAM M, et al. Phenotypic correlation between somatic cell count and milk components[J]. Allattenyesztes es Takarmanyozas, 1996, 45: 205-215.
[7] RUPP R, BOICHARD D. Relation of early fi rst lactation somatic cell count with risk of subsequent clinical mastitis[J]. Livestock Production Science, 2000, 62(2): 169-180.
[8] JUOZAITIENE V, JUOZAITIS A, MICIKEVICIENE R. Relationship between somatic cell count and milk production or morphological traits of udder in black-and-white cows[J]. Turkish Journal of Veterinary and Animal Sciences, 2009, 30(1): 47-51.
[9] 张慧林, 余文文, 刘小林, 等. 牛乳中体细胞数与产奶量和乳成分的相关分析[J]. 西北农业学报, 2010, 19(4): 1-4.
[10] HAND K J, GODKIN A, KELTON D F. Milk production and somatic cell counts: a cow-level analysis[J]. Journal of Dairy Science, 2012, 95(3): 1358-1362.
[11] HARMON R J. Physiology of mastitis and factors affecting somatic cell counts[J]. Journal of Dairy Science, 1994, 77: 2103-2112.
[12] SCHALLIBAUM M. Impact of SCC on the quality of fl uid milk and cheese[C]//40 thAnnual Meeting. Madison WI, USA: National Mastitis Council, 2001: 38-46.
[13] SURIYASATHAPOM W, VINITKETKUMNUEN U, BERGLUND B, et al. Higher somatic cell counts resulted in higher malondialdehyde concentrations in raw cows’ milk[J]. Internation Dairy Journal, 2006, 16: 1088-1091.
[14] SURIYASATHAPOM W, VINITKETKUMNUEN U, CHEWONARIN T. Relationships among malondialdehyde, milk compositions, and somatic cell count in milk from bulk tank[J]. Songklanakarin Journal of Science and Technology, 2010, 32(1): 23-26.
[15] YANG Fengli, LI Xiaoshan, HE Baoxiang, et al. Malondialdehyde level and some enzymatic activities insubclinical mastitis milk[J]. African Journal of Biotechnology, 2011, 10(28): 5534-5538.
[16] FERNANDES A M, OLIVEIRA C A F, LIMA C G. Effects of somatic cell counts in milk on physical and chemical characteristics of yoghurt[J]. International Dairy Journal, 2007, 17(2): 111-115.
[17] MA Y, RYAN C, BARBANO D M, et al. Effects of somatic cell count on quality and shelf-life of pasteurized fl uid milk[J]. Journal of Dairy Science, 2000, 83(2): 264-274.
[18] PALMQUIST D L, JENKINS T C. Fat in lactation rations: review[J]. Journal of Dair y Science, 1980, 62(1): 1-14.
[19] ZHAO X, LACASSE P. Mammary tissue damage during bovine mastitis: causes and control[J]. Journal of Animal Science, 2008, 86(13): 57-65.
[20] 常玲玲, 杨章平, 吴海涛, 等. 奶牛正常乳与隐性乳房炎乳中脂肪酸组成的比较研究[J]. 畜牧兽医学报, 2011, 42(1): 44-47.
[21] RANDOLPH H E, ERWIN R E. Influence of mastitis on properties of milk. X. Fatty acid composition[J]. Journal of Dairy Science, 1974, 57(8): 865-868.
[22] MILLER R H, BITMAN J, BRIGHT S A, et al. Effect of clinical and subclinical mastitis on lipid composition of teat canal keratin[J]. Journal of Dairy Science, 1992, 75( 6): 1436-1442.
[23] BU Dengpan, WANG Jiaqi, DHIMAN T R, et al. Effectiveness of oils rich in linoleic and linolenic acids to enhance conjugated linoleic acid in milk from dairy cows[J]. Journal of Dairy Sc ience, 2007, 90(2): 998-1007.
[24] AYASAN T, HIZLI H, YAZGAN E, et al. The effect of somatic cell count on milk urea nitrogen and milk composition[J]. Kafkas Üniversitesi Veteriner Fakültesi Dergisi, 2011, 17(4): 659-662.
[25] 毛永江, 常玲玲, 杨章平, 等. 中国荷斯坦牛乳中体细胞评分与脂肪酸含量和组成的相关分析[J]. 中国农业科学, 2011, 44(24): 5073-5082.
Correlation Analysis between Somatic Cell Count and Fatty Acid Compositions in Milk of Dairy Cows
ZHAO Xiaowei, YANG Yongxin, HUANG Dongwei, ZHAO Huiling, CHENG Guanglong*
(Institute of Animal Sciences and Veterinary Medicine, Anhui Academy of Agricultural Sciences, Hefei 230031, China)
Abstract:Purpose: The study was carried out to investigate the correlation between somatic cell count (SCC) and the profi le of fatty acids in milk of dairy cows. Methods: Four hundred and seventy four milk samples from early lactating (30–100 days) dairy cows with no clinical mastitis were determined for SCC and milk fatty acids. The effect of S CC on the contents of milk fatty acids and the correlation between SCC and milk fatty acids were analyzed by the software SAS 9.0. Resul ts: SCC had a signifi cant effect on C 16:1, cis9, trans11-CLA and C 18:3 n3(P < 0.01). The relative levels of polyunsaturated fatty acids (PUFA) were signifi cantly positively correlated with SCC in milk (P < 0.05), but a signifi cantly negative correlation was found between SCC and short-chain fatty acids (SCFA) (P < 0.01). Conclusions: These results reveal a negative correlation between SCC and SCFA in milk of dairy cows.
Key words:somatic cell count; fatty acid; correlation analysis; milk
中图分类号:TS252.2
文献标志码:A
文章编号:1002-6630(2015)08-0167-04
doi:10.7506/spkx1002-6630-201508030
收稿日期:2014-06-13
基金项目:农业科技成果转化资金项目(2013GB2C300216);牛奶品质调控及乳房炎防控技术创新团队项目(14C0403)
作者简介:赵小伟(1985—),男,助理研究员,硕士,研究方向为奶牛营养与饲料。E-mail:xiaowei1986mm@163.com
*通信作者:程广龙(1964—),男,研究员,学士,研究方向为奶牛健康养殖。E-mail:cgl0126@qq.com