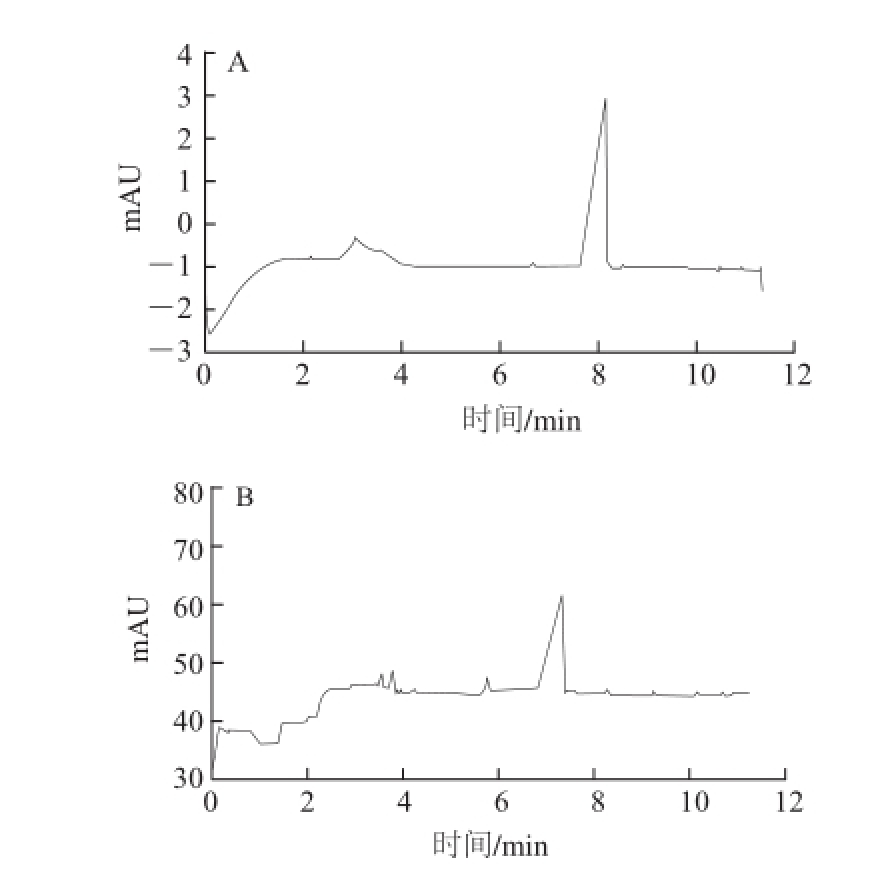
图 1 甲醛次硫酸氢根的DAD(A)和C4D(B)响应
Fig.1 Chromatograms of sodium formaldehyde sulfoxylate
郭启雷,穆同娜,吴燕涛,于晓瑾,宋 杰,周 靖,杨红梅
(国家食品质量安全监督检验中心,北京 100094)
摘 要:采用毛细管电泳-非接触式电导检测器,建立小麦粉、粉丝中非食用物质甲醛次硫酸氢钠(吊白块)残留的直接测定方法。本方法无需将甲醛次硫酸氢钠转化为甲醛,其测定结果不受食品中甲醛本底含量的干扰。本方法采用水超声提取,甲醛次硫酸氢钠在1.00~200 μg/mL质量浓度范围内呈线性关系(r 2=0.999 8),在小麦粉、粉丝中的定量限为10 mg/kg;加标量为20~100 mg/kg时,加标回收率为84.0%~94.7%,相对标准偏差小于5%。本方法操作简单、快速,准确可靠,为小麦粉和粉丝中甲醛次硫酸氢钠的检测提供了新的技术手段。
关键词:毛细管电泳;非接触式电导检测器;甲醛次硫酸氢钠;直接测定
甲醛次硫酸氢钠(NaHSO 2CH 2O·2H 2O)俗称吊白块或雕白粉,是一种白色块状或结晶性粉粒的有机化合物,甲醛次硫酸氢钠在高温及低酸条件下会分解为甲醛和二氧化硫等有害物质,具有强还原性,主要作为印染工业中的拔色剂、橡胶合成及制糖工业中的漂白剂 [1]。人若误食甲醛次硫酸氢钠则会产生喷嚏、咳嗽、视物模糊、头晕、上腹痛、呕吐、呼吸困难等甲醛急性中毒症状,一次性食用10g就会有生命危险 [2-4]。国家已明令禁止将甲醛次硫酸氢钠加入食品中,近年来一些不法商贩在经济利益的驱使下将其违法添加在腐竹、粉丝、面粉、竹笋等食品中,以达到改善感观性状、漂白、防腐的作用,严重损害了消费者的身体健康 [5-7]。
目前对甲醛次硫酸氢钠的检测有间接法 [8-11]和直接法 [12-13]。间接法是在酸性条件下,将甲醛次硫酸氢钠转化为甲醛和二氧化硫,再用分光光度或高效液相色谱的方法检测甲醛,折算成甲醛次硫酸氢钠的质量。对于测定结果的判定,要同时考虑样品中甲醛和二氧化硫的本底值,同时还要考察二者的比例是否与1∶1的理论值相吻合 [14-15]。这种方法不但费时费力,而且甲醛、二氧化硫的测定受到很多因素的干扰。在现有相关检测方法中,GB/T 21126—2007《麦粉与大米粉及其制品中甲醛次硫酸氢钠含量的测定》 [16]中规定甲醛含量不超过10 μg/g时,报告结果为未检出。DB35/T 638—2005《腐竹中次硫酸氢钠甲醛的测定》 [17]中规定当腐竹中甲醛含量≤20 mg/kg,视为未检出。直接法是采用离子色谱法直接测定甲醛次硫酸氢根,比如安徽省地方标准DB34/T 1108—2009《米线中甲醛次硫酸氢钠(吊白块)的测定:离子色谱法》 [18]。直接法的优势在于可以直接测定目标化合物,而不必通过转化再折算的步骤,同时检测结果不受样品本底的干扰。通过对该方法的实验室内验证发现,该方法对标准品的测定没有问题,线性和灵敏度都能满足要求,但在实际样品的加标实验中发现,空白样品的提取液加标后,其响应与纯溶剂配制的标准溶液相比降低很多,而且降低的幅度并没有一个稳定的趋势,在实际样品测定时,加标回收率往往不能满足检测要求。
本实验采用毛细管电泳-非接触式电导检测器(capacitively coupled contactless conductivity detection,CE-C4D)探索建立甲醛次硫酸氢钠的直接测定方法,利用CE的高效分离和C4D的通用性和高灵敏度实现了甲醛次硫酸氢钠的直接检测,将该方法应用于小麦粉、粉丝样品,为食品中添加非食用物质的非法行为的监管提供了技术手段。
1.1 材料与试剂
一水合柠檬酸(分析纯) 西陇化工股份有限公司;甲醛次硫酸氢钠(纯度≥98.0%) 美国Aldrich公司。
1.2 仪器与设备
7100毛细管电泳仪(配有二极管阵列检测器(diode array detector,DAD)) 美国Agilent公司;非接触式电导检测器(ER125 C4D检测器、ET120 C4D探头)澳大利亚eDAQ公司;AB 265-S电子天平(感量0.000 1、0.01 g) 梅特勒-托利多仪器(上海)有限公司;未涂层石英毛细管(75 μm×68.5 cm,C4D有效长度54 cm,DAD有效长度60 cm) 美国MicroSolv公司;Milli-Q纯水系统 美国Millipore公司;HY-5回旋振荡器国华电器有限公司;KQ5200超声波清洗器 昆山市超声仪器有限公司。
1.3 方法
1.3.1 色谱条件
CE条件:未涂层石英毛细管;操作温度:25 ℃;分离缓冲溶液:10 mmol/L柠檬酸溶液;分离电压:-15 kV;进样压力:50 mbar;进样时间:5 s;检测波长:210 nm。每次开机后用0.1 mol/L的NaOH溶液冲洗5 min,水冲洗5 min,运行缓冲液冲洗20 min,2 次进样之间依次用0.1mol/L NaOH、水、运行缓冲液冲洗2 min。
C4D条件:Multiplier 1 000 mAU/V、频率900 MHz、振幅100%、增益1、探头增益:关。
1.3.2 标准曲线的制备
准确称取0.1 g(精确至0.000 1g)甲醛次硫酸氢钠标准品,用水溶解并定容至100 mL棕色容量瓶中,配制成1.00 mg/mL的标准储备液。然后用水稀释成质量浓度为1.00、2.00、5.00、10.0、20.0、50.0、100.0、200.0 μg/mL的系列标准工作溶液,经0.45 μm水相滤膜过滤后经CE-C4D测定,峰面积对质量浓度作图。
1.3.3 样品处理
称取样品10 g(精确至0.01 g)于250 mL具塞三角烧瓶中(粉丝样品需预先粉碎并混合均匀),加入100 mL水,摇匀后超声提取20 min,静置后取上清液依次经滤纸、0.45 μm水相滤膜,供CE-C4D测定。
2.1 甲醛次硫酸氢根离子的确定
以10 mmol/L柠檬酸为运行缓冲液,-15 kV分离电压的条件下,串联的C4D和DAD分别记录到一个色谱峰信号(图1),提取DAD记录该色谱峰的紫外吸收光谱图(图2a)。另外,由紫外分光光度计扫描得到甲醛次硫酸氢钠标准溶液的紫外吸收光谱图(图2b),二者与文献[19]记载的甲醛次硫酸氢根的紫外吸收光谱图相同,以此确认图1中的色谱峰为甲醛次硫酸氢根离子的响应。

图 1 甲醛次硫酸氢根的DAD(A)和C4D(B)响应
Fig.1 Chromatograms of sodium formaldehyde sulfoxylate
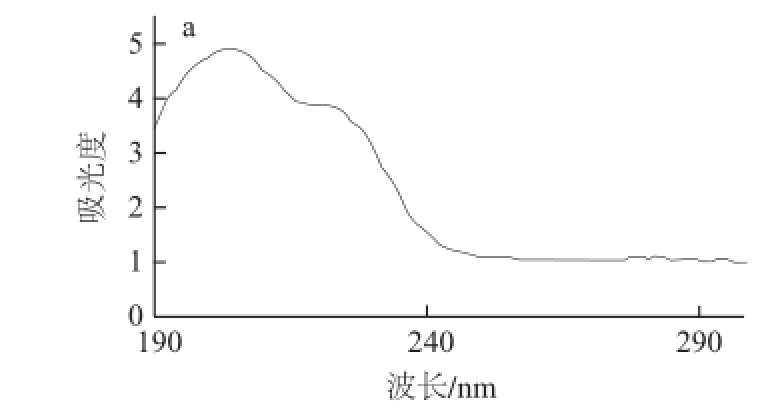
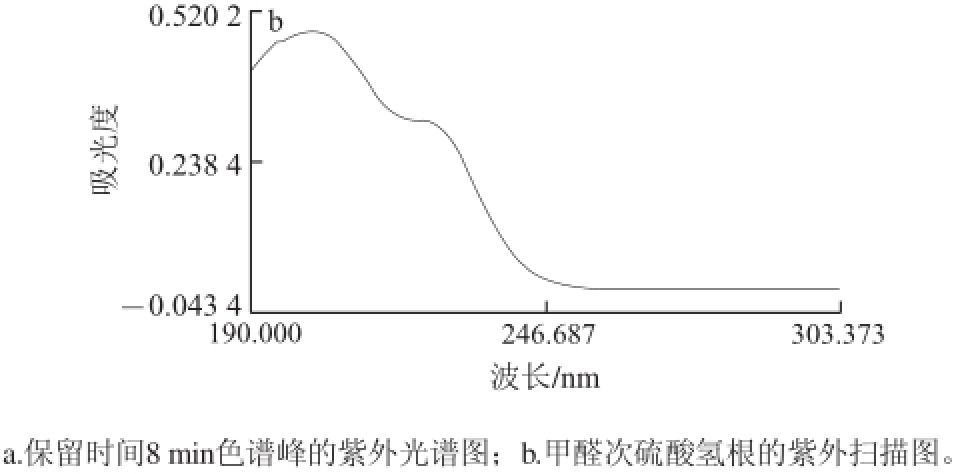
图 2 甲醛次硫酸氢根的紫外吸收图
Fig.2 Chromatographic peak at 8 min retention time and UV spectrum of sodium formaldehyde sulfoxylate
在实验条件下,几种常见阴离子N
 、N
、N
 、SCN
-、Br
、SCN
-、Br
 、S
、S
 、Cl
、Cl
 、S
、S
 、Cl
-的出峰情况如图3所示,它们与甲醛次硫酸氢根离子的出峰时间均不重叠。在所选实验条件下,F
-、P
、Cl
-的出峰情况如图3所示,它们与甲醛次硫酸氢根离子的出峰时间均不重叠。在所选实验条件下,F
-、P
 的出峰比上述离子都要延后,甲醛未出峰。
的出峰比上述离子都要延后,甲醛未出峰。
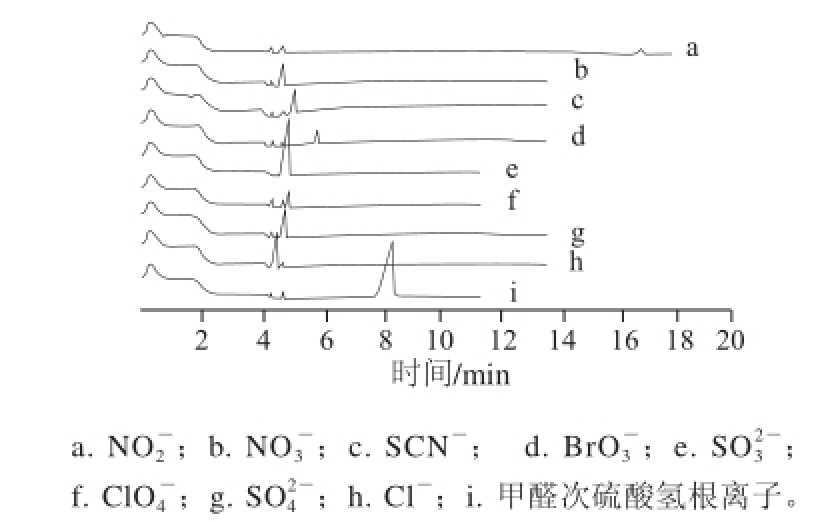
图 3 相关离子的色谱图
Fig.3 Chromatograms of common anions
2.2 甲醛次硫酸氢根离子的稳定性研究
文献[12]中提到甲醛次硫酸氢钠在温度大于60 ℃时开始分解,在碱性和中性条件下相对较稳定,在低酸性条件下迅速分解。为研究甲醛次硫酸氢钠在实验条件下的稳定性,本研究分别以水和10 mmol/L柠檬酸溶液为溶剂,配制了甲醛次硫酸氢钠标准溶液,在本课题的实验条件下分别连续进样8 次,以第一针的色谱峰面积为100%,计算每一针的相对峰面积,甲醛次硫酸氢钠的衰减趋势如图4所示。甲醛次硫酸氢钠的保留时间加上两针之间的平衡时间6 min,则相邻两针的时间间隔为13 min左右。从图4可以看出,甲醛次硫酸氢钠的水溶液在前6 次进样,即1 h左右的时间内是稳定的,基本没有衰减。而在10 mmol/L柠檬酸溶液中,甲醛次硫酸氢根离子有较为明显的衰减,对前4 次进样的数据进行线性拟合,得到线性方程为A=9.862 4C+107.91(r 2=0.971 7),由第一次进样的峰面积100%与纵坐标的截距107.91%相比较,由此估算在一次进样分析的8 min时间内,甲醛次硫酸氢根离子在10 mmol/L柠檬酸溶液中衰减约7.3%。与文献[20]中的数据相比,显示出相同的趋势。
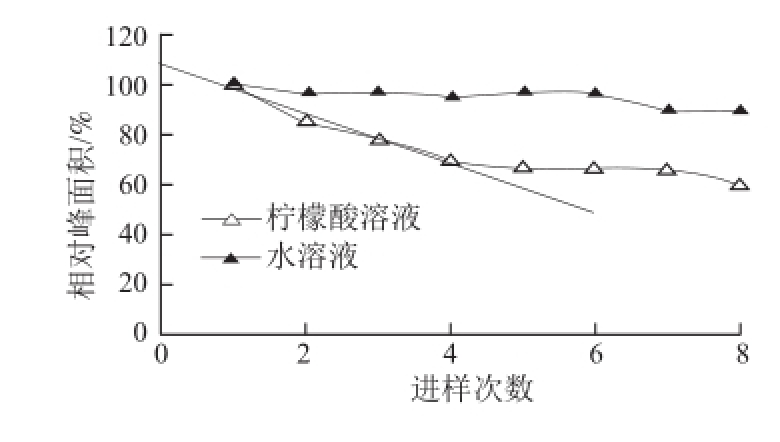
图 4 甲醛次硫酸氢根的稳定性研究
Fig.4 Stability of hydroxymethane sulphinate
2.3 提取条件的选择

图 5 小麦粉加标(a)和空白(b)样品色谱图
Fig.5 Chromatograms of spiked (a) and blank (b) samples of wheat flour
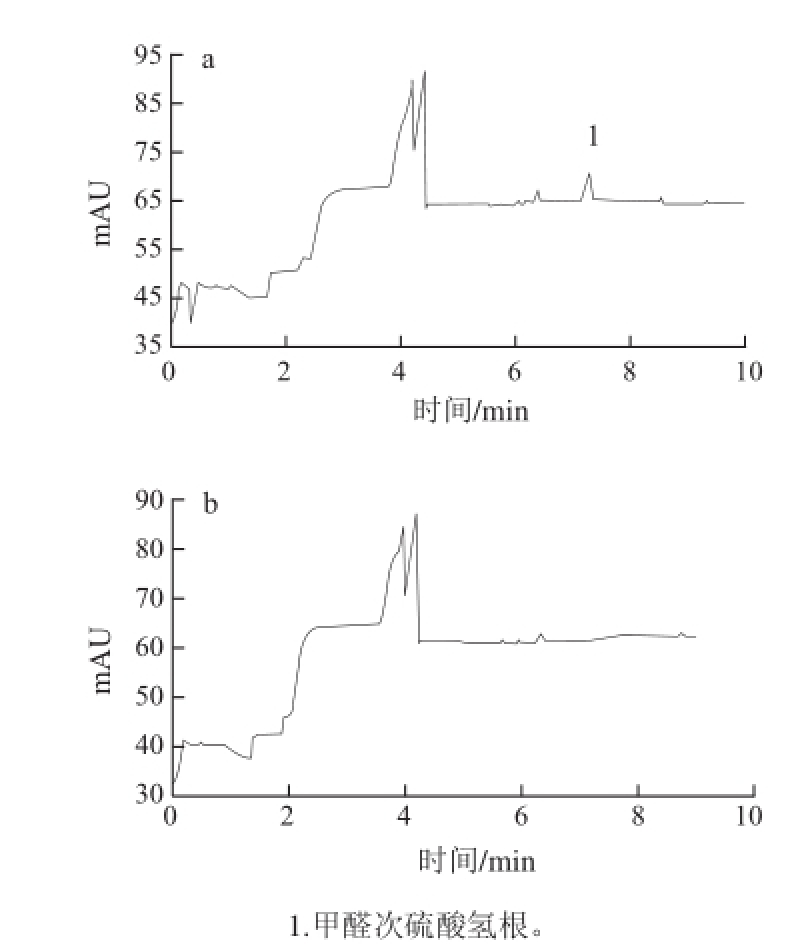
图 6 粉丝加标(a)和空白(b)样品色谱图
Fig.6 Chromatograms of spiked (a) and blank (b) samples of bean starch noodles
在离子色谱直接测定甲醛次硫酸氢钠的文献 [12-13]中,均采用0.1 mol/L NaOH溶液为提取溶剂,C 18固相萃取柱净化。在本课题研究中,从图4可以看出,在一个分析周期内,甲醛次硫酸氢钠在水溶液中是稳定;同时,小麦粉用0.1mol/L NaOH溶液提取,提取液十分混浊,难以过滤,因此本实验选用水作为提取溶剂。从图5、6可以看出,即使没有用C 18固相萃取柱净化,仍然得到了良好的分离效果。
2.4 检出限、线性范围和回收率
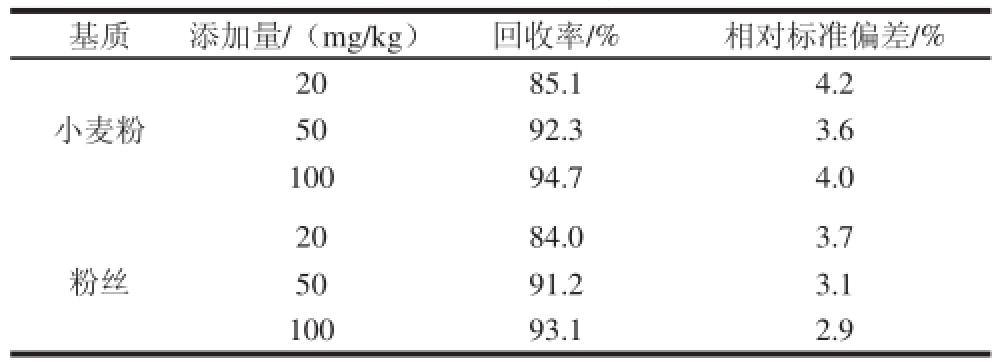
在空白样品中添加一定量的标准工作溶液,按照上述实验方法进行处理,用CE-C4D测定,以信噪比为10计算本方法的定量限为10 mg/kg。按照1.3.2节制备系列标准工作溶液,按质量浓度由低到高依次经CE-C4D测定,峰面积对质量浓度作图,得到甲醛次硫酸氢钠的线性方程A=1.761 5C-0.309,r 2=0.999 8,线性范围1.00~200 μg/mL。采用经测定不含有甲醛次硫酸氢钠的小麦粉和粉丝样品,进行添加回收和精密度实验,加标量为20、50、100 mg/kg,按1.3.3节方法进行处理,用CE-C4D进行测定。平均添加回收率(每个添加实验平行测定5 次)为84.0%~94.7%,相对标准偏差小于5%,结果见表1。
表 1 回收率实验结果(n=5)
Table 1 Results of recovery tests (n= 5)
基质添加量/(mg/kg)回收率/%相对标准偏差/%小麦粉2085.14.2 5092.33.6 10094.74.0粉丝2084.03.7 5091.23.1 10093.12.9
甲醛在自然界中天然存在,在各种食品中都有一定的本底值 [21-23]。食品中的甲醛主要来源于3个方面 [24],动植物生长过程中细胞的生理代谢、加工过程中食物成分的分解、食品接触材料的分解迁移。因此传统的甲醛次硫酸氢钠间接检测方法,将吊白块转化为甲醛进行测定,无法区分食品中的甲醛本底与甲醛次硫酸氢钠。间接方法在测出一定含量的甲醛后,通常需要再检测二氧化硫的值,结合甲醛和二氧化硫的比例进行判断。但二氧化硫本身在食品中也有一定的本底,同时加工食品中有时会添加亚硫酸氢盐作为食品添加剂,因此传统的间接方法不但操作复杂,而且影响结果判定的因素很多且不确定。甲醛次硫酸氢钠整体测定的方法有离子色谱法和单扫描极谱法 [25],离子色谱法灵敏度高,但对于实际样品的测定效果并不理想,单扫描极谱法目前尚不成熟,前处理方法还不能去除基质中的干扰物质。
本研究建立了小麦粉、粉丝中非食用物质甲醛次硫酸氢钠残留的直接测定方法。本方法采用毛细管电泳分离,电容耦合非接触式电导检测器直接检测甲醛次硫酸氢根离子,无需将样品转化为甲醛,其测定结果不受食品中甲醛本底含量的干扰,同时样品经提取后可直接上机测定,无需通过固相萃取净化、操作简单、准确可靠,为小麦粉和粉丝中甲醛次硫酸氢钠的检测提供了新的技术手段。
参考文献:
[1] 林丹, 陆文英, 赖艳, 等. 从食品中甲醛的来源试论甲醛次硫酸氢钠测定方法的缺陷及补救措施[J]. 山东农业大学学报: 自然科学版, 2010, 41(4): 531-533.
[2] 麦妙, 何耀湘. 粉类及其制品中甲醛次硫酸氢钠的含量测定[J]. 中国药业, 2013, 22(12): 85-86.
[3] 韩飞, 崔淑莲, 曹智启, 等. 离子色谱法测定水产品中甲醛次硫酸氢钠含量[J]. 理化检验: 化学分册, 2013, 49(5): 531-534.
[4] 李银花, 孙丽娜. 吊白块在食品中检测方法的研究[J]. 乳品加工, 2007(8): 70-71.
[5] 许丹, 郑创亮, 余泳红, 等. 萝岗区市售食品中添加剂使用情况调查[J].实用预防医学, 2012, 19(9): 1349-1350.
[6] 梁雪金. 南宁市193 份食品中甲醛、甲醛次硫酸氢钠监测结果分析[J].现代预防医学, 2013, 40(18): 3390-3391.
[7] 赵秋艳, 乔明武, 李宁, 等. 市售腐竹安全性的初步分析[J]. 湖北农业科学, 2012, 51(2): 380-381.
[8] 李光, 赵建民, 高中灿, 等. 食品中甲醛合次硫酸氢钠的测定方法探讨[J]. 中国卫生检验杂志, 2006, 16(10): 1261-1263.
[9] 任学坤, 殷微微, 徐文平, 等. 大米粉中吊白块检测方法的研究[J].黑龙江农业科学, 2010(12): 112-114.
[10] 杜燕萍, 杨蓉珠. 食品中甲醛次硫酸氢钠测定方法中的甲醛馏出液与回收率的探讨[J]. 上海预防医学杂, 2003, 15(10): 507-508.
[11] 刘志明, 孟令, 张瑞. 水豆腐中吊白块的检测[J]. 现代食品科技, 2007, 23(11): 75-77.
[12] 钱疆, 黄杰, 卢声宇, 等. 液相电化学方法检测食品中甲醛合次硫酸氢钠[J]. 福建分析测试, 2008, 17(3): 11-14.
[13] 赵士权, 查河霞, 林明珠. 离子色谱法测定水发食品中吊白块残留量[J]. 中国卫生检验杂志, 2007, 17(10): 1787-1788; 1804.
[14] 韩彩轩. 浅谈面制品中甲醛次硫酸氢钠的定性与定量[J]. 中国食品卫生杂志, 1999, 11(1): 17-18.
[15] 何小青, 罗美中, 蓝勇波, 等. 食品中吊白块新的测定方法[J]. 粮油食品科技, 2004, 12(5): 40-41; 47.
[16] 河南工业大学, 国家粮油质量监督检验中心, 陕西省粮油产品质量监督检验所. GB/T 21126—2007 小麦粉与大米粉及其制品中甲醛次硫酸氢钠含量的测定[S]. 北京: 中国标准出版社, 2007.
[17] 福建省粮油质量监测所. DB35/T 638—2005 腐竹中次硫酸氢钠甲醛的测定[S].
[18] 国家农副加工食品质量监督检验中心, 国家农业标准化与监测中心(安徽). DB34/T 1108—2009 米线中甲醛次硫酸氢钠(吊白块)的测定: 离子色谱法[S].
[19] RALF S, VERA M. Sulphur compounds CLIX. Determination of dithionite (S 2O 4 2-) and hydroxymethanesulphinate (HOCH 2SO 2 -;Rongalite) by ion-pair chromatography[J]. Journal of Chromatography A, 1992, 623(1): 174-177.
[20] 曹呈勇, 卿荣, 史炎, 等. 甲醛合次硫酸氢钠氧化反应速率常数的测定[J]. 华西药学杂志, 2005, 20(5): 399-400.
[21] 安利华, 孙群, 郑万源. 东海地区常见水产品甲醛本底值调查及含量分析[J]. 中国食品卫生杂志, 2005, 17(6): 524-527.
[22] 郭会芝, 徐静清, 赵菲琦, 等. 几种常见食品中甲醛本底值的调查研究[J]. 中国食品卫生杂志, 2003, 15(4): 338-339.
[23] 都薇, 杨秀兰, 陆美斌, 等. 小麦粉中甲醛本底值的测定[J]. 食品科学, 2007, 28(4): 270-272.
[24] 张文德. 甲醛的来源与检测意义[J]. 中国食品卫生杂志, 2006, 18(5): 455-459.
[25] 向仕学, 汤晓勤, 罗维. 粮食制品中甲醛合次硫酸氢钠的极谱分析[J].中国食品卫生杂志, 2000, 12(5): 18-19.
Determination of Sodium Formaldehyde Sulfoxylate Residues in Wheat Flour and Bean Starch Noodles by Capillary Electrophoresis-Contactless Conductivity Detection
GUO Qilei, MU Tongna, WU Yantao, YU Xiaojin, SONG Jie, ZHOU Jing, YANG Hongmei
(National Food Quality & Safety Supervision and Inspection Center, Beijing 100094, China)
Abstract:A novel method was developed to determine sodium formaldehyde sulfoxylate residues in wheat flour and starch noodles without degradation. The samples were extracted ultrasonically with water and the extracted analytes were separated by capillary electrophoresis (CE) in combination with capacitively coupled contactless conductivity detection (CE-C4D). Under optimal conditions, the linear range was 1.00–200 μg/mL (r 2= 0.999 8), and the limit of detection for both food matrices was 10 mg/kg. Recoveries varying from 84.0% to 94.7% with a relative standard deviation (RSD) smaller than 5% were achieved for the analyte spiked between 20 and 100 mg/kg. The proposed method was simple and rapid. It has beensuccessfully applied for analysis of sodium formaldehyde sulfoxylate in wheat flour and bean starch noodles.
Key words:capillary electrophoresis; contactless conductivity detection; sodium formaldehyde sulfoxylate;direct determination
中图分类号:TS207.3
文献标志码:A
文章编号:1002-6630(2015)08-0216-04
doi:10.7506/spkx1002-6630-201508040
收稿日期:2014-07-05
基金项目:北京市科技计划项目(Z111100056811006);质检总局公益性行业科研专项(2012104003-2)
作者简介:郭启雷(1979—),男,研究员,博士,研究方向为食品安全。E-mail:guo-ql@163.com