高效液相色谱法同时测定保健食品中11种功效成分
陈毓芳,林海丹,吴宏中,金 梦,宋 阳,梁小茹,谢玉珊,官咏仪
(广东出入境检验检疫局检验检疫技术中心,广东 广州 510623)
摘 要:建立高效液相色谱同时测定保健食品中11 种功效成分的高通量分析方法。样品前处理采用甲醇-水-磷酸溶液提取,对油脂样品则采用甲醇-水-磷酸溶液与正己烷液液萃取除脂。采用Agilent TC-C
18色谱柱(250 mm×4.6 mm,5μm),乙腈-2 g/L辛烷磺酸钠溶液(加入1 mL磷酸)作为流动相,流速1.0 mL/min,梯度洗脱,用二极管阵列检测器串联荧光检测器检测,外标法峰面积定量。VB
2在0.25~25 mg/L、VB
6在0.5~20 mg/L、烟酸、烟酰胺在1~100 mg/L、其余5 种功效成分在0.5~50 mg/L质量浓度范围内线性良好,相关系数r为0.999 1~1.000 0。在样品中待测成分含量约0.5、1 倍和2 倍3 个水平的添加回收率为86.4%~110%之间,相对标准偏差为0.21%~11.7%。方法的定量限:烟酸、烟酰胺为20 mg/kg,其余9 种功效成分方法的定量限为10 mg/kg。
关键词:高效液相色谱法;水溶性维生素;吡啶甲酸铬;褪黑素;红景天苷
VB
1(硫胺素)、VB
2(核黄素)、VB
6(吡哆醇、吡哆醛、吡哆胺)、烟酸、烟酰胺、吡啶甲酸铬、褪黑素、咖啡因、红景天苷作为保健食品的功效成分,对多种疾病的预防治疗有重要的辅助作用。这些功效成分在生产中根据需求的不同,可能单独或同时加入到一种保健食品中。如褪黑素经常与VB
6一起使用,用于治疗失眠症;VB
1、VB
2、VB
6、烟酸、烟酰胺与吡啶甲酸铬同时存在多种营养素片中,作为营养补充剂。因此,多种功效成分被同时添加入一种保健食品中的现象较为普遍。但这些物质对于人体只能适量使用,缺乏和超量都是有害的,研究建立同时检测维生素及其他功效成分的多成分同时检测分析方法显得尤其重要。
现有的大部分分析方法仅能检测其中一种或较少几种功效成分。检测方法主要有微生物法
[1]、荧光分光光度法
[2-3]、毛细管电泳法
[4]、液相色谱-质谱法
[5-6]、液相色谱法
[7-23]。其中,液相色谱法应用最为广泛。如高效液相色谱(high performance liquid chromatography,HPLC)法测定保健食品中红景天苷的含量
[7-8],HPLC法测定保健食品中褪黑素含量
[16],HPLC法测定保健食品中的吡啶甲酸铬含量
[17-23],HPLC-荧光法测定保健食品中VB
2含量
[3],HPLC法同时测定保健食品中几种水溶性维生素
[10-12],HPLC法测定保健食品中VB
6和褪黑素
[15]等。方法中能同时检测的组分较少,比如GB/T 5009.197—2003《保健食品中盐酸硫胺素、盐酸吡哆醇、烟酸、烟酰胺和咖啡因的测定》
[14]只能测定保健食品中的VB
1、吡哆醇、烟酸、烟酰胺、咖啡因5 种物质。其中,检测VB
1时所用流动相和其他几种维生素不同,需更换流动相重新进样分析,增加分析时间和检测费用,且只检测VB
6三种组分中的吡哆醇,不能全面准确地反映VB
6的含量。有关VB
1、VB
2、VB
6(吡哆醇、吡哆醛、吡哆胺)、烟酸、烟酰胺、吡啶甲酸铬、褪黑素、咖啡因、红景天苷11 种功效成分同时测定的文献至今未见报道。
本实验参照GB/T 5009.197—2003现有的多组分分析的提取技术,采用新的液相色谱流动相体系,以及梯度洗脱的方法,二极管阵列检测器(photo-diode array,PDA)多通道多波长检测,同时串联荧光检测器(fluorescence detector,FLD),对有荧光的物质VB
2、VB
6(吡哆醇、吡哆胺、吡哆醛)及褪黑素同时采用FLD多通道多波长检测,一次进样能同时分析VB
1、VB
2、VB
6(吡哆醇、吡哆胺、吡哆醛)、烟酸、烟酰胺、咖啡因、吡啶甲酸铬、褪黑素、红景天苷11种组分。方法的重复性好、灵敏度高、成本低、简单快速,能满足实际检测的需要。
本工作选择多种维生素片、保健饮料作为代表基质复杂的保健食品样品进行实验,考察不同提取溶剂提取方法对11 种功效成分的提取效率,同时应用PDA与FLD串联技术,采用梯度洗脱方法,HPLC法准确定量检测11种功效成分:VB
1、VB
2、VB
6(吡哆醇、吡哆醛、吡哆胺)、烟酸、烟酰胺、吡啶甲酸铬、褪黑素、咖啡因、红景天苷。
1 材料与方法
1.1 材料与试剂
甲醇、乙腈、辛烷磺酸钠(均为色谱纯) 美国Tedia公司;磷酸(分析纯) 广州分析试剂厂;VB
1(纯度≥99%)、VB
2(纯度≥98%)、吡哆醇(纯度≥98%)、吡哆醛(纯度≥99%)、吡哆胺(纯度≥98%)、烟酸(纯度≥98%)、烟酰胺(纯度≥99.5%)、褪黑素(纯度≥98%)、吡啶甲酸铬(纯度≥98%)、红景天苷(纯度≥98%) 美国Sigma公司;咖啡因(纯度≥99%) 德国DR公司。
吡哆醛、吡哆醇、吡哆胺、烟酸、烟酰胺、红景天苷、咖啡因标准贮备液(1 mg/mL):称取0.05 g(精确至0.000 1 g)吡哆醛、吡哆醇、吡哆胺、烟酸、烟酰胺、红景天苷、咖啡因(经80 ℃干燥4 h)标准品,分别置于50 mL容量瓶中,用水溶解定容。
VB
1标准贮备液(500 µg/mL):称取相当于硫胺素0.05 g(精确至0.000 1 g)的VB
1标准品,置于100 mL容量瓶,用0.01 mol/L盐酸溶液溶解定容;VB
2标准贮备液(250 mg/L):称取0.025 g(精确至0.000 1 g)的VB
2标准品,置于100 mL容量瓶中,用盐酸(1+1)溶液2 mL超声溶解后,立即用水转移并定容至100 mL;褪黑素标准贮备液(1 mg/mL):称取0.05 g(精确至0.000 1 g)褪黑素标准品,分别置于50 mL容量瓶中,用甲醇(1+1)溶液溶解定容;吡啶甲酸铬标准贮备液(500 mg/L):称取0.025 g(精确至0.000 1 g)吡啶甲酸铬标准品,置于50 mL容量瓶中,用甲醇(1+1)溶液溶解定容,如有少量残渣,可使用超声波加速溶解;取适量标准储备液,用提取液配成适当质量浓度的混合标准工作溶液。流动相A:乙腈;流动相B:称2 g辛烷磺酸钠加水至1 L溶解,加入1 mL磷酸,过滤备用。提取液:甲醇-水-磷酸(100∶400∶0.5,V/V)。
1.2 仪器与设备
HPLC仪(配PDA、FLD和Empower色谱工作站)美国Waters公司;3-16PK离心机 德国Sigma公司;超声波振荡器 德国IKA公司;往复振荡器、Mill-Q超纯水器 美国Millipore公司。
1.3 方法
1.3.1 样品前处理
固相样品:准确称取适量打碎并混合均匀的样品于50 mL带刻度离心管中,加入提取液溶解并定容至50 mL,使各待测物的质量浓度范围在标准曲线的线性范围内,摇匀,超声振荡提取5 min,放往复振荡器上振荡20 min,在4 000 r/min离心5 min,取清液层过0.45 μm滤膜,供HPLC测定。
液体样品:准确称取适量混合均匀的样品于50 mL带刻度离心管中,加入提取液溶解并定容至50 mL,使各待测物的质量浓度范围在标准曲线的线性范围内,摇匀,超声振荡提取5 min,放往复振荡器上振荡20 min后,在4 000 r/min离心5 min,取清液层过0.45 μm滤膜,供HPLC测定。
含油脂样品:准确称取适量打碎并混合均匀的样品于50 mL带刻度离心管中,加入提取液溶解并定容至50 mL,使各待测物的质量浓度范围在标准曲线的线性范围内,摇匀,加入2 mL正己烷,超声振荡提取5 min,放往复振荡器上振荡20 min后,在4 000 r/min离心5 min,弃去上层正己烷,加入正己烷重复萃取1 次,下层清液用提取液定容至50 mL,过0.45 μm滤膜,供HPLC测定。
1.3.2 色谱条件
色谱柱:Agilent TC-C
18柱(250 mm×4.6 mm,5μm);流动相:乙腈(A)- 2 g/L辛烷磺酸钠溶液+1 mL磷酸(B);梯度洗脱程序:0~5.00 min,3%~10% A;5.00~8.00 min,10%~18% A;8.0~11.0 min,18%~18% A;11.0~18.0 min,18%~34% A;18.0~20.0 min,34%~34% A;20.0~25.0 min,34%~40% A;25.1 min,3% A。流速:1.0 mL/min;柱温:30 ℃;进样量:10 μL;PDA检测波长:200、260 nm。FLD激发/发射波长:293 nm/395 nm;462 nm/522 nm。
2 结果与分析
2.1 提取溶液的选择
实验测定的11 种功效成分的性质相差较大。例如,VB
1易溶于水,VB
2微溶于水,VB
6溶于水,在酸性介质中稳定。褪黑素溶于乙醇,溶于酸水,在水中的溶解度为800 mg/L;咖啡因易溶于稀酸,微溶于乙醚;红景天苷极易溶于水,易溶于甲醇;吡啶甲酸铬微溶于水。考察11种成分在水或极性强的有机溶剂中溶解的性质,但在酸性提取液中的稳定性有待进一步实验。
为了测试待测物质的稳定性,用甲醇-水-磷酸(100∶400∶0.5,V/V)提取液配制的混合标准溶液放置不同时间后进行检测。结果表明11 种组分都有较好稳定性,工作溶液在连续3 d的检测中,11种组分含量没有明显变化,15 d后10 mg/L标准液在提取液中吡啶甲酸铬含量为原值的77.7%,红景天苷约为75.0%,其余成分的含量变化小于5%,故考虑采用GB/T 5009.197—2003保健食品中盐酸硫胺素、盐酸吡哆醇、烟酸、烟酰胺和咖啡因的测定方法的提取溶液甲醇-水-磷酸(100∶400∶0.5,V/V)提取。
实验中考察提取溶液对吡啶甲酸铬、VB
2、吡哆醛、吡哆胺、褪黑素、红景天苷的提取能力,并比较GB 5413.12—2010《婴幼儿食品和乳品中VB
2的测定》、GB 5413.13—2010《婴幼儿食品和乳品中VB
6的测定》、GB/T 5009.195—2003《保健食品中吡啶甲酸铬含量的测定》、GB/T 5009.170—2003《保健食品中褪黑素含量的测定》及保健食品检验技术规范(2003年版)中保健食品中红景天苷含量的测定的提取和检测。采用各自方法中所用的提取溶液分别对样品中VB
2、吡哆醛、吡哆胺、吡啶甲酸铬、褪黑素、红景天提取检测,以样品测得值作为考察指标。不同提取溶剂及检测方法结果比较见表1。
表 1 保健食品中6 种功能成分的提取溶液比较(n=6)
Table 1 Comparison of different extraction solvents for 6 functional components in health foods (n= 6)

标准方法提取溶液测得值/(mg/kg)吡啶甲酸铬红景天苷VB
2吡哆醛褪黑素吡哆胺GB/T 5009.197—2003甲醇-水-磷酸(100∶400∶0.5,V/V)1.20×10
23.10×10
21.06×10
39.96×103.40×10
38.02×10 GB/T 5009.170—2 003甲醇—3.09×10
2——3.38×10
3—GB/T 5009.195—2003甲醇-水(1∶1,V/V)1.21×10
23.10×10
21.03×10
3—3.36×10
3—GB 5413.12—20100.1 mol/L盐酸溶液1.18×10
2—1.03×10
39.99×10—8.02×10 GB 5413.13—2010水——9.98×10—8.22×10
表1表明,此提取溶液提取VB
2、吡哆醛、吡哆胺、吡啶甲酸铬、褪黑素、红景天苷的效果与国标及保健食品检验技术规范的检测方法没有显著性差异,符合GB/T 27404—2008《实验室质量控制规范:食品理化检测的检测要求》,表明甲醇-水-磷酸(100∶400∶0.5,V/V)提取溶液适合保健食品中VB
2、吡哆醛、吡哆胺、吡啶甲酸铬、褪黑素、红景天苷的提取。
2.2 超声时间的选择
虽然GB/T 5009.197—2003采用液相色谱法测定保健食品中的VB
1、吡哆醇、烟酸、烟酰胺、咖啡因5 种物质时选择超声5 min,但考虑增加了6 种性质有差异的物质,为了确保提取完全,实验考察了超声波时间对待测组分溶解效率的影响,分别以5、10、15、20 min 4 个超声时间测试,以样品测得值作指标,实验表明超声5 min后,测得值几乎不变。结果表明:5 min提取时间已满足检测需要,故仍选择5 min超声时间。
2.3 脱脂实验结果
研究含脂类物质中提取效率,在样液中加入正已烷,进行脱脂实验,结果表明,对于有些含脂类物质,在使用正已烷脱脂后,VB
2的测得值增加,更加接近国标值,而其他成分影响甚微。实验表明,正已烷能更好地溶解和分散脂类物质,从而使VB
2溶出更完全。
2.4 色谱条件的优化结果
本实验考察流动相的组成、pH值、梯度洗脱条件,以及Cloversil C
18、Discovery C
18、Ecosil C
18、Agilent HCC
18、Agilent TC-C
18等不同的色谱柱对11 种组分的保留行为和分离度的影响。实验表明采用Agilent TC-C
18,乙腈-2 g/L辛烷磺酸钠溶液(pH (2.1±0.1))梯度洗脱得到较好地分离。水相中加入磷酸进行实验,结果表明随着酸度的增加,色谱峰形和分离度得到改善,当调至pH值不高于2.3时峰形和分离度理想,综合考虑柱子对酸度的耐受性和酸度对待测物响应值的影响,因此采用乙腈-2 g/L辛烷磺酸钠溶液(pH 2.1)作为流动相,既保护色谱柱又获得好的分离效果。11 种功效成分的液相色谱图见图1(峰编号同表2成分编号)。
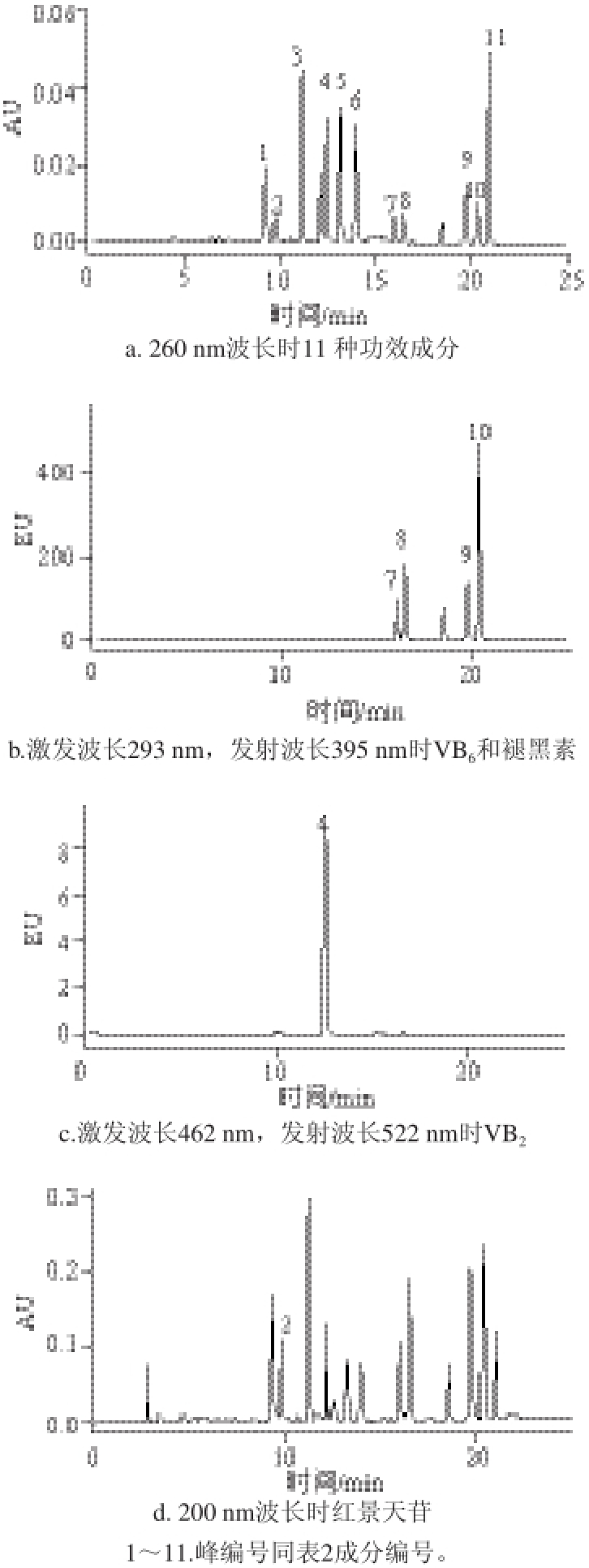
图 1 11 种功效成分标准的液相色谱图
Fig.1 Chromatograms of 11 functional components standards
2.5 检测器和波长的选择
本实验考虑到几种物质的最大吸收波长各不相同,同时考虑VB
2、VB
6(吡哆醇、吡哆胺、吡哆醛)及褪黑素具有荧光,且激发和发射波长也不尽相同,故采用PDA串联FLD多通道多波长的检测方法,检测器及波长选择见表2。其中VB
2及褪黑素还可同时采用PDA检测器选择260 nm波长定性和定量,以达到最灵敏最准确的检测结果。
2.6 线性范围
分析提取液配成的系列混合标准工作溶液,以峰面积(Y)-质量浓度(X)作校正曲线,得到线性回归方程,线性关系良好,相关系数均大于0.999,结果见表2。
表 2 方法的线性方程和相关系数
Table 2 Regression equations with correlation coefficients and linear ranges for 11 functional components

成分编号系数(r)检测器检测波长/nm时间/min分析物回归方程相关出峰线性范围/(mg/L)19.310吡啶甲酸铬Y=1.35×10
4X-3.47×10
20.999 7PDA2600.50~50.0 29.830红景天苷Y=3.56×10
4X-3.17×10
40.999 8PDA2000.50~50.0 311.231咖啡因Y=2.74×10
4X-8.95×10
10.999 98PDA2600.50~50.0 Y=8.09×10
4X+3.00×10
30.999 8FLR激发462,发射522 0.25~25.0 Y=5.15×10
4X+1.94×10
40.999 8PDA260 513.221烟酸Y=3.16×10
4X+1.39×10
30.999 99PDA2600.50~50.0 613.997烟酰胺Y=3.22×10
4X-1.08×10
30.999 997PDA2600.50~50.0 716.020吡哆醛Y=5.29×10
5X+1.41×10
50.999 1FLR激发293,发射3950.50~20.0 816.470吡哆醇Y=9.75×10
5X-7.49×10
40.999 6FLR激发293,发射3950.50~20.0 919.711褪黑素Y=3.20×10
6X+5.33×10
50.999 9FLR激发293,发射3950.50~50.0 Y=1.15×10
4X-2.25×10
31.000 0PDA260 1020.368吡哆胺Y=3.28×10
6X+3.42×10
50.999 8FLR激发293,发射3950.50~20.0 1120.977VB
1Y=3.02×10
4X-1.70×10
30.999 9PDA2600.50~50.0 412.504VB
2
2.7 回收率、精密度及定量限
表 3 多种维生素片中11 种功效成分的添加回收率和精密度(n=6)
Table 3 Recoveries and precision for 11 functional components in multivitamin tablets (ts (n = 6)

注:组分编号同表2。
组分编号加标量/(mg/kg)测得值/(mg/kg)回收率/%相对标准偏差/%组分编号加标量/(mg/kg)测得值/(mg/kg)回收率/%相对标准偏差/% 00 16728191.11.0716715089.71.00 33343090.30.8533329688.81.32 66674993.04.8466661892.71.55 0129 1 7 02628.90 167183 109 2.61 1674401063.47 333342 1035.11 3336211054.80 666644 96.7 4.47 6669621054.80 00 2 8 00 167162 97.0 0.39 1671681001.40 333323 97.0 0.90 33332497.40.97 666645 96.8 1.48 66663495.21.54 00 3 9 008.90 83.5406 86.4 1.08 16715794.20.87 166.5489 92.9 1.10 33333099.11.20 333656 96.6 2.14 6666721011.45 0300 2.13 4 10 0304 1 6701 601 95.9 0.21 16745389.55.52 3 3303 168 95.1 1.84 33361392.81.81 6 6606 260 94.0 1.48 66663995.91.81 00 5 11 03 574 1.57 1 6705 238 99.6 0.38 3 3306 778 96.2 0.93 6 6609 767 93.0 1.38 6
采用本方法在多种维生素片、保健饮料中各添加3 个水平的11 种混合标准溶液,按方法进行回收率实验,每个添加实验重复测定6 次,计算添加回收率和相对标准偏差。2种基质中11 种功效成分的回收率在86.4%~110%之间,相对标准偏差为0.21%~11.7%,结果见表3、4。方法的准确度和精密度均符合保健食品含量分析的要求
[20]。结果表明,不同基质样品中烟酸、烟酰胺不小于20 mg/kg,其余9 种功效成分含量不小于10 mg/kg水平时,信噪比(R
SN)均大于10,且回收率和精密度满意,因此以烟酸、烟酰胺20 mg/kg,其余9 种功效成分10 mg/kg作为方法的定量限;以信噪比为3计算11 种功效成分的检出限,其中烟酸、烟酰胺为6.0 mg/kg,其余9 种功效成分为3.0 mg/kg。
表 4 保健饮料中11 种功效成分的添加回收率和精密度(n=6)
Table 4 Recoveries and precision for 11 functional components in health drink samples (s (n = 6)

注:组分编号同表2。
组分编号加标量/(mg/kg)测得值/(mg/kg)回收率/%相对标准偏差/%组分编号加标量/(mg/kg)测得值/(mg/kg)回收率/%相对标准偏差/% 00 5049.699.22.785049.899.62.91 1001021021.241001041041.45 20019195.74.9220061892.71.25 00 1 7 00 5050.21003.505054.61094.60 1001101103.911001061061.83 2002051032.2120019798.60.93 00 2 8 00 5017493.01.405049.999.74.89 1002291022.021001041040.86 20032498.72.202002021011.43 0127 3 9 00 2524.497.41.555050.61017.70 5048.496.81.251001091094.31 10091.991.90.772002061033.09 00 4 10 00 5050.31011.425045.390.51.56 1001051053.9110096.096.02.92 2002052052.212002131076.29 00 5 11 00 5048.096.011.7 10099.699.61.62 2002091054.20 6
2.8 实际样品测定结果
采用本方法对10 种样品共30 份(谷物提取物复合片、松果体素片、多种营养素咀嚼片、天然B族维生素片、儿童水果口味软糖、5 种多功能性饮料各3 份)进行测定。其中,谷物提取物复合片中检出了VB
2(1.04×10
3mg/kg)、烟酰胺(1.25×10
3mg/kg)、吡哆醇(1.23×10
3mg/kg)、VB
1(667 mg/kg);松果体素片中检出了烟酰胺(400 mg/kg)、吡哆醇(1.18×10
3mg/kg)、褪黑素(3.39×10
3mg/kg);多种营养素咀嚼片中检出了吡啶甲酸铬(120 mg/kg)、VB
2(330 mg/kg)、烟酰胺(3.77×10
3mg/kg)、吡哆醇(355 mg/kg)、VB
1(300 mg/kg);天然B族维生素片中检出了VB
2(2.98×10
3mg/kg)、烟酰胺(1.52×10
4mg/kg)、吡哆醇(2.56× 10
3mg/kg)、褪黑素(155 mg/kg)、吡哆胺(80.5 mg/kg)、VB
1(2.62×10
3mg/kg);儿童水果口味软糖中检出吡哆胺(688 mg/kg);4种多功能饮料都被检出咖啡因(126~142 mg/kg);烟酰胺(16.1~16.5 mg/kg);吡哆醇(1.21~1.33 mg/kg);褪黑素(1.33×10
3~1.40×10
3mg/kg);1种多功能饮料被检出红景天苷(575 mg/kg)。
3 结 论
本实验研究高效液相色谱法同时检测保健食品中VB
1、VB
2、VB
6(吡哆醇、吡哆醛、吡哆胺)、烟酸、烟酰胺、吡啶甲酸铬、褪黑素、咖啡因、红景天苷11 种功效成分。通过对前处理条件和高效液相色谱条件的优化,建立合理、可靠的且能同时检测保健食品中11 种功效成分的液相色谱测定方法。该方法对11 种功效成分分离效果好,以信噪比为3计算11种功效成分的检出限,其中烟酸、烟酰胺为6.0 mg/kg,其余9 种功效成分为3.0 mg/kg;以信噪比为10的条件下,计算11 种功效成分的定量限,烟酸、烟酰胺为20 mg/kg,其余9 种功效成分为10 mg/kg。方法操作简便,结果准确可靠,能满足对保健食品中VB
1等11 种功效成分同时检测的监控需求
[23]。
参考文献:
[1] 王为黎, 马景宏, 张旭, 等. 运用微生物法测定保健食品中的维生素B
6[J]. 中国微生态学杂志, 2006(4): 291-292.
[2] 王永芳, 韩宏伟, 赵馨, 等. 光黄素荧光法测定保健食品中的维生素B
2的方法研究[J]. 中国食品卫生杂志, 2000, 12(2): 20-22.
[3] 张烁, 宋书锋, 杨大进. HPLC-荧光法与荧光分光光度法测定复合维生素保健食品中核黄素含量的比较[J]. 中国卫生检验杂志, 2010, 20(5): 1059-1061.
[4] 吴敏, 卢佳, 孙成均, 等. HPCE法同时测定保健品及中成药中的5种苷类成分[J]. 华西药学杂志, 2011(2): 165-167.
[5] CHEN Pei, WOLF W R. LC/UV/MS-MRM for the simultaneous determination of water-soluble vitamins in multi-vitamin dietary supplements[J]. Analytical and Bioanalytical Chemistry, 2007, 387(7): 2441-2448.
[6] 潘正斐. UPLC/MS/MS法检测保健食品中的咖啡因、酚酞和西布曲明[J]. 中国热带医学, 2011, 11(9): 1118-1119.
[7] 林宏琳, 李晓明, 华永有, 等. 高效液相色谱法同时测定保健食品中红景天苷和腺苷[J]. 中国食品卫生杂志, 2013, 25(2): 159-162.
[8] 秦榕, 薄海波, 韩舜愈. 超高效液相色谱法同时测定红景天保健品中红景天苷和甙元酪醇含量[J]. 理化检验: 化学分册, 2009, 45(6): 674-678.
[9] 杨晓艳, 芦启琴, 沈建伟, 等. HPLC法测定红景天饮料中红景天苷的含量[J]. 天然产物研究与开发, 2009, 21(B05): 138-140.
[10] 杨润, 李莉, 李放, 等. HPLC同时测定保健食品中4种水溶性维生素[J].江苏预防医学, 2013, 24(6): 32-34.
[11] MORENO P, SALVADO V. Determination of eight water- and fatsoluble vitamins in muti-vitamin pharmaceutical fromulations by highperformance liquid chromatography[J]. Journal of Chromatography A,2000, 870: 207-215.
[12] BENDRYSHEV A A, PASHKOVA E B, PIROGOV A V, et al. Determination of water-soluble vitamins in vitamin premixes, bioacitve dietary supplements, and pharmaceutical preparations using high-efficiency liquid chromatography with gradient elution[J]. Moscow University Chemistry Bulletin, 2010, 65(4): 260-268.
[13] 陈丽波, 张斌. HPLC法同时测定多维营养素片中维生素B
6、烟酰胺、咖啡因的含量[J]. 中国现代药物应用, 2012, 23(6): 4-5.
[14] 中国标准化管理委员会. GB/T 5009.197—2003 保健食品中盐酸硫胺素、盐酸吡哆醇、烟酸、烟酰胺和咖啡因的测定[S]. 北京: 中国标准出版社, 2003.
[15] 王旭, 任琳, 邹晓莉, 等. 同时测定保健食品中褪黑素和维生素B
6的高效液相色谱方法研究[J]. 现代预防医学, 2012, 39(23): 6245-6247; 6250.
[16] 中国标准化管理委员会. GB/T 5009.170—2003 保健食品中褪黑素含量的测定[S]. 北京: 中国标准出版社, 2003.
[17] 中国标准化管理委员会. GB/T 5009.195—2003 保健食品中吡啶甲酸铬含量的测定[S]. 北京: 中国标准出版社, 2003.
[18] 万玉萍, 段毅宏, 栗阳. 高效液相色谱法测定保健食品中的吡啶甲酸铬的含量[J]. 中国卫生检验杂志, 2003, 13(1): 79.
[19] 廖一民. 保健食品中吡啶甲酸铬的高效液相色谱测定法[J]. 预防医学情报杂志, 2005, 21(6): 751-753.
[20] 王美菡, 李敏, 孙海燕, 等. 高效液相色谱法测定保健食品中吡啶甲酸铬含量[J]. 中国卫生检验杂志, 2003, 13(5): 617-618.
[21] 杨大进, 方从容, 王竹夫. 保健食品中吡啶甲酸铬的检测方法研究[J].中国食品卫生杂志, 2001, 13(3): 8-10.
[22] KOLL M, HOENEN H, ABOUL-ENEIN H Y. A validated method for analysis of chromium picolinate in nutraceuticals by reversed phase high performance liquid chromatography[J]. Biomedical Chromatography, 2005, 19(2): 119-122.
[23] 卫生部. 保健食品检验与评价技术规范[S]. 2003.
Simultaneous Determination of 11 Functional Components in Health Foods by High Performance Liquid Chromatography
CHEN Yufang, LIN Haidan, WU Hongzhong, JIN Meng, SONG Yang, LIANG Xiaoru, XIE Yushan, GUAN Yongyi
(Inspection and Quarantine Technology Center, Guangdong Entry-Exit Inspection and Quarantine Bureau, Guangzhou 510623, China)
Abstract:A high performance liquid chromatography (HPLC) method was developed for simultaneous determination of 11 functional components in health foods. Samples were extracted with methanol-water-phosphoric acid solution/ n-hexane-methanol-water-phosphoric acid solution (for lipid-containing samples). Analysis was performed using an HPLC system equipped with an Agilent TC- C
18column (250 mm × 4.6 mm, 5 μm) and a PDA/FLR detector with a mobile phase composed of acetonitrile and 2 g/L sodium octanesulfonate solution (containing 1 mL of phosphoric acid) at a flow rate of 1.0 mL/min with gradient elution. Good linearity was observed in the range of 0.25–25 mg/L for vitamin B
2, 0.5–20 mg/L for vitamin B
6, 1–100 mg/L for nicotinic acid and nicotinamide, 0.5–50 mg/L of the other five functional components with correlation coefficients of 0.999 1–1.000 0. The average recoveries in health foods were in the range of 86.4%–110% at three spiked levels with relative standard deviations varying between 0.21% and 11.7% (n = 6). The limit of quantification was 20 mg/kg for nicotinic acid and nicotinamide, and 10 mg/kg for the remaining nine functional components.
Key words:high performance liquid chromatography (HPLC); water-soluble vitamin; chromium picolinate;melatonine; salidroside
中图分类号:O657.72
文献标志码:A
文章编号:1002-6630(2015)08-0244-06
doi:10.7506/spkx1002-6630-201508046
收稿日期:2014-07-16
作者简介:陈毓芳(1968—),女,高级工程师,学士,主要从事食品和化妆品检测研究。E-mail:fangyuc@163.com




