
图1 不同pH值条件下的剪切速率对芋艿分离蛋白溶液黏度的影响
Fig.1 Influence of shear rate on the viscosity of taro protein isolate under different pH conditions
a. 25 ℃;b. 35 ℃;c. 45 ℃。实线表示剪切速率增加时的黏度曲线;虚线表示剪切速率减小时的黏度曲线。
王教飞 1,2,黄友如 1,*,钱雅萍 1,赵 琳 1,陈 茵 1
(1.常熟理工学院生物与食品工程学院,江苏 常熟 215500;2.中国矿业大学化工学院, 江苏 徐州 221116)
摘 要:以芋艿分离蛋白为材料,研究了不同pH值环境条件下芋艿分离蛋白的流变特性、紫外和荧光光谱。结果表明:pH值环境对芋艿蛋白的变性及聚集有明显的影响。在pH值接近芋艿蛋白的等电点时,芋艿分离蛋白因聚集导致其表观黏度较高,滞后现象明显,胶凝点温度(T gel)及凝胶储能模量(G’)较高;当pH值升高至8.0时(大于芋艿蛋白的等电点),芋艿分离蛋白解聚集,构象展开,表观黏度较低,滞后现象减弱,T gel及凝胶G’降低。随溶液pH值的升高,频率扫描曲线G’与损耗模量(G″)的交点逐渐向高频方向移动并最终消失。在pH 7.0时,芋艿分离蛋白的紫外吸收峰位于284 nm波长处;其荧光光谱最大激发波长为289.7 nm,最大发射波长为330.3 nm。
关键词:芋艿分离蛋白;流变;紫外;荧光;等电点
芋艿为单子叶植物,属天南星科。芋艿为地下茎的膨大部分,其外皮棕色,肉有白色、粉色和紫色之别,表皮环绕一层绒毛状根 [1]。芋艿肉质球茎,富含淀粉,可供食用,其食用模式因国家和地区不同而异 [1-6]。芋艿球茎蛋白组分中有一种黏液蛋白,人体吸收后能促使人体产生免疫球蛋白,或称抗体球蛋白,可以提高机体的抵抗力,具有解毒作用,对体内的痈肿毒痛包含癌毒有抑制和消解作用,可用来防治肿瘤及淋巴结核等病症 [7]。在18 种氨基酸中,芋艿蛋白含量最高的为天冬氨酸,其次为谷氨酸。8 种人体必需氨基酸含量占总氨基酸量的43.42%,氨基酸评分(amino acid score,AAS)为0.79。 8 种人体必需氨基酸占总氨基酸量的百分比和化学评分均接近或超过酪蛋白 [8]。因此,芋艿蛋白质具有重要的食用及药用价值。
目前,有关芋艿分离蛋白提取及结构与功能性质方面的研究甚少。Huang [9]、Kaushal [10]等研究了芋艿球茎蛋白质的含量为1.1%~2.5%,常银子等 [11]研究了酶法提取芋艿蛋白质工艺,在最佳提取工艺下蛋白质提取率为10.20%,至今没有对其性质、结构和功能的研究报道。作为江南地区的传统食物,对芋艿分离蛋白的性质、结构与功能的研究,将有助于我们理解在可能导致食品性能变化的处理过程中,对芋艿蛋白质食品性质变化的影响。
本实验采用碱溶酸沉工艺提取芋艿分离蛋白 [12-14],应用安东帕Physica MCR301高级旋转流变仪结合荧光光谱等分析探讨芋艿分离蛋白的流变特性。由于流变测试用于蛋白质凝胶性能监控独特的优势,提供的实验数据可能对芋艿蛋白质食品生产有用。
1.1 材料与试剂
芋艿,产自江苏省常熟市。
氢氧化钠、盐酸 江苏强盛化工有限公司;磷酸二氢钠、磷酸氢二钠 上海强顺化工有限公司;所有试剂均为分析纯。
1.2 仪器与设备
LXY-Ⅱ型离心沉淀机 上海医用分析仪器厂;JY10001型电子天平 上海民桥精密科学仪器有限公司;FE20实验室pH计 梅特勒-托利多(上海)公司;UV2100型紫外-可见分光光度计 UNCO公司;RF-5301PC型荧光分光光度计 日本岛津公司;Physica MCR301高级旋转流变仪 奥地利安东帕公司;JJ-2B型电动高速组织捣碎机 江苏荣华仪器制造公司。
1.3 方法
1.3.1 芋艿分离蛋白的提取工艺
芋艿→去皮→打浆(料液比1∶8(m/m),25 ℃)→调pH 8.0,低速搅拌浸提30 min→离心(4 000×g,15 min)→上清液→调pH值至5.0→离心(4 000×g,30 mi n)→沉淀→回调pH值至7.0→冷冻干燥→芋艿分离蛋白(蛋白质含量92.1%,凯氏定氮法测定)
1.3.2 芋艿分离蛋白的流变性质测定
取冷冻干燥的芋艿分离蛋白粉末分别溶于pH 6.5、7.0和8.0的磷酸盐缓冲液(0.2 mol/L)中,配制成质量分数为8%的芋艿分离蛋 白溶液。使用Physica MCR301型流变仪进行流变性质分析,平板半径50 mm,间距1 mm,加样量0.9 mL,硅油密封,加样前将底板的温度调至25 ℃。
结构恢复实验(structure recovery):采用Hysteresis Area:up-hold-down ramp模式,参数设定为:温度分别固定在25、35、45 ℃,剪切速率0.1~200 s —1,200 s —1停留1 min,再从200~0.1 s —1。考察温度和剪切速率对芋艿分离蛋白黏度及结构的影响。
频率扫描:温度25 ℃,自动应力,初始应力0.8 Pa,目标应变0.5%。扫描频率范围在0.5~100 s —1之间。
温度扫描:固定角频率10 rad/s,应变0.5%。程序升温:25~95 ℃,95 ℃保温1 min,程序降温:95~25 ℃,速率:10 ℃/min。
1.3.3 芋艿分离蛋白的紫外吸收光谱分析
将芋艿分离蛋白分别溶于pH 6.5、7.0和8.0的磷酸盐缓冲液(0.2 mol/L)中,配制成2.0 mg/mL的蛋白质溶液,以对应不同pH值的0.2 mol/L磷酸盐缓冲液作参比,采用UV-2100扫描型紫外-可见分光光度计做紫外-可见光扫描,扫描速率10 nm/min,波长范围200~800 nm之间。
1.3.4 芋艿分离蛋白的荧光光谱分析
将1.3.2节配制的蛋白质溶液采用RF-5301PC型荧光分光光度计进行荧光测定。参照Kalapathy等 [15]的方法,发射光谱:激发波长固定在280 nm,扫描范围300~800 nm;激发光谱:发射波长固定在335 nm,扫描范围220~400 nm。
2.1 芋艿分离蛋白的流变性质
2.1.1 结构恢复实验分析

图1 不同pH值条件下的剪切速率对芋艿分离蛋白溶液黏度的影响
Fig.1 Influence of shear rate on the viscosity of taro protein isolate under different pH conditions
a. 25 ℃;b. 35 ℃;c. 45 ℃。实线表示剪切速率增加时的黏度曲线;虚线表示剪切速率减小时的黏度曲线。
由图1可知,随着剪切速率的增大,不同pH值条件下蛋白质溶液的黏度均迅速降低,剪切速率达到一定值后,剪切速率对黏度的影响很小。这主要是由于蛋白质溶液在低剪切速率或者悬浮状态下往往会发生缠绕和絮凝,增加了蛋白质与流体之间的阻力,表现为高黏度的性质;当剪切速率增加时,速率梯度增加,剪切应力也随之增大,缠绕在一起的蛋白质会发生解体或者变形,依靠微弱作用形成的二聚体或低聚体解离成单体,流动阻力降低,出现剪切稀化现象 [16]。
芋艿分离蛋白溶液黏度随着剪切速率的增加逐渐稳定,稳定后的黏度表现为样品pH 8.0<pH 7.0<pH 6.5。撤去外力时,各样品黏度不能瞬时恢复,出现较弱的滞后现象,各样品滞后环面积pH 8.0<pH 7.0<pH 6.5,滞后起点对应的剪切速率也是样品pH 8.0<pH 7.0<pH 6.5。滞后环的出现乃是由于剪切力对蛋白质分子本身和蛋白质分子间的相互作用产生影响,导致其结构在外力撤去时不能马上复原 [17]。上述现象表明pH值环境影响芋艿分离蛋白的溶解性能及其在溶液中的聚集状态。在pH 6.5接近该蛋白的等电点时,芋艿分离蛋白因聚集导致其表观黏度较高,滞后现象明显;当pH值升高至7.0和8.0时(大于芋艿蛋白的等电点),芋艿分离蛋白解聚集,构象展开,表观黏度较低,滞后现象较弱,这与荧光及紫外-可见光谱实验结果相吻合。
芋艿分离蛋白溶液的力学效应可应用牛顿幂律模型η=Kr n解释,图1中不同pH值条件下芋艿分离蛋白溶液的流动指数(或谓特性指数)均为n<0,说明此条件下芋艿分离蛋白溶液为假塑性流体 [18-20]。表1是不同温度条件下(pH 7.0)芋艿分离蛋白牛顿幂律模型参数及滞后面积。可见,随着温度上升,稠度系数K与滞后面积递减,而特性指数n递增,表明升温可降低芋艿分离蛋白溶液的黏度,流体行为逐渐接近牛顿流体(n=0)。其他pH值样品的温度影响趋势与之类似。
表1 不同温度条件下芋艿分离蛋白牛顿幂律模型参数及滞后面积(pH 7.0)
Table 1 Newtonian power law index and hysteresis area of taro protein at different temperatures (pH 7.0)

温度/℃KnR 2滞后面积/Pa 250.258 16—0.551 950.957 463.05 350.191 40—0.545 780.997 922.36 450.136 42—0.452 250.961 590.59
2.1.2 频率扫描曲线分析


图2 不同pH值条件下的芋艿分离蛋白溶液的频率扫描曲线
Fig.2 Frequency scanning curves of taro protein isolate solution under different pH conditions
a. pH 6.5;b. pH 7.0;c. pH 8.0。下同。
图2是不同pH值条件下质量分数为8%芋艿分离蛋白溶液的储能模量(G’)和损耗模量(G″)相对于角频率(ω)的变化曲线。可见,随溶液pH值的升高,G’与G″曲线的交点逐渐向高频方向移动并最终消失;伴随着角频率的增加G’递增,而G″则呈递减的趋势。前期的预实验工作证明在pH 7.0时芋艿分离蛋白形成热凝胶的最低质量分数为7%,此时的凝胶强度较弱,但在相同条件下的频率扫描结果显示,质量分数同为7%的3 种不同pH值(6.5、7.0和8.0)样品在较大频率范围内,G’与G″曲线始终相交,且交点随溶液pH值的升高逐渐向高频方向移动。
现有的流变资料认为 [21],在较大频率范围内,G″和G’与频率的关系为G″~G’~ω △,即在蛋白质浓度可以形成凝胶时,G″和G’彼此平行,相角与频率无关。据此本实验又对质量分数分别为9%和10%芋艿蛋白溶液的3 种不同pH值(6.5、7.0和8.0)样品进行频率扫描,结果显示体积分数为9%的3 种不同pH值样品的G’与G″曲线的交点均消失,但不平行,溶液pH值越高,两曲线平行的趋势越明显;体积分数为10%的3 种不同pH值样品的G’与G″曲线几近平行,溶液pH值越高,两曲线平行的趋势更加显著。由此可见,将G″和G’平行时的蛋白质溶液质量分数作为蛋白质溶液由黏性流体转变为凝胶的转化点最低质量分数,值得商榷。这与相关文献[21]报道中将G″和G’平行时的蛋白质溶液浓度作为蛋白质溶液由黏性流体转变为凝胶转化点最低浓度的结论并不完全符合,原因有待进一步探讨。此类情况可能适用于豆类蛋白,对于分子结构尚未明了的芋艿蛋白而言并不完全符合。
但上述实验结果也表明,pH值对芋艿分离蛋白的流变行为有着显著的影响。这种现象可否解释为:在pH 6.5接近该蛋白的等电点时,芋艿蛋白因聚集导致其溶解性能较差,体系不均一;当pH值升高至7.0和8.0时(大于芋艿蛋白的等电点),芋艿蛋白解聚集,构象展开,溶解性能较好,形成均一体系的缘故。故本课题组将在后续的研究中进行芋艿蛋白分子的结构分析。
2.1.3 温度扫描曲线分析
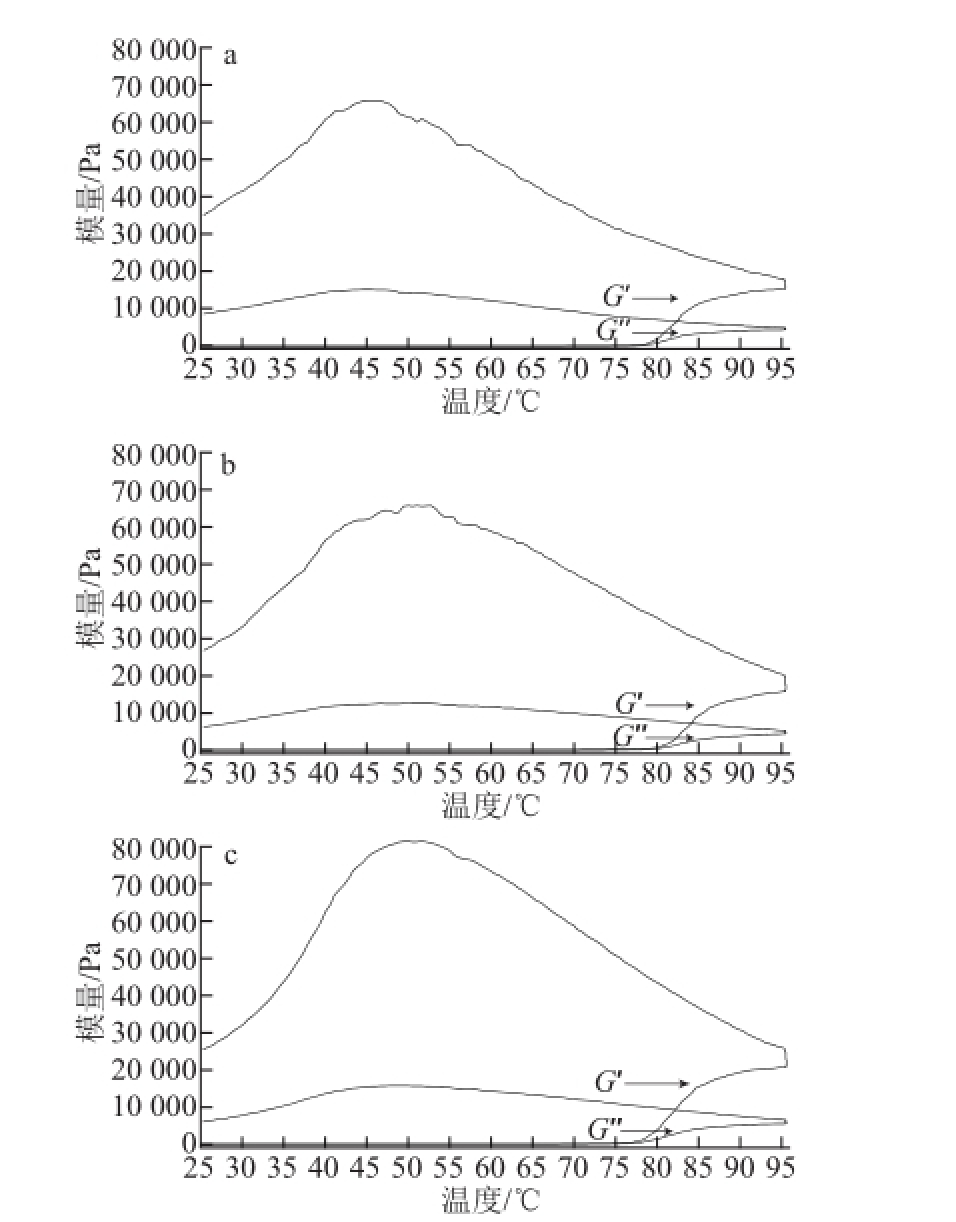
图3 不同pH值条件下的芋艿分离蛋白溶液的温度扫描曲线
Fig.3 Temperature scanning curves of taro protein isolate solution under different pH conditions
图3是不同pH值条件下质量分数为8%芋艿分离蛋白溶液的G’和G″相对于温度的变化曲线。依据Li等 [22]的研究,将G’值快速偏离0点时的温度定义为胶凝点(gel point)温度(T gel),则pH 6.5、7.0和8.0 3 个样品的T gel分别为78、79 ℃和77 ℃。在程序降温开始点对应的G’分别是17 972、20 070 Pa和25 467 Pa。而在程序降温过程中呈现G’峰值和对应的温度分别是65 613、65 706 Pa和81 023 Pa以及45、51 ℃和51 ℃。直至温度降至25 ℃时对应的G’值分别为35 118、26 775 Pa和25 273 Pa。G″与蛋白质黏性形变性能有关,pH 6.5、7.0和8.0 3 个样品G″的变化点分别为78、79 ℃和77 ℃,pH值对G″的影响与G’现象相对应。说明溶液的pH值环境对芋艿蛋白的变性及聚集有明显的影响。在pH 6.5接近该蛋白的等电点时,芋艿蛋白因聚集及体系均一性较差导致其T gel较高(78 ℃),最终形成的凝胶G’也较高(G’=35 118 Pa);当pH值升高至8.0时(大于芋艿蛋白的等电点),芋艿蛋白解聚集,构象展开,溶解性 能较好,形成较为均一的体系,T gel降低(77 ℃),最终形成的凝胶G’也较低(G’=25 273 Pa)。芋艿分离蛋白的凝胶预实验也表明,在pH 6.5时形成的热凝胶混浊且粗糙,而在pH 8.0时形成的热凝胶透明且细腻。
2.2 芋艿分离蛋白的紫外-可见光光谱
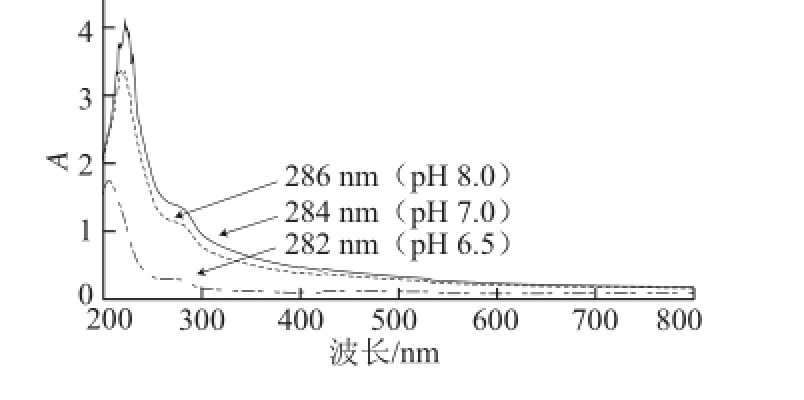
图4 不同pH值条件下芋艿分离蛋白溶液的紫外吸收光谱
Fig.4 UV absorption spectra of taro protein isolate solution under different pH conditions
图4为不同pH值条件下的芋艿分离蛋白溶液的紫外吸收光谱。由于pH值环境条件的改变,芋艿分离蛋白的紫外吸收峰位产生了位移。前期预实验芋艿蛋白的等电点测定结果表明,该蛋白等电点主要集中在pH 5.21和 6.73两个条带。在pH 6.5接近该蛋白的等电点时,芋艿分离蛋白280 nm波长附近的吸收峰减弱,峰位向短波方向位移(蓝移),说明芋艿分离蛋白有聚集沉淀的现象,这与芋艿分离蛋白制备过程中调浸提液pH<7时,溶液出现乳白色混浊现象相吻合。当pH值升高至7.0和8.0时(大于芋艿蛋白的等电点),芋艿分离蛋白解聚集,构象展开,溶解度增加,280 nm波长附近的吸收峰增强,峰位向长波方向位移(红移)。
2.3 芋艿分离蛋白的荧光光谱
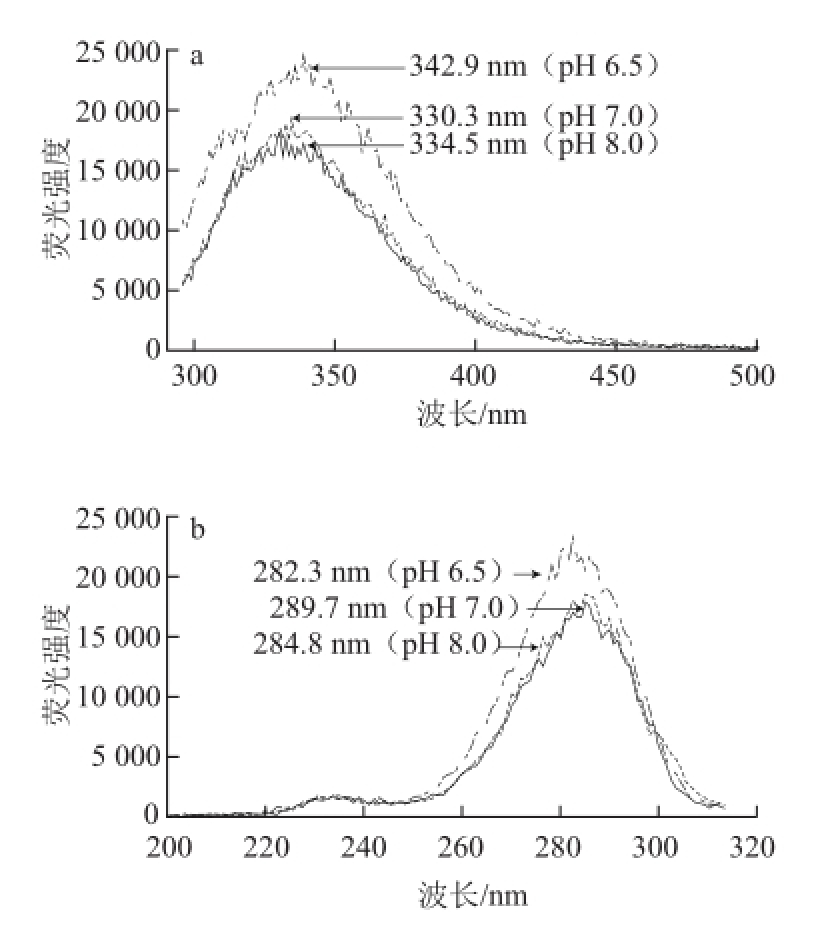
图5 不同pH值条件下芋艿分离蛋白溶液荧光发射(a)和激发(bb)光谱
Fig.5 Fluorescence emission (a) and excitation (b) spectrum of taro protein isolate solution under different pH conditions
图5是不同pH值条件下芋艿分离蛋白溶液荧光发射和激发光谱。由图5a可知,蛋白质溶液在280 nm波长激发后均可在300~400 nm波长范围内得到荧光发射光谱,pH 6.5、7.0、8.0条件下溶液的λ max分别位于342.9、330.3、334.5 nm。在pH 6.5接近该蛋白的等电点时,芋艿分离蛋白因聚集致使色氨酸残基埋藏在蛋白质分子的内部,λ max向长波方向位移(红移);当pH值升高至7.0和8.0时(大于芋艿蛋白的等电点),芋艿分离蛋白解聚集,构象展开,色氨酸残基暴露,λ max向短波方向位移(蓝移),这与紫外-可见光谱结果相吻合。
由图5b可知,溶液在260~300 nm波长范围内有较强的荧光激发,主要是由蛋白质中苯丙氨酸、酪氨酸和色氨酸残基的激发荧光引起。pH 6.5、7.0、8.0条件下溶液激发光谱峰分别位于282.3、289.7、284.8 nm,pH值环境造成蛋白质聚集程度的差异,蛋白质聚集体周围水分子和分子能级发生变化,导致蛋白质溶液出现不同的荧光激发曲线。
本实验结果表明:溶液的pH值环境对芋艿蛋白的变性及聚集有明显的影响。在pH 6.5接近芋艿蛋白的等电点时,芋艿分离蛋白因聚集导致其表观黏度较高,滞后现象明显,胶凝点温度T gel及最终形成的凝胶G’较高;当pH值升高至8.0时(大于芋艿蛋白的等电点),芋艿分离蛋白解聚集,构象展开,表观黏度较低,滞后现象减弱,T gel及凝胶G’降低。频率扫描发现,随溶液pH值的升 高,G’与G″曲线的交点逐渐向高频方向移动并最终消失,但不平行。在pH 7.0时,芋艿分离蛋白的紫外吸收峰位于284 nm波长处;其荧光光谱最大激发波长为289.7 nm,最大发射波长为330.3 nm。由于流变测试用于蛋白质凝胶性能的监控独特的优势,不同pH值条件下所提供的数据可能对芋艿蛋白质产品生产有用,从而促进芋艿蛋白质在食品加工方面的应用。
参考文献:
[1] STRAUSS M S. Taro: a review of Colocasia esculenta and its potentials[M]. Hawaii: University of Hawaii Press, 1983: 23-25; 261-268.
[2] DAVIDSON A. The oxford companion to food[M]. New York: Oxford University Press, 1999: 67-69.
[3] AMMAR M S, HEGAZY A E, BEDEIR S H. Using of taro flour as partial substitute of wheat flour in bread making[J]. World Journal of Dairy & Food Sciences, 2009, 4(2): 94-99.
[4] KAUR M, KAUSHAL P, SANDHU K S. Studies on physicochemical and pasting properties of Taro (Colocasia esculenta L.) flour in comparison with a cereal, tuber and legume flour[J]. Journal of Food Science and Technology, 2013, 50(1): 94-100.
[5] NJINTANG Y N, MBOFUNG C M F. Effect of precooking time and drying temperature on the physico-chemical characteristics and invitro carbohydrate digestibility of taro flour[J]. LWT-Food Science and Technology, 2006, 39(6): 684-691.
[6] PÉREZ E, SCHULTZ F S, de DELAHAYE E P. Characterization of some properties of starches isolated from Xanthosoma sagittifolium (tannia) and Colocasia esculenta (taro)[J]. Carbohydrate Polymers,2005, 60(2): 139-145.
[7] 高瑞莲. 芋艿营养价值剖析[J]. 食品科学, 2000, 21(2): 19-21.
[8] 藤咸, 柳琪, 黎秀卿, 等. 芋头蛋白质含量及氨基酸组分的分析与营养评价[J]. 莱阳农学院学报, 1992, 9(4): 313-314.
[9] HUANG A S, TITCHENAL C A, MEILLEUR B A. Nutrient composition of taro corms and breadfruit[J]. Journal of Food Composition and Analysis, 2000, 13(5): 859-864.
[10] KAUSHAL P, KUMA V, SHAMA H K. Utilization of taro (Colocasia esculenta): a review[J]. Journal of Food Science and Technology,2013, 50(2): 1-14.
[11] 常银子, 王丽霞, 仲山民, 等. 酶法提取芋艿蛋白质工艺[J]. 食品研究与开发, 2011, 32(3): 19-22.
[12] 杨红兵, 石磊. 半夏蛋白质提取方法的研究[J]. 中药材, 2010,33(10): 1647-1649.
[13] 张羽, 郑铁松, 陈静. 莲子蛋白质提取工艺研究[J]. 食品科学, 2007,28(9): 144-147.
[14] LESTARI D, MULDER W, SANDERS J. Improving Jatropha curcas seed protein recovery by using counter current multistage extraction[J]. Biochemical Engineering Journal, 2010, 50(1/2): 16-23.
[15] KALAPATHY U, HETTIARACHCHY N S, RHEE K C. Effect of drying methods on molecular properties and functionalities of disulfide bond-cleaved soy proteins[J]. Journal of the American Oil Chemists’Society, 1997, 74(3): 195-199.
[16] 王琴, 成坚, 纪少丽, 等. 银杏全果粉的流变特性研究[J]. 河 南工业大学学报: 自然科学版, 2006, 26(5): 44-47.
[17] 谭洪卓, 谷文英, 刘敦华, 等. 甘薯淀粉糊的流变特性[J]. 食品科学,2005, 26(1): 58-63.
[18] 王洪武, 马榴强, 周建国, 等. 大豆蛋白质流变性能的研究[J]. 高分子材料科学与工程, 2002, 18(2): 112-114.
[19] 李汴生, 陈伯暖. 高压处理后大豆分离蛋白溶解性和流变特性的变化及其机理[J]. 高压物理学报, 1999, 13(1): 22-29.
[20] 金日光. 高聚物流变学及其在加工中的应用[M]. 北京: 化学工业出版社, 1986: 31-42.
[21] 华欲飞, CUI S W, WANG Qi, 等. 不同大豆分离蛋白凝胶的流变学性质[J]. 中国粮油学报, 2003, 18(6): 43-48.
[22] LI J, OULD ELEYA M M, GUNASEKARAN S. Gelation of whey protein and xanthan mixture: effect of heating rate on rheological properties[J]. Food Hydrocolloids, 2006, 20(5): 678-686.
Rheological Properties of Taro Protein Isolate
WANG Jiaofei
1,2, HUANG Youru
1,*, QIAN Yaping
1, ZHAO Lin
1, CHEN Yin
1
(1. School of Biotechnology and Food Engineering, Changshu Institute of Technology, Changshu 215500, China; 2. School of Chemical Engineering and Technology, China University of Mining and Technology, Xuzhou 221116, China)
Abstract:Taro protein isolate was studied for its rheological properties and characterized by ultraviolet and fluorescence spectroscopy at different pH conditions. The results showed that pH had an obvious effect on denaturation and aggregation of taro protein isolate. At pH values close to the isoelectric point, taro protein isolate aggregates had higher apparent viscosity, obvious hysteresis, and higher gelling temperature (T gel) and gel storage modulus (G’). At pH 8.0 (greater than taro proteins isoelectric point), disaggregation, conformational unfolding, lower apparent viscosity, reduced hysteresis, and decreased T geland gel G’ of taro protein isolate were observed. Along with an increase in solution pH, intersection of G’ and G″ was shifted in the high frequency direction and disappear gradually. At pH 7.0, the ultraviolet absorption peak occurred at 284 nm, and the maximum fluorescence excitation and emission wavelengths were 289.7 nm and 330.3 nm, respectively.
Key words:taro protein isolate; rheology; ultraviolet; fluorescence; isoelectric point
中图分类号:TS255.1
文献标志码:A
文章编号:1002-6630(2015)09-0017-05
doi:10.7506/spkx1002-6630-201509004
收稿日期:2014-07-25
基金项目:“十二五”国家科技支撑计划项目(2012BAD34B04-1;2013AA102203-03);江苏省高校自然科学研究资助项目(10KJB550001);苏州市科技计划项目(SYN201211)
作者简介:王教飞(1987—),男,硕士研究生,研究方向为生物化工。E-mail:wangjiaofei@163.com
*通信作者:黄友如(1966—),男,副教授,博士,研究方向为粮食、油脂及植物蛋白工程。E-mail:huangyouru@aliyun.com