涂宗财 1,2,钮培佩 1,王 辉 1,石 燕 1,黄小琴 2,李瑞平 1,常海霞 1,包中宇 1
(1.南昌大学 食品科学与技术国家重点实验室,生物质转化教育部工程研究中心,江西 南昌 330047;2.江西师范大学生命科学学院,江西 南昌 3 30022)
摘 要:采用亚临界水处理卵清蛋白(ovalbumin,OVA),研究其对蛋白粒径、自由巯基、表面疏水性、运动黏度、起泡性能、乳化性能的影响。结果表明:亚临界水能显著降低卵清蛋白的粒径、自由巯基含量、运动黏度,增强其表面疏水 性;经过亚临界水处理后,卵清蛋白的起泡性显著提高,其中刚升至140 ℃(处理0 min)时样品的起泡性最高,比未处理的提高了2.7 倍,但随着处理时间的延长,起泡性明显下降;处理后的卵清蛋白乳化性显著提高,并随着处理时间的延长先增高后趋于不变,其中160 ℃处理15 min的乳化性最高,比未处理的提高了1.5 倍。
关键词:亚临界水;卵清蛋白;起泡性;乳化性
鸡蛋因其营养价值高、味道鲜美等优点成为日常生活的主要食物之一,由于蛋黄中富含卵磷脂、ω-3脂肪酸、胆碱等生物活性物质,实现了其高效利用;但人们对蛋清重视不够,甚至废弃不用,因此,拓宽蛋清的应用范围意义重大。国内外学者采用高压 [1]、辐照 [2]、超声 [3]、糖基化 [4]等对其进行改性以期对其综合利用,而卵清蛋白作为蛋清中的主要蛋白组分,其结构与功能性质会显著影响蛋清蛋白的功能性质 [5]。
亚临界水(subcritical water)是指低于临界压力(P c= 22.1 MPa)和临界温度(T c= 374 ℃)而温度高于100 ℃的液态水;具有低黏度、低密度、较低的介电常数和较高的电离常数等理化特性,同时还具有高效、无毒、循环利用和低污染等优点 [6]。它通过解聚作用,分裂、脱水、脱羧和脱氨作用和重组反应片段3 个步骤作用于生物质 [7-8]。目前,用亚临界水技术处理蛋白质的研究逐年增加 [9-12],但是这些研究主要集中于蛋白质水解产物和废弃物的综合利用,而关于亚临界水改性蛋白质的研究较少。因此,本实验以卵清蛋白(ovalbumin,OVA)为研究对象,研究亚临界水对卵清蛋白颗粒大小、自由巯基、表面疏水性、运动黏度、起泡性能、乳化性能的影响,为亚临界水对蛋白质的改性提供一定的理论依据。
1.1 材料与试剂
鲜鸡蛋为老南沟粮食蛋;大豆油 益海嘉里食品营销有限公司。
5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithio bis-(2-nitrobenzoic acid),DTNB)、十二烷基硫酸钠(sodium dodecyl sulfonate,SDS)、硫酸铵、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、三羟甲基氨基甲烷(Tris)、甘氨酸(Gly) 天津市大茂化学试剂厂;8-苯胺基-1-萘磺酸铵(8-anilino-1-naphthalenesulfonic acid,ANS) 美国Sigma公司。
1.2 仪器与设备
GSHA实验室磁力搅拌高压反应釜 威海嘉毅化工机械有限公司;T6新世纪紫外-可见分光光度计北京普析通用仪器责任有限公司;F-7000荧光分光光度计 日本日立高新科技公司;毛细管黏度计 上海中谊玻璃制品有限公司;HH-4数显恒温水浴锅 国华电器有限公司;LGJ-1冷冻干燥机 北京亚泰科隆仪器技术有限公司;NICOMPTM 380激光纳米粒度测定仪美国Nicomp公司。
1.3 方法
1.3.1 卵清蛋白的提取 [13]
以鲜鸡蛋为原料,采用盐析法分离提纯卵清蛋白,冷冻干燥后备用。
卵清蛋白制备工艺:蛋清→过滤→蒸馏水稀释并调pH 5.5→4 000 r/min离心→上清液添加硫酸铵至饱和度50%→4 000 r/min离心→上清液调pH 4.5→沉淀用10 —4mol/L EDTA溶解→添加硫酸按至饱和度38%→4 000 r/min离心→重复上述步骤直至6 次重结晶→透析24 h→冻干。
1.3.2 卵清蛋白的亚临界水处理
将卵清蛋白配成5 mg/mL的溶液,取400 mL样品于120、140、160 ℃的高压反应釜中,以温度升至设定温度时开始计时 [14],分别处理0、15、30、60 min,取出用冰浴终止反应。样品经冷冻干燥后备用,所有测定以未经亚临界水处理的卵清蛋白作对照。
1.3.3 粒径大小的测定
采用激光纳米粒度测定 仪测定亚临界水处理前后样品溶液蛋白的粒径,使用CW388软件计算蛋白的粒径大小。
1.3.4 自由巯基含量的测定
采用Ellman法 [15]测定蛋白质中自由巯基的含量。
Ellman试剂:4 mg DTNB溶于l.0 mL Tris-Gly缓冲液(0.086 mol/L Tris,0.09 mol/L Gly和0.004 mol/L EDTA,pH 8.0)。
4 mL 1 mg/mL样品溶液(溶剂为含8 mol/L尿素的Tris-Gly缓冲液)与200 μL Ellman试剂混合,室温下放置30 min后在离心机中以8 000 r/min离心20 min,于412 nm波长处测定吸光度,以Tris-Gly缓冲液作对照。
自由巯基含量的计算公式如下。
式中:摩尔消光系数=13 600 mol/(L·cm)。
1.3.5 表面疏水性的测定 [16]
将亚临界水处理前后的样品用蒸馏水配制成5 mg/mL,取4 mL样品,与 20 μL 8 mmol/L ANS溶液(溶剂为0.01 mol/L,pH 7.0的磷酸盐缓冲溶液)混合,在激发波长390 nm,发射波长400~650 nm范围内进行荧光扫描,扫描速率10 nm/s。以荧光强度的大小表示表面疏水性。
1.3.6 运动黏度的测定 [17-18]
将毛细管黏度计垂直放入25 ℃恒温水浴槽中,取15 mL 10 mg/mL的亚临界水处理前后的样品溶液注入毛细管黏度计中,恒温12 min后,将样品溶液吸起使其没过上刻度线,取下洗耳球,使溶液自由流下,待溶液流至毛细管黏度计的上刻度线时开始计时,流至下刻度线时停止计时,记录时间,同上操作重复测定3 次,取平均值。运动黏度的计算公式如下。
式中:ν为试样的运动黏度/(mm 2/s);t为样品溶液流经上部刻度线 至下部刻度线的时间/s;C为黏度计常数/(mm 2/s 2)。
1.3.7 起泡性能的测定 [19]
取10 mg/mL亚临界水处理前后样品溶液15 mL,室温下用高速分散均质机均质2 min,转速为9 500 r/min,然后快速移至50 mL量筒中,记录泡沫体积(V 0),静置30 min后,记录泡沫体积(V 30)。
起泡性和泡沫稳定性分别采用以下公式进行计算。

1.3.8 乳化性能的测定 [20]
取大豆色拉油3 mL,加入9 mL 1 mg/mL的蛋白溶液,在室温下用高速分散均质机均质2 min,转速为9 500 r/min,迅速从底部吸取100 μL乳状液,加入到4.9 mL 1 mg/mL的SDS溶液中(溶剂为100 mmol/L pH 7.4的磷酸盐缓冲液),混合均匀,500 nm波长处测定吸光度(A 0),10 min后,以同样方式再次测其吸光度(A 10)。
乳化性(emulsibility,EAI)和乳化稳定性(emulsion stability,ESI)分别采用以下公式进行计算。

式中:DF为稀释倍数,此处为50;F为乳状液中油体积分数,此处为25%;Δ t=10 min;ρ为乳化液形成前蛋白质水溶液中蛋白质量浓度/(g/mL)。
1.4 统计分析
本实验均进行3 次平行实验,2 次重复实验。采用Origin 7.5软件作图,SPSS 13.0软件进行统计分析;P<0.05表示有显著性差异,P<0.01表示有极显著性差异。
2.1 亚临界水处理对卵清蛋白粒径的影响
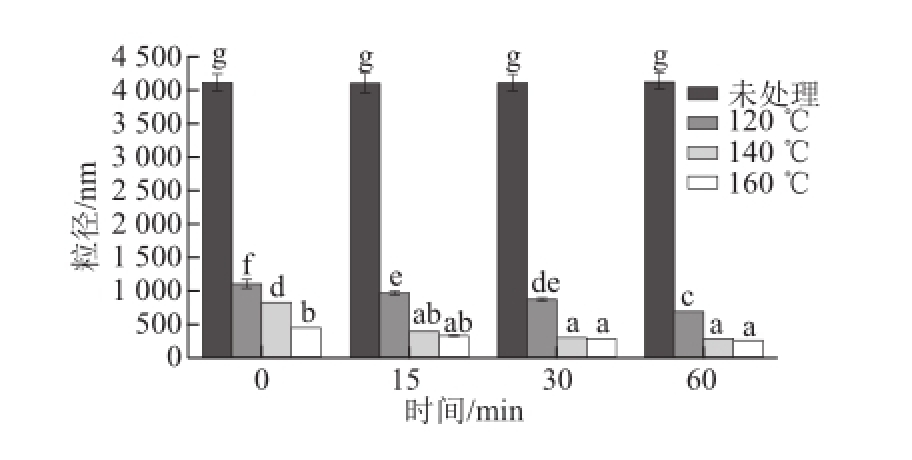
图1 亚临界水条件下卵清蛋白粒径随时间及温度的变化
Fig.1 Effect of subcritical water on the particle size of OVA at different time points and temperatures
小写字母不同表示差异显著(P<0.05)。下同。
卵清蛋白溶液粒径的变化可以反映出亚临界水处理对卵清蛋白宏观结构的变化。由图1可知,经过亚临界水处理后,溶液中卵清蛋白的粒径显著降低(P<0.05),且随着处理时间和温度增加逐渐减小。卵清蛋白在160 ℃处理60 min时粒径达最小,为258.3 nm,较未处理样品的4 103.8 nm显著下降,说明亚临界水处理可降低卵清蛋白颗粒粒径,这可能是因为亚临界水的高温高压作用对蛋白质有很好的分散破碎效果 [6],使蛋白粒径发生改变。
2.2 亚临界水处理对卵清蛋白自由巯基含量的影响
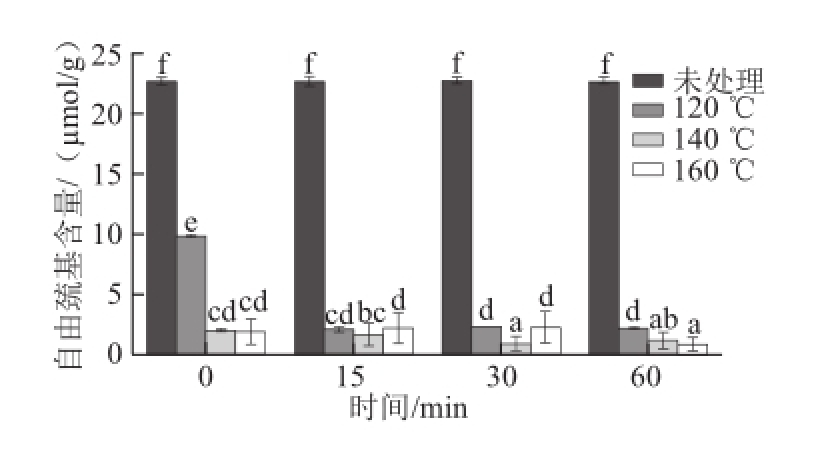
图2 亚临界水条件下卵清蛋白自由巯基含量随时间及温度的变化
Fig.2 Effect of subcritical water on the free sulphydryl content of OVA at different time points and temperatures
巯基是维持蛋白质二级结构的重要因素,巯基含量改变会引起蛋白质二级结构的变化。卵清蛋白中的巯基基团多藏于天然蛋白分子的疏水核心,加工过程如加热、高压等会引起巯基含量以及蛋白质二级结构的变化 [1]。由图2可知,经亚临界水处理后,卵清蛋白自由巯基的含量急剧下降(P<0.05),这说明亚临界水处理 使卵清蛋白的高级结构发生了很大程度的变化。其原因可能是亚临界水处理过程中的高温高压,使自由巯基互相靠近,进而进一步相互结合形成了二硫键,导致巯基含量下降 [16]。
2.3 亚临界水处 理对卵清蛋白表面疏水性的影响
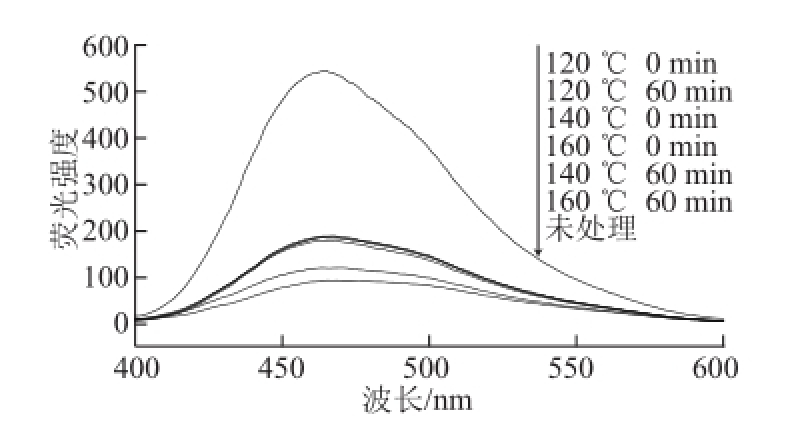
图3 亚临界水条件下卵清蛋白荧光强度随时间及温度的变化
Fig.3 Effect of subcritical water on the surface hydrophobicity of OVA at different time points and temperatures
疏水基团的相互作用是维持蛋白质三级结构的主要作用力,其对卵清蛋白结构的稳定和功能性质具有重要作用 [21]。由图3可知,亚临界水处理后的卵清蛋白的荧光强度均高于未经亚临界水处理的卵清蛋白的荧光强度。其中120 ℃ 0 min条件下的卵清蛋白的荧光强度最大。这可能是亚临界水处理过程中的高温高压改变了卵清蛋白的空间结构,使卵清蛋白分子变性并伸展,弱化了蛋白质分子内部的疏水相互作用,并产生和暴露了更多的疏水性区域,导致蛋白质的表面疏水性增强。但是随着温度的升高和时间的延长,荧光强度降低。这可能是因为持续的高温高压使分子间的分子作用增强,极性侧链基团的水合作用增强,亲水性提高,导致表面疏水性下降 [1]。
2.4 亚临界水处理对卵清蛋白运动黏度的影响
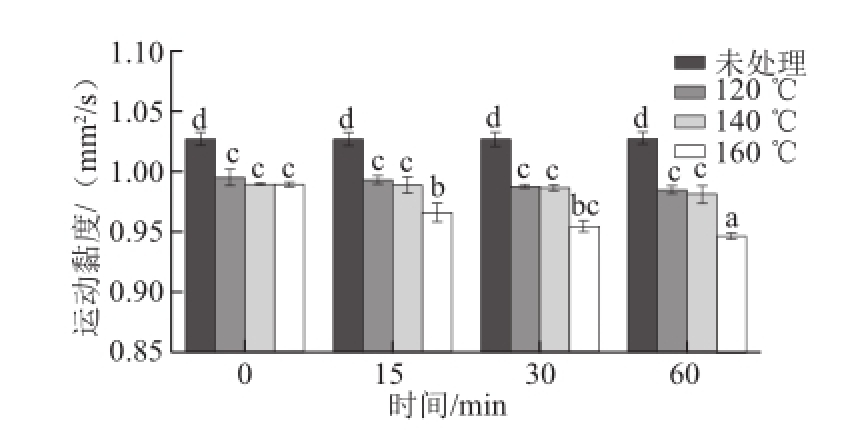
图4 亚临界水条件下卵清蛋白运动黏度随时间及温度的变化
Fig.4 Effect of subcritical water on the kinematic viscosity of OVA at different time points and temperatures
由图4可知,经亚临界水处理后,卵清蛋白的运动黏度降低,且随着处理温度的升高和处理时间的增加而降低,其中以160 ℃亚临界水处理60 min后蛋白的运动黏度最低(P<0.05)。黄小波等 [22]研究表明,在蛋白质流体黏度特性中,溶液中蛋白质分子或颗粒的表观直径起主要作用,表观直径越大,黏度越大。这说明,亚临界水处理降低卵清蛋白运动黏度的根本原因 是亚临界水处理降低了卵清蛋白的粒径。
2.5 亚临界水处理对卵清蛋白起泡性能的影响
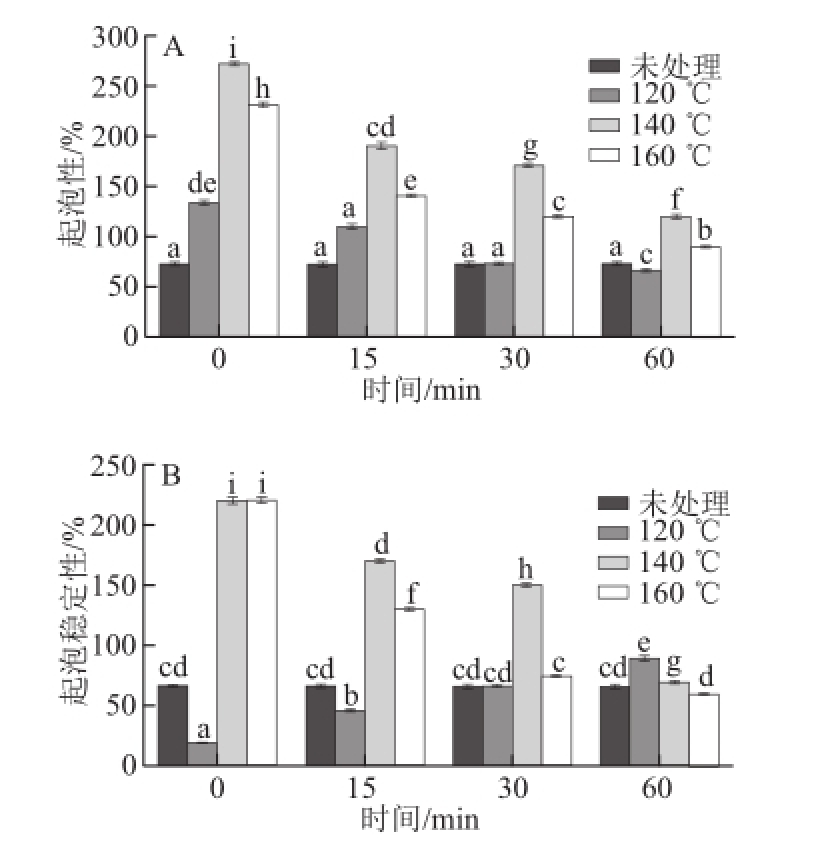
图5 亚临界水条件下卵清蛋白起泡性能随时间及温度的变化
Fig.5 Effect of subcritical water on the foaming capacity and foam stability of OVA at different time points and temperatures
蛋白质的起泡性能由众多因素共同决定,其中蛋白质分子的柔顺性、疏水性、自由巯基-二硫键是影响泡沫性能的关键因素 [23]。由图5A可知,经亚临界水处理后,卵清蛋白的起泡性明显提高(P<0.05),其中140 ℃处理0 min的起泡性最高,比未处理的提高了2.7 倍,但相同温度下,随着处理时间的增加,起泡性降低;由图5B可知,在较高温度下起泡稳定性有明显的提高,其中160 ℃处理0 min及140 ℃处理0 min的起泡稳定性最高,比未处理的提高了2.3 倍,但随着处理时间的延长,起泡稳定性显著下降(P<0.05)。可能原因是:亚临界水的高温高压作用使得蛋白质表面结构一定程度地展开,疏水基团暴露,使空气/水界面的表面张力有所下降,使得蛋白质能更好地扩散到空气/水界面,蛋白质的起泡能力及起泡稳定性提高;另外,更小的蛋白颗粒使其在空气/水界面扩散和吸附更容易,界面张力降低,蛋白分子柔性提高,促进了泡沫的形成,蛋白质的起泡能力及起泡稳定性提高 [24]。但是,随着处理时间的延长,蛋白质分子进一步展开,内部的疏水基团和巯基暴露加剧,从而极化的蛋白分子间通过非共价键重新聚集,即疏水性降低,形成不稳定的二维网络结构和界面膜,因此起泡能力与起泡稳定性逐渐下降。以上研究表明亚临界水的短时间处理,能够显著改善卵清蛋白的起泡性能。
2.6 亚临界水处理对卵清蛋白乳化性及乳化稳定性的影响

图6 亚临界水条件下卵清蛋白乳化性能随时间及温度的变化
Fig.6 Effect of subcritical water on the emulsifying activity and emulsion stability of OVA at different time points and temperatures
蛋白质的乳化性能是指将油水混合在一起的能力。影响乳化性能的因素有蛋白浓度、pH值、温度、盐类、糖类或其他介质等 [25]。由图6A可知,经亚临界水处理后,卵清蛋白的乳化性显著提高(P<0.05),且随着处理时间与处理温度的增加而趋于不变,其中160 ℃处理15 min的乳化性最高,比未处理的提高了1.5 倍;由图6B可知,低温(<140 ℃)短时间亚临界水处理对卵清蛋白的乳化稳定性影响不大,高温(≥140 ℃)长时间处理能提高卵清蛋白的乳化稳定性,经160 ℃亚临界水处理60 min后,乳化稳定性变为原卵清蛋白的4.2 倍(P<0.05)。可能原因是:高温高压作用使蛋白质结构松散,极性基团的水合作用增强,亲水性提高;同时,包含在分子内部的疏水基团暴露,亲油性亦增强,两者达到较好的平衡时,表现为乳化性的明显提高。随着处理时间的增加,持续的高温高压使得卵清蛋白分子进一步展开,极化的卵清蛋白分子之间相互吸引,通过非共价键相互作用力重新形成分子聚集体,表面疏水性降低,蛋白质的表面积也减小,故乳化性的增加趋于不变。
亚临界水能降低卵清蛋白的粒径、自由巯基含量、运动黏度;并显著提高卵清蛋白的表面疏水性,但随着反应温度的升高和处理时间的延长,表面疏水性降低;经亚临界水处理后,卵清蛋白的起泡性、起泡稳定性显著提高,其中140 ℃处理0 min的起泡性最高,比未处理的提高了2.7 倍,160 ℃处理0 min及140 ℃处理0 min的起泡稳定性最高,比未处理的提高了2.3 倍,随着处理时间的延长,起泡性、起泡稳定性明显降低;同时,处理后的卵清蛋白乳化性明显提高,并随处理时间与温度的增加而趋于不变,其中160 ℃处理15 min的乳化性最高,比未处理的提高了1.5 倍;低温(<140 ℃)短时间亚临界水处理对卵清蛋白的乳化稳定性影响不大,高温(≥140 ℃)长时间处理能提高卵清蛋白的乳化稳定性,在160 ℃亚临界水处理60 min后,乳化稳定性变为原卵清蛋白的4.2 倍。为研制高起泡性及乳化性的卵清蛋白或蛋清蛋白提供一种研究思路。
参考文献:
[1] 豆玉新. 动态超高压微射流均质对卵清蛋白改性机理的研究[D]. 南昌: 南昌大学, 2009: 41-42.
[2] MANZOCCO L, PANOZZO A, NICOLI M C. Effect of ultraviolet processing on selected properties of egg white[J]. Food Chemistry,2012, 135(2): 522-527.
[3] ARZENI C, PEREZ O E, PILOSOF A M R. Functionality of egg white proteins as affected by high intensity ultrasound[J]. Food Hydrocolloids, 2012, 29(2): 308-316.
[4] 涂宗财, 胡月明, 王辉, 等. 超声波对蛋清蛋白-果糖美拉德反应体系的影响[J]. 食品工业科技, 2013, 34(3): 61-64.
[5] HATTA H, KITABATAKE N, DOI E. Turbidity and hardness of a heat-induced gel of hen egg ovalbumin (food & nutrition)[J]. Agricultural and Biological Chemistry, 1986, 50(8): 2083-2089.
[6] TOOR S S, ROSENDAHL L, RUDOLF A. Hydrothermal liquefaction of biomass: a review of subcritical water technologies[J]. Energy,2011, 36(5): 2328-2342.
[7] DEMIRBAS A. Mechanisms of liquefaction and pyrolysis reactions of biomass[J]. Energy Conversion and Management, 2000, 41(6): 633-646.
[8] PETERSON A A, VOGEL F, LACHANCE R P, et al. Thermochemical biofuel production in hydrothermal media: a review of sub-and supercritical water technologies[J]. Energy & Environmental Science, 2008, 11: 32-65.
[9] ZHU Xian, ZHU Chao, ZHAO Liang, et al. Amino acids production from fish proteins hydrolysis in subcritical water[J]. Chinese Journal of Chemical Engineering, 2008, 16(3): 456-460.
[10] ZHU Guangyong, ZHU Xian, FAN Qi, et al. Kinetics of amino acid production from bean dregs by hydrolysis in sub-critical water[J]. Amino Acids, 2011, 40(4): 1107-1113.
[11] ZHU Guangyong, ZHU Xian, FAN Qi, et al. Recovery of biomass wastes by hydrolysis in sub-critical water[J]. Resources, Conservation and Recycling, 2011, 55(4): 409-416.
[12] SUNPHORKA S, CHAVASIRI W, OSHIMA Y, et al. Kinetic studies on rice bran protein hydrolysis in subcritical water[J]. The Journal of Supercritical Fluids, 2012, 65: 54-60.
[13] ENOMOTO H, ISHIMARU T, LI C P, et al. Phosphorylation of ovalbumin by dry-heating in the presence of pyrophosphate: effect of carbohydrate chain on the phosphorylation level and heat stability[J]. Food Chemistry, 2010, 122(3): 526-532.
[14] ESPINOZA A D, MORAWICKI R O. Effect of additives on subcritical water hydrolysis of whey protein isolate[J]. Journal of Agricultural and Food Chemistry, 2012, 60(20): 5250-5256.
[15] HE Rong, HE Haiyan, CHAO Dongfang, et al. Effects of high pressure and heat treatments on physicochemical and gelation properties of rapeseed protein isolate[J]. Food and Bioprocess Technology, 2014,7(5): 1344-1353.
[16] 李迎秋. 脉冲电场对大豆蛋白理化性质和脂肪氧化酶的影响[D]. 无锡: 江南大学, 2007: 55-57.
[17] 李红, 原雯, 郑焕云. 乌氏粘度计校准中的不确定度来源及影响因素控制[J]. 工业计量, 2012, 22(增刊1): 178-179.
[18] GB/T 5516—2011 粮油检验 粮食运动粘度测定 毛细管粘度计法[S].
[19] HUANG Xiaoqin, TU Zongcai, WANG Hui, et al. Increase of ovalbumin glycation by the maillard reaction after disruption of the disulfide bridge evaluated by liquid chromatography and high resolution mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2013, 61(9): 2253-2262.
[20] OGUNWOLU S O, HENSHAW F O, MOCK H P, et al. Functional properties of protein concentrates and isolates produced from cashew (Anacardium occidentale L.) nut[J]. Food Chemistry, 2009, 115(3): 852-858.
[21] IAMETTI S, DONNIZZELLI E, VECCHIO G, et al. Macroscopic and structural consequences of high-pressure treatment of ovalbumin solutions[J]. Journal of Agricultural and Food Chemistry, 1998, 46(9): 3521-3527.
[22] 黄小波, 马美湖, 李文革. 辐照杀菌对鸡蛋蛋白液特性的影响[J]. 农业工程学报, 2009, 25(5): 244-248.
[23] PLANCKEN I V D, ANN V L, HENDRICKX M E. Foaming properties of egg white proteins affected by heat or high pressure treatment[J]. Journal of Food Engineering, 2007, 78(4): 1410-1426.
[24] 涂宗财, 豆玉新, 刘成梅, 等. 动态超高压均质对蛋清蛋白溶液的起泡性、成膜性的影响[J]. 食品工业科技, 2008, 29(6): 77-78.
[25] PEARCE K N, KINSELLA J E. Emulsifying properties of proteins: evaluation of a turbidimetric technique[J]. Journal of Agricultural and Food Chemistry, 1978, 26(3): 716-723.
Effect of Subcritical Water on Structure, Foamability and Emulsibility of Ovalbumin
TU Zongcai
1,2, NIU Peipei
1, WANG Hui
1, SHI Yan
1, HUANG Xiaoqin
2, LI Ruiping
1, CHANG Haixia
1, BAO Zhongyu
1
(1. Engineering Research Center for Biomass Conversion, Ministry of Education, State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China; 2. College of Life Science, Jiangxi Normal University, Nanchang 330022, China)
Abstract:Ovalbumin was treated with subcritical water at temperatures for different durations, and the effect of subcritical water on particle size, free sulfhydryls, surface hydrophobicity, kinematic viscosity, foamablility and emulsibility was investigated. The results showed that subcritical water significantly reduced particle size, free sulfhydryl content and kinematic viscosity of ovalbumin. Moreover, it also enhanced surface hydrophobicity. The foamabilty increased significantly,as the temperature of subcritical water increased to 140 ℃. The highest level foamability was observed immediately when the temperature reached 140 ℃, implying a 3.7-fold increase over that of the untreated one, while with the extension of treatment time, the foamability decreased. After subcritical water treatment, the emulsibility was improved, and the highest emulsibility was attained at 160 ℃ for 15 min, representing a 2.5-fold rise compared with the unprocessed sample.
Key words:subcritical water; ovalbumin; foamablility; emulsibility
中图分类号:TQ93
文献标志码:A
文章编号:1002-6630(2015)09-0039-05
doi:10.7506/spkx1002-6630-201509008
收稿日期:2014-06-30
基金项目:江西省重大科技创新研究项目(20124ACB00600);江西省现代农业产业技术体系建设专项(JXARS-02)
作者简介:涂宗财(1965—),男,教授,博士,研究方向为食物资源开发与高效利用。E-mail:tuzc_mail@aliyun.com