袁美兰,陈丽丽,吴润锋,赵 利*,张娅楠,魏丽莉
(江西科技师范大学生命科学学院,国家淡水鱼加工技术研发分中心,江西 南昌 330013)
摘 要:以草鱼为原料,通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳、质构分析和化学作用力测定等方法,研究辅料改善草鱼鱼糜凝胶性能的机理。结果表明:草鱼鱼糜蛋白自溶最适温度和pH值分别为65 ℃和6.5;马铃薯淀粉对鱼糜蛋白交联结构的填充能力强于胶原蛋白,而胶原蛋白对鱼糜组织蛋白酶的抑制效果好于马铃薯淀粉;辅料加入后,改变了鱼糜蛋白间的离子键、氢键、疏水性相互作用和二硫键等化学作用力,从而达到改善鱼糜品质的目的。
关键词:草鱼鱼糜;辅料;自溶;鱼糜品质
为提高淡水鱼糜制品凝胶强度,近年来,马铃薯淀粉 [1-6]、牛血浆 [4]及蛋清粉 [2-3,7-8]等食品辅料被广泛用于鱼糜生产。马铃薯淀粉、牛血浆蛋白及蛋清粉中含有一些特殊的抑制成分,这些抑制成分可与鱼肉内源蛋白酶争夺活性位点。有研究表明,蛋清粉和牛血浆蛋白的添加能够增强比目鱼(flatfish)鱼糜制品的凝胶强度 [9],还能提高太平洋无须鳕(Pacific hake)鱼糜制品的应变力 [10]。由于牛血浆蛋白不仅能够抑制蛋白酶活性,还可以与蛋白发生交联作用,因此牛血浆蛋白被认为是目前最为有效的蛋白酶抑制剂,但是牛血浆蛋白因疯牛病的危害而被禁用 [11],而蛋清粉最大的不足就是会使鱼糜产生不良风味和色泽,同时近年来禽流感的传播也导致蛋清粉的使用受限,因此寻找更好的替代辅料成为目前急需解决的问题。
国内外对鱼糜制品的诸多研究中,多数以马铃薯淀粉、玉米淀粉和甘薯淀粉等作为筛选对象,大多认为添加马铃薯淀粉可以更好地提高低值鱼糜的凝胶强度 [12]。同时也有研究者发现鮰鱼皮中的胶原蛋白可以显著提高草鱼鱼糜凝胶强度 [13]。目前,国内外鲜有关于胶原蛋白和马铃薯淀粉增强鱼糜凝胶性能的机理报道。因此,本实验以草鱼为对象,研究鱼糜中辅料的作用、组织蛋白酶活性和鱼糜凝胶性能三者之间的内在联系。
1.1 材料与试剂
草鱼:活鱼,购自南昌市下罗农贸市场,每条质量800~1 500 g;马铃薯淀粉,购自南昌市下罗农贸市场;百合粉、紫山药粉、葛粉,购自南昌市经济技术开发区枫林大道乐买佳超市。
魔芋精粉、蔗糖、山梨醇 南昌市长城生物制剂有限公司;鱼皮胶原蛋白和鱼头酶解物 江西科技师范大学国家淡水鱼加工技术研发分中心;大豆蛋白 南昌市下罗农贸市场;乳清蛋白 南昌市宝灵生物制剂有限公司。Tris、考马斯亮蓝R-250 北京Solarbio公司;十二烷基硫酸钠(sodium dodecyl sulfonate,SDS)美国Sigma公司;尿素 天津大茂化学试剂厂;β-巯基乙醇 美国Amresco公司;过硫酸铵 北京夏斯生物有限公司;甘氨酸 美国Sanland-chem International公司;30%甲叉双丙烯酰胺、N,N,N’,N’-四甲基二乙胺(N,N,N’,N’-tetramethylethylenediamine,TEMED) 上海Beyotime公司;250 kD标准蛋白质 美国Bio-Rad公司。
1.2 仪器与设备
TJ12-H型绞肉机 广东恒联食品机械有限公司;JJ1000型精密电子天平 常熟双杰仪器厂;T25 basic型分散机 德国IKA公司;F-2700型荧光分光光度计 日本Hitachi公司;Delta320 pH计 瑞士Mettler Toledo公司;TDL-5A型离心机 上海菲恰尔分析仪器有限公司;WSC-S型色差计 上海精密科学仪器有限公司;CT3型质构仪 美国Brookfield公司;HHS-型恒温电热水浴锅 上海博讯实业有限公司医疗设备厂;PowerPac Basic型电泳仪 美国Bio-Rad公司。
1.3 方法
1.3.1 鱼糜肌原纤维蛋白在不同温度下的自溶实验
参考Nishimoro等 [14]的方法并略作修改。称取漂洗后的草鱼鱼糜样品6 组,质量均为0.5 g,在pH值约7.0条件下,温度分别为5、35、45、55、65、75 ℃条件下放置90 min,分别取出样品并溶解到3 mL 20 mmol/L Tris-HCl(2.0% SDS,8.0 mol/L尿素,2.0% β-巯基乙醇,pH 8.0)缓冲液中,沸水浴3 min,然后室温放置24 h,使蛋白质充分溶解出来,离心后取出一定量上清液进行电泳实验 [15]。
1.3.2 鱼糜肌原纤维蛋白在不同pH值条件下的自溶实验
称取漂洗后的草鱼鱼糜样品6 组,质量均为0.5 g,分别加入到pH值为3.5、4.5、5.5、6.5、 7.5、8.5的1 mL Tris-HCl缓冲液中,于65 ℃条件下静置90 min,其后分别离心去水,取出样品进行电泳处理,步骤同1.3.1节。
1.3.3 加入不同辅料后鱼糜肌原纤维蛋白的自溶实验
分别取11 组草鱼鱼糜样品,其中10 组分别含3%的不同辅料,1 组为空白对照,根据实验1.3.1节及1.3.2节结果,选取草鱼鱼糜的最佳自溶温度及p H值条件,并在该条件下将11 组样品放置90 min,其后进行电泳处理,步骤同1.3.1节。
1.3.4 加入不同辅料后鱼糜肌原纤维蛋白经过不同时间的自溶实验
分别取3 组草鱼鱼糜样品,其中2 组分别含3%马铃薯淀粉和胶原蛋白,1 组为空白对照,3组样品在最佳自溶温度及pH值条件下分别放置30、60、90、120 min,其后进行电泳处理,步骤同1.3.1节。
1.3.5 加入不同辅料后经历不同时间自溶后凝胶强度的测定
称取一定量鱼糜样品若干份,分别添加3%的不同种类的辅料,在最佳条件下分别放置30、60、90 min和120 min,再进行灌肠、凝胶化(40 ℃加热30 min后再90 ℃加热30 min),用质构仪分别测定破断强度和凹陷深度,最后计算出凝胶强度 [16]。质构仪测试条件如下:采用直径5 mm的球形探头(TA50),触发点负载4.5 g,探头压缩距离15 mm,探头测试速率1.0 mm/s,每组取3 个平行样品,每个样品重复测6 次,取平均值,凝胶强度计算见如下公式。
1.3.6 加入不同辅料后对鱼糜凝胶的几种化学作用力的测定
鱼糜凝胶在不同蛋白变性溶剂下溶解性的测定参照Hwang等 [17]的方法,略有改动。称取10 g的鱼糜凝胶样品,加入50 mL 0.6 mol/L NaCl(S1)溶液,利用组织捣碎机捣碎(15 000 r/min)2 min,离心(15 000×g,4 ℃)30 min后,采用考马斯亮蓝试剂盒测定上清液的蛋白质含量;在沉淀部分中加入50 mL 0.6 mol/L NaCl+1 mol/L尿素(S2)溶液,同样通过捣碎、离心后,测定鱼糜凝胶在S2溶液中的蛋白质溶解性。根据上述方法,测定鱼糜凝胶在0.6 mol/L NaCl+8 mol/L尿素(S3)溶液和0.6 mol/L NaCl+8 mol/L尿素+0.5 mol/L β-巯基乙醇(S4)溶液中的蛋白质溶解性。S4溶液都不溶解的沉淀部分则通过凯氏定氮法测定鱼糜凝胶的不溶性蛋白含量。
2.1 不同温度对草鱼鱼糜肌原纤维蛋白自溶的影响
自溶指组织细胞失去生活机能,因受内源酶的作用而发生的组织溶解。鱼肉中的组织蛋白酶极易引起自溶现象,而组织蛋白酶对环境温度变化极为敏感,因此温度对鱼肉自溶速率影响较大 [18]。
图1为草鱼鱼糜肌原纤维蛋白在不同温度下自溶的SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gelelectrophoresis,SDS-PAGE)图谱,随着温度升高,草鱼鱼糜肌原纤维蛋白重链(main heavy chain,MHC)含量也出现变化,这与鱼糜内源性组织蛋白酶活性大小随温度变化有关,鱼糜内源性组织蛋白酶活性越大,MHC的降解速率越快,自溶速率则越快。当温度达到65 ℃时,MHC降解最为严重,自溶速率最大。超过65 ℃后,组织蛋白酶活性逐渐降低,MHC含量逐渐升高。图1表明草鱼鱼糜最佳自溶温度为65 ℃,因此在鱼糜的实际生产中为了避免鱼糜凝胶劣化,通常采用两段加热法以迅速通过最佳自溶温度达到提升鱼糜品质的目的 [19]。

图1 不同温度对草鱼鱼糜肌原纤维蛋白自溶影响的SDS-PAGE图
Fig.1 SDS-PAGE pattern showing the effect of temperature on grass carp surimi myofibril protein autolysis
2.2 不同pH值对草鱼鱼糜肌原纤维蛋白自溶的影响
有研究者已从鱼肉中分离出了8 种组织蛋白酶,它们分别是A、B1、B2、C、D、E、H和L,它们最适活性的pH值均偏酸性,其中组织蛋白酶B最适活性pH值范围为5.0~6.0,组织蛋白酶L最适活性的pH值范围为3.0~6.5 [20]。
由图2可知,pH值低于6.5时,鱼糜MHC自溶不明显,在pH值为6.5处,MHC含量明显减少,自溶速率达到最大;pH值大于6.5时,自溶仍然较明显,但速率低于pH 6.5处。图2表明,pH值为6.5时草鱼内源性组织蛋白酶活性最大,最易导致草鱼鱼糜自溶。
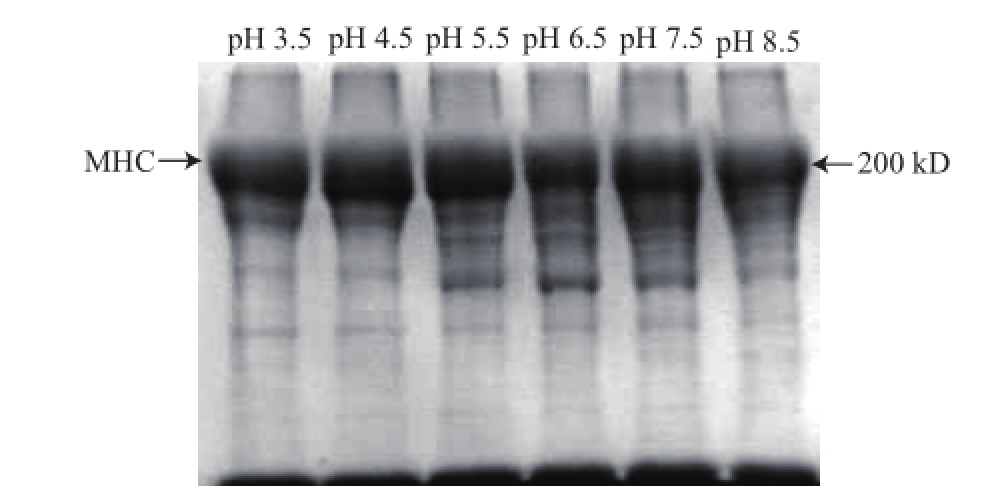
图2 不同pH值对草鱼鱼糜肌原纤维蛋白自溶影响的SDS-PAGE图谱
Fig.2 SDS-PAGE pattern showing the effect of pH on grass carp surimi myofibril protein autolysis
2.3 不同辅料对草鱼鱼糜肌原纤维蛋白自溶的影响
图3为在最佳自溶温度和pH值条件下,不同糖类辅料对草鱼鱼糜肌原纤维蛋白自溶的影响,其中对照组鱼糜中MHC几乎完全降解,1~6号组鱼糜MHC则均保留了一部分,这是由于对照组鱼糜中所含的内源性组织蛋白酶在最佳自溶条件下容易将MHC降解,而辅料对鱼糜的内源性组织蛋白酶活性有抑制作用,且不同辅料的抑制效果也不相同。1~6号组中MHC含量较多的为1、2号和4号,表明抑制自溶效果较好的糖类辅料为马铃薯淀粉、蔗糖+山梨醇和紫山药。
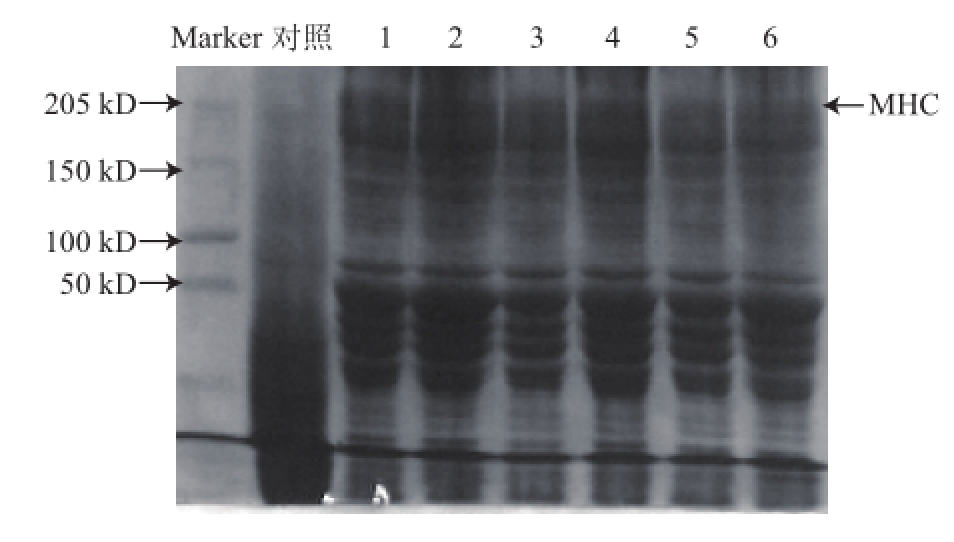
图3 不同糖类辅料对草鱼鱼糜肌原纤维蛋白自溶影响的SDS-PAGE图
Fig.3 SDS-PAGE pattern showing the effect of different saccharide additives on myofibril protein autolysis of grass carp surimi
对照为未添加任何辅料;不同数字分别代表添加了如下辅料:1.马铃薯淀粉;2.蔗糖+山梨醇;3.百合粉;4.紫山药;5.葛粉;6.魔芋精粉。
图4所示为在最佳自溶温度和pH值条件下,不同蛋白类辅料对草鱼鱼糜MHC自溶影响的SDS-PAGE图,对照组中MHC经过90 min的自溶反应几乎完全降解,而加入蛋白类辅料的鱼糜中MHC均未完全降解,表明蛋白类辅料对鱼糜内源组织蛋白酶有抑制作用。由图4可知,根据鱼糜MHC含量大小可得出对鱼糜内源组织蛋白酶抑制的强弱顺序依次为:胶原蛋白>乳清蛋白>大豆蛋白>鱼头酶解物。

图4 不同蛋白类辅料对草鱼鱼糜肌原纤维蛋白自溶影响的SDS-PAGE图
Fig.4 SDS-PAGE pattern showing the effect of different protein additives on myofibril protein autolysis of grass carp surimi
对照为未添加任何辅料;不同数字分别代表添加了如下辅料:1.大豆蛋白;2.胶原蛋白;3.乳清蛋白;4.鱼头酶解物。
2.4 加入辅料后不同时间对草鱼鱼糜肌原纤维蛋白自溶的影响
图5为在最佳自溶温度和pH值条件下,加入马铃薯淀粉(图5a)和胶原蛋白(图5b)后草鱼鱼糜MHC经过不同时间自溶的电泳图谱。图5a所示为加入3%马铃薯淀粉后鱼糜MHC在120 min内降解变化电泳图谱,随着时间延长,鱼糜MHC含量迅速降低,经过120 min自溶后,鱼糜MHC已经完全降解,这是由于马铃薯淀粉对鱼糜组织蛋白酶的抑制效果不佳,鱼糜MHC在120 min内被迅速降解。图5b所示为加入3%胶原蛋白后鱼糜MHC在120 min内降解情况,随着时间延长,鱼糜MHC逐渐降解,其速率较为缓慢,经过120 min自溶后,鱼糜MHC仍有一部分未被降解,这与胶原蛋白对鱼糜组织蛋白酶的抑制效果较好有关,它延缓了鱼糜MHC被降解的速率。
比较图5a和图5b可知,马铃薯淀粉和胶原蛋白均能抑制草鱼鱼糜内源组织蛋白酶部分活性,不同的辅料对鱼糜内源组织蛋白酶抑制效果不同,本实验发现胶原蛋白的抑制效果好于马铃薯淀粉。

图5 加入辅料后不同时间对草鱼鱼糜肌原纤维蛋白自溶影响的SDS-PAGE图PAGE
Fig.5 SDS-PAGE patterns showing myofibril protein autolysis of grass carp surimi at different time points after individual addition of potato starch and collagen
a.加入马铃薯淀粉后自溶不同时间;b.加入胶原蛋白后自溶不同时间。
2.5 加入辅料后经过不同自溶时间对草鱼鱼糜凝胶强度的影响
鱼糜凝胶强度构成的主要因素是鱼糜肌原纤维蛋白之间形成的三维结构,因此鱼糜肌原纤维蛋白含量在一定程度上能够体现鱼糜的凝胶强度。有研究表明,辅料能够改善鱼糜制品品质,主要原因有两个:一是辅料作为填充物能起到固定鱼糜蛋白间交联结构的作用,从而提升鱼糜凝胶强度以及应变力 [9-10];二是辅料中含有可与鱼肉中的蛋白酶争夺活性位点的物质,抑制蛋白酶活性,因此可有效抑制鱼糜制品的自溶 [9]。
图6为草鱼鱼糜对照以及分别加入3%马铃薯淀粉和3%胶原蛋白后,置于65 ℃和 pH 6.5条件下,经过不同时间自溶后凝胶强度的变化情况。从图中变化趋势可以看出,3 组鱼糜凝胶强度均随着自溶时间延长而降低,这是由于鱼糜中含有的内源性组织蛋白酶对鱼糜肌原纤维蛋白MHC进行不断降解,减少了肌原纤维蛋白的数量,降低了鱼糜凝胶强度。
0 min时,即自溶前,加入马铃薯淀粉的鱼糜凝胶强度最大,其次为含胶原蛋白的鱼糜,未添加辅料的鱼糜凝胶强度最弱,表明马铃薯淀粉和胶原蛋白均能与鱼糜蛋白产生一定的填充能力,且马铃薯淀粉对鱼糜蛋白交联结构的填充能力强于胶原蛋白。
在0~30 min时间段内3 组鱼糜凝胶强度下降速率显著,30 min时,加入3%马铃薯淀粉的鱼糜凝胶强度小于含3%胶原蛋白的鱼糜,这是由于马铃薯淀粉组自溶程度大于胶原蛋白组,表明胶原蛋白对鱼糜组织蛋白酶的抑制效果好于马铃薯淀粉。
30~120 min时间段内加入辅料的两组鱼糜凝胶强度下降并不显著,对照组则在60~90 min时间段内出现显著下降。经过120 min自溶后,3 组鱼糜凝胶强度强弱顺序依次为:胶原蛋白组>马铃薯淀粉组>对照组。

图6 不同自溶时间对草鱼鱼糜凝胶强度的影响
Fig.6 Effect of different autolysis time on the gel strength of grass carp surimi
不同小写字母表示同组数据间有显著性差异(P<0.05)。图7同。
2.6 不同辅料对鱼糜凝胶形成作用力的影响
在鱼糜凝胶网络结构中,蛋白之间的相互作用主要通过离子键、氢键、疏水性相互作用、二硫键和非二硫共价键等化学结合力进行维持 [17]。0.6 mol/L NaCl(S1)溶液可以切断鱼糜蛋白之间的离子键结合,0.6 mol/L NaCl+1 mol/L 尿素(S2)溶液可以切断离子键结合和氢键结合,0.6 mol/L NaCl+8 mol/L尿素(S3)溶液可以切断疏水性相互作用,0.6 mol/L NaCl+8 mol/L尿素+0.5 mol/L β-巯基乙醇(S4)溶液甚至能切断二硫键,因此鱼糜凝胶蛋白在S1、S2、S3和S4溶液中的溶解率分别表示了蛋白之间的离子键、氢键、疏水性相互作用和二硫键等化学作用力的比例 [21]。为了阐明胶原蛋白和马铃薯淀粉对鱼糜凝胶中蛋白质之间化学结合力的影响,利用各种蛋白变性剂测定了鱼糜凝胶的溶解性。

图7 不同辅料对草鱼鱼糜凝胶化学作用力的影响
Fig.7 Effect of different additive agents on chemical interactions in grass carp surimi
图7为10 g鱼糜在S1、S2、S3和S4溶液中蛋白质溶解程度,它反映了加入不同辅料对鱼糜蛋白的4 种化学作用力的影响。可明显看出无论有无辅料加入,S3溶解的蛋白均最多,表明鱼糜蛋白间起主要作用的化学键为疏水相互作用,这与Benjakul [22]和刘海梅 [23]等认为的疏水相互作用、二硫键和非二硫共价键是维持鱼糜凝胶稳定构象的主要化学作用力有一定差异。当加入3%胶原蛋白后S1和S4溶解的蛋白增加,而S2和S3溶解的蛋白减少,表明胶原蛋白促进了鱼糜蛋白间离子键和二硫键的作用,同时减弱了氢键和疏水相互作用。当加入3%马铃薯淀粉后,S1溶解蛋白增多,S2、S3和S4溶解的蛋白稍有减少,S4溶解的蛋白含量无显著变化,表明马铃薯淀粉增加了鱼糜蛋白间的离子键,减少了氢键、二硫键和疏水相互作用。
通过上述研究进一步表明,辅料加入鱼糜后能够使鱼糜蛋白间的相互作用力产生变化,导致鱼糜凝胶内部结构发生改变,从而影响了鱼糜制品的品质。
草鱼鱼糜蛋白在不同温度和pH值条件下自溶的SDS-PAGE图表明草鱼鱼糜蛋白自溶最适温度和pH值分别为65 ℃和6.5。
草鱼鱼糜蛋白经过不同时间自溶后的SDS-PAGE图以及鱼糜凝胶强度的结果表明马铃薯淀粉对鱼糜蛋白交联结构的填充能力强于胶原蛋白,而胶原蛋白对鱼糜组织蛋白酶的抑制效果好于马铃薯淀粉。
草鱼鱼糜加入辅料前后的4 种化学作用力的变化结果表明胶原蛋白促进了鱼糜蛋白间离子键和二硫键的作用,同时减弱了氢键和疏水相互作用,而马铃薯淀粉增加了鱼糜蛋白间的离子键,减少了氢键、二硫键和疏水相互作用。因此,辅料的加入能够使鱼糜蛋白间的离子键、氢键、疏水性相互作用和二硫键等化学作用力产生变化,导致鱼糜凝胶内部结构发生改变,从而影响了鱼糜制品的品质。
参考文献:
[1] KABATA Z, WHITAKER D. Two species of kudoa parasite in the flesh of merluccius products[J]. Journal of Zoology, 1981, 59: 2085-2091.
[2] 陈海华, 薛长湖. 不同添加物对鲤鱼鱼糜蛋白凝胶品质改良的研究[J].食品与发酵工业, 2008, 34(10): 79-84.
[3] 陈晓平, 何姣, 李燕, 等. 不同辅料对鱼糜制品品质的影响研究[J].食品工业, 2011, 22(11): 87-90.
[4] 刘欢, 马兵, 宋怿, 等. 几种食品辅料抑制鲢鱼组织蛋白酶B、L、H参与鱼糜凝胶软化的研究[J]. 食品科技, 2010, 35(11): 150-154; 159.
[5] 吴润锋, 袁美兰, 赵利, 等. 不同辅料对草鱼鱼糜品质的影响[J]. 食品科学, 2014, 35(7): 53-57. doi: 10.7506/spkx1002-6630-201407011.
[6] 黄诚, 尹红. 鱼糜凝胶特性改良条件研究[J]. 食品科学, 2009,30(24): 65-67.
[7] 杨贤庆, 丁利, 马海霞, 等. 几种添加物对草鱼鱼糜制品凝胶品质改良的影响[J]. 食品与发酵工业, 2013, 39(3): 67-72.
[8] 高翔, 王蕊, 刘后祥. 低值淡水鱼鱼糜制品凝胶强度的研究[J]. 食品与发酵工业, 2010, 36(6): 53-56.
[9] RAWLINGS N D, BARRETT A J. Protease inhibitors affect physical properties of arrow tooth flounder and walleye Pollock surimi[J]. Journal of Food Science, 1990, 58: 96-98.
[10] MORRISSEY M T, WU J W, LIN D D, et al. Effect of food grad protease inhibitor on autolysis and gel strength of surimi[J]. Journal of Food Science, 1993, 58: 1050-1054.
[11] PARK J W. Surimi and surimi seafood[M]. Boca Raton, Florida: CRC Press Inc., 2013: 227-277.
[12] 张弘. 影响鱼糜制品品质因素的探讨[J]. 食品科学, 1991, 12(2): 18-22. [13] 陈丽丽. 鮰鱼皮中胶原蛋白的提取、性质及其应用研究[D]. 南昌:江西科技师范大学, 2012: 60-69.
[14] NISHIMORO S, HASHIMOTO A, SEKI N, et al. Influencing factors on changes in myosin heavy chain and jelly strength meat paste from Alaska Pollack during setting[J]. Nippon Suisan Gakkaishi, 1987, 52: 2011-2020.
[15] 张楠. 部分纯化的内源组织蛋白酶B、L对鲢鱼鱼糜凝胶的作用[D].北京: 中国农业大学, 2006: 14.
[16] 林琳, 陆剑锋, 翁世兵, 等. 漂洗工艺对鲢鱼鱼糜凝胶强度和色泽的影响[J]. 食品研究与开发, 2012, 33(2): 8-12.
[17] HWANG J S, LAI K M, HSU K C. Changes in textural and rheological properties of gels from tilapia muscle proteins induced by high pressure and setting[J]. Food Chemistry, 2007, 104: 746-753.
[18] HO M L, CHEN G H. Effects of mackerel cathepsins L and L-like, and calpain on the degradation of mackerel surimi[J]. Fisheries Science,2000, 66(3): 558-568.
[19] 张呈峰. 白鲢鱼糜制品加工关键工艺及酶解白鲢鱼内脏的研究[D].北京: 中国农业大学, 2003: 16-25.
[20] FENNEMAO R. 食品化学[M]. 王璋, 译. 北京: 中国轻工业出版社,2003: 359-442.
[21] 黄玉平, 翁武银, 张希春, 等. 鱼皮明胶蛋白对淡水鱼糜凝胶特性的影响[J]. 中国食品学报, 2012, 12(11): 51-58.
[22] BENJAKUL S, VISESSANGUAN W, CHANTARASUWAN C. Effect of high temperature setting on gelling characteristic of surimi from some tropical fish[J]. International Journal of Food Science and Technology, 2004, 39: 671-680.
[23] 刘海梅, 熊善柏, 谢笔钧, 等. 鲢鱼糜凝胶形成过程中化学作用力及蛋白质构象的变化[J]. 中国水产科学, 2008, 15(3): 469-475.
Mechanism of Additive Agents for Improving Gel Performance of Grass Carp Surimi
YUAN Meilan, CHEN Lili, WU Runfeng, ZHAO Li*, ZHANG Yanan, WEI Lili
(National R&D Branch Center for Conventional Freshwater Fish Processing, School of Life Science,Jiangxi Science and Technology Normal University, Nanchang 330013, China)
Abstract:In this study, the mechanism for improving the performance of grass carp surimi gel with additive agents was studied through gel electrophoresis, texture profile analysis and chemical reaction of surimi gel. The results showed that the optimal temperature and pH for grass carp surimi autolysis were 65 ℃ and 6.5, respectively. The filling ability of potato starch in cross-linking structure of surimi protein was higher than in that of collagen, while collagen had higher inhibition on cathepsin than potato starch did. The additive agents improved the quality of surimi through changing ionic bonds, hydrogen bonds, hydrophobic interactions and disulfide bonds in surimi.
Key words:grass carp surimi; additive agents; autolysis; surimi quality
中图分类号:TS254.4
文献标志码:A
文章编号:1002-6630(2015)09-0044-05
doi:10.7506/spkx1002-6630-201509009
收稿日期:2014-07-23
基金项目:江西省高等学校科技落地计划项目(KJLD12009);江西省现代农业产业技术体系建设专项(赣财教指2013258)
作者简介:袁美兰(1978—),女,副教授,博士,研究方向为食品科学。E-mail:yuanmimi@163.com
*通信作者:赵利(1967—),女,教授,博士,研究方向为食品化学。E-mail:lizhao618@hotmail.com