
图1 紫皮石斛及其横切面
Fig.1 Cross sections of Dendrobium devoninum stems
a.紫鞘型;b.紫条型;c.血草型。图3~6同。
杨晓娜 1,徐 玲 1,*,赵昶灵 2,尹卓平 3
(1.保山学院资源环境学院,云南 保山 678000;2.云南农业大学农学与生物技术学院,云南 昆明 650201;3.龙陵石斛研究所,云南 保山 678300)
摘 要:以3 种类型的龙陵紫皮石斛(Dendrobium devonianum)茎为试材,用溶剂法提取色素,并研究其稳定性。结果表明:3 种类型龙陵紫皮石斛色素溶液在可见光533.0 nm波长处有吸收峰,其色素的主要成分为花色苷。紫鞘型、紫条型和血草型紫皮石斛花色苷含量分别为39.65、35.05、15.85 mg/L。温度的改变对紫皮石斛花色苷影响较大,随着温度升高,颜色逐渐加深;在阳光照射下,花色苷极不稳定,Mg 2+和Al 3+对花色苷有很好的增色、稳定作用;Cu 2+、Zn 2+和Fe 3+使花色苷明显褪色,并伴有沉淀;随着H 2O 2和VC、Na 2SO 3浓度的增大,颜色逐渐消退;食盐对紫皮石斛花色苷有一定的增色作用;蔗糖和柠檬酸使花色苷明显褪色。
关键词:紫皮石斛;花色苷;提取;鉴定;稳定性
紫皮石斛是以齿瓣石斛(Dendrobium devonianum Paxt.)为代表的一类兰科石斛属植物,属附生多年生草本,是近年来开发利用的药用佳品,主要分布于中国的云南、贵州等省,缅甸、越南、泰国等地 [1]。云南省龙陵县是最早实现紫皮石斛人工栽培的县 [2],其代表种为齿瓣石斛,主要分布于龙山、龙江、象达、平达、木城等乡镇,该类石斛以茎条紫红色为显著特征。经调查,发现其在种植过程中出现5 种变异类群(血草型、紫鞘型、紫条型、铁线草型和绿壳型),其中紫鞘型、紫条型、血草型茎紫化现象较为明显,富含天然色素。
花色苷类化合物是类黄酮合成途径的有色末端产物,是影响花和果实的主要色素 [3],不仅不存在安全性问题,而且具有辅助降血脂 [4]、降低冠状动脉心脏病发病率、调理血液循环的紊乱、治疗糖尿病和口腔溃疡 [5]、缓解视疲劳 [5]、抗衰老、抗肿瘤、抗病原体、抗炎、保护胃免受损伤 [6]等生理功能。大量的流行病学研究证明食物中的花色苷和植物多酚对人类许多疾病有预防和治疗作用 [6]。随着科技的发展,人们对食品添加剂的安全性越来越重视,合成色素的使用种类和数量已经大幅度下降 [7]。因此,开发和应用天然色素已成为世界食用色素发展的总趋势。
紫皮石斛作为保山重要的植物资源,虽已证明其富含多糖、氨基酸、矿物质、生物碱等,但对紫皮石斛花色苷的鉴定及稳定性鲜有报道。为充分利用紫皮石斛植物资源,本研究用溶剂法提取紫鞘型、紫条型、血草型紫皮石斛花色苷,并进行鉴定和稳定性分析,旨在为紫皮石斛的天然色素开发提供参考。
1.1 材料与试剂
选用新鲜、无病虫害、无霉烂的紫鞘型、紫条型、血草型紫皮石斛茎(图1)作试材,采购自龙陵县紫皮石斛人工种植基地,除叶后于—20 ℃冰箱保存备用。

图1 紫皮石斛及其横切面
Fig.1 Cross sections of Dendrobium devoninum stems
a.紫鞘型;b.紫条型;c.血草型。图3~6同。
甲醇、乙醇、盐酸、乙酸、石油醚、氯仿、丙酮、甲苯、乙酸乙酯、亚硫酸钠、氯化铁、氨水、碳酸钠、氢氧化钠、氯化镁、氯化铝、硫酸铜、氯化钾、氯化亚铁、氯化铁、氯化钙、氯化铅、VC、过氧化氢、亚硫酸钠、食盐、蔗糖、柠檬酸(均为分析纯) 昆明云科生物技术有限公司。
1.2 仪器与设备
SHB-ⅢA循环水式多用真空泵(配有特制的流体消声器) 郑州长城科工贸有限公司;RE-52AA旋转蒸发仪(配有国外先进变频控制系统和温度控制系统) 上海亚荣生化仪器厂;UV5000紫外-可见分光光度计(配有计算机操作系统,防水式7寸大屏幕触摸和进口硅光二极管) 安徽皖仪科技股份有限公司;CP系列电子天平(配有100 g校准砝码) 上海奥豪斯仪器有限公司;PHS-25 pH仪(配有“定位”、“温度补偿”外,还设有“斜率调节”,可对电极转换系数进行校正) 上海虹益仪器仪表有限公司;DK-8AX型电热恒温水槽(配有三组独立的水槽和相应的控温设备) 上海一恒科技有限公司。
1.3 方法
1.3.1 溶剂法提取紫皮石斛花色苷
将以上3 种类型紫皮石斛从—20 ℃冰箱取出,紫鞘型(取紫色分布区域)、紫条型(取紫色分布区域)、血草型(整株)各称取100 g,均切成约1~2 cm长,1~2 mm厚的片段,置于1 000 mL体积分数1%盐酸-甲醇溶液中,标记后于4 ℃冰箱浸提24 h后过滤。将滤液用旋转蒸发仪浓缩(温度<40 ℃),并回收甲醇,将浓缩液于棕色瓶4 ℃保存以待备用。
1.3.2 紫外-可见光谱分析方法
将3 种类型紫皮石斛色素提取液用紫外-可见分光光度计在200~690 nm波长范围内扫描,获得紫外-可见图谱 [8]。
1.3.3 理化性质鉴定方法 [9]
1.3.3.1 溶解性测定
吸取3 份乙酸、石油醚、水、80%乙醇、氯仿、丙酮、甲苯、乙酸乙酯各10 mL,分别加3 种类型紫皮石斛色素浓缩液3 滴,观察溶解情况。
1.3.3.2 颜色反应
取紫皮石斛提取液10 mL,加入几滴Na 2SO 3溶液,振荡,观察溶液颜色变化情况,然后再加入几滴浓盐酸,振荡,观察颜色变化情况;取紫皮石斛提取液10 mL,逐滴加入3% FeCl 3溶液,振荡,观察颜色变化情况。将紫皮石斛提取液滴在滤纸上,置于浓氨水上方,观察颜色变化情况;将紫皮石斛提取液滴在滤纸上,加几滴饱和Na 2CO 3溶液,放置空气中观察颜色变化情况;取紫皮石斛提取液20 mL 14 份,用1 mol/L NaOH和1 mol/L HCl将花色苷提取液配制为pH 1.0~14.0的溶液,观察溶液颜色变化情况。
1.3.4 紫皮石斛提取液中花色苷含量测定
用pH示差法测定 [10],分别取紫鞘型、紫条型、血草型样品5 mL,分别用pH 1.0的KCl(0.2 mol/L KCl与0.2 mol/L HCl体积比为25∶67 )和pH 4.5的乙酸钠缓冲液(1 mol/L CH 3COONa、1 mol/L HCl和H 2O体积比为100∶60∶90)定容至25 mL,室温下平衡20 min,分别测定两样品在533 nm和700 nm波长处的吸光度。吸光度及紫皮石斛提取液中花色苷含量(ρ)计算公式如下。
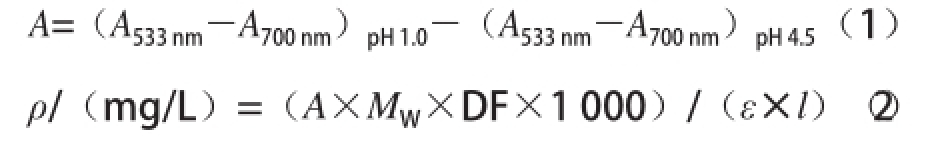
式中:M W为矢车菊素-3-葡萄糖苷的分子质量,为449.2 g/mol;DF为稀释因子,此处为5;ε为矢车菊素-3-葡萄糖苷摩尔消光系数,此处为26 900 L/(cm·mg);l为比色皿厚度/cm。
1.3.5 稳定性测定 [11]
1.3.5.1 热稳定性
分别取200 mL稀释了10 倍的紫鞘、紫皮和血草花色苷提取液7 份,分别装于21 个碘量瓶中,其中一份为对照,其余在不同温度(20、30、40、50、60、70 ℃)的水浴中各加热3 h,常温冷却后测定533 nm波长处的吸光度,并观察其颜色变化。
1.3.5.2 光稳定性
分别取200 mL稀释10 倍的紫鞘、紫皮和血草花色苷提取液各3 份,分别装于9 个碘量瓶中,分别置于阳光直射处(夏季室外晴天)、室内自然光处、室内避光处保存,7 d后测定其 533 nm波长处的吸光度,并观察其颜色变化。
1.3.5.3 金属离子对花色苷稳定性的影响
分别配制5.0×10 —4mol/L 的Mg 2+、Al 3+、Zn 2+、Cu 2+、Fe 2+、Fe 3+、Ca 2+溶液,吸取稀释10 倍的紫鞘、紫皮和血草花色苷提取液各5 mL,分别加入金属离子溶液定容至15 mL。在室内暗处放置7 d后,测定其533 nm波长处的吸光度并观察其颜色变化。
1.3.5.4 氧化还原剂对花色苷稳定性的影响
各取10 份10 mL稀释了10 倍的紫鞘、紫皮和血草花色苷提取液,其中各取一份为对照,加蒸馏水定容到25 mL,其余的分别加入质量分数为0.5%、1%、2%的VC,0.1%、0.5%、1%的H 2O 2和0.1%、0.5%、1%的Na 2SO 3,定容为25 mL,在室内暗处放置7 d后测定其在533 nm波长处的吸光度。
1.3.5.5 食品添加剂对花色苷稳定性的影响
分别取54 份10 mL稀释了10 倍的紫鞘、紫皮和血草花色苷提取液,其中9 份为对照,其余分别加入质量分数为0.5%、1%、1.5%、2%、2.5%、3%的蔗糖,3%、4%、5%、6%的食盐,1%、2%、3%、4%、5%的柠檬酸)溶液15 mL,在室内暗处放置7 d后测定其在533 nm波长处的吸光度。
2.1 紫皮石斛色素的光谱特征
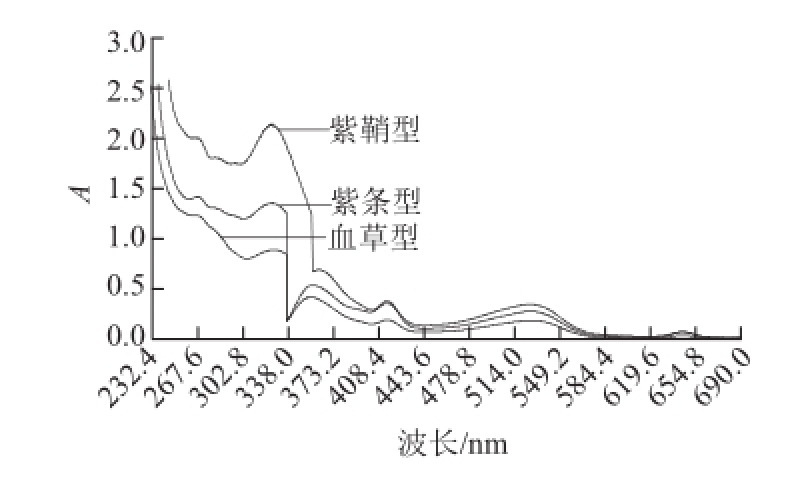
图2 紫皮石斛花色苷紫外扫描图谱
Fig.2 Absorption spectra of anthocyanins from Dendrobium devonianum
由图2可知,紫鞘型、紫条型、血草型紫皮石斛色素最大吸收波长均为533 nm。刘玉芹 [12]以6 种紫色蔬菜(紫洋葱、紫甘蓝、羽衣甘蓝、紫山药、紫薯、紫红薯)为试材提取花色苷,光谱特征表明:这6 种紫色蔬菜在500~540 nm波长处都有吸收峰;陈亮等 [13]提取了野生桑葚的花色苷,光谱特征表明野生桑葚花色苷在520 nm波长有吸收峰;张学宁等 [14]提取了蓝莓果实花色苷,光谱特征表明:蓝莓花色苷在535 nm波长处有吸收峰。岳桦等 [15]提取了卫矛叶片的花色苷,光谱特征表明:卫矛叶片花色苷在530 nm波长处有吸收峰。经查阅文献,花色苷及其色素元在可见光465~550 nm波长范围内有吸收峰 [8]。由此可以判断紫皮石斛色素属花色苷 [16]。
2.2 紫皮石斛色素理化性质
2.2.1 溶解性
3 种类型紫皮石斛色素浓缩液不溶于石油醚、氯仿、丙酮等非极性溶剂,易溶于水、酸、醇。可以判断该色素属水溶性色素,这一现象符合花色苷的特征 [17]。
2.2.2 颜色反应
表1 紫皮石斛花色苷颜色反应
Table 1 Color reactions of anthocyanins from Dendrobium devonianum
试剂Na 2SO 3+HCl5% FeCl 3NH 3·H 2O饱和Na 2CO 3色相褪色后恢复红色棕褐色变蓝后褪色变蓝不褪色
紫皮石斛色素溶液在不同试剂中的颜色反应见表1。该色素遇Na
2SO
3褪色,加HCl溶液恢复为红色,这一现象符合花色苷的 特点
[7]。紫皮石斛色素遇5% FeCl
3呈棕褐色,是化合物中无酚羟基的特征性反应。紫皮石斛色素遇浓氨水先变蓝后褪色,是因为浓氨水呈碱性,可改变介质pH值,并解离出铵根离子与色素分子相结合,通过改变紫皮石斛色素的结构而导致其褪色
[18]。紫皮石斛色素遇碱性的碳酸钠,介质pH值升高,溶液变蓝,但
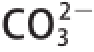 与Na
+均不与色素分子结合,因而溶液的蓝色不会褪去
[18]。
与Na
+均不与色素分子结合,因而溶液的蓝色不会褪去
[18]。
3 种紫皮石斛花色苷溶液在pH 1.0~6.0,花色苷颜色均呈现红色,且随pH值的增大颜色逐渐变淡,pH 3.0均呈现深红色,pH 7.0时,颜色均转为淡紫色,紫鞘和紫皮花色苷在pH 8.0~14.0时均有絮状沉淀,血草花色苷在pH 9.0、10.0、12.0、14.0时有絮状沉淀。
可见,紫皮石斛色素的颜色反应现象均符合花色苷的特性,可初步判断紫皮石斛色素主要成分为花色苷。
2.2.3 紫皮石斛花色苷含量
根据pH示差法公式,计算3 种紫皮石斛花色苷的含量,紫鞘型、紫条型和血草型紫皮石斛花色苷含量分别为39.65、35.05、15.85 mg/L。孙婧超 [19]用pH示差法测定蓝莓酒酿过程中花色苷含量,其含量为395.43 mg/L;张采等 [20]用pH示差法对自制蓝莓米酒中总花色苷含量进行测定,其含量为17.48 mg/100 mL。经查阅相关花色苷含量测定的文献并进行比较,发现本实验的花色苷含量不高,可能是因为在提取过程中虽进行了浓缩,但没有冷冻干燥机,浓缩后的花色苷溶液没有进行冷冻干燥,溶液的中含有一定的水,所以含量偏低。
2.3 紫皮石斛色素稳定性
2.3.1 温度对紫皮石斛花色苷的影响

图3 温度对紫皮石斛花色苷稳定性的影响
Fig.3 Effect of temperature on the stability of anthocyanins from Dendrobium devonianum
由图3可知,3 种类型的紫皮石斛花色苷溶液在20 ℃条件下,花色苷稳定性均较好,但随着温度升高和加热时间的延长,颜色均逐渐加深,吸光度也随之增大,说明花色苷可以经过分子自聚作用使花色苷的颜色增强 [21]。
2.3.2 光照对紫皮石斛花色苷的影响

图4 光照对紫皮石斛花色苷稳定性的影响
Fig.4 Effect of light on the stability of anthocyanins from Dendrobium devonianum
由图4可知,3 种类型紫皮石斛花色苷溶液在避光和室内自然光下保存,稳定性均较好,但在室外受阳光照射后,吸光度均下降,稳定性较差,说明紫皮石斛花色苷的稳定性易受光照影响,光照能加快花色苷的降解 [22],在保存花色苷溶液时,应避光、低温保藏。
2.3.3 金属离子对紫皮石斛花色苷的影响
由图5可知,金属离子对3 种类型紫皮石斛花色苷溶液的稳定性作用由大到小均为:Mg 2+>Al 3+>Ca 2+>Fe 2+>Cu 2+>Zn 2+>Fe 3+>Pb 2+。其中Mg 2+和Al 3+对花色苷有很好的增色、稳定作用;Ca 2+和Fe 2+对花色苷的稳定性影响不大;Cu 2+、Zn 2+和Fe 3+使花色苷明显褪色,并伴有沉淀,这可能是因为花色苷与金属离子形成了络合物 [23],因此,在生产应用中应尽量避免与Cu 2+、Zn 2+和Fe 3+等金属离子的接触。
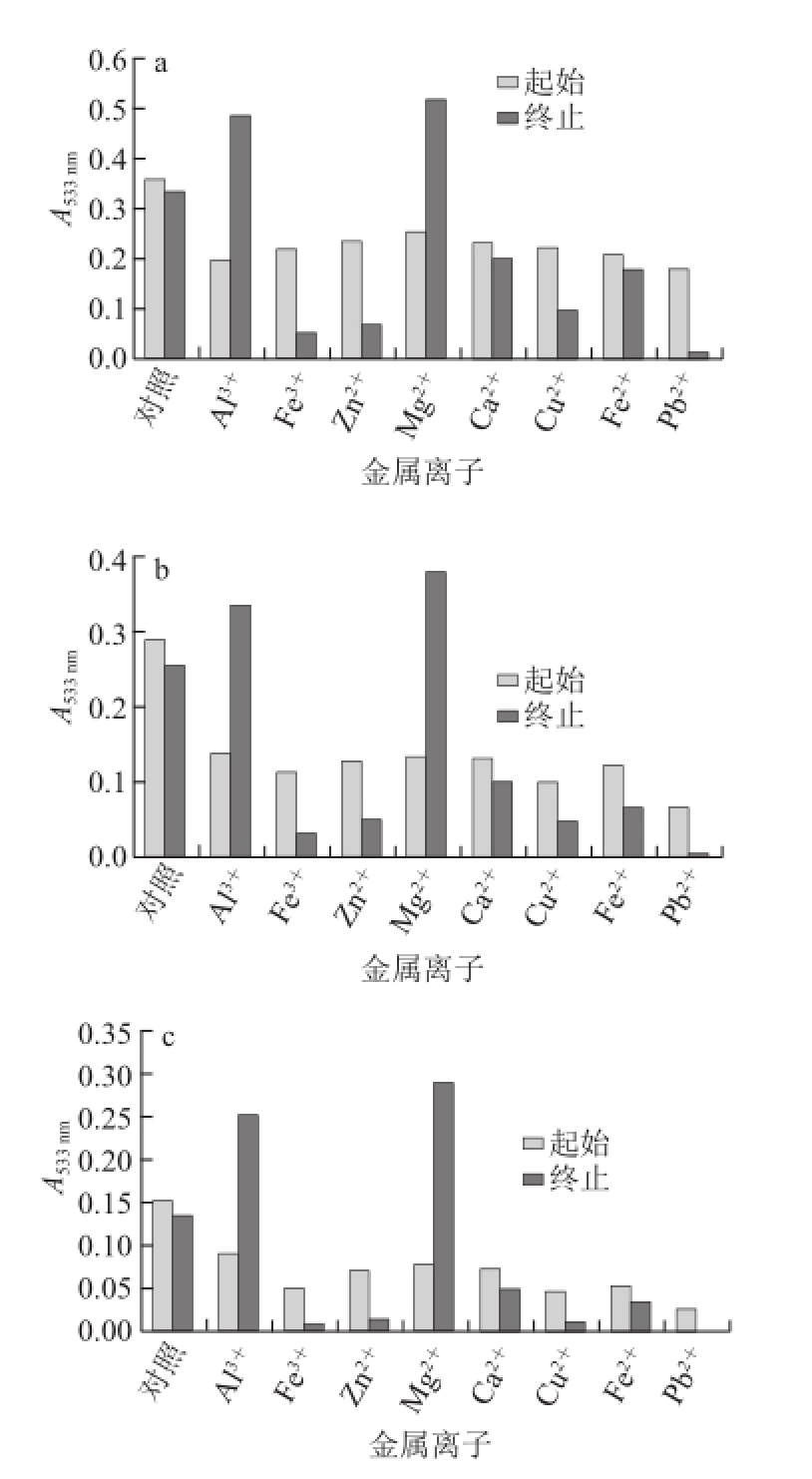
图5 金属离子对紫皮石斛花色苷稳定性的影响
Fig.5 Effect of metal ions on the stability of anthocyanins from Dendrobium devonianum
起始为花色苷溶液与各金属离子溶液混合时的吸光度;终止为混合7 d后的吸光度;对照组为花色苷溶液加蒸馏水。
2.3.4 氧化还原剂对紫皮石斛花色苷的影响
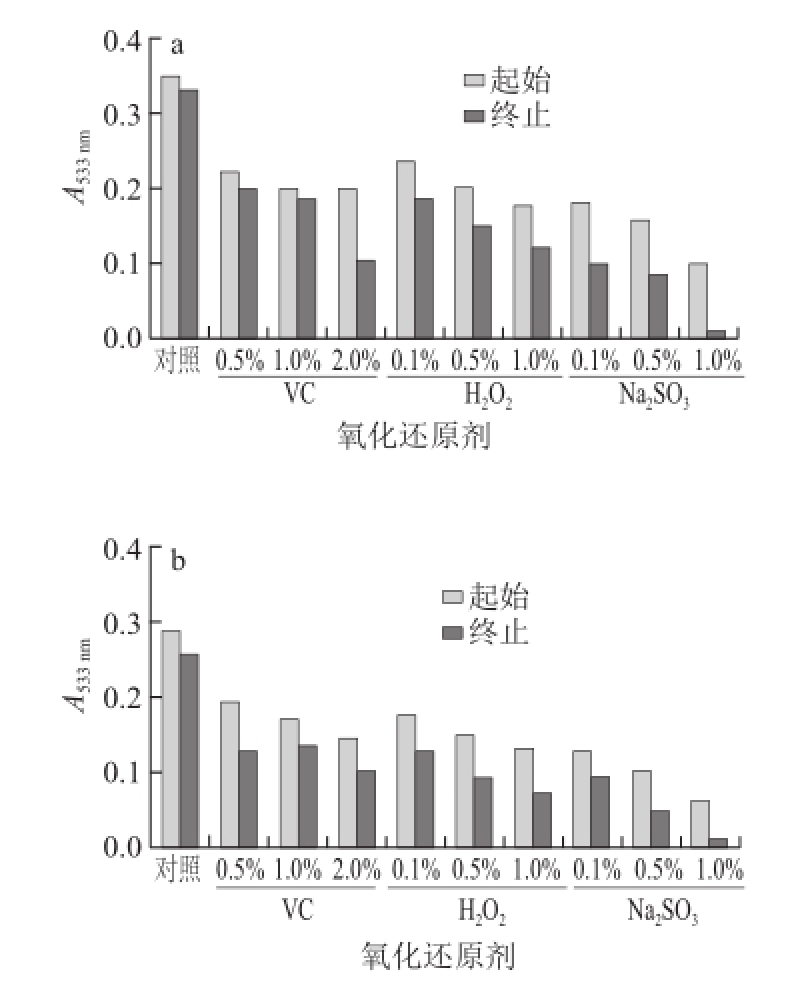
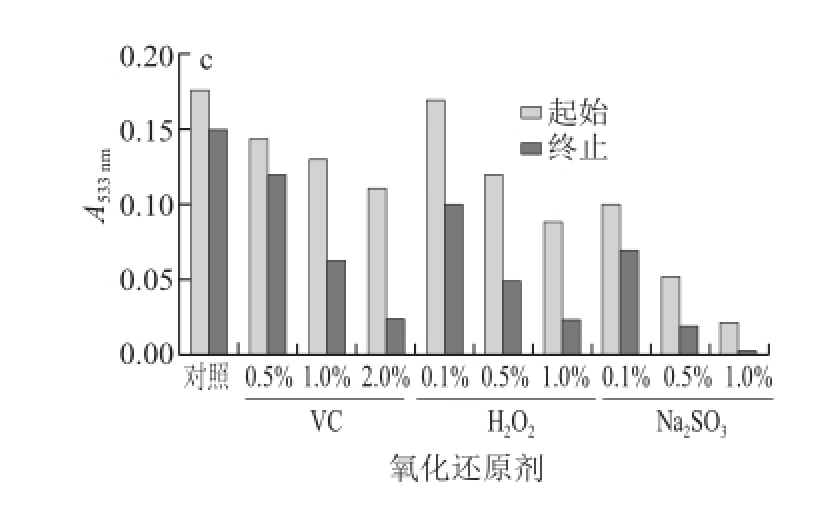
图6 氧化还原剂对紫皮石斛花色苷稳定性的影响
Fig.6 Effect of redox agents on the stability of anthocyanins from Dendrobium devonianum
由图6可知,3 种类型紫皮石斛花色苷溶液随着H 2O 2和VC、Na 2SO 3质量分数的增大,花色苷的吸光度急剧下降,颜色逐渐消退,表明紫皮石斛花色苷耐氧化、耐还原性差 [24],在使用时应尽量避免与氧化性或还原性物质接触。
2.3.5 食盐、蔗糖和柠檬酸对紫皮石斛花色苷的影响
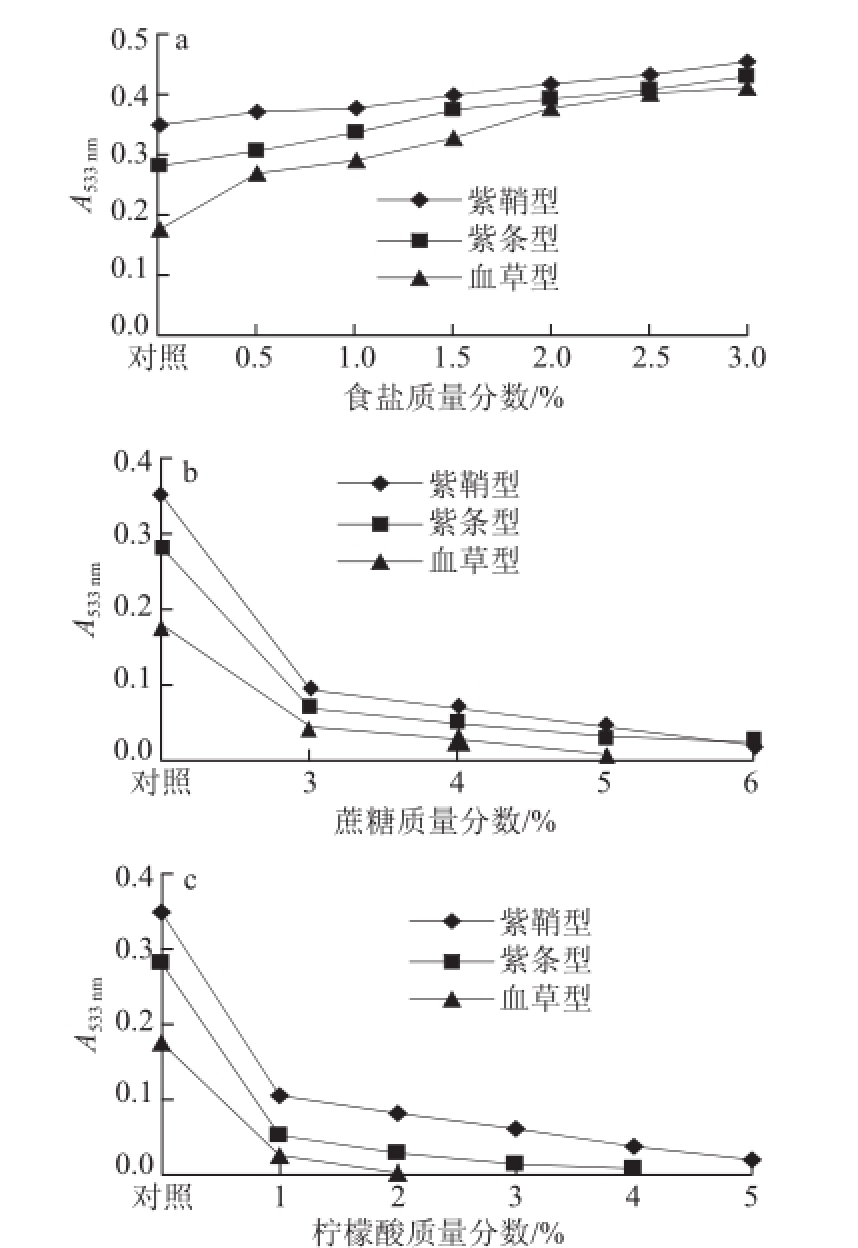
图7 食盐(a)、蔗糖(b)、柠檬酸(c)对紫皮石斛花色稳定性的影响
Fig.7 Effect of salt (a), sugar (b) and citric acid (c) on the stability of anthocyanins from Dendrobium devonianum
由图7可知,3 种类型紫皮石斛花色苷溶液吸光度随食盐质量分数的增大而增大,说明食盐对紫皮石斛花色苷有一定的增色作用;而加入蔗糖和柠檬酸后,花色苷溶液吸光度随蔗糖和柠檬酸质量分数的增大而减小,说明一定质量分数的蔗糖和柠檬酸有明显的褪色作用,且随质量分数的增大而加强。
3 种类型紫皮石斛花色苷经紫外-可见光谱仪扫描,图谱分析表明在可见光区533 nm波长处有吸收峰,结合理化性质分析的结论,由此可以判定紫皮石斛色素属于花色苷类色素。用pH示差法,测得紫鞘型、紫条型和血草型紫皮石斛花色苷含量分别为39.65、35.05、15.85 mg/L。
以温度、光照、金属离子、氧化还原剂和食品添加剂作为影响紫皮石斛花色苷稳定性的因素进行实验,结果发现3 种类型紫皮石斛花色苷溶液在不同因素作用下,其影响效果均一致,温度的改变对紫皮石斛花色苷影响较大,随着温度升高,颜色逐渐加深,花色苷可以经过分子自聚作用使花色苷的颜色增强。光照条件影响花色苷的稳定性,在自然光照射下,花色苷极不稳定。Mg 2+和Al 3+对花色苷有很好的增色、稳定作用;Cu 2+、Zn 2+和Fe 3+使花色苷明显褪色,并伴有沉淀,这可能是因为花色苷与金属离子形成了络合物。随着VC、H 2O 2和Na 2SO 3浓度的增大,花色苷颜色逐渐消退,0.5% Na 2SO 3就能使花色苷褪色,原因是SO 2作用于花色苷类色素的苯并吡喃环的4位碳上,生成了一种无色物质 [25]。食盐对紫皮石斛花色苷有一定的增色作用,一定质量分数的蔗糖和柠檬酸有明显的褪色作用,且随质量分数的增大而加强。
参考文献:
[1] 包雪声, 顺庆生, 陈立钻. 中国药用石斛彩色图谱[M]. 上海: 上海医科大学出版社, 2001: 56-60.
[2] 冉懋雄, 刘家保. 云南龙陵紫皮石斛产业发展的思考与建议[J]. 中国现代中药, 2010, 12(2): 11-13.
[3] HOLTON T A, CORNISH E C. Genetics and biochemistry of anthocyanin biosynthesis[J]. The Plant Cell, 1995, 7(7): 1071-1083.
[4] FOSSEN T, SLIMESTAD R, ANDERSEN ☒ M. Anthocyanins from maize (Zea mays) and reed canary grass (Phalaris arundinacea)[J]. Journal of Agricultural and Food Chemistry, 2001, 49(5): 2318-2321.
[5] CHANDRA A, RANA J, LI Y. Separation, indentification, quantification , and method validation of anthocyanins in botanical supplement raw materials by HPLC and HPLC-MS[J]. Journal of Agricultural and Food Chemistry, 2001, 49(8): 3515-3521.
[6] ANDERSEN. Chemical studies of anthocyanins in plants, isolation qualitative and quantitative determination[D]. Norway: University of Bergen, 1988: 12-16.
[7] 肖军霞, 黄国清, 耿欣. 红树莓色素的定性鉴定及提取工艺研究[J].食品研究与开发, 2012, 33(2): 112-114.
[8] HARBORNE J B. Spectral methods of characterizing anthocyanins[J]. Biochemistry Journal, 1958, 70(1): 22-28.
[9] 马自超. 天然食用色素化学及生产工艺学[M]. 北京: 中国林业出版社, 1994: 5-6.
[10] FULEKI T, FRANCIS F J. Quan titative methods for anthocyanins. 1. Extraction and determination of total anthocyanin in cranberries[J]. Journal of Food Science, 1968, 33(1): 72-77.
[11] 李伟. 黑粒小麦麸皮中花色苷组分的分离、鉴定及抗氧化功能的研究[D]. 泰安: 山东农业大学, 2011: 42-45.
[12] 刘玉芹. 六种紫色蔬菜中花色苷的定性定量分析及抗氧化活性研究[D]. 泰安: 山东农业大学, 2011: 28-30.
[13] 陈亮, 辛秀兰, 袁其朋. 野生桑葚中花色苷成分分析[J]. 食品工业科技, 2012, 33(15): 307-310.
[14] 张学宁, 高志华, 刘庆忠, 等. 蓝莓花色苷提取工艺的优化研究[J].河北工业科技, 2013, 30(2): 66-72.
[15] 岳桦, 于淼. 卫矛叶片花色苷的提取及稳定性研究[J]. 河南农业科学, 2014, 43(4): 110-113.
[16] JURD I. Spectral properties of flavonoid compounds[M]//TEISSMAN T A. The chemistry of flavonoid compounds. New York: Pergaamon Press, 1962: 130-135.
[17] 李颖畅. 植物花色苷[M]. 北京: 化学工业出版社, 2013: 8-9.
[18] 孙中武. 植物化学[M]. 哈尔滨: 东北林业大学出版社, 2001: 94-98.
[19] 孙婧超. 蓝莓酒酿造过程中花色苷变化规律的研究[D]. 烟台: 烟台大学, 2012: 53-55.
[20] 张采, 沈晓同. 蓝莓米酒中总花色苷含量的测定[J]. 安徽农学通报,2014, 20(8): 163-165.
[21] GOTO T, KONDO T. Structure and molecular stackong of anthocyanins-flower color variation[J]. Angewandte Chemie International Edition, 1991, 30: 17-33.
[22] 郑杰, 丁晨旭, 赵先恩, 等. 花色苷化学研究进展[J]. 天然产物研究与开发, 2011, 23(5): 970-978.
[23] 任二芳, 李昌宝, 孙健, 等. 金属离子和食品添加剂对桑果花色苷稳定性的影响[J]. 南方农业学报, 2014, 4(1): 98-103.
[24] 肖湘, 王立亚. 黑玉米穗轴色素的稳定性研究[J]. 现代食品科技,2012, 28(1): 18-22.
[25] 汪东风. 食品化学[M]. 2版. 北京: 化学工业出版社, 2014: 214-216.
Extraction and Stability of Anthocyanins from Dendrobium devonianum Grown in Longling
YANG Xiaona
1, XU Ling
1,*, ZHAO Changling
2, YIN Zhuoping
3
(1. Resources and Environmental Sciences, Baoshan University, Baoshan 678000, China; 2. College of Agricultural and Biotechnology, Yunnan Agricultural University, Kunming 650201, China; 3. Longling Dendrobium Institute, Baoshan 678300, China)
Abstract:The solvent extraction and stability of anthocyanins from the stems of Dendrobium devonianum grown in Longling, Yunnan province, China were studied. The results showed that the absorption peak of the anthocyanins occurred at 533.0 nm. Solubility and color tests showed that anthocyanins were the major components of the pigments extracted from Dendrobium devonianum. The total contents of anthocyanin in purple sheath-type, purple strip-type and red core-type Dendrobium devonianum were 39.65, 35.05 and 15.85 mg/L, respectively. The temperature to some extent had great effect on the anthocyanins of Dendrobium devonianum. As the temperature rose, the color gradually deepened. When exposed to sunlight, the anthocyanins were unstable extremely. Metal ions such as Mg 2+and Al 3+had hyperchromic and protective effects on the pigments, while Cu 2+, Zn 2+and Fe 3+could result in fading of the color accompanied with apparent precipitation. Increasing concentration of H 2O 2, VC and Na 2SO 3could accelerate fading. However, Na 2SO 3exhibited a hyperchromic effect on the pigments, but sucrose and citric acid could exert negative effects on the stability of the anthocyanins.
Key words:Dendrobium devonianum; anthocyanin; extraction; identification; stability
中图分类号:TS255.1
文献标志码:A
文章编号:1002-6630(2015)09-0049-06
doi:10.7506/spkx1002-6630-201509010
收稿日期:2014-05-12
基金项目:保山市第一批中青年学术和技术带头人项目(bszqnxshjsdtr2012-04);保山市科技计划项目;云南省应用研究基础面上项目(2011FB094)
作者简介:杨晓娜(1984—),女,助教,硕士,研究方向为植物天然色素。E-mail:hemuzeyang@163.com
*通信作者:徐玲(1978—),女,副教授,博士,研究方向为植物组织培养与病虫害防治。E-mail:xuling09083@163.com