白 雪 1,张 彬 1,*,邓丹雯 1,赵 强 2,罗家星 3,肖义波 1
(1.南昌大学中德食品工程中心,江西 南昌 330047;2.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;3.金佳谷物股份有限公司樟树油厂,江西 樟树 331200)
摘 要:碱溶酸沉法所制备的番茄籽分离蛋白,其溶解性等功能性质较差。以番茄籽分离蛋白为原料,研究微射流均质对其功能性质及结构的影响。结果表明:微射流均质过程中番茄籽分离蛋白的结构变化与其功能性质的改变存在关联。微射流均质提高了番茄籽分离蛋白的溶解性、乳化性及乳化稳定性;均质后的番茄籽蛋白粒径更小,分布更均匀;暴露巯基和总巯基含量减少;分子内部疏水基团暴露,表面疏水性提高;蛋白晶体结构变化不大;蛋白质的二级结构发生了变化,α-螺旋、无规卷曲、β-转角均减少,而β-折叠增加。这些变化说明,微射流均质处理使蛋白分子发生了伸展或折叠,从而改变其功能性质。
关键词:番茄籽分离蛋白;微射流处理;功能性质;结构
目前,我国番茄的种植和加工规模已位居世界第三,番茄酱出口位居世界第一。番茄加工厂产生的番茄果渣质量占原料总质量的3%~5%,主要成分是番茄籽,占果渣60%以上 [1]。据联合国粮食及农业组织(Food and Agriculture Organization,FAO)统计,2012年中国番茄产量达5 000万t [2],可产生90~150万t番茄籽。
番茄籽中含22.2%~33.9%粗蛋白 [1],且没有抗营养因子或有害成分 [3],番茄籽蛋白的氨基酸种类齐全,赖氨酸含量较高,达80~100 g/kg,可作为强化赖氨酸的蛋白源 [4]。由此可见,番茄籽是一种潜在的廉价蛋白资源。但分离得到的番茄籽蛋白功能性质较差,限制了其在食品工业中的应用。
高压微射流利用超高压、高频振动、高速撞击、强烈剪切和气蚀等一系列机械力综合作用,可达到很好的微乳化、超微化和均一化效果 [5]。微射流均质已不同程度地改善了芸豆分离蛋白 [6]、小麦面筋蛋白 [7]、乳球蛋白 [8]等多种蛋白的功能特性。目前关于微射流处理番茄籽蛋白、探讨功能特性及其结构变化的研究尚未见报道。本实验采用微射流处理番茄籽蛋白,通过高压均质改变蛋白分子的排列和结构 [6,9-10],提高番茄籽蛋白的功能特性,以期为番茄籽蛋白的应用提供实验依据。
1.1 材料与试剂
番茄籽由中粮屯河股份有限公司提供。
三羟甲基胺基甲烷(Tris)、Folin-酚试剂、乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA) 索莱宝化学试剂公司;8-苯胺基-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)、5,5’-二硫代双-(2-硝基苯甲酸)(5,5’-dithio bis-(2-nitrobenzoic acid),DTNB)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、甘氨酸 美国Sigma公司;石油醚(沸程60~90 ℃) 天津市大茂化学试剂厂;大豆调和油 市售;其他化学药品均为分析纯。
1.2 仪器与设备
FreeZone 12-Plus冷冻干燥机 美国Labconco公司;T6紫外-可见分光光度计 北京普析通用仪器有限责任公司;F-4500荧光分光光度计 日本日立公司;FSH-Ⅱ型高速匀浆机 江苏金坛市环宇科学仪器厂;PB-10 pH计 赛多利斯科学仪器(北京)有限公司;Nicolet 5700傅里叶变换红外光谱仪 美国Thermo Nicolet公司;Nano-ZS90纳米粒度仪 英国马尔文公司;D8-Focus X衍射仪 德国布鲁克公司;M-110EH微射流均质机 美国Microfluidics公司。
1.3 方法
1.3.1 番茄籽分离蛋白(tomato seed protein isolate,TSPI)的制备
番茄籽粉碎后,过60 目筛,取过筛的番茄籽粉用于分离番茄籽蛋白。番茄籽粉与石油醚按1∶4(m/V)混合,常温搅拌1 h,抽滤,浸提液通过旋转蒸发仪回收石油醚,番茄籽继续用石油醚浸提2 次,置通风厨中挥干,得到脱脂番茄籽粉。脱脂番茄籽粉用蒸馏水(1∶20,m/V)分散,用1 mol/L NaOH溶液调节pH值至8.5,在50 ℃保温30 min,期间滴加NaOH溶液以维持pH值,4 800 r/min离心10 min,收集上清液。用1 mol/L HCl溶液调节该上清液pH值至4.5,4 ℃冰箱冷沉20 min后,4 800 r/min离心15 min,弃上清液,沉淀经2 次水洗后,冷冻干燥,得到的TSPI在—20 ℃冰箱内贮存备用。
1.3.2 微射流处理
称取2.5 g TSPI,用250 mL蒸馏水分散,用1 mol/L NaOH溶液调节pH值至7.0,用普通均质机预处理后,再用微射流均质机处理一次,均质压力分别为40、80、120、 160 MPa。冷冻干燥,得到的TSPI微射流均质样品在—20 ℃冰箱内贮存备用。
1.3.3 溶解性测定
用去离子水配制0.1 g/100 mL的样品溶液,磁力搅拌30 min,5 000 r/min离心15 min,取适量上清液,以去离子水补足至1 mL,按Folin-酚法测定上清液的蛋白质含量。
1.3.4 乳化活性及乳化稳定性测定
乳化活性及乳化稳定性采用比浊法测定
[11]。乳化活力指数(emulsifying activity index,EAI)是指单位质量的蛋白质所产生的界面面积,可根据乳状液的浊度(T)与界面面积(S)的关系(S=2T),测得吸光度,计算T
![]() 得到T=2.303A(式中:I
0为入射光强度;I为透射光强度;A为500 nm波长处的吸光度),再依照该式计算得出EAI值。
得到T=2.303A(式中:I
0为入射光强度;I为透射光强度;A为500 nm波长处的吸光度),再依照该式计算得出EAI值。
EAI和乳化稳定性指数(emulsion stability i n d e x,E S I)测定方法:在圆底离心管中加入16 mL 0.1 g/100 mL的样品溶液和4 mL大豆油,用匀浆机以12 000 r/min高速剪切1 min,立即用移液枪从底部0.5 cm处取乳状液50 ☒L,加入5 mL 0.1 g/100 mL SDS溶液稀释,涡旋振荡混匀,在500 nm波长处测吸光度(A 0),10 min后再次用移液枪取50 ☒L乳状液,用SDS溶液稀释后测定其吸光度(A 10)。

式中:ρ为样品溶液质量浓度/(g/mL),本实验取0.001 g/mL;φ为油相所占体积分数/%,取0.20;D为稀释倍数,取100;2.303是ln10计算结果。
1.3.5 表面疏水性测定
表面疏水性的测定采用荧光探针ANS法 [13]。用蒸馏水配制0.05 g/100 mL的蛋白质溶液,高速分散机(12 000 r/min)均质1 min后,再逐步稀释至质量浓度为0.005~0.025 g/100 mL,取不同质量浓度的样品溶液2 mL,测定各质量浓度蛋白质的荧光强度(FI 0),再分别加入8 mmol/L 的ANS溶液20 ☒L,涡旋振荡5 s,避光静置10 min,然后测定添加ANS溶液的样品的荧光强度(FI 1)。激发波长λ ex=390 nm,发射波长λ em=470 nm。FI 1与FI 0的差值记为FI,以荧光强度FI对蛋白质质量浓度作图,不同图的斜率即为不同处理的蛋白分子的表面疏水性指数(H 0)。
1.3.6 暴露巯基和总巯基含量测定 [14]
精确称取30 mg TSPI样品,加入10 mL 溶解液(pH 8.0的Tris-Gly缓冲液溶解暴露巯基,Tris-Gly-8 mol/L尿素缓冲液溶解总巯基)中,振荡溶解,再加入0.1 mL Ellman试剂(DTNB含量为4 mg/mL的Tris-Gly缓冲液),25 ℃避光振荡1 h,5 000 r/min离心10 min,测定上清液在412 nm波长处的吸光度(A 412 nm)。巯基(—SH)含量的计算公式如下。
式中:D为稀释倍数,取1.01;ρ为蛋白质质量浓度/(mg/mL);73.53=10 6/1.36×10 4,1.36×10 4为TNBA(Ellman试剂与巯基反应所生成的5-硫代-2-硝基苯甲酸(盐)阴离子)的摩尔消光系数,单位为L/(mol·cm)。
1.3.7 X衍射分析
蛋白质样品的结晶结构,采用X衍射仪测试。测定条件:Cu Kα辐射,石墨单色器,电压40 kV,电流40 mA,在2°~60°范围内扫描。
1.3.8 粒径测定
蛋白质样品用蒸馏水分散,采用粒度仪测定蛋白粒子分布及其大小。
1.3.9 红外光谱分析
取少量蛋白粉末与KBr混合,充分研磨,压片,采用傅里叶红外光谱仪进行扫描。分辨率4 cm -1,扫描次数32 次,扫描范围4 000~400 cm -1。
2.1 溶解性
蛋白质的溶解性体现了蛋白质的水化作用,衡量蛋白质溶解性的指标是水溶液中蛋白质的含量。有研究表明,与高质量浓度蛋白质溶液相比,低质量浓度蛋白质溶液经高压均质处理后溶解性更高 [15-16],所以本实验以1 g/100 mL TSPI为实验材料。由图1可知,在160 MPa内,TSPI的溶解性随压力升高而增大。这主要是因为微射流处理所产生的高频振动、高速撞击、强烈剪切等机械作用,使TSPI的分子结构得以伸展,从而使蛋白质分子内部的极性基团暴露出来,蛋白质分子的表面电荷增加,与水的结合能力增强,从而改善了蛋白的溶解性 [17]。
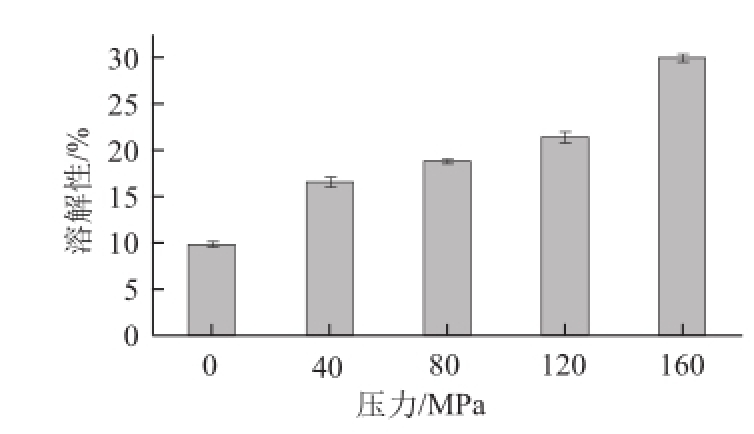
图1 微射流处理对番茄籽分离蛋白溶解性的影响
Fig.1 Effect of microfluidization treatment on the solubility of TSPI
2.2 乳化活性和乳化稳定性
蛋白质的乳化过程复杂,影响其乳化性的因素很多,如蛋白分子质量分布、溶解性、表面疏水性、pH值等。经过微射流处理的TSPI的乳化活性及乳化稳定性的变化如图2所示。随着微射流处理压力的增大,TSPI的EAI和ESI呈现先增大后减小的变化趋势,在120 MPa时EAI和ESI达到最大,高于120 MPa,EAI和ESI降低,但均高于未经微射流处理样品。这与溶解性和表面疏水性的结果比较一致。这可能是因为蛋白质的溶解性提高,向油-水界面的扩散能力增强,另一方面,蛋白质在压力的作用下结构变得较为松散,分子去折叠,暴露出更多的极性基团和非极性基团,亲水性和亲油性提高,从而提高了蛋白质的EAI和ESI。压力进一步加大,可能使已展开的蛋白质分子通过疏水相互作用重新聚合,形成了高分子聚集体,表面疏水性减少,蛋白质的表面积减小,乳化性能变差 [18]。

图2 微射流处理对番茄籽分离蛋白乳化活性及乳化稳定性的影响
Fig.2 Effect of microfluidization treatment on the emulsifying activity and emulsion stability of TSPI
2.3 表面疏水性
疏水相互作用是保持蛋白质独特三维结构的主要作用力,它对蛋白质结构的稳定、蛋白质构象及其功能性质,具有显著的影响。由图3可知,TSPI的表面疏水性(H 0)随着微射流均质处理压力的增加而增加,压力上升到120 MPa时,H 0达到最大,继续增大到160 MPa时,H 0反而下降。由此表明,微射流均质处理使TSPI的三维结构发生了变化,蛋白质分子发生去折叠,破坏了分子内部的疏水相互作用,从而使更多的疏水基团暴露,H 0增大;而经160 MPa均质处理的蛋白质H 0有所减少,可能是因为压力过大,使已展开的蛋白质分子通过疏水相互作用重新聚合,形成了稳定的高分子聚集体 [19]。
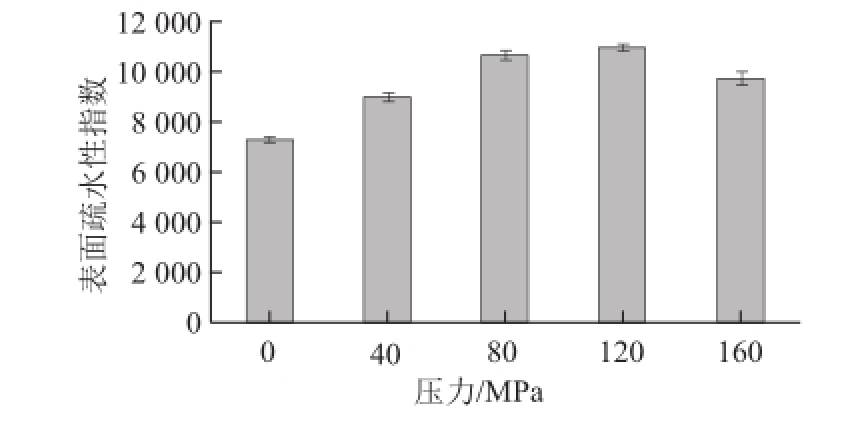
图3 微射流处理对番茄籽分离蛋白表面疏水性的影响
Fig.3 Effect of microfluidization treatment on the surface hydrophobicity of TSPI
2.4 总巯基和暴露巯基含量
巯基是蛋白质中重要的功能基团,对蛋白的功能性质有着重要影响,如成膜性 [20],形成面筋、凝胶等 [21]。加热、还原剂、氧化剂和高压处理等都能使巯基发生变化。在蛋白质中,一部分游离巯基暴露在表面,一部分埋藏在分子内部 [22]。由图4可知,TSPI的暴露巯基与总巯基含量相近,说明TSPI中的巯基大部分是暴露在分子表面的。TSPI的暴露巯基和总巯基含量随着压力的升高,均有不同程度的降低。这可能是因为微射流处理时所产生的超高压、瞬时压降、强烈剪切等机械作用使分子结构松散,非共价键断裂,内部巯基暴露,但暴露出来的巯基容易被氧化生成二硫键,从而使其含量降低。也可能是因为高压处理使得蛋白质分子氧化重折叠,在这聚合过程中暴露的巯基被包埋到分子内部去了,使暴露巯基减少。这与花生蛋白的研究结果相似 [23]。

图4 微射流处理对番茄籽分离蛋白巯基含量的影响
Fig.4 Effect of microfluidization treatment on the exposed sulfhydryl and total sulfhydryl contents of TSPI
2.5 X衍射分析
X衍射分析主要用来鉴定结晶化合物,但也可以用于分析含部分结晶的无定形态混合物 [24]。如大豆分离蛋白,通过研究其衍射角度及其峰型的变化,判断其晶型结构的变化 [25]。
由图5可知,TSPI的衍射图谱峰型较宽,说明它是无定型态混合物。在衍射角2θ=8°和20°附近有两个主要的衍射峰。与未经微射流处理的TSPI相比,经过40 MPa以上压力处理的TSPI的衍射谱图明显平坦了许多。由表1可知,衍射峰的强度随压力增大而持续减弱,其中峰2强度减弱幅度较大,40 MPa和80 MPa处理后的TSPI的衍射峰的角度略向左移,当压力上升到120 MPa和160 MPa,其衍射角却又向右移动。由此表明,微射流均质处理对TSPI的晶型微结构略有破坏,但并不显著,其晶体结构变化不明显。

图5 微射流处理后的番茄籽分离蛋白X衍射图谱
Fig.5 X-ray diffraction curves of TSPI influenced by microfluidization treatment
表1 微射流处理后的番茄籽分离蛋白X衍射图谱峰值参数
Table 1 Peak parameters of XRD pattern of TSPI influenced by microfluidization treatment

压力/MPa峰1峰2 2θ/(°)强度/cps2θ/(°)强度/cps 08.299300.0120.336445.02 408.139295.0119.621360.02 807.85728 0.0118.717310.01 1208.738275.0119.363295.01 1608.857185.0020.694260.01
2.6 粒径分布

图6 微射流处理对番茄籽分离蛋白粒度分布的影响
Fig.6 Effect of microfluidization treatment on the particle size distribution of TSPI
由图6可知,经过微射流处理的TSPI的粒径分布向左移动,并且随着压力增加,向左移动越大,表明微射流处理使蛋白的粒径减小了。但经160 MPa处理的TSPI的粒子峰向左移动距离略微小于120 MPa处理的TSPI。从表2也可以看出,120 MPa以内处理的TSPI的平均粒径随压力的增大而减小,但超过120 MPa,平均粒径反而有所增大。与未经微射流处理的TSPI的粒子峰相比,经过处理的TSPI的粒子峰更窄,说明粒径分布更均匀。微射流作用时所产生的超高压、瞬时压降、强烈剪切、高速撞击等机械作用可破碎蛋白颗粒,形成小颗粒蛋白,使高分子蛋白聚集体解聚,形成较小的分子,所以粒径更小,这与Bouaouina [26]、Rastogi [27]等的报道相符;但当压力过大,小分子蛋白又可重新聚合。这就解释了经160 MPa处理的TSPI的粒径比120 MPa处理得到的TSPI略大。
表2 微射流处理对番茄籽分离蛋白平均粒径的影响
Table 2 Effect of microfluidization treatment on the mean particle diameter of TSPI
压力/MPa04080120160平均粒径/nm526.7466.8448.0428.0434.9
2.7 红外光谱分析
红外光谱可用于不同质量浓度、状态及环境中蛋白质或多肽的测定 [28]。红外光谱中酰胺Ⅲ带不受水分子干扰,不同二级结构在此区域的光谱性质特征明显,去卷积和拟合后容易将它们分开,避免了酰胺Ⅰ带中谱峰重叠而导致螺旋和无规卷曲结构难以区分的问题,所以本实验采用酰胺Ⅲ来进行蛋白质二级结构指认。


图7 微射流处理后番茄籽分离蛋白的红外光谱图
Fig.7 Deconvoluted and fitting results of FTIR spectra of TSPI influenced by microfluidization treatment
a~e.压力分别为0、40、80、120、160 MPa。
配合Peakfit 4.12软件,对TSPI的红外光谱酰胺Ⅲ带进行去卷积及拟合,拟合图见图7。参照文献[27],1 330~1 290 cm -1归属为α-螺旋,1 295~1 265 cm -1归属为β-转角,1 270~1 245 cm -1归属为无规卷曲,1 250~1 220 cm -1归属为β-折叠。表3为TSPI二级结构变化的分析结果。
由图7可知,去卷积和拟合后,在酰胺Ⅲ带区域获得了6 个子峰。均质处理后,1 243 cm -1处的峰发生了2~4 cm的蓝移。从表3中分析得出的蛋白质二级结构的组成来看,α-螺旋、β-折叠和无规卷曲都有不同程度的减少,β-转角结构组成增加。与TSPI相比,160 MPa时TSPI的β-折叠增加了22.72%,β-转角减少了11.22%,无规卷曲减少了8.77%。由此看来,微射流处理使TSPI的二级结构发生了较大变化。
表3 番茄籽分离蛋白的二级结构含量变化
Table 3 Changes in the secondary structure contents of TSPI %
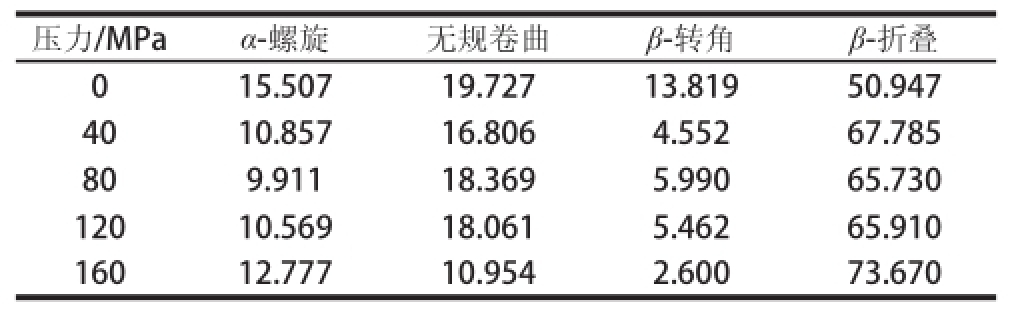
压力/MPaα-螺旋无规卷曲β-转角β-折叠015.50719.72713.8195 0.947 4010.85716.8064.55267.785 809.91118.3695.99065.730 12010.56918.0615.46265.910 16012.77710.9542.60073.670
高压微射流处理可明显改善TSPI的溶解性、乳化性及乳化稳定性,随着处理压力的增加,溶解性、乳化性及乳化稳定性均不断提高。当处理压力为160 MPa时,溶解性达到最大,由原来的9.82%提高到29.96%。乳化活性指数随压力的增加变化不大,而乳化稳定性在压力为120 MPa时,由77.95%提高到93%。处理压力超过120 MPa时,对蛋白的乳化性能产生不利影响。随着压力的增加,蛋白质的粒度分布及微观结构发生了不同程度的变化,蛋白质颗粒尺寸随压力增加而减小,分布也更均匀;经120 MPa均质后,疏水基团暴露出来,表面疏水性指数由7 304.6增加到10 980.4;自由巯基基团随压力增大而减少,但减少幅度不大;晶体结构变化不显著。高压微射流处理后,蛋白质的二级结构也发生了不同程度的变化,α-螺旋、无规卷曲、β-转角均减少,而β-折叠增加。在不同压力下TSPI的功能性质和结构变化程度不同的主要原因是蛋白质分子的展开/折叠及聚集的程度不同。
参考文献:
[1] SOGI D S, BHATIA R, GARG S K, et al. Biological evaluation of tomato waste seed meals and protein concentrate[J]. Food chemistry,2005, 89(1): 53-56.
[2] Food and Agriculture Organization of the United Nations. FAOSTAT [DB/OL]. (2012)[2014-08-06]. http://faostat.fao.org/site/339/default.as px.
[3] SOGI D S, ARORA M S, GARG S K, et al. Fractionat ion and elec trophoresis of tomato waste seed proteins[J]. Food Chemi stry,2002, 76(4): 449-454.
[4] SOGI D S, SIDHU J S, ARORA M S, et al. Effect of tomato seed meal supplementation on the dough and bread characteristics of wheat (PBW 343) flour[J]. International Journal of Food Properties, 2002,5(3): 563-57 1.
[5] 雷勇刚, 郑茵, 李理. 微射流处理对发酵豆乳流变学特性及微观结构的影响[J]. 现代食品科技, 2013, 29(2): 251-255.
[6] 尹寿伟, 唐传核, 温其标, 等. 微射流处理对芸豆分离蛋白构象和功能特性的影响木[J]. 华南理工大学学报: 自然科学版, 200 9, 37(10): 112-116.
[7] 刘国琴, 阎乃珺, 陈璐瑶. 动态高压微射流对小麦面筋蛋白功能性质影响的研究[J]. 现代食品科技, 2013, 29(5): 936-940.
[8] ZHONG Junzhen, LIU Wei, LIU Chenmei, et al. Aggregation and conformational changes of bovine β-lactoglobulin subjected to dynamic high-pressure microfluidization in relation to antigenicity[J]. Journal of Dairy Science, 2012, 95(8): 4237-4245.
[9] SHEN Lan, TANG Chuanhe. Microfluidization as a potential technique to modify surface properties of soy protein isolate[J]. Food Research International, 2012, 48(1): 108-118.
[10] CHEN Lin, CHEN Jianshe, REN Jiaoyan, et al. Modificati ons of soy protein isolates using combined extrusion pre-treatment and controlled enzymatic hydrolysis for improved emulsifying properties[J]. Food Hydrocolloids, 2011, 25(5): 887-897.
[11] PEARCE K N, KINSELLA J E. Emulsifying properties of protein s: evaluation of a turbidimetric technique[J]. Journal of Agricultural and Food Chemistry, 1978, 26(3): 716-723.
[12] CASTANHO M A, SANTOS N C, LOURA L M. Separating the turbidity spectra of vesicles from the absorption spectra of membrane probes a nd other chromophores[J]. European Biophysics Journa l,1997, 26(3): 253-259.
[13] KATO A, NAKAI S. Hydrophobicity determined by a fluorescence probe method and its correlation with surface properties of proteins[J]. Biochimica et Biophysica Acta (BBA)-Protein Structure, 1980, 624(1): 13-20.
[14] ZHAO Qiang, XIONG Hua, SELOMULYA C, et al. Effects of spray drying and freeze drying on the properties of protein isolate from rice dreg protein[J]. Food and Bi oprocess Technology, 2013, 6(7): 1759-1769.
[15] PUPPO C, CHAPLEAU N, SPERONI F, et al. Physicochemical mod ifications of high-pressure-treated soybean protein isolates[J]. Journal of Agricultural and Food Chemistry, 2004, 52(6): 1564-1571.
[16] WANG Xiansheng, TANG Chuanhe, LI Biansheng, et al. Effects of high-pressure t reatment on some physicochemical and functional properties of soy protein isolates[J]. Food Hydrocolloids, 2008, 22(4): 560-567.
[17] HU Xiao, ZHAO Mouming, SUN Weizheng, et al. Effects of microfluidization tr eatment and transglutaminase cross-linking on physicochemical, functional, and conformational properties of peanut protein isolate[J]. Journal of Agricultural and Food Chemistry, 2011,59(16): 888 6-8894.
[18] 豆玉新. 动态超高压微射流均质对卵清蛋白改性机理的研究[D]. 南昌: 南昌大学, 2008.
[19] YAN Wei, QIAO Xiaohong, GU Junhua, et al. Effect of high pressure treatment on the physicochemical and functional properties of egg yolk[J]. Euro pean Food Research and Technology, 2010, 231(3): 371-377.
[20] HANDA A, GENNADIOS A, HANNA M A, et al. Physical and molecular properties of egg-white lipid films[J]. Journal of Food Science, 1999, 64(5): 860-864.
[21] SHIMADA K, CHEFTEL J C. Determination of sulfhydryl groups and disulfide bonds in heat-induced gels of soy protein isolate[J]. Journal of Agricultural and Food Chemistry, 1988, 36(1): 147-153.
[22] 李丽娜, 李军生, 阎柳娟. 分光光度法测定食品蛋白质中二硫键的含量[J]. 食品科学, 2008, 29(8): 562-564.
[23] 张雪春. 超高压微射流技术对花生蛋白改性的研究[D]. 南昌: 南昌大学, 2007.
[24] SILVA H D, CERQUEIRA M ☒, VICENTE A A. Nanoemulsions for food applications: development and characterization[J]. Food and Bioprocess Technology, 2012, 5(3): 854-867.
[25] GUERRERO P, BEATTY E, K ERRY J P, et al. Extrusion of soy protein with gelatin and sugars at low moisture content[J]. Journal of Food Engineering, 2012, 110(1): 53-59.
[26] BOUAOUINA H, DESRUMAUX A, LOISEL C, et al. Functional properties of whey proteins as affected by dynamic high-pressure treatment[J]. International Dairy Journal, 2006, 16(4): 275-284.
[27] RASTOGI N K, RAGHAVARAO K S, BALASUBRAMAN IAM V M,et al. Opportunities and challenges in high pressure processing of foods[J]. Critical Reviews in Food Science and Nutrition, 2007, 47(1): 69-112.
[28] 谢孟峡, 刘媛. 红外光 谱酰胺Ⅲ带用于蛋白质二级结构的测定研究[J].高等学校化学学报, 2003, 24(2): 226-231.
Changes in Functional Properties and Structure of Tomato Seed Protein Isolate after Microfluidization Treatment
BAI Xue
1, ZHANG Bin
1,*, DENG Danwen
1, ZHAO Qiang
2, LUO Jiaxing
3, XIAO Yibo
1
(1. Sino-German Food Engineering Center, Nanchang University, Nanchang 330047, China; 2. State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China; 3. Zhangshu Oil Factory of Jiangxi Jinjia Grains Co. Ltd., Zhangshu 331200, China)
Abstract:Functional properties of tomato seed protein isolate (TSPI) prepared by alkali extraction and acid precipitation are not as good as desired. The effect of high-pressure microfluidization treatment on functional properties and structure of TSPI was studied. The results indicated that the changes in functional properties of TSPI might be related to the changes in its structure. The solubility and emulsifying ability of TSPI were improved after microfluidization treatment; the diameter of protein particles became smaller and the particle size distribution became more uniform; the exposed sulfhydryl and total sulfhydryl contents were decreased; some intramolecular hydrophobic groups were exposed and the surface hydrophobicity was improved; the changes of crystal structure were small; the secondary structures of TSPI were changed, that is, the contents of α-helix, random coil and β-turn were decreased while the content of β-sheet was increased. These changes revealed that the protein molecules were spread or folded after microfluidization treatment a nd thus the functional properties were changed.
Key words:tomato seed protein isolate; microfluidization treatment; functional properties; structure
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2015)09-0060-06
doi:10.7506/spkx1002-6630-201509012
收稿日期:2014-06-16
作者简介:白雪(1988—),女,硕士研究生,研究方向为天然产物的开发与利用。E-mail:986800207@qq.com
*通信作者:张彬(1956—),男,教授,本科,研究方向为食品工程。E-mail:394517020@qq.com