王 爽 1,周 巍 1,2,刘红冉 1,李永波 1,马超峰 1,张 岩 1,*
(1.河北省食品检验研究院,河北省食品安全重点实验室,河北 石家庄 050071;2.河北农业大学食品科技学院,河北 保定 071000)
摘 要:为有效改善纳他霉素发酵液中的氧传递速率,研究了几种氧载体对纳他霉素发酵的影响。结果表明,氧载体不能作为碳源被细胞利用,并能提高发酵体系溶氧量和传氧速率,有效促进单位细胞的纳他霉素产率的提高。在摇瓶发酵初期添加6%的大豆油、6%的橄榄油和9%的二甲基硅油,纳他霉素产量分别提高了56.8%、59.5%和72.5%。发酵初期添加6%的表面活性剂吐温-80可促进菌体生长,同时有效提高纳他霉素产量82.6%。
关键词:褐黄孢链霉菌;纳他霉素;氧载体;表面活性剂
纳他霉素(Natamycin),又称游链霉素,是一种天然的二十六元多烯大环内酯类抗生素,由褐黄孢链霉菌(Streptomyces gilvosporeus)等产生,能够有效抑制酵母菌等真菌的生长及真菌毒素的产生。目前,我国允许使用的生物防腐剂仅为乳酸链球菌素(Nisin)、纳他霉素(Natamycin) [1]。纳他霉素在食品中的使用剂量低,很难被人体消化道吸收,对人体无致癌、致畸、致突变和致敏作用。同时纳他霉素溶解度很低,既不会影响食品中的其他成分,也不会影响食品风味,其作为一种天然、广谱、高效、安全的食品防腐剂,已在世界30多个国家广泛应用于乳制品、肉制品、发酵酒、饮料和果汁等食品的生产和保藏 [2-3]。
目前纳他霉素在国际市场上需求数量巨大,产品出口空间广阔。但国内发酵水平较低,导致生产成本太高,纳他霉素的价格高达每千克上千元,这严重制约了纳他霉素在食品工业的广泛应用。因此许多研究机构开展了包括优化发酵培养菌株 [4]、发酵培养基 [5]、发酵培养条件 [6]、添加前体物质 [7-8]等优化方案的课题研究,以期降低纳他霉素的生产成本,提高纳他霉素的产量。
在发酵过程中,发酵液中的溶氧浓度(dissolved oxygen,DO)可以直接影响微生物的酶活性、代谢途径,对微生物的生长和产物合成具有重要的影响。在常规的液态发酵体系中加入氧载体(oxygen vectors),其一般具有比水更高的溶氧量,且与发酵液不互溶,可以减少气-液两相之间的传氧阻力,提高底物溶氧能力 [9]。添加氧载体的发酵体系具有氧传递速度快、能耗低、气泡生成少、剪切力小等特点 [10]。近年来研究发现常用的氧载体有烷烃类化合物、氟碳化合物、煤油、植物油和表面活性剂等。液态烷烃类及煤油储存使用过程中易引发一定的安全隐患,全氟化碳的高价格也抑制了其工业化的大量应用。因此研究植物油脂和表现活性剂对纳他霉素生物合成的影响具有重要的理论和实用价值。
1.1 菌株、培养基与试剂
实验菌株:褐黄孢链霉菌(S t re p t o m y c e s gilvosporeus)ATCC 13326,购于美国典型培养物保藏中心(American Type Culture Collection,ATCC)。
斜面保存/平板分离培养基:葡萄糖10 g/L、蛋白胨5 g/L、酵母粉3 g/L、麦芽浸粉3 g/L、琼脂粉15 g/L、蒸馏水1 L,pH 7.0。
种子培养基:葡萄糖20 g/L、蛋白胨6 g/L、酵母粉6 g/L、NaCl 10 g/L、蒸馏水1 L,pH 7.0。
发酵培养基(YEME,酵母膏-麦芽膏培养基):葡萄糖10 g/L、蛋白胨5 g/L、酵母粉3 g/L、麦芽浸粉3 g/L、MgCl 2•6H 2O 1.05 g/L、蒸馏水1 L,pH 7.0。
酵母粉、蛋白胨、麦芽浸粉、琼脂、葡萄糖均为生化试剂;氢氧化钠、氯化钠、无水甲醇、二甲基硅油、橄榄油、吐温-80均为分析纯;大豆油(食用级);纳他霉素标准品 美国Sigma公司。
1.2 仪器与设备
BS-124S型电子天平 北京赛马利斯公司;ES2315高压蒸汽灭菌器 日本Tomy公司;HWY 22112型恒温培养摇床 上海智城分析仪器制造有限公司;DH-101-2型电热鼓风干热箱 天津市中环试验公司;UV22550双光束紫外-可见分光光度计 日本岛津公司。
1.3 方法
1.3.1 菌体培养方法
将1 环试管斜面菌种接入50 mL种子培养基中,28 ℃、180 r/min摇床培养48 h;然后取1 mL种子液加入50 mL发酵培养基中,于28 ℃、180 r/min摇床培养96 h。
1.3.2 样品处理
取1.0 mL发酵液于离心管中,加入9.0 mL无水甲醇,振荡器充分振荡后4 000 r/min离心15 min,除去菌丝体及培养基中的杂质,所得上清液再用无水甲醇适当稀释后即为待测液。
1.3.3 菌体生物量的测定
发酵液培养96 h后,用移液管吸取40 mL经过漏斗过滤,收集菌体,用去离子水洗涤3 次,滤纸105 ℃烘干24 h至质量恒定,以空白滤纸质量为对照,称量并计算菌体生物量,重复测定3 次,取平均值。
1.3.4 紫外分光光度法测定纳他霉素产量
配制一定质量浓度梯度的纳他霉素标准溶液,用UV-2550双光束紫外-可见分光光度计测定其在303.0 nm波长处的吸光度。以纳他霉素标准溶液质量浓度x为横坐标,303.0 nm波长处的吸光度y为纵坐标绘制标准曲线,得到线性回归方程为:y=0.115x—0.016(R² = 0.999)。回归方程线性关系明显,说明纳他霉素质量浓度在0.2~30.0 μg/mL范围内与303 nm波长处的吸光度线性关系良好。测定按照1.3.2节得到的待测液在303 nm波长处的吸光度,代入标准曲线,计算得到待测液中纳他霉素的含量。以未添加氧载体的发酵液中纳他霉素含量为基准,计算添加氧载体的发酵液中纳他霉素的产量,重复测定3 次,取平均值。
1.3.5 氧载体添加实验
1.3.5.1 褐黄孢链霉菌对氧载体的可利用性
种子培养液离心,无菌水冲洗3 次,收集不含培养基成分的菌体,加入无菌水配成一定浓度的菌悬液。二甲基硅油、橄榄油、豆油及吐温-80高温灭菌将制备的菌悬液以10%的接种量接入无碳源培养基(对照组)以及添加3%氧载体的培养基(实验组),摇床发酵培养。取等体积对照组和实验组培养液比较菌体生物量。
1.3.5.2 氧载体添加量影响实验
二甲基硅油、橄榄油、大豆油及吐温-80高温灭菌。在发酵初始阶段按0%、3%、6%、9%、12%的添加量添加在装液量50 mL/250 mL三角瓶中,28 ℃、180 r/min进行发酵培养96 h。测定菌体生物量和纳他霉素产量。
1.3.5.3 氧载体添加时间影响实验
二甲基硅油、橄榄油、大豆油及吐温-80高温灭菌。按各氧载体的最优添加体积分数,分别在发酵后0、24、48、72 h时添加在装液量50 mL/250 mL三角瓶中,28 ℃、180 r/min进行发酵培养96 h。测定菌体生物量和纳他霉素产量。得率系数计算公式同1.3.5.2节。
1.4 统计分析
所有数据结果采用SPSS统计软件进行方差分析(analysis of variance,ANOVA)和邓肯氏多重检验(P<0.05)。
2.1 褐黄孢链霉菌对氧载体的可利用性
有机试剂作为氧载体用于微生物好氧发酵的前提是不能作为碳源被细菌利用,考察褐黄孢链霉菌对液态烷烃的可利用性,以确定添加的氧载体能否作为碳源供细胞生长 [11]。由图1可知,对照组和实验组菌体生物量基本相等(P<0.05),说明实验所用褐黄孢链霉菌不以其作为碳源生长繁殖 [11],因此添加物质可以作为氧载体用于纳他霉素发酵。

图1 氧载体对菌体生长的影响
Fig.1 Effect of oxygen vectors on the growth of Streptomyces gilvosporeus
2.2 氧载体添加量的影响
2.2.1 大豆油添加量的影响

图2 大豆油添加量对菌体生物量和纳他霉素合成的影响
Fig.2 Effect of soybean oil concentration on cell dry weight and natamycin production
由图2a可知,在0%~15%的添加量范围内,随着大豆油的添加量的增加,菌体生物量显著增加(P<0.05),在添加量为15%时达到最大值26.5 g/L。发酵体系中加入大豆油时纳他霉素产量比未加入时高,其中添加6%的大豆油可使纳他霉素产量达到最高值580 mg/L,比对照组提高了56.8%。梁新乐等 [12]报道,添加大豆油0.5%~5.0%,虾青素产量随大豆油添加量逐步提高,最高时达到2.98 mg/L。
由图2b可知,不同大豆油添加量对纳他霉素得率系数有显著影响(P<0.05),呈先增加后减小的变化趋势,当大豆油添加量为6%时,纳他霉素得率系数达到最大值,为38.67 mg/g。这说明产量的提高是单位质量细胞的纳他霉素合成效率提高的结果,与梁新乐等 [12]的研究报道一致。当添加9%、12%和15%的大豆油时,促进了菌体细胞的生长,但一定程度上抑制了产物的合成,因此得率系数显著下降。这是因为过量加入大豆油摇瓶中存在较大油滴,易浮于表面,导致发酵液水分流失,表观黏度增大引起氧气传质系数下降;而添加量为0~6%豆油的摇瓶中分散乳化效果较好,从而更有利于油-水两相间的接触与物质传递。
2.2.2 橄榄油添加量的影响
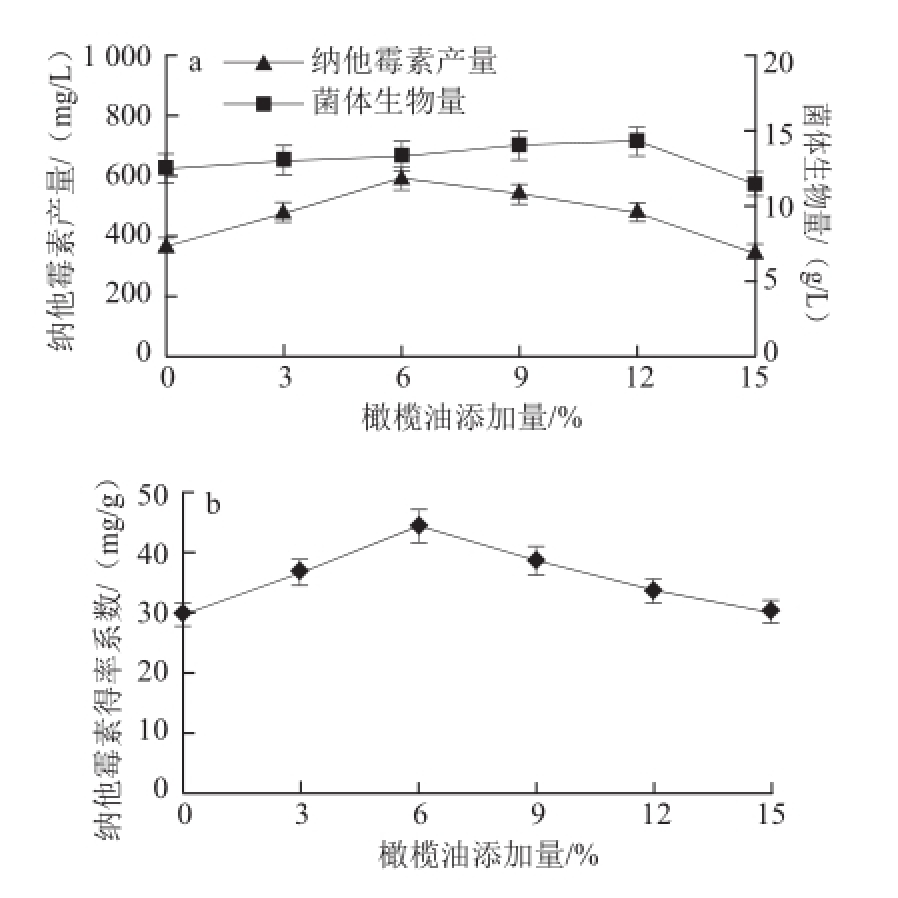
图3 橄榄油添加量对菌体生物量和纳他霉素合成的影响
Fig.3 Effect of Olive oil concentration on cell dry weight and natamycin production
由图3a可知,与大豆油添加效果类似,纳他霉素产量随橄榄油添加量的增加呈现先增加后减小的趋势,在添加量为6%时达到最大值590 mg/L,比对照组提高59.5%,之后产量显著降低(P<0.05),当添加量为15%时,产量为345 mg/L,低于对照组,这说明高浓度的油脂不利于纳他霉素的合成。与对照组相比,橄榄油添加量为12%时,菌体生物量由初始的12.5 g/L增加到14.3 g/L,影响并不明显,当添加量为15%时油,菌体生物量显著降低(P<0.05),说明高添加量的橄榄油抑制菌体的生长。
由图3b可知,纳他霉素得率系数的变化趋势与产物含量的变化趋势基本一致,先升高后降低,并在添加量为6%时达到最高值44.36 mg/L。以上结果表明,添加适量橄榄油强化传氧作用的最直接后果就是纳他霉素的合成得到加强,而对细胞的生长(菌体生物量)影响不显著,即单位细胞的纳他霉素合成能力得到加强,单位产率提高。
2.2.3 二甲基硅油添加量的影响
由图4a可知,随着二甲基硅油添加量的增加,菌体生物量和纳他霉素产量的影响均呈现先增加后减小的变化趋势,且分别在添加量为6%和9%时达到最大值,纳他霉素产量比对照组提高了72.5%,促进效果明显(P<0.05)。随着添加量继续增加,促进作用减弱,可能是由于表观黏度的不断增加影响了氧传质系数 [13]。
由图4b可知,二甲基硅油低添加量的处理下得率系数较低,随着添加量的升高,得率系数逐渐升高。这可能是因为抗生素的发酵过程分为即菌体生长阶段和代谢物生产阶段。在生长阶段,菌体生长速率高,但产物合成速率较低;随着菌体生长速率的减缓,产物进入大量合成生长阶段。
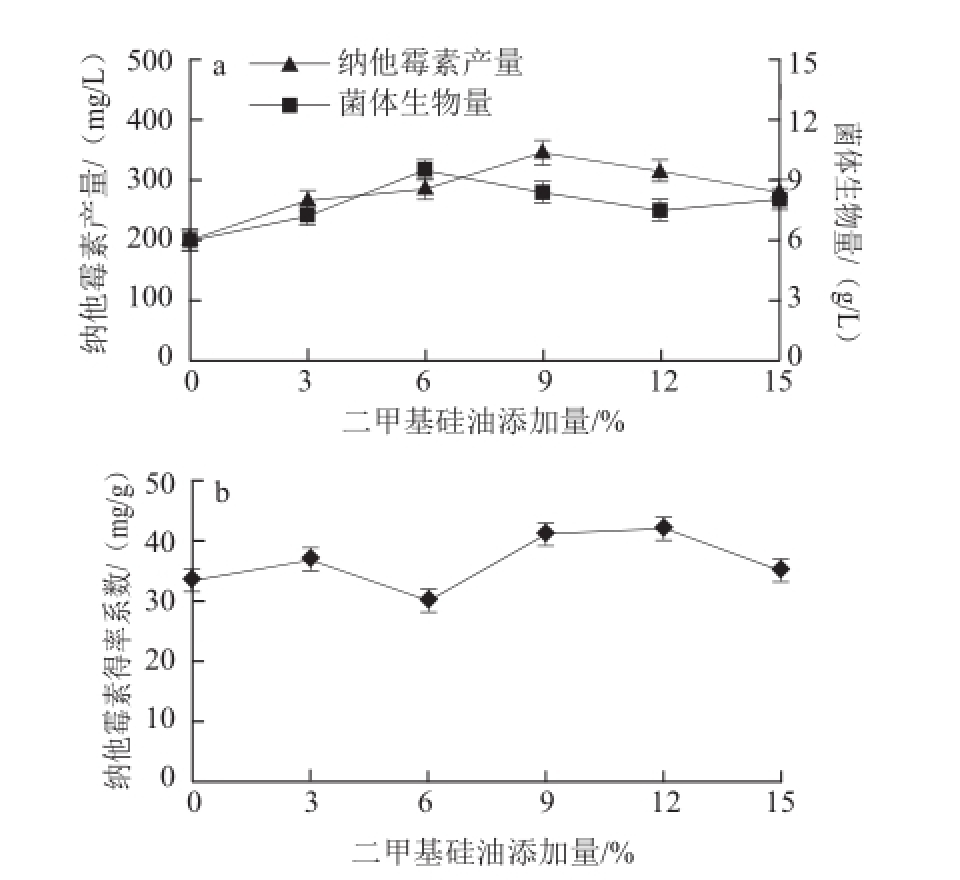
图4 二甲基硅油添加量对菌体生物量和纳他霉素合成的影响
Fig.4 Effect of polydimethyl iloxane concentration on cell dry weight and natamycin production
2.2.4 吐温-80添加量的影响

图5 吐温-80添加量对菌体生物量和纳他霉素合成的影响
Fig.5 Effect of Tween-80 concentration on dry weight of cells and the yield of natamycin
由图5a可知,与对照组相比,吐温-80添加量对菌体生物量和纳他霉素产量的影响均呈现增加趋势,分别在添加量为15%和6%时分别达到最大值,分别为13.20 g/L和210 mg/L,纳他霉素产量对照组提高了82.6%,促进效果明显(P<0.05)。当吐温-80的添加量超过6%后,纳他霉素的生成量略有减弱,但仍高于对照组。吐温-80本质是一种油酸酯,具有乳化性质。目前表面活性剂对发酵产生的促进作用原理尚不很清楚,一般认为其作用在于改善细胞的通透性,增大细胞膜的通透能力,增加胞内胞外的物质平衡,改善通气效果 [15]。同时,吐温-80又可以增加溶氧量、促进传氧速率,改变发酵液流体特性,有利于提高纳他霉素的产量。
由图5b可知,那他霉素得率系数呈现出随着吐温-80添加量的升高不断下降的趋势,这与其他结果相异。这是因为吐温-80对菌体生长和代谢产物的合成均呈现促进作用。低吐温-80添加量对纳他霉素的促进作用较强,添加较高添加量的吐温-80更有利于菌体的生长,这与朱艳等 [15]的研究结果一致。
2.3 氧载体添加时间的影响
2.3.1 氧载体添加时间对菌体生长和纳他霉素产量的影响

图6 氧载体添加时间对菌体生物量和纳他霉素合成的影响
Fig.6 Effect of oxygen vector addition time on cell dry weight and natamycin production
在氧载体添加量单因素试验的基础上,选取不同氧载体的最适添加量,分别研究其在发酵后0、24、48、72 h添加对褐黄孢链霉菌生长和纳他霉素合成的影响。结果如图6所示,添加4 种物质的作用趋势一致,即随着发酵后添加时间的延长,菌体生物量和纳他霉素的生物合成量整体呈现下降趋势,即最适的添加条件为发酵初期。这可能是因为在摇瓶培养时,由于褐黄孢链霉菌的耗氧速率很快,接种后数小时内培养液中的溶氧量降低,成为培养的限制因素。接种同时添加氧载体比指数生长期添加效果要明显(P<0.05),就是因为较早加入的氧载体,可以及时缓解培养过程中很快就会出现的氧不足问题 [13]。
2.3.2 氧载体添加时间对纳他霉素得率系数的影响

图7 氧载体添加时间对纳他霉素得率系数的影响
Fig.7 Effect of Effect of oxygen vector addition time on the yield coefficient of natamycin
由图7可知,单位细胞纳他霉素产量逐渐降低(P<0.05),最大值为在发酵初始添加氧载体。这是因为氧载体添加时间的不同对菌体生长影响比对纳他霉素合成的影响小,这进一步验证添加氧载体并不是由细胞总生物量提高所导致的,而是单位细胞的纳他霉素产率增大的结果。随着添加时间的延长,得率系数逐渐降低。推测可能是因为发酵初期体系溶氧较充足,同时前期生成的产物具有表面活性剂性质,可生成大量小气泡,强化了气-液界面的扩散,能一定程度上提高氧传递速率。随着发酵的进行,体系中的纳他霉素产量不断增加,黏度增大,同时小气泡能相互接合,气-液比表面积降低,氧传递系数减小,出现溶氧不足问题。氧载体添加时间较晚,无法及时解决体系的溶氧限制问题,干扰了纳他霉素的生物合成,单位细胞纳他霉素产量也大量减少。
发酵过程中,氧的传质速率主要受发酵液中溶解氧的浓度和传递阻力影响。而溶解氧对发酵的影响分为两方面:一方面溶氧浓度影响与呼吸链有关的能量代谢,从而影响微生物生长;另一方面氧直接参与代谢产物的合成 [16]。因此研究溶氧对发酵的影响及控制对提高生产效率,改善产品质量等都有重要意义 [17]。
双液相发酵(two-liquid phase fermentation)是在常规液态发酵体系中加入一种与水不相溶的油相,以提高底物或溶解氧的供给能力或解除产物的抑制作用 [9]。按其目的不同分为三类:1)传统的石油发酵,其目的是为了获得菌体、菌体代谢产物和生物转化产物;2)氧载体(oxygen vectors)发酵体系,以强化发酵体系中的氧传递过程;3)在上述两类液相发酵体系中引入固体载体(或乳化剂),利用这种载体增加双液相间的接触面积,从而提高传质速率和发酵产率 [18]。微生物只能利用溶解于水中的氧而不能利用气态的氧。而氧的溶解实质上是气体吸收过程,是由气相向液相传递的过程 [19]。有学者 [20-21]认为像植物油脂、油酸等具有正铺展系数的氧载体加入到水中后,通过搅拌、超声波等作用被分散乳化。由于油-水的相互排斥,氧载体最终将集中在气液界面上,形成覆盖气泡的油膜,氧载体相对氧气来说具有较强的溶解度,使得氧穿过水边界层的渗透力增强,从而有利于氧的传递。孟娜等 [22]研究表明,添加豆油、表面活性剂等氧载体后,可以提高统一发酵系统的氧传递系数值30%~300%,这与本研究的结果一致。
本实验结果表明,添加种类、添加量和时间不同,对发酵体系的菌体生长和产物合成影响作用不同。大豆油、橄榄油、二甲基硅油及吐温-80在发酵体系中不能作为碳源被利用。在发酵初期分别添加6%大豆油、6%橄榄油、9%二甲基硅油和6%的吐温-80,纳他霉素产量分别提高了56.8%、59.5%、72.5%和82.6%。其中二甲基硅油和吐温-80作为乳化剂和活性剂,其在发酵体系中的促进效果较好,且价格低廉,能有效促进单位细胞的纳他霉素产率增大从而提高产量,为后期的发酵罐实验提供一定理论基础。
参考文献:
[1] 李勃, 冯光利, 王长晔. 纳他霉素产业发展现状及前景分析[J]. 保鲜与加工, 2011, 11(2): 49-53.
[2] 王春艳, 刘树立. 纳他霉素的研究概况及其在食品工业中的应用[J].中国食品添加剂, 2007(2): 169-173.
[3] 高玉荣, 王雪平, 刘洋. 纳他霉素水溶液生物稳定性研究[J]. 食品科学, 2010, 31(9): 41-44.
[4] 刘变芳, 岳田利, 李卓, 等. 纳他霉素高产菌株的诱变选育[J]. 西北农业学报, 2010, 19(8): 180-184.
[5] 徐广宇, 骆健美, 杨德山, 等. 纳他霉素培养基及发酵条件优化[J].微生物学杂志, 2007, 27(4): 73-77.
[6] 郝晓兵, 卢英华. 褐黄孢链霉菌生产纳他霉素工艺条件研究[J]. 厦门大学学报, 2009, 48(6): 866-870.
[7] 相启森, 岳田利, 高振鹏, 等. 金属离子对褐黄孢链霉菌生长和纳他霉素生物合成的影响[J]. 西北农林科技大学学报, 2010, 38(1): 209-215.
[8] 王岁楼, 吴晓宗, 陈德经, 等. 金属离子和氧载体对红酵母NR06胡萝卜素发酵的影响[J]. 食品科技, 2008, 33(1): 5-8.
[9] 陆旋, 何捷, 周兵, 等. 双液相发酵与氧传递研究进展[J]. 食品工业科技, 2010, 31(6): 421-423.
[10] 翁雪清, 施巧琴, 吴松刚. 氧载体, 表面活性剂及H 2O 2对L-phe发酵影响的研究[J]. 氨基酸和生物资源, 2012, 34(2): 39-42.
[11] 杨秋艳, 程蓉, 汪智姝, 等. 氧载体正己烷对黄原胶发酵的影响[J].食品科技, 2009, 34(4): 218-221.
[12] 梁新乐, 励建荣, 陈敏, 等. 氧载体强化氧传递促进法夫酵母虾青素的合成[J]. 菌物学报, 2003, 22(3): 424-429.
[13] 刘元帅, 石国领, 吴建勇. 添加液态烷烃氧载体对法夫酵母发酵生产虾青素的影响[J]. 食品与发酵工业, 2005, 31(6): 43-46.
[14] LOWE K C, DAVEY M R, POWER J B. Perfluorochemicals: their applications and benefits to cell culture[J].Trends in Biotechnology,1998, 16(1): 272-277.
[15] 朱艳, 袁其朋, 王航. 添加氧载体及表面活性剂对番茄红素发酵的影响[J]. 微生物学通报, 2006, 33(1): 90-93.
[16] 赵东峰, 梁春艳, 任翔, 等. 溶氧对生物转化泰乐菌素为其酰化物的影响[J]. 中国医药工业杂志, 2006, 37(3): 162-164.
[17] 张智, 滕婷婷, 王淼. 溶氧对发酵的影响及控制[J]. 科学咨询, 2008(21):163-164.
[18] 贾士儒, 冈部满康. 提高供氧能力对土曲霉生产衣康酸的影响[J].天津轻工业学院学报, 1996, 11(1): 6-10.
[19] LOWE K C. Perfluorochemical respiratory gas carriers:benefits to cell culture systems[J]. Journal of Fluorine Chemistry, 2002, 118(1/2): 19-26.
[20] KANG Y, FAN L T, MIN B T, et al. Promotion of oxygen transfer in three-phase fluidized-bed bioreactors by floating bubble breakers[J]. Biotechnology and Bioengineering, 1991, 37(6): 580-586.
[21] JU L K, LEE J F, ARMIGER W B. Effect of the interfacial surfactant layer on oxygen transfer through the oilwater phase boundary in perfluorocarbon emulsions[J]. Biotechnology and Bioengineering,1991, 37(6): 505-511.
[22] 孟娜, 薛正莲, 魏胜华, 等. 添加氧载体促进林可霉素发酵过程中的研究[J]. 应用化工, 2013, 42(12): 2198-2203.
Effects of Oxygen Vectors on Microbial Production of Natamycin
WANG Shuang
1, ZHOU Wei
1,2, LIU Hongran
1, LI Yongbo
1, MA Chaofeng
1, ZHANG Yan
1,*
(1. Hebei Food Safety Key Laboratory, Hebei Food Inspection and Research Institute, Shijiazhuang 050071, China; 2. College of Food Science and Technology, Agricultural University of Hebei, Baoding 071000, China)
Abstract:In order to effectively improve the oxygen transfer rate in the microbial production of natamycin, the effect of several oxygen vectors on Streptomyces gilvosporeus biomass and natamycin production was studied. The results showed that oxygen vectors and surfactants could not be used as carbon source although they were useful to improve dissolved oxygen and transfer rate, as well as the production of natamysin. The yield of natamycin could be improved by 56.8%, 59.5% and 72.5% after adding 6% soybean oil, 6% olive oil and 9% polydimethyls iloxane at the beginning of fermentation, respectively. With the addition of 6% Tween-80, the yield of natamycin was improved by 82.6% and growth-promoting effect on the strain was observed.
Key words:Streptomyces gilvosporeus; natamycin; oxygen vector; surfactant
中图分类号:TQ465.92;Q939.13
文献标志码:A
文章编号:1002-6630(2015)09-0102-06
doi:10.7506/spkx1002-6630-201509019
收稿日期:2014-07-12
基金项目:河北省质量技术监督局科技计划项目(100107)
作者简介:王爽(1989—),女,工程师,硕士,研究方向为农产品加工及贮藏工程。E-mail:wangshuang19890720@126.com
*通信作者:张岩(1979—),男,正高级工程师,博士,研究方向为食品安全。E-mail:snowwinglv@126.com