
王男男,李岩松,孟星宇,周 玉 *,乔 斌,孙 宇,胡 盼,卢士英,任洪林,柳增善
(人兽共患病研究教育部重点实验室,吉林大学动物医学学院,人兽共患病研究所,吉林 长春 130062)
摘 要:以9-芴乙酸(fluorene-9-aceticacid,FLU)为原料,经活性酯法合成完全抗原FLU-牛血清白蛋白(bovine serum albumin,BSA)和FLU-卵清白蛋白(ovalbumin,OVA),偶联产物通过非变性聚丙烯酰胺凝胶电泳及紫外扫描法鉴定。使用FLU-BSA足垫免疫BALB/c小鼠获得多克隆抗体,间接酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA)测得多克隆抗体效价为51 200,间接竞争ELISA方法测得芴多克隆抗体的特异性,与荧蒽的交叉反应率为12%,与其他14 种多环芳烃交叉反应不明显。
关键词:9-芴乙酸;完全抗原;多克隆抗体;酶联免疫吸附实验
多环芳烃(polycyclic aromatic hydrocarbons,PAHs)是指分子中含有两个或两个以上苯环的碳氢化合物,可分为芳香稠环型及芳香非稠环型 [1]。PAHs主要由石油、煤炭、焦油等矿物燃料及其他有机物不完全燃烧产生 [2]。一些多环芳烃类化合物已被确定具有致癌、致突变、致畸形等有害作用 [3],是受到广泛关注的污染物之一。食品中PAHs的污染一部分来源于食品产地环境如大气、水体和土壤的污染 [4],另一部分则来源于烹饪过程如油炸、熏制和烧烤等 [5]产生的污染。多环芳烃存在于食品中,严重影响人类的身体健康,因此,需要建立食品中PAHs的快速灵敏的检测方法。与传统的薄层扫描法 [6]等仪器分析方法相比,免疫学检测方法以其灵敏度高、特异性强、前处理简单、操作简便等优点被越来越多地应用到食品中PAHs的检测 [7]。目前国内外学者已经建立了几种测定PAHs的间接酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA)方法 [8-9]。芴作为美国环保署规定的16 种优先监测的PAHs之一,目前尚未见相关免疫学检测方法的报道。如何制备出免疫效果好的完全抗原是建立其免疫学检测方法的关键性一步。芴是半抗原,相对分子质量224.26,只具有反应原性,不能刺激机体产生抗体,与载体蛋白偶联,制备完全抗原是制备芴抗体以及进一步建立免疫学检测方法的前提。本实验制备了针对芴的两种完全抗原,并制备出多克隆抗体,以期为ELISA和免疫胶体金试纸条等检测方法的建立奠定基础。
1.1 动物与试剂
2 只SPF级6~8 周龄雌性BALB/c小鼠,购于吉林大学白求恩医学院动物实验中心,合格证号为2011-0003,动物使用许可证号为长春生物制品研究所有限责任公司SCXK(吉)。
9-芴乙酸(fluorene-9-aceticacid,FLU)标准品美国Alfa公司;二甲基甲酰胺(dimethylformamide,DMF)、N-羟基琥珀酸亚胺(N-hydroxy succinimide,NHS) 北京百灵威科技有限公司;双二环己基-碳化二亚胺盐酸盐(N,N’-dicyclohexylcarbodiimide,DCC)上海晶纯生化科技股份有限公司;牛血清白蛋白(bovine serum albumin,BSA)、卵清白蛋白(ovalbumin,OVA)、弗氏完全佐剂和弗氏不完全佐剂 美国Sigma公司;其他试剂均为分析纯。
1.2 仪器与设备
B S I O S电子天平 德国S a r t o r i o u s公司;MilliQPL524超纯水仪 美国Millipore公司;320 pH计瑞士Mettler公司;离心机 德国Heraeus公司;移液器美国Thermo公司;IKARH BASIC磁力搅拌器 德国IKA公司;Bio-It Imaging System凝胶成像分析系统 美国UVP公司;U-3010紫外-可见分光光谱仪 日本Hitachi公司;Mode1680酶联免疫检测仪 美国Bio-Rad公司。
1.3 完全抗原的制备
选取FLU为半抗原,采用活性脂法 [10]制备完全抗原FLU-BSA和FLU-OVA。方法如下:称取22.4 mg(0.2 mmol)DCC和41 mg(0.2 mmol)NHS,溶解于0.75 mL DMF中,将此混合液缓慢滴加到0.5 mL溶解了44.8 mg(0.2 mmol)FLU的DMF溶液中,边加边振荡,混合液于4 ℃振荡过夜,4 ℃、9 000 r/min低温离心15 min,离心后上清逐滴加入到6 mL溶解了240 mg BSA或720 mg OVA的碳酸盐缓冲液(carbonate buffer solution,CBS)缓冲液(0.05 mol/L,pH 9.6)中,偶联液于4 ℃振荡4 h后用0.01 mol/L、pH 7.4磷酸盐缓冲液(phosphate buffer solution,PBS)进行透析,每6~8 h更换一次透析液,72 h后取出于10 000 r/min,4 ℃离心15 min,取上清分装后于—80 ℃冻存备用。
过程载体的制备方法,除不加半抗原外,其余过程同上 [11]。
1.4 完全抗原的鉴定
1.4.1 非变性聚丙烯酰胺凝胶电泳(native polyacrylamide gel electrophoresis,Native-PAGE)
对比载体蛋白、过程载体以及完全抗原在12%分离胶的非变性聚丙烯酰胺凝胶电泳中迁移距离的差别,分析偶联结果 [12]。
1.4.2 紫外扫描法
将过程载体以及完全抗原用PBS(0.01 mol/L,pH 7.4)稀释至终质量浓度为10 mg/mL,载体蛋白质量浓度为8 mg/mL,以PBS做空白;将半抗原用DMF稀释至1 mg/mL,以DMF做空白。分别对上述溶液在200~350 nm波长范围内进行紫外光谱扫描,观察特殊吸收峰的迁移变化,分析偶联结果 [13]。
1.4.3 完全抗原含量及偶联比的测定
考马斯亮蓝G-250在游离状态下呈红色,465 nm波长处为最大吸光度,当在稀酸条件下,可与蛋白质结合变为青色,一定范围内595 nm波长处的吸光度与蛋白质含量呈正比,故可用于蛋白质的定量检测 [14]。具体操作方法见考马斯亮蓝法蛋白质含量测定试剂盒说明书。
结合1.4.2节中半抗原、载体蛋白以及完全抗原紫外扫描结果,通过朗伯-比尔定律计算出摩尔消光系数(ε),最终计算出偶联比 [15]。

式中:ε 1为偶联物在280 nm波长处的摩尔消光系数/(L/(mol·cm));ε 2为载体蛋白在280 nm波长处的摩尔消光系数/(L/(mol·cm));ε 3为半抗原在280 nm波长处的摩尔消光系数/(L/(mol·cm))。
1.5 多克隆抗体的制备与鉴定
1.5.1 多克隆抗体的制备
本实验共免疫2 只BALB/c小鼠。免疫程序如下:取FLU-BSA(2 mg/mL)与佐剂(首免使用弗 氏完全佐剂,非首免使用不完全佐剂)等体积混合,乳化完全后,每只小鼠足垫注射50 μL。每次免疫间隔一周,免疫4 次后,对小鼠进行眼球采血,将采集后的血液3 000 r/min离心5 min,去除上层脂肪等物质后即获得多克隆抗体,保存备用 [16]。
1.5.2 多克隆抗体效价和特异性的鉴定
采用间接ELISA方法检测抗血清效价 [17]。具体步骤:在酶标板内包被FLU-OVA,每孔100 μL,4 ℃,8 h;使用磷酸盐-吐温缓冲液(phosphate buffered saline tween-20,PBST)清洗酶标板3 遍,拍干;加入不同稀释倍数的待检血清,每孔100 μL,37 ℃,1 h;使用PBST清洗酶标板3 遍,拍干;加入4 000 倍稀释的羊抗鼠二抗,每孔100 μL,37 ℃,1 h;使用PBST清洗酶标板4 遍,拍干;加入邻苯二胺(o-phenylenediamine,OPD)底物显色,每孔100 μL,37 ℃,10 min;加入2 mol/L浓硫酸终止,每孔50 μL;使用酶标仪测定492 nm波长处的光密度(optical density,OD)值。
采用间接竞争ELISA方法检测多克隆抗体的特异性 [18]。具体步骤:在酶标板内包被FLU-OVA,每孔100 μL,4 ℃,8 h;使用PBST清洗酶标板3 遍,拍干;加入不同浓度的PAHs标准品作竞争,每孔50 μL,再加入阳性血清,每孔50 μL,37 ℃,1 h;使用PBST清洗酶标板3 遍,拍干;加入4 000 倍稀释的羊抗鼠二抗,每孔100 μL,37 ℃,1 h;使用PBST清洗酶标板4 遍,拍干;加入OPD底物显色,每孔100 μL,37 ℃,10 min;加入2 mol/L浓硫酸终止,每孔50 μL;使用酶标仪测定492 nm波长处的OD值。以竞争浓度的对数做横坐标(x),以抑制率为纵坐标(y)建立标准曲线y=0.301 2x—0.344 8(R 2=0.997 0),根据标准曲线,计算出IC 50,用其余15 种优先监测PAHs进行多克隆抗体特异性检测,用交叉反应率表示 [19]。
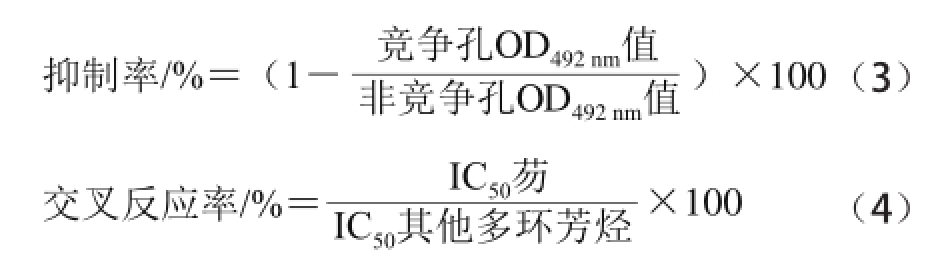
2.1 Native-PAGE鉴定结果
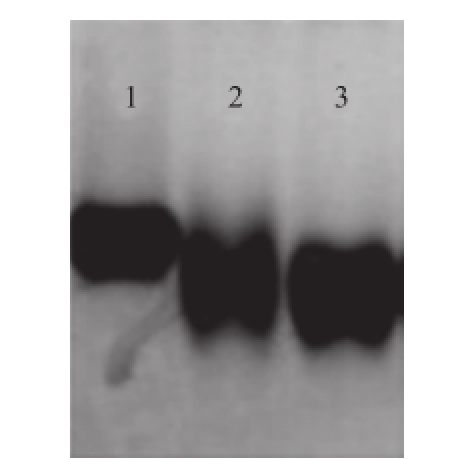
图1 FLU-BSA完全抗原的Native-PAGE结果
Fig.1 Native-PAGE of FLU-BSA
采用活性脂法制备的完全抗原,经12% Native-PAGE鉴定。本实验半抗原较载体蛋白相比,分子质量较小,偶联后的分子质量增加不明显,故采用非变性凝胶电泳,利用电荷影响迁移距离来判定偶联结果,电荷的改变亦能证明偶联成功 [20]。结果如图1所示,FLU-BSA完全抗原的迁移距离与BSA载体蛋白和过程载体有差异,表明完全抗原所带电荷发生改变,由此表明,FLU-BSA完全抗原制备成功。同理,图2为FLU-OVA完全抗原的鉴定。
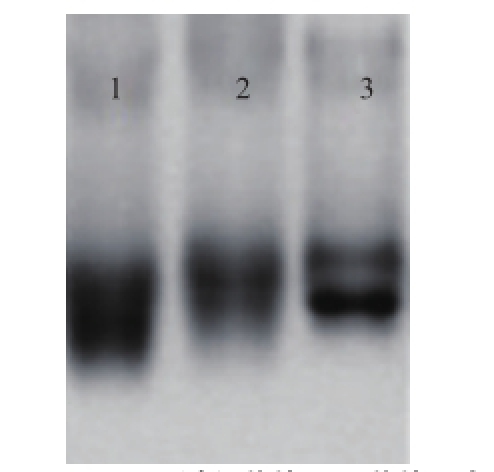
图2 FLU-OVA完全抗原的Native-PAGE结果Fig.2 Native-PAGE of FLU-OVA
1. FLU-OVA;2. OVA过程载体;3. 载体蛋白OVA。
2.2 紫外扫描法

图3 BSA、BSA过程载体、FLU、FLU-BSA的紫外扫描结果
Fig.3 Ultraviolet spectra of BSA, BSA carrier, FLU and FLU-BSA
对半抗原、载体蛋白、过程载体以及完全抗原进行紫外光谱扫描,结果如图3所示,BSA的紫外扫描波形在230 nm以及280 nm处存在特殊吸收峰;FLU在265 nm处存在特殊吸收峰;BSA过程载体的特殊吸收峰与BSA相比稍有偏移;而FLU-BSA则兼具载体蛋白以及半抗原的紫外扫描波形特征,在230 nm及265 nm处均存在特殊吸收峰。由此表明,FLU-BSA完全抗原制备成功。同理,图4为FLU-OVA的鉴定。
图4 OVA、OVA过程载体、FLU、FLU-OVA的紫外扫描结果
Fig.4 Ultraviolet spectra of OVA, OVA carrier, FLU and FLU-OVA
2.3 完全抗原含量及偶联比
采用考马斯亮蓝法测定完全抗原含量,以595 nm波长处的吸光度为纵坐标(y),蛋白质含量为横坐标(x,mg/mL),获得标准曲线为y=1.648 3x+0.829 6(R 2=0.975 5)。根据标准曲线计算出FLU-BSA和FLU-OVA的质量浓度分别为20 mg/mL和18 mg/mL。根据图3和图4可知,完全抗原FLU-BSA、FLU-OVA、载体蛋白BSA、OVA和半抗原FLU在280 nm处的吸光度。根据上样浓度可求出偶联物FLU-BSA、FLU-OVA、载体蛋白BSA、OVA和半抗原FLU在280 nm处的摩尔消光系数。根据公式计算得出FLU-BSA和FLU-OVA的偶联比分别为16∶1和28.5∶1(表1)。
表1 完全抗原偶联比
Table 1 Coupling ratios of complete antigens

项目FLU-BSAFLU-OVABSAOVAFLU A 280 nm8.0011.504.203.755.00 ε 280 nm/(10 6L/(mol·cm))5.2805.1753.4652.1091.077偶联比16∶128.5∶1
2.4 多克隆抗体效价和特异性
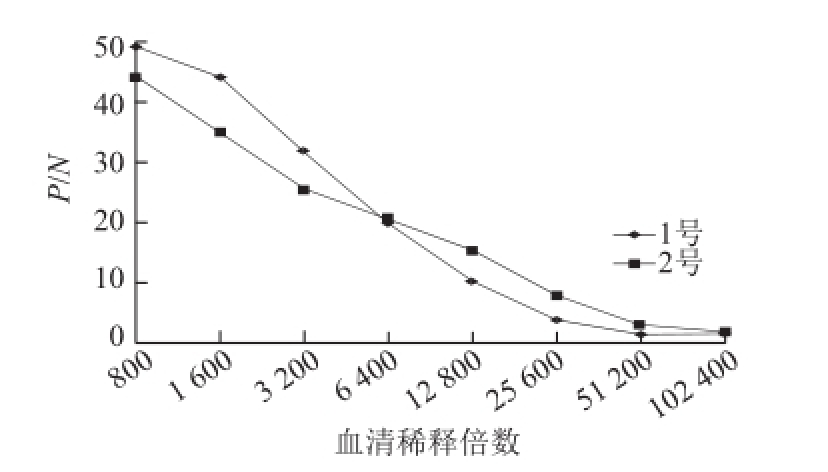
图5 ELISA法测定的1、2号小鼠多克隆抗体的效价
Fig.5 Determination of polyclonal antibody titer for mice No.1 and No.2 by ELISA
通过间接ELISA对多克隆抗体进行效价测定。根据待测孔OD 492 nm值/对应阴性孔OD 492 nm值(P/N)≥2时,多抗的最大稀释倍数为多抗的效价,1号和2号小鼠的效价如图5所示,免疫4 次后,1号小鼠血清效价为21 600,低于2号小鼠血清效价51 200。故选取2号小鼠抗血清建立标准曲线(1.5.2节)。通过该标准曲线测得芴的IC 50为637.94 ng/mL。本实验获取的多抗与荧蒽的交叉反应率为12%,与其他PAHs的交叉反应不明显,均小于1%(表2)。
表2 多克隆抗体与15种PAHs的交叉反应率
Table 2 Cross-reactivity of polyclonal antibody with 15 kinds of PAHs
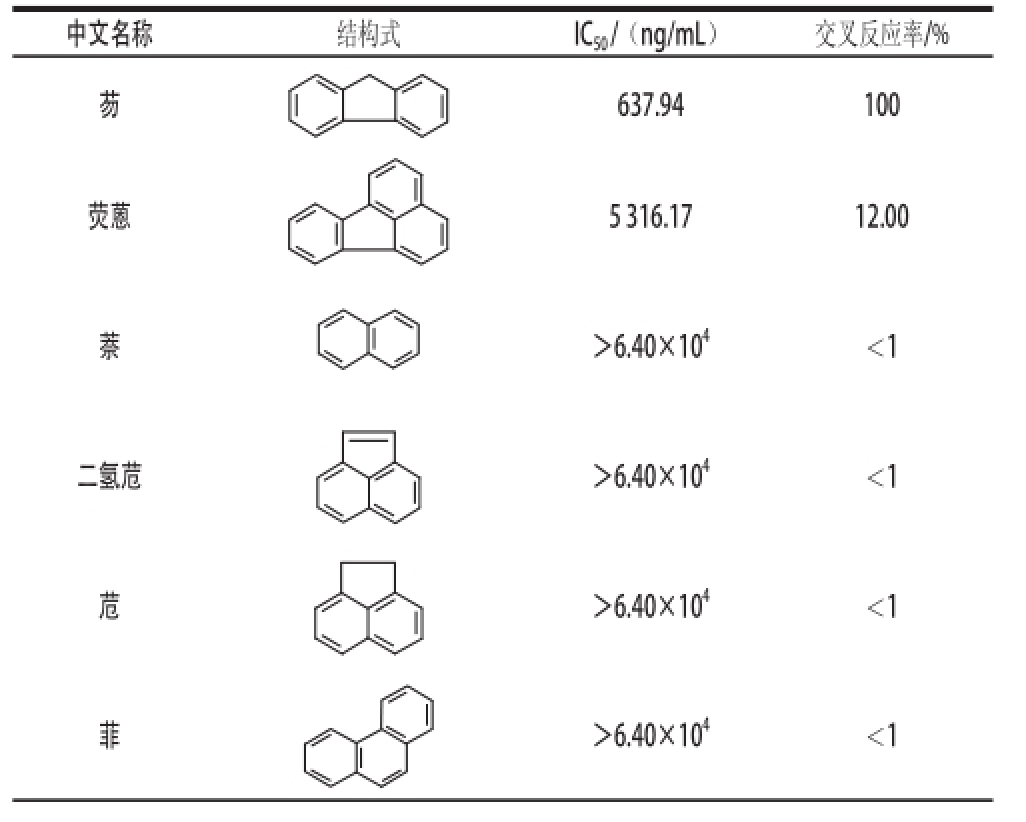
?
续表2
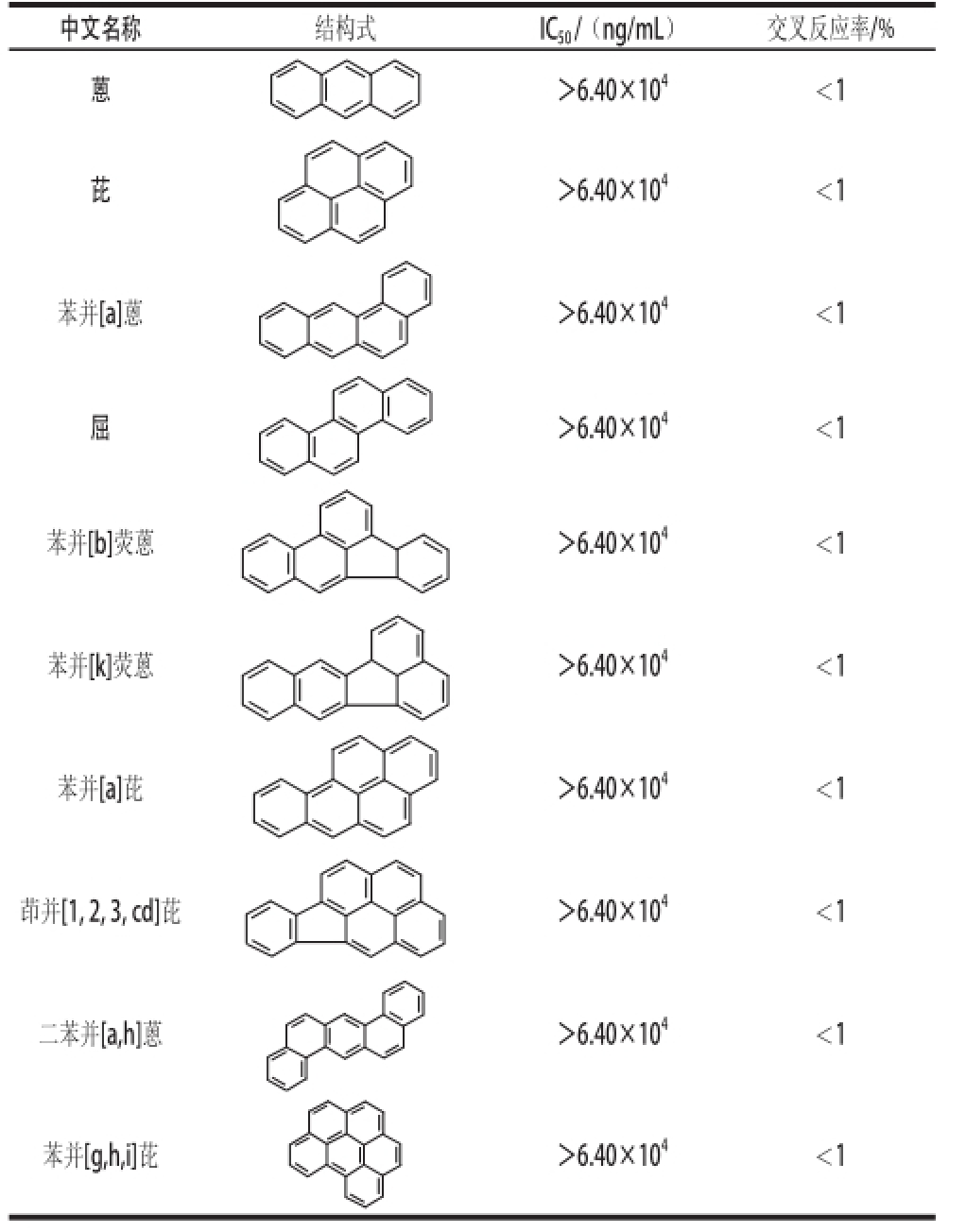
?
如何制备出免疫效果好的完全抗原,通常由半抗原的设计与选择、载体蛋白的选择和偶联方法等多方面因素决定。
3.1 半抗原的选择
本实验研究对象芴的化学性质比较稳定,难以与载体蛋白结合,选取半抗原时需遵循的原则包括与目标物结构相似,要带有易与载体蛋白结合的活性基团,侧链不影响半抗原电化学环境等 [21]。FLU的侧链结构简单,其末端羧基基团能够与载体蛋白上的氨基反应,侧链长度能有效暴露芴的特征结构供免疫细胞识别,比较适合做芴的半抗原。
3.2 载体蛋白的选择
本实验选取的载体蛋白BSA和OVA具备免疫活性强、性质稳定、廉价易得等优点。且均具有较多的游离氨基,能与半抗原FLU的羧基活性基团结合。
3.3 偶联方法的选择
羧基基团与载体蛋白偶联的常用方法主要有碳二亚胺法、混合酸酐法和活性酯法等。其中活性酯法是在碳二亚胺法基础上进行改进,避免了碳二亚胺直接作用于载体蛋白 而引起蛋白分子间的自身交联。
参考文献:
[1] 杨发忠, 颜阳, 张泽志, 等. 多环芳烃研究进展[J]. 云南化工, 2005,32(2): 44-48.
[2] 赵文昌, 程金平, 谢海贇, 等. 环境中多环芳烃(PAHs)的来源与监测分析方法[J]. 环境科学与技术, 2006, 29(3): 105-107.
[3] 聂静, 钱岩, 段小丽, 等. 食品中多环芳烃污染的健康危害及其防治措施[J]. 环境与 可持续发展, 2009(4): 38-41.
[4] 程家丽, 黄启飞, 魏世强, 等. 我国环境介质中多环芳烃的分布及其生态风险[J]. 环境工程学报, 2007, 1(4): 138-144.
[5] 朱小玲. 烹饪过程中多环芳烃的产生及控制[J]. 四川烹饪高等专科学校学报, 2012(5): 22-25.
[6] 厉曙光, 潘定华. 薄层扫描法测定食用油及其加热产物中多环芳烃含量[J]. 卫生研究, 1991, 20(4): 44-46.
[7] PSCHENITZA M, HACKENBERG R, NIESSNER R, et al. Analysis of benzo [a] pyrene in vegetable oils using molecularly imprinted solid phase extraction (MISPE) coupled with enzyme-linked immunosorbent assay (ELISA)[J]. Sensors, 2014, 14(6): 9720-9737.
[8] SCHARNWEBER T, FISHER M, SUCHANEK M, et al. Monoclonal antibody to polycyclic aromatic hydrocarbons based on a new benzo [a] pyrene immunogen[J]. Fresenius’ Journal of Analytical Chemistry,2001, 371(5): 578-585.
[9] KARSUNKE X Y, PSCHENITZA M, RIEGER M, et al. Screening and characterization of new monoclonal anti-benzo [a] pyrene antibodies using automat ed flow-thr ough microarray technology[J]. Journal of Immunological Methods, 2011, 371(1): 81-90.
[10] 王宇, 沈玉栋, 徐振林, 等. 氟甲哇单克隆抗体制 备, 鉴定及间接竞争酶联免疫吸附分析法[J]. 分析化学, 2010, 38(3): 313-317.
[11] 张煜超, 王芳芳, 李周敏, 等. 小分子药物人工抗原的合成与鉴定研究进展[J]. 药物分析杂志, 2014, 34(6): 947-951.
[12] 褚晓红, 周玉, 李岩松, 等. 牛乳中α-酪蛋白完全抗原的合成及多克隆抗体的制备[J]. 中国畜牧兽医, 2014, 41(2): 75-78.
[13] 李丽华, 徐振林, 孙远明, 等. 3-氨基-2-唔唑烷酮半抗原, 人工抗原的合成及鉴定[J]. 食品工业科技, 2012, 33(2): 49-51.
[14] 王孝平, 邢树礼. 考马斯亮蓝法测定蛋白含量的研究[J]. 天津化工,2009(3): 40-42.
[15] 马丽苹. 氨苄青霉素完全抗原合成及间接竞争ELISA检测条件的初步优化[J]. 中国畜牧兽医文摘, 2013(12): 187.
[16] 郝亚明, 周玉, 卢士英, 等. 重金属镉单克隆抗体的制备[J]. 中国实验诊断学, 2011, 15(5): 822-825.
[17] 宋宏新, 柏红梅, 薛海燕, 等. 酪蛋白和乳球蛋白的抗体及酶标物制备研究[J]. 食品科学, 2008, 29(12): 486-489.
[18] 王梅, 徐乃丰, 刘丽强, 等. 孔雀石绿抗原的合成及多克隆抗体的制备[J]. 食品科学, 2011, 32(7): 282-285.
[19] 金海燕. 重金属汞多克隆抗体的制备及间接竞争ELISA方法的研究[D].大连: 辽宁师范大学, 2009.
[20] 雷红涛, 庞杰, 贺丽苹, 等. 半抗原-载体蛋白偶联物的三种电泳鉴定方法[J]. 中国农业科学, 2010, 43(3): 565-570.
[21] 孙峰, 李方实. 异丙隆半抗原的制备及鉴定[J]. 南京工业大学学报:自然科学版, 2006, 27(6): 33-36.
Preparation and Characterization of Fluorene Complete Antigen and Anti-fluorene Polyclonal Antibody
WANG Nannan, LI Yansong, MENG Xingyu, ZHOU Yu*, QIAO Bin, SUN Yu, HU Pan, LU Shiying, REN Honglin, LIU Zengshan
(Key Laboratory of Zoonosis, Ministry of Education, Institute of Zoonosis, College of Veterinary Medicine, Jilin University,Changchun 130062, China)
Abstract:Fluorene-9-acetic acid (FLU) was chosen as the hapten and was coupled with bovine serum albumin (BSA) and ovalbumin (OVA) respectively to prepare complete antigens by active ester method. The complete antigens were characterized by native polyacrylamide gel electrophoresis and ultraviolet spectrum. FLU-BSA was used to obtain polyclonal antibody through footpad injection of BALB/c mice. The titer was 51 200 as measured by indirect enzyme linked immunosorbent assay (ELISA), and the cross-reactivity with fluoranthene was measured by indirect competitive ELISA to be 12% while having no obvious cross-reaction with 14 other kinds of polycyclic aromatic hydrocarbons (PAHs). This ELISA method for fluorene can lay the foundation for further experimental research.
Key words:fluorene-9-acetic acid; complete antigen; polyclonal antibody; enzyme linked immunosorbent assay (ELISA)
中图分类号:TS201.6
文献标志码:A
文章编号:1002-6630(2015)09-0108-05
doi:10.7506/spkx1002-6630-201509020
收稿日期:2014-10-13
基金项目:吉林省科技发展计划项目(20140101012JC);国家自然科学基金面上项目(61171022;60971011;30771657)
作者简介:王男男(1989—),女,硕士研究生,研究方向为兽医公共卫生。E-mail:1072274488@qq.com
*通信作者:周玉(1969—),男,教授,博士,研究方向为食品及水环境有害物质快速检测新方法。E-mail:zhouyu69@sina.com