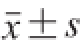 表示。数据分析采用SPSS 18.0软件,进行最小显著差异法(least significant difference,LSD)两两分析比较,以P<0.05作为具有统计学意义上的差异。
表示。数据分析采用SPSS 18.0软件,进行最小显著差异法(least significant difference,LSD)两两分析比较,以P<0.05作为具有统计学意义上的差异。
郭金英,杜 洁,李彤辉,任国艳,王 萍,张玉先,李政军
(河南科技大学食品与生物工程学院,河南 洛阳 471023)
摘 要:采用BG-11培养液,悬浮培养发状念珠藻,提取发状念珠藻胞外多糖。通过测滤纸片周围抑菌圈直径大小,研究发状念珠藻胞外多糖抑菌作用;通过研究发状念珠藻胞外多糖对二甲苯致小鼠耳肿胀的影响及对角叉菜胶致小鼠足跖肿胀的影响,探究它的抗炎性能。结果表明,发状念珠藻多糖在一定的质量浓度范围内对研究的几种细菌及青霉和红曲霉都有一定的抑菌作用,而对根霉无抑制作用;其能够有效缓解二甲苯和角叉菜胶引起的小鼠耳部与足部炎症。发状念珠藻胞外多糖具有一定的抑菌抗炎性。
关键词:发状念珠藻;胞外多糖;抑菌性;抗炎性
近年来,天然生物性 药品由于疗效好、对人体毒害性小甚至没有毒副作用而受到人们普遍的重视和喜爱。生物活性多糖生理活性广泛,已被证明有抑菌性和抗炎性。Matsui等 [1]报道了红藻硫酸多糖抑制皮肤出现红斑。常向东等 [2]发现葛仙米水溶性多糖有抑制霉菌、大肠杆菌及绿脓杆菌的活性。Martins等 [3]研究表明伞菇多糖能够促进小鼠腹膜巨噬细胞杀死感染的白色念珠菌。生物活性多糖的抗菌和抗炎作用越来越受到重视。
发状念珠藻(Nostoc flagelliforme)属于念珠蓝细菌科念珠蓝细菌属 [4],俗称发菜、地毛、龙须菜等,是一种在全世界范围内广泛分布的可食用陆生念珠藻 [5]。我国主要分布在西部和北部的干旱半干旱荒漠地区。作为一种食品,发状念珠藻在我国已有近两千年的历史,其药用价值也早有记载 [6-7]。同时,又因其在生态上的特殊性和经济价值而倍受关注 [8-9]。发状念珠藻多糖是一种酸性杂多糖,由木糖、甘露糖、葡萄糖及半乳糖组成,是一种极具开发潜力的天然药物资源 [10-14]。目前关于发状念珠藻多糖生物活性的研究尚处于起步阶段,虽已证明这种多糖具有抗病毒 [15]、抗氧化 [16]等功能,但对于它的抑菌及抗炎活性的研究尚未见报道。因此,本研究主要对发状念珠藻多糖的抑菌性与抗炎性进行研究,以待为它的深入开发利用奠定坚实的科学基础。
1.1 试剂、细菌与培养基
地塞米松 大连第三制药厂;其他均为国产分析纯。
细菌:大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌、沙门氏菌;真菌:青霉、根霉、红曲霉。均由河南科技大学微生物实验室提供。
细菌培养基:蛋白胨5 g、牛肉膏1.5 g、氯化钠2.5 g、琼脂7.5 g,加蒸馏水至500 mL,调pH值为7.0~7.2,高压灭菌;真菌培养基:马铃薯(去皮切块)100 g、葡萄糖10 g、琼脂7.5 g,加蒸馏水至500 mL,高压灭菌 [17]。
1.2 动物
健康ICR小鼠,雄性,体质量18~22 g,购自河南科技大学动物实验中心。
1.3 仪器与设备
YXQ-LS-SⅡ全自动蒸汽灭菌锅 上海博讯实业有限公司医疗设备厂;DNP电热恒温培养箱 常州普天仪器制造有限公司;101-0电热鼓风干燥箱 天津市泰斯特仪器有限公司;SW-CJ-1F单人双面超净工作台 苏州净化设备有限公司;SF2000数显游标卡尺 桂林广陆数字测控股份有限公司。
1.4 方法
1.4.1 发状念珠藻胞外多糖制备
取100 mL发状念珠藻培养液经绢筛过滤去藻体,滤液用蛋白酶-Sevag法脱蛋白,然后将脱蛋白的多糖溶液装入选择性半透膜,透析48 h去除小分子物质;透析后,加入50 mL无水乙醇,4 ℃静置24 h,4 000 r/min离心10 min,收集沉淀,冷冻干燥获得胞外多糖。
1.4.2 菌悬液的制备
在对应的固体培养基上活化各个菌种,37 ℃培养细菌24 h,28 ℃培养真菌48 h。活化后,用接种环各挑取一环于灭菌生理盐水中,使分布均匀,制成含菌数约为10 7~10 8CFU/mL的系列菌悬液。
1.4.3 多糖液的制备
将0.2 g发状念珠藻多糖溶于10 mL无菌水中,配成质量浓度为20 mg/mL的多糖液,再依次稀释成10、5、2.5、1.25 mg/mL的多糖液。
1.4.4 抑菌实验
采用滤纸片扩散法 [18]。用打孔器将定性滤纸制成直径为6 mm的小圆片若干,装于6 个干燥的离心管中,高压灭菌后再将其干燥。然后将不同质量浓度的多糖液加入其中5 个离心管中,剩下的一个加入无菌水作为空白对照,浸泡30 min。于超净工作台上将灭菌后的培养基倒入无菌平板,待其冷却后,在培养基上加入适量不同菌悬液,涂布均匀。再用镊子夹取含不同浓度多糖液的小圆片轻贴于培养基表面,每个平板6 片,分别代表5 个质量浓度和1 个空白对照,每种菌种3 个平板。最后将细菌平板置于37 ℃培养24 h,真菌平板置28 ℃培养48 h后,各自取出比较抑菌圈直径大小。
1.4.5 对二甲苯致小鼠耳肿胀的影响 [19]
将癌症研究所(Institute of Cancer Research,ICR)小鼠随机分成5 组,每组8 只,包括空白对照组,阳性对照组及发状念珠藻多糖低、中、高剂量组。各组每天定时给药剂量为0.1 mL/10 g(以体质量计,下同),连续4 d,其中空白对照组灌胃生理盐水,阳性对照组腹腔注射地塞米松。最后一次给药前30 min在每只小鼠左耳廓两侧均匀涂布0.03 mL二甲苯,右耳作自身对照。最后一次给药4 h后,将小鼠颈椎脱臼处死,剪下小鼠两耳,并分别在两耳同一部位用打孔器打取6 mm耳片,称质量。计算肿胀度,即左耳片与右耳片质量的差值。
1.4.6 对角叉菜胶致小鼠足肿胀的影响 [20]
将ICR小鼠随机分成5 组,每组8 只,包括空白对照组,阳性对照组及发状念珠藻多糖低、中、高剂量组。各组每天定时给药剂量为0.1 mL/10 g,连续4 d,其中空白对照组灌胃生理盐水,阳性对照组腹腔注射地塞米松。最后一次给药1 h后,用数显游标卡尺测定它们的右后足厚度,之后于每只小鼠右后足进行皮下注射0.05 mL 1 g/100 mL的角叉菜胶致炎,24 h后再次测定右后足厚度。计算肿胀度,即致炎后与致炎前厚度的差值。
1.5 统计学处理
实验结果以
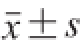 表示。数据分析采用SPSS 18.0软件,进行最小显著差异法(least significant difference,LSD)两两分析比较,以P<0.05作为具有统计学意义上的差异。
表示。数据分析采用SPSS 18.0软件,进行最小显著差异法(least significant difference,LSD)两两分析比较,以P<0.05作为具有统计学意义上的差异。
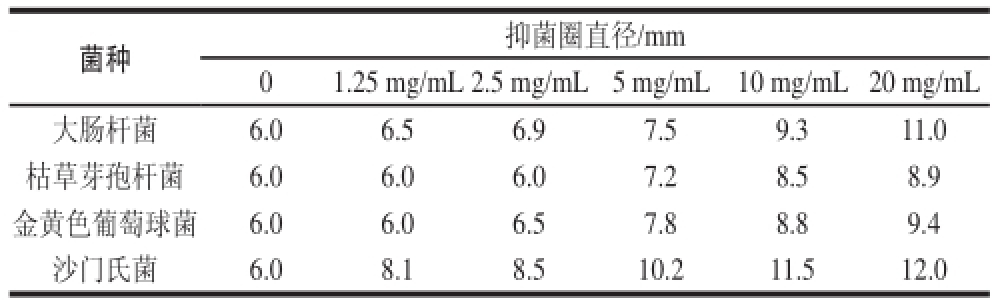
2.1 发状念珠藻多糖抑制细菌作用
表1 发状念珠藻多糖抑制细菌效果(x±s,n=8)
Table 1 Antibacterial effects of Nostoc flfl agelliforme exopolysaccharides(x±s,n=8)
菌种抑菌圈直径/m m 01.25 mg/mL 2.5 mg/mL5 mg/mL10 mg/mL 20 mg/mL大肠杆菌6.06.56.97.59.311.0枯草芽孢杆菌6.06.06.07.28.58.9金黄色葡萄球菌6.06.06.57.88.89.4沙门氏菌6.08.18.510.211.512.0
由表1可知,发状念珠藻多糖对几种细菌都有一定的抑制作用,尤其对沙门氏菌抑制作用效果最好,抑制作用随着多糖质量浓度的增大而增强;对于大肠杆菌,在多糖质量浓度为1.25 mg/mL和2.5 mg/mL时,抑制效果不明显,随着多糖质量浓度的继续增大,抑制作用有所增强;多糖质量浓度达到5 mg/mL时才开始对枯草芽孢杆菌有抑制作用;多糖质量浓度为1.25 mg/mL时对金黄色葡萄球菌没有抑制作用,之后多糖质量浓度越高,抑制效果越明显。
2.2 发状念珠藻多糖抑制真菌作用
表2 发状念珠藻多糖抑制真菌效果(x±s,n=8)
Table 2 Antifungal effects of Nostoc flfl agelliforme exopolysaccharides(x±s,n=8)

菌种抑菌圈直径/mm 01.25 mg/mL 2.5 mg/mL 5 mg/mL 10 mg/mL 20 mg/mL青霉6.06.47.08.110.411.7根霉6.06.06.06.06.06.0红曲霉6.07.28.09.512.212.8
由表2可知,发状念珠藻多糖抑制青霉与红曲霉,而对根霉没有抑制作用。随着多糖质量浓度的增大,多糖抑制青霉及红曲霉能力逐渐增强;10 mg/mL和20 mg/mL的多糖对红曲霉的抑制作用没有明显差别。
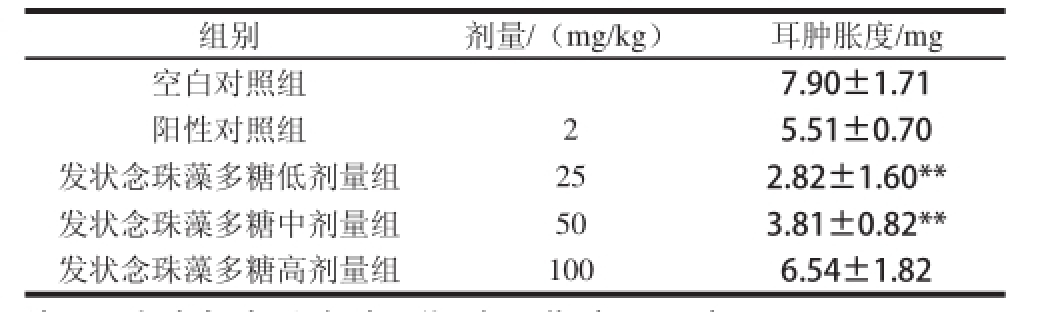
2.3 发状念珠藻多糖对二甲苯致小鼠耳肿胀的影响
表3 发状念珠藻多糖对二甲苯致小鼠耳肿胀的影响(x±s,n=8)
Table 3 Effects of Nostoc flfl agelliforme exopolysaccharides on mouse ear swelling induced by xylene(x±s,n=8)
注:**.与空白对照组相比,差异极显著(P<0.01)。下同。
组别剂量/(mg/kg)耳肿胀度/mg空白对照组7.90±1.71阳性对照组25.51±0.70发状念珠藻多糖低剂量组252.82±1.60**发状念珠藻多糖中剂量组503.81±0.82**发状念珠藻多糖高剂量组1006.54±1.82
由表3可知,发状念珠藻多糖能够显著抑制二甲苯引起的小鼠耳肿胀,并呈一定的量效关系,说明发状念珠藻多糖能够有效缓解二甲苯造成的小鼠耳部炎症。与空白对照组相比,发状念珠藻多糖低、中剂量均显著降低小鼠耳肿胀度量,差异极显著;发状念珠藻多糖高剂量降低小鼠耳肿胀度,但差异无显著性。
2.4 发状念珠藻多糖对角叉菜胶致小鼠足肿胀的影响
表4 发状念珠藻多糖对角叉菜胶致小鼠足肿胀的影响(x±s,n=8)
Table 4 Effects of Nostoc flfl agelliforme polysaccharides on the swelling of hind paws in mice induced by carrageenin(x±s,n=8)
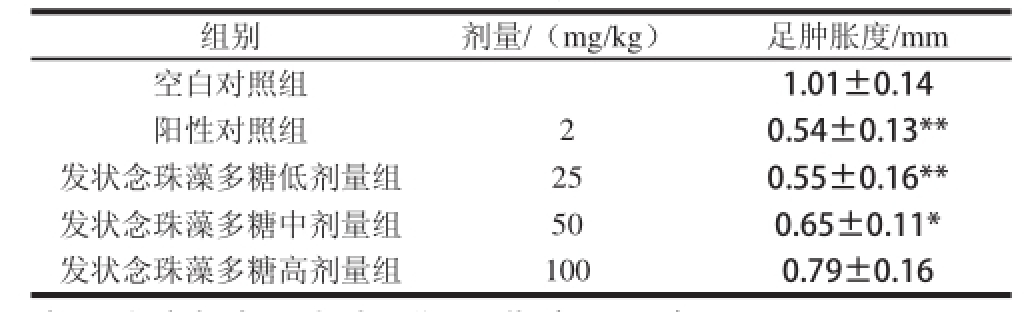
注:*.与空白对照组相比,差异显著(P<0.05)。
组别剂量/(mg/kg)足肿胀度/mm空白对照组1.01±0.14阳性对照组20.54±0.13**发状念珠藻多糖低剂量组250.55±0.16**发状念珠藻多糖中剂量组500.65±0.11*发状念珠藻多糖高剂量组1000.79±0.16
由表4可知,与空白对照组相比,发状念珠藻多糖低剂量显著降低小鼠足肿胀度,发状念珠藻多糖中剂量差异显著,而发状念珠藻多糖高剂量差异不显著。发状念珠藻多糖剂量越高,小鼠足肿胀度越高,说明低剂量发状念珠藻多糖对角叉菜胶引起的小鼠足部炎症抗炎效果最好。
蓝藻是一类结构简单的原核生物,目前,超过100 种蓝藻被发现具有分泌胞外多糖的能力,与植物多糖和大型海藻多糖相比,蓝藻多糖具有更好的物理或生态特性 [21]。不同蓝藻多糖的抑菌活性有差异 [22]。邓庆华等 [23]研究黑木耳多糖发现其抑制细菌作用比霉菌强。王宪伟 [24]通过竹荪多糖对几种菌最小抑制质量浓度的比较,确定了其抑制活性高的菌种。本研究表明发状念珠藻多糖在一定的质量浓度范围内对研究的菌种具有一定的抑菌效果。
炎症是机体受到有害刺激后,在受刺激部位产生的系列复杂病理过程。在此过程中,致炎因素引起毛细血管扩张,通透性增加等反应,尤其在一些慢性疾病中会损伤机体。因此,抗炎效果好且毒副作用小的生物抗炎药品成为迫切需求,关于它的研究也得到普遍重视。
二甲苯能够刺激诸如缓激肽、组织胺等炎症介质的释放,使毛细血管通透性增加,炎症细胞浸润,从而引起小鼠耳壳肿胀。刘立新等 [25]进行胡萝卜多糖的抗炎性研究时,运用二甲苯致炎,观察发现其能够有效地抑制二甲苯引起的小鼠耳肿胀,且多糖剂量越大,抑制作用越强。张庭延等 [26]研究报道了金樱子多糖的抗炎作用,证明其能够明显抑制小鼠耳部由二甲苯引起的炎症。本研究表明,发状念珠藻多糖能够有效缓解二甲苯造成的小鼠耳部炎症,并呈一定的量效关系。角叉菜胶引起小鼠足肿胀是目前建立炎症水肿模型的一种典型方法,炎症反应中表现出细胞浸润与特征性的炎性渗出。本实验结果显示,低剂量发状念珠藻多糖对小鼠足部炎症抗炎效果最好。
综上所述,发状念珠藻胞外多糖有一定的抑菌及抗炎活性,而关于它的抑菌、抗炎作用机制还有待于深入研究。
参考文献:
[1] MATSUI M S, MUIZZUDDIN N, ARAD S, et al. Sulfated polysaccharides from red microalgae have anti-infl ammatory properties in vitro and in vivo[J]. Applied Biochemistry and Biotechnology, 2003, 104(1): 13-22.
[2] 常向东, 李冰冰, 邓伊苓, 等. 葛仙米水溶性多糖的抗菌性实验研究[J].医学理论与实践, 2009, 22(9): 1032-1034.
[3] MARTINS P R, GAMENIRO M C, CASTOLDI L, et al. Polysaccharide-rich fraction of Agaricus brasiliensis enhances the candidacidal activity of murine macrophages[J]. Memorias do Instituto Oswaldo Cruz, 2008, 103(3): 244-250.
[4] BUCHANAN R E, GIBBONS N E. 伯杰细菌鉴定手册[M]. 9版. 中国科学院微生物研究所“伯杰细菌鉴定手册”翻译组, 译. 北京: 科学出版社, 1994.
[5] 王治本, 梁家骥. 发菜生态和形态的近年研究[J]. 内蒙古大学学报:自然科学版, 1989(2): 250-259.
[6] JAO C C. Studies on the freshwater algae of China. ⅪⅤ: some freshwater alage frome kansu[J]. Botanical Bulletin of Academia Sinica, 1947, 1: 67-75.
[7] GAO Kunshan. Chinese studies on the edible blue-green alga, Nostoc fl agelliforme: a review[J]. Journal of Applied Phycology, 1998, 10(1): 37-49.
[8] 李运广, 胡征宇. 发菜(No stoc fl agelliforme)培养条件的研究[J]. 武汉植物学研究, 2003, 21(5): 411-414.
[9] CHEN Xuefeng, JIA Shiru, WANG Yue, et al. Biological crust of Nostoc fl agelliforme (cyanobacteria)on sand bed materials[J]. Journal of Applied Phycology, 2011, 23: 67-71.
[10] DING Zhen, JIA Shiru, HAN Peipei. Effects of carbon sources on growth and extracellular polysaccharide production of Nostoc flagelliforme under heterotrophic high-cell-density fed-batch cultures[J]. Journal of Applied Phycology, 2013, 25: 1017-1021.
[11] 戴治稼. 宁夏发菜营养及化学成份测定[J]. 宁夏农林科技, 1991(3): 42-43.
[12] 倪大洲. 发状念珠藻氨基酸成分的初步研究[J]. 植物学通报, 1984, 2(5): 23-24.
[13] GAO Kunshan, YE Changeng. Culture of the terrestrial cyanobacterium, Nostoc fl agelliforme (cyanobacterium) under aquatic conditions[J]. Journal of Phycology, 2003, 39(3): 617-623.
[14] TAKENAKA H, YAMAGUCHI Y, SAKAKI S. et al. Safety evaluation of Nostoc flagelliforme (nostocales, cyanophyceae) as a potential food[J]. Food and Chemical Toxicology, 1998, 36: 1073-1077.
[15] KANEKIYO K, LEE J B, HAYASHI K, et al. Isolation of an antiviral polysaccharide nostoflan from a terrestrial cyanobacterium Nostoc fl agelliforme[J]. Journal of Narural Products, 2005, 68(7): 1037-1041.
[16] 陈雪峰, 贾士儒, 王岳, 等. 发菜多糖的红外光谱分析与抗氧化活性的研究[J]. 食品与发酵工业, 2008, 35(7): 133-137.
[17] 范秀容, 李广武, 沈萍. 微生物学实验[M]. 北京: 高等教育出版社, 1989: 5.
[18] 王叔淳. 食品卫生检验技术手册[M]. 3版. 北京: 化学工业出版社, 2002: 161-163.
[19] 赵容杰, 赵正林, 王丹, 等. 姬松茸多糖的抗炎作用[J]. 延边大学医学学报, 2004, 27(1): 19-22.
[20] 张均田. 现代药理实验方法(下)[M]. 北京: 北京医科大学中国协和医科大学联合出版社, 1998: 1382-1383.
[21] 陈玮, 刘启顺, 李曙光, 等. 微藻多糖生物活性研究进展[J]. 中国海洋药物杂志, 2012, 31(3): 55-60.
[22] 刘春兰, 杨逸, 何林, 等. 植物多糖抑菌作用研究方法进展[J]. 时珍国医国药, 2013, 24(7): 1725-1727.
[23] 邓庆华, 赵志宇, 张中振. 黑木耳多糖的提取及其理化特性与抑菌活性研究[J]. 安徽农业科学, 2012, 40(12): 7380-7381; 7384.
[24] 王宪伟. 竹荪多糖的抑菌活性研究[J]. 安徽农业科学, 2013, 41(4): 1415; 1452.
[25] 刘立新, 张羽男, 沙靖全, 等. 胡萝卜多糖抗炎及体外抗氧化作用研究[J]. 时珍国医国药, 2011, 22(10): 2334-2335.
[26] 张庭延, 潘继红, 聂刘旺, 等. 金樱子多糖的抑菌和抗炎作用研究[J].生物学杂志, 2005, 22(2): 41-42.
Antimicrobial and Antiinflammatory Activities of Extracellular Polysaccharides from Nostoc fl agelliforme
GUO Jinying, DU Jie, LI Tonghui, REN Guoyan, WANG Ping, ZHANG Yuxian, LI Zhengjun
(College of Food and Bioengineering, Henan University of Science and Technology, Luoyang 471023, China)
Abstract:Extracellular polysaccharides from Nostoc fl agelliforme in liquid suspension culture with BG-11 medium were obtained. By measuring the diameter of the inhibition zone using fi lter paper disc diffusion method, the antimicrobial activity of the exopolysaccharides against different bacteria and fungi were evaluated, and the anti-infl ammatory activity was also tested by examining their effects on the mouse ear swelling induced by xylene and the swelling of hind paws in mice induced by carrageenin. The results showed that Nostoc fl agelliforme extracellular polysaccharides could inhibit Penicillium and Monascus to a certain degree, but had no inhibitory activity on Rhizopus. Nostoc fl agelliforme extracellular polysaccharides could effectively alleviate the infl ammation of mouse ears and hind paws induced by xylene and carrageenin. Therefore, Nostoc fl agelliforme extracellular polysaccharides have certain antimicrobial and antiinfl ammatory activities.
Key words:Nostoc fl agelliforme; extracellular polysaccharides; antimicrobial activity; antiinfl ammatory activity
中图分类号:R285.5
文献标志码:A
文章编号:1002-6630(2015)09-0190-04
doi:10.7506/spkx1002-6630-201509035
收稿日期:2014-06-22
基金项目:河南省重点科技攻关计划项目(142102110038);河南科技大学博士科研启动基金项目
作者简介:郭金英(1971—),男,副教授,博士,研究方向为食物新资源。E-mail:guojinying8@163.com