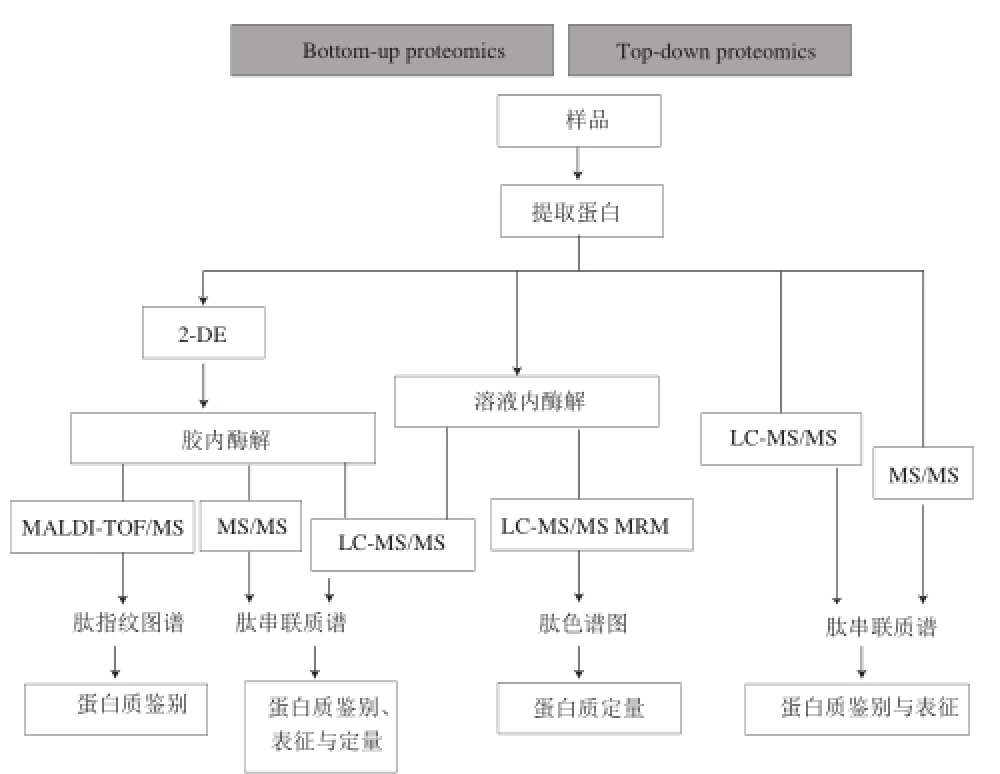
图1 食品科学研究中常用的蛋白质组学工作流程
[12]
Fig.1 Proteomic workflow commonly used for food research
[12]
李学鹏,陈 杨,蔡路昀,仪淑敏,徐永霞,励建荣 *>
(渤海大学食品科学研究院,辽宁省食品安全重点实验室,辽宁 锦州 121013)
摘 要:蛋白质组学技术在水产品品质与安全研究中已有较多应用。本文介绍了蛋白质组学的研究途径,综述了蛋白质组学在水产品物种鉴定、过敏原检测、致病性和腐败性微生物的检测与鉴定、贮藏加工过程中品质变化机制研究等方面的应用进展,并对其发展方向和应用前景进行了展望。
关键词:蛋白质组学;质谱分析法;物种鉴定;过敏原检测;品质与安全
蛋白质组(proteome)是指一个细胞在特定时间和特定环境条件下所有蛋白质的表达,是由澳大利亚Macquarie大学的Wilkins和Williams在1994年首先提出的 [1]。如今,蛋白质组学技术已经广泛应用于基础生物学和临床医学等科学领域,为应用研究的高速发展和发病机制的研究奠定了基础。在食品科学领域中,蛋白质组学的研究与应用虽然还处于起步阶段,但在各个方面已经广泛开展。
鱼类等水产品是人体膳食营养素的主要来源之一,在发展中国家,人均年消耗量在9.0~15.1 kg之间 [2],且摄入量还在逐年增加,这与鱼类中富含的不饱和脂肪酸有关,这些不饱和脂肪酸有助于预防和治疗心血管疾病、神经系统和炎症疾病 [3];同样,鱼类是优质动物性蛋白质来源之一,也能提供丰富微量元素,包括各种维生素(A、D、E、K、B 1、B 6、B 12)和矿物质(Fe、I、P、Ca、K)等。
如今,商业全球化使得我们可以在一个国家捕获鱼,在另一个国家加工,并在其他国家销售,在创造大量商业机会的同时也伴随着各种风险。常见现象就是物种掺假,将低值鱼或非法捕获的鱼替代高经济价值的鱼,欺骗消费者,并对人类健康造成了潜在危害。因为人们一旦食用了含有过敏原的鱼类等水产品,常会引起过敏反应,加重敏感病人的症状或引发并发症。此外,水产品在捕捞、运输、加工、贮藏过程中,组成成分发生改变,进而影响感官品质和安全性。因此,需要一种准确、灵敏、快速的检测方法,以便直接鉴定和监测水产食品中潜在的威胁。在过去的20年,为了达到这个目的,研究者发现了一些DNA和蛋白质分子标记 [4-5],尤其是蛋白质组学技术取得的成功使这个目标得以实现,蛋白质组学在水产品物种鉴定、过敏原分析、致病性和腐败性微生物鉴定、贮藏加工过程中品质变化等研究领域发挥着越来越重要的作用。
蛋白质组学(proteomics)作为一门学科,它是以蛋白质组为研究对象,应用相关技术,从整体水平上来研究蛋白质的存在形式、表达水平、翻译后的修饰、功能及相互作用等 [6]。因此,蛋白质组学研究不仅包括蛋白质结构和功能,还包括蛋白质修饰、蛋白质间的交互作用及分析它们在细胞内的位置和丰度的变化。
蛋白质组学始于20世纪70年代双向凝胶电泳(twodimensional gel electrophoresis,2-DE)的发展 [7]。2-DE技术是在单一凝胶上分离数以千计蛋白质的第一个方法。而质谱分析法是蛋白质组学研究中不可或缺的一项工具,主要包括基质辅助激光解析离子化飞行时间质谱(matrix-assisted laser desorption/ionizationtime of flight,MALDI-TOF)、电喷雾电离-离子阱质谱(electrospray-ion trap,ESI-IT)和串联质谱(mass spectrometry/mass spectrometry,MS/MS) [8]。如今,利用生物信息学的方法处理数据,扩大了蛋白质组学的应用范围,为蛋白质和肽的高通量识别及量化提供了一个强大的途径。蛋白质组学研究方法取得的巨大成功,使它在食品科学领域的应用成为现实。目前,科研院所、行业机构和监管机构共同努力下,利用蛋白质组学研究已经获得了一些有关食品成分、食品质量和安全方面的研究成果,蛋白质组学技术被提议作为最有希望的战略食品认证方案 [9-10]。
根据蛋白质分离、质谱分析方式的不同,蛋白质组学可分为:自下而上蛋白质组学(bottom-up proteomics)和自上而下(top-down proteomics)蛋白质组学两种。Bottom-up proteomics是经典的蛋白质组学研究方法,它的主要步骤包括:分离出感兴趣的蛋白,使用蛋白酶(如胰蛋白酶)进行消化,进行质谱分析 [8]。Top-down proteomics也称鸟枪法蛋白质组学,其基本过程是蛋白质混合物经过简单分离或不经过分离就被酶解为肽段混合物,肽段混合物经液相色谱分离和离子化后,经串联质谱(MS/MS)进行分析 [11]。该方法具有高灵敏度和重现性,可在短时间内获得大量鉴定结果,因此在蛋白质组研究中被广泛采用。然而也存在许多缺点,比如易丢失蛋白质亚型信息、难以识别和表征蛋白质等,尤其是对于水产品这类缺乏基因组测序物种的蛋白质。两种蛋白质组学的研究流程如图1所示 [12]。

图1 食品科学研究中常用的蛋白质组学工作流程
[12]
Fig.1 Proteomic workflow commonly used for food research
[12]
Carrera等 [13-16]提出了用于鱼类物种认证的蛋白质组学方法,并根据研究目的和研究方法的差异,将蛋白质组学研究分为两个连续阶段:发现阶段(discovery phase)和目标驱动阶段(target-driven phase),如图2所示。
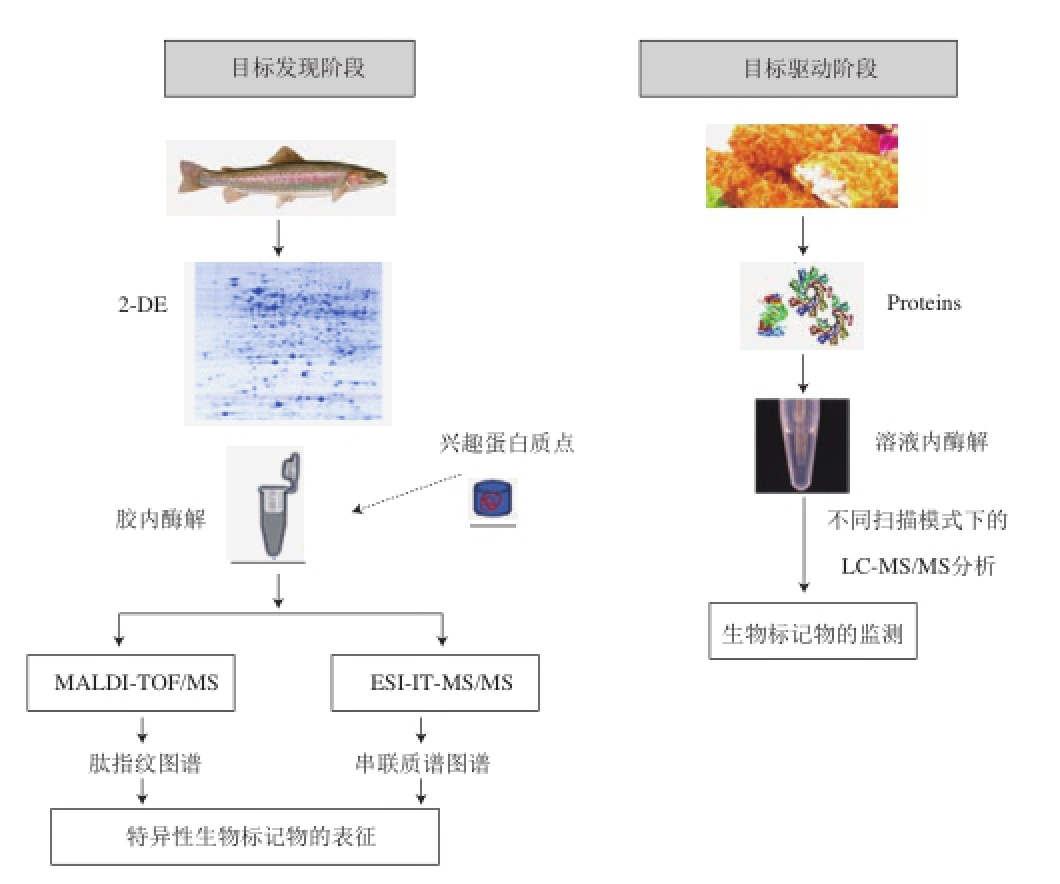
图2 基于生物标记物鉴定与监测的蛋白质组学研究途径
[16]
Fig.2 Proteomics pipeline used for identification and detection of species-specific peptide biomarkers
[16]
2.1 发现阶段(discovery phase)
发现阶段的目标是全面探索特定的蛋白质组,以筛选潜在的蛋白质生物标记物,通常采用Bottom-up proteomics。蛋白质的分离纯化可采用双向凝胶电泳(2-DE)和液相色谱法。其中,2-DE由于其高分辨率,是区分复杂生物样品蛋白质的最有效方法,也是蛋白质组分析中最广泛应用的蛋白质分离方法。对于未完全测序的生物(如鱼类),2-DE是最好的选择,因为这类生物蛋白质是基于特定蛋白质以及与来自其他物种的同源蛋白质之间肽片段的比较来识别的。当然,2-DE也有局限性,如对疏水性和难溶性蛋白质的分离效果不佳等。
质谱是表征和鉴定蛋白质的首选方法,利用生物质谱鉴定蛋白质的过程分为质谱数据的获得和质谱解析两步骤。纯化后的蛋白质被酶切为肽段混合物,离子化后经一级质谱产生肽质量指纹图谱(peptide mass fingerprint,PMF) [17],或经串联质谱产生肽碎片指纹图谱(peptide fragmentation fingerprint,PFF) [18]。现有的解析图谱方法包括序列库搜索、图谱库搜索、从头测序(de novo sequencing)以及从头测序结合容错性搜索的方法。其中,蛋白质序列库搜索法是常用的解析图谱方法。一些经典的搜库软件已得到广泛应用,其中包括MASCOT、SEQUEST、X!Tandem等 [6]。因此,相应的蛋白质序列数据库在蛋白质组学研究中是很重要的,如果分离出来的蛋白不存在于数据库中,但是有高度同源性的蛋白存在,那么最佳匹配的蛋白质是最接近的同源,通常是目标蛋白质的相关种类。如果数据库蛋白的序列相似性太低,必须采用从头测序法,并通过手动或借助计算机辅助工具来解释MS/MS的图谱 [18]。
2.2 目标驱动阶段(target-driven phase)
目标驱动阶段的蛋白质组学方法主要用于监测已被鉴定出的物种特异性肽标记物。如前所述,对于没有完成基因组测序的物种,物种特异性肽的筛选和鉴定需要采用繁琐的从头测序法。一旦获得了这种物种特异性肽,质谱分析仪集中分析由选择反应监测(selectedreaction monitoring,SRM)、多反应监测(multiple reaction monitoring,MRM)和选择离子监测(selected MS/MS ion monitoring,SMIM)等模式得到的几种肽化合物 [19-21]。监测离子对(母离子对和碎片离子对)是鉴定肽标记物的常用方法。目标驱动蛋白质组学方法的优势在于它的高特异性和灵敏性,能够对质量浓度低于ng/mL级的复杂样品中的蛋白质进行定量分析 [20]。
3.1 物种鉴定
鱼类物种的鉴定是水产品质量与安全研究中的一个重要领域,已引起政府、水产品加工企业和消费者们的极大关注 [16]。传统的鱼类认证主要是通过解剖学和生态学特征进行鉴定,然而,对于相似的鱼种类别,特别是经过加工的产品来说,传统鉴定方法很难实现。因此,需要一个快速、可信的分子识别技术,满足政府和水产加工企业所需的物种标识和可追溯性的要求,从而确保产品质量,保护消费者健康。
目前已经存在的鱼类物种鉴定技术主要有以DNA为基础的物种鉴定等技术,但DNA技术存在一定的局限性。在鱼制品加工过程中,细胞完整性被破坏,释放出水解酶,加上加工过程中的热处理和酸性条件,导致DNA的完整性被破坏,减少了片段长度扩增以及提高具有非特异性识别的机会。蛋白质电泳和免疫学技术已广泛应用于鱼类物种的鉴定 [4-5]。等电聚焦(isoelectric focusing,IEF)在1990年就被美国化学会(Association of Official Analytical Chemists,AOAC)作为鱼种鉴定的官方认证方法。与基因组不同,蛋白质组不是一个静态的实体,蛋白质会随着组织和环境条件的变化而变化,蛋白质组学比基因组学的方法产生更多的信息,并可表征除了物种鉴定以外的有关品质的更多信息。因此,蛋白质组学方法已成为水产品品种鉴伪和可追溯的一种更快、更敏感和高通量的方法。
2-DE可以通过检测潜在的物种特异性蛋白质组或蛋白质点来区分相近物种的鱼类,如鳕鱼 [11]、河豚鱼 [22]、鲈鱼 [23]、金枪鱼 [24]等。2-DE法检测潜在的物种特异性蛋白质,通常采用经典的自下向上蛋白质组学方法(bottom-up proteomics),采用胰蛋白酶消化目标蛋白点,通过质谱得到肽指纹图谱。利用肽质量指纹图谱技术(peptide mass fingerprinting,PMF)可以分析无须鳕鱼科的10 个近似商业品种 [11]。肌浆蛋白中的小清蛋白PRVB具有较高的热稳定性,被选为鱼类物种鉴定的目标蛋白质,其MALDI-TOF质量指纹图谱被视为鱼类物种鉴定的分子标记物 [12]。通过监测小清蛋白的肽质量可以区分新鲜的、加工的和煮过的水产品。Mazzeo等 [25]利用MALDI-TOF/MS指纹技术直接对整个肌浆蛋白进行分析(样品不经2-DE分离),通过分析特定PRVB的质量图谱,成功实现了25 种(包括鲈形目、鳕形目和蝶形目)鱼类的区分与鉴定。
3.2 过敏原检测
食物过敏是人类常见的一种过敏性疾病, 绝大部分是由食物蛋白质引起,免疫球蛋白E(IgE)介导的Ⅰ型超敏反应。近年来,食物过敏现象越来越引起人们的重视。据联合国粮食及农业组织(The Food and Agriculture Organization of the United States,FAO)统计,世界范围内约有2%的成人,8%的儿童对食物过敏,其中儿童主要以牛奶和鸡蛋过敏为主,而成人主要以海鲜类食物过敏为主 [26]。在FAO公布的八大类过敏食物中,水产品占了两大类。为了确保消费者的安全,欧盟规定生产者在水产品及其制品的标签中必须标明14 种过敏原 [27]。然而,由于生产过程可能存在交叉污染,市场上流通的产品中很可能含有痕量的过敏原,而极少量的过敏原蛋白即可引起严重的过敏反应。因此,可靠、精确、快捷的过敏原检测方法是非常必要的。
β-PRVBs是主要的鱼类过敏原,大量出现在鱼类白色肌肉中 [28]。Carrera等 [29]建立了一种可以快速、直接检测任何食物中的鱼源β-PRVBs的方法。该方法采用目标驱动蛋白质组学方法,通过热处理使β-PRVBs快速分离,利用高强度聚焦超声法加速样品的胰蛋白酶消化,采用选择离子监测模式(SMIM)进行质谱分析,实现了对19 种常见的β-PRVBs肽标记物的检测。由于PRVBs对热稳定,因此该方法能够快速直接检测存在于任何产品包括经过加工的及预煮的产品中的β-PRVBs。
Yu等 [30]采用蛋白质组学技术筛选出了斑节对虾(Penaeus monodon)中的过敏原,结果表明,该过敏原是一种与精氨酸激酶具有高度相似性的蛋白质,具有精氨酸激酶的活性,并可与对虾过敏人群血清中IgE发生反应,导致皮肤过敏反应。
3.3 致病性和腐败性微生物的检测与鉴定
微生物是导致大部分水产品腐败变质的主要原因,但只有极少种类的特定腐败菌参与腐败过程产生不可接受的异味,使其丧失商品价值。另外,水产品加工过程中致病微生物的污染事件引起消费者食物中毒,同样给水产加工企业带来重大的经济损失。水产品食物中毒大都是由其所携带的致病菌(包括大肠杆菌、沙门氏菌、金黄色葡萄球菌和副溶血性弧菌等)产生的毒素引起的。因此,对水产品中的主要腐败菌和致病菌进行鉴定、检测及有效控制是延长水产品货架期、提高质量和安全性、保障行业健康发展的关键技术需求。
目前食品中微生物的鉴定主要是通过传统方法、表型实验及16S rRNA基因序列鉴定等方法实现的,存在效率偏低、精确度不高等缺点,而蛋白质组学技术在腐败菌和致病菌的检测、鉴定中显示出强大优势。Mazzeo等 [31]通过对细菌细胞膜全蛋白的MALDI-TOF/MS分析实现了对24 种食源性致病菌和腐败菌的检测与鉴别,其中包括埃希氏杆菌属、耶尔森氏菌属、变形菌属、沙门氏菌属、葡萄球菌属、微球菌、乳球菌属、假单胞菌属、明串珠菌和李斯特菌属等。细菌细胞膜中低分子质量蛋白质的MALDI-TOF/MS分析已成功用于新鲜和加工水产品的安全性评估,主要的腐败和致病性革兰氏阴性细菌,包括嗜水气单胞菌、鲍氏不动杆菌、假单胞菌属和肠杆菌属等被鉴定出来 [32-33]。B☒hme等 [34]报道了利用MALDITOF/MS鉴定出水产品中革兰氏阳性菌的研究,包括芽孢杆菌、李斯特菌属、梭状芽孢杆菌属和葡萄球菌属等。Fernández-No等 [35-37]利用MALDI-TOF/MS鉴定出水产品中生物胺的产生菌和引起大菱鲆等养殖鱼类腐败和传染性疾病的副乳房链球菌(Streptococcus parauberis)。
如今已经有多个商业数据库用于细菌的MALDITOF/MS鉴定,如AXIMMA@SARAMISA(日本岛津公司),MicrobeLynx细菌鉴定系统(英国沃特斯公司),NALDI Biotyper(美国布鲁克·道尔顿公司)。尽管这些数据库主要是针对引起人类传染性疾病的病原菌,但其中有些细菌种类在水产品的腐败和安全中也发挥重要作用。最近,西班牙Santiago de Compostela University的一个研究组开发了一个新的公共数据库——Spectrabank,该数据库中包括水产品中主要的腐败和致病菌的质量指纹图谱,并涵盖了食品中存在的120 种细菌 [16]。
3.4 水产品贮藏加工过程中品质变化机制
影响水产品新鲜度和品质的主要因素包括肌肉蛋白质水解和细菌性腐败,都会引起肌原纤维蛋白和细胞骨架蛋白的变化 [38-39]。鱼类等水产品在捕捞、宰杀、贮藏、加工等过程中肌肉蛋白质的变化极具复杂性,蛋白质组学分析可为其变化机制的阐释提供一定的帮助。
宰杀前状态(包括鱼的活力、鱼肉密度、环境压力等)、宰杀过程中糖原损耗和pH值下降等都会影响鱼类死后肌肉的完整性和肌肉品质,这些变化可用蛋白质组学技术(主要是2-DE)来表征 [40]。Morzel等 [41]采用2-DE技术研究了宰杀前生理活性和应激反应对养殖鲑鱼肌肉品质的影响,发现了能量产生酶和结构蛋白在表达水平的差异。Veiseth-Kent等 [42]采用2-DE技术研究了拥挤应激对三文鱼肌肉和血液中蛋白质组的影响,发现了二级、三级应激反应引起的蛋白质表达水平的变化。王彦波等 [43]研究了宰杀方式对鲫鱼肌肉质构和蛋白质组的影响,发现与直接打头致死组比较,氮气致死组2-DE图谱中小分子质量蛋白质点增多,相同蛋白质的相对含量下降,这些变化与肌肉硬度等品质相关。
利用蛋白质组学技术可以表征贮藏过程中鱼类肌肉蛋白质的变化与其品质性状之间的相关性等信息,从而为贮藏过程中水产品品质变化机制的解析和水产品新鲜度评价提供参考和依据。Kj☒rsg☒rd等 [44]采用2-DE技术研究了大西洋鳕鱼贮藏过程中的肌球蛋白、α-辅肌动蛋白、3-磷酸丙糖异构酶等蛋白质的变化并提出了鱼类死后肌肉蛋白质降解的一般途径。Terova等 [45]采用2-DE和MS技术比较了不同冷冻贮藏条件的鳕鱼肌肉蛋白质图谱并分析了与鱼肉质地变化的相关性。李学鹏 [46]、李婷婷 [47]等采用2-DE和MS技术分别研究了中国对虾和大黄鱼肌肉蛋白质在冷藏过程中的变化规律,筛选出与新鲜度密切相关的指示蛋白质。
贮藏加工过程中,蛋白质氧化修饰如羰基化反应、硫醇氧化、芳香族羟基化和美拉德反应等,会引起蛋白质的交联、侧链修饰和肽键断裂等变化,改变蛋白质的结构性质(如疏水性、凝胶性、水合性等),进而影响水产品的感官和营养品质 [48]。采用2-DE、串联质谱等蛋白质组学技术可以监测检测蛋白质羰基化反应,跟踪贮藏过程中蛋白质的氧化水平,并对参与氧化的蛋白质进行鉴别 [49-50]。Kj☒rsg☒rd等 [44]利用LC-MS/MS技术鉴别出冷冻虹鳟鱼鱼片贮藏过程中发生氧化的蛋白质,包括核苷二磷酸激酶、腺苷酸激酶、丙酮酸激酶、肌动蛋白、肌酸激酶、原肌球蛋白、肌球蛋白轻链1和2和肌球蛋白重链。Pazos等 [51]采用2-DE、MALDI-TOF/TOF、LC-ESIIT-MS/MS研究了马鲛鱼肌原纤维蛋白质氧化情况,发现α-肌动蛋白、糖原磷酸化酶、丙酮酸激酶、亚型肌酸激酶、醛缩酶A和亚型甘油醛-3-磷酸脱氢酶等蛋白质均发生了氧化。
蛋白质组学能够提供参与决定食品种属、品质、功能与安全性的各种生理机制过程中的蛋白质结构和功能等信息,已广泛用于食品科学研究领域,极大地拓展了食品科学的研究范围。近年来,利用蛋白质组学研究水产品品质与安全的研究著作的数量快速增长,这些研究表明,蛋白质组学技术在水产品物种鉴别、过敏原检测、水产品腐败与安全性、水产品品质变化机制等研究方面是一个强大的工具。水产品品质与安全性是由多种因素间复杂的相互作用决定的,蛋白质组学只是用于分析的有力工具而不是解决品质与安全问题的最终方法,以蛋白质组学技术为基础,筛选、建立可靠的生物标记物(如水产品新鲜度指示蛋白等)并将其运用于水产品贮藏加工过程中品质与安全性的评价与控制,是水产品蛋白质组学研究中的一个重要方向。此外,新的研究平台(如微流体设备、蛋白质芯片)的开发与应用也为现代食品科学研究提供更为广阔的发展空间,将有助于利用蛋白质组学研究结果实现水产品品质的常规诊断、监测与控制,为水产食品科学研究提供了新的思路和方法。
参考文献:
[1] WASINGER V C, CORDWELL S J, CERPA-POLJAK A,et al. Progress with gene-product mapping of the mollicutes: Mycoplasmagen italium[J]. Electtrophoresis, 1995, 16(1): 1090-1094.
[2] FAO. The state of world fisheries and aquaculture[R]. Rome: Food and Agriculture Organization of the United Nations, 2014.
[3] HOOPER L, THOMPSON R L, HARRISON R A, et al. Risks and benefits of omega 3 fats for mortality, cardiovascular disease, and cancer: systematic review[J]. British Medical Journal, 2006, 332: 752-760.
[4] BOZIARIS I S. Fish and seafood authenticity: species identification[M]//LAGO F C, ALONSO M, VIEITES J M, et al. Seafood processing: technology, quality and safety. Hoboken: John Wiley & Sons Inc., 2013.
[5] TEPEDINO V, BERRINI A, BORROMEO V, et al. Identification of commercial fish species belonging to the orders pleuronectiformes and gadiformes: library of isoelectric focusing patterns[J]. Journal of AOAC International, 2001, 84(5): 1600-1607.
[6] 李学鹏, 励建荣, 于平, 等. 蛋白质组学及其在食品科学研究中的应用[J]. 中国粮油学报, 2010, 25(2): 141-149.
[7] AEBERSOLD R, MANN M. Mass spectrometry-based proteomics[J]. Nature, 2003, 422: 198-207.
[8] ZHANG Y, FONSLOW B R, SHAN B, et al. Protein analysis by shotgun/bottom-up proteomics[J]. Chemical Review, 2013, 113(4): 2343-2394.
[9] RODRIGUES P M, SILVA T S, DIAS J, et al. Proteomics in aquaculture: applications and trends[J]. Journal of Proteomics, 2012,75(14): 4325-4345.
[10] D’ALESSANDRO A, ZOLLA L. We are what we eat: food safety and proteomics[J]. Journal of Proteome Research, 2011, 11(1): 26-36.
[11] MOTOYAMA A, YATES J R, Ⅲ. Multidimensional LC separations in shotgun proteomics[J]. Analytical Chemistry, 2008, 80(19): 7187-7193.
[12] GALLARDO J M, ORTEA I, CARRERA M. Proteomics and its applications for food authentication and food-technology research[J]. TrAC Trends in Analytical Chemistry, 2013, 52: 135-141.
[13] CARRERA M, CA☒AS B, PI☒EIRO C, et al. Identification of commercial hake and grenadier species by proteomic analysis of the parvalbumin fraction[J]. Proteomics, 2006, 6(19): 5278-5287.
[14] CARRERA M, CA☒AS B, L☒PEZ-FERRER D, et al. Fast monitoring of species-specific peptide biomarkers using high-intensity-focusedultrasound-assisted tryptic digestion and selected MS/MS ion monitoring[J]. Analytical Chemistry, 2011, 83(14): 5688-5695.
[15] CARRERA M, CA☒AS B, V☒ZQUEZ J, et al. Extensive de novo sequencing of new parvalbumin isoforms using a novel combination of bottom-up proteomics, accurate molecular mass measurement by FTICR-MS, and selected MS/MS ion monitoring[J]. Journal of Proteome Research, 2010, 9(9): 4393-4406.
[16] CARRERA M, CA☒AS B, GALLARDO J M. Proteomics for the assessment of quality and safety of fishery products[J]. Food Research International, 2013, 54: 972-979.
[17] PAPPIN D J C, HOJRUP P, BLEASBY A. Rapid identification of proteins by peptide-mass fingerprinting[J]. Current Biology, 1993,3(6): 327-332.
[18] ENG J K, MCCORMACK A L, YATES J R. An approach to correlate tandem mass spectral data of peptides with amino acid sequences in a protein database[J]. Journal of the American Society for Mass Spectrometry, 1994, 5(11): 976-989.
[19] GALLIEN S, DURIEZ E, DOMON B. Selected reaction monitoring applied to proteomics[J]. Journal of Mass Spectrometry, 2011, 46(3): 298-312.
[20] JORGE I, CASAS E M, VILLAR M, et al. High-sensitivity analysis of specific peptides in complex samples by selected MS/MS ion monitoring and linear ion trap mass spectrometry: application to biological studies[J]. Journal of Mass Spectrometry, 2007, 42(11): 1391-1403.
[21] UNWIN R D, GRIFFITHS J R, WHETTON A D. A sensitive mass spectrometric method for hypothesis-driven detection of peptide posttranslational modifications: multiple reaction monitoring-initiated detection and sequencing (MIDAS)[J]. Nature Protocols, 2009, 4(6): 870-877.
[22] CHEN R, CHANG L, CHUNG Y, et al. Quantification of cow milk adulteration in goat milk using high-performance liquid chromatography with electrospray ionization mass spectrometry[J]. Rapid Communications in Mass Spectrometry, 2004, 18(10): 1167-1171.
[23] BERRINI A, TEPEDINO V, BORROMEO V, et al. Identification of freshwater fish commercially labelled ‘perch’ by isoelectric focusing and two-dimensional electrophoresis[J]. Food Chemistry, 2006, 96(1): 163-168.
[24] PEPE T, CERUSO M, CARPENTIERI A, et al. Proteomics analysis for the identification of three species of Thunnus[J]. Veterinary Research Communications, 2010, 34(1): 153-155.
[25] MAZZEO M F, GIULIO B D, GUERRIERO G, et al. Fish authentication by MALDI-TOF mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2008, 56(23): 11071-11076.
[26] SICHERER S H. Epidemiology of food allergy[J]. Journal of Allergy and Clinical Immunology, 2011, 127(3): 594-602.
[27] JEEBHAY M F, ROBINS T G, LEHRER S B, et al. Occupational seafood allergy: a review[J]. Occupational and Environmental Medicine, 2001, 58(9): 553-562.
[28] 刘光明, 曹敏杰, 蔡秋凤, 等. 水产品过敏原的研究现状和展望[J].中国食品学报, 2012, 12(5): 1-9.
[29] CARRERA M, CA☒AS B, GALLARDO J M. Rapid direct detection of the major fish allergen, parvalbumin, by selected MS/MS ion monitoring mass spectrometry[J]. Journal of Proteomics, 2012, 75(11): 3211-3220.
[30] YU C J, LIN Y F, CHIANG B L, et al. Proteomics and immunological analysis of a novel shrimp allergen, Pen m 2[J]. The Journal of Immunology, 2003, 170(1): 445-453.
[31] MAZZEO M F, SORRENTINO A, GAITA M, et al. Matrix-assisted laser desorption ionization-time of flight mass spectrometry for the discrimination of food-borne microorganisms[J]. Applied and Environmental Microbiology, 2006, 72(2): 1180-1189.
[32] B☒HME K, FERN☒NDEZ-NO I C, BARROS-VEL☒ZQUEZ J, et al. Rapid species identification of seafood spoilage and pathogenic Gram-positive bacteria by MALDI-TOF mass fingerprinting[J]. Electrophoresis, 2011, 32(21): 2951-2965.
[33] B☒HME K, FERN☒NDEZ-NO I C, BARROS-VEL☒ZQUEZ J, et al. Species differentiation of seafood spoilage and pathogenic Gramnegative bacteria by MALDI-TOF mass fingerprinting[J]. Journal of Proteome Research, 2010, 9(6): 3169-3183.
[34] B☒HME K, FERN☒NDEZ-NO I, GALLARDO J M, et al. Safety assessment of fresh and processed seafood products by MALDI-TOF mass fingerprinting[J]. Food and Bioprocess and Technology, 2011,4(6): 907-918.
[35] FERN☒NDEZ-NO I C, B☒HME K, GALLARDO J M, et al. Differential characterization of biogenic amine-producing bacteria involved in food poisoning using MALDI-TOF mass fingerprinting[J]. Electrophoresis, 2010, 31(6): 1116-1127.
[36] FERN☒NDEZ-NO I C, B☒HME K, CALO-MATA P, et al. Isolation and characterization of Streptococcus parauberis from vacuumpackaging refrigerated seafood products[J]. Food Microbiology, 2012,30(1): 91-97.
[37] B☒HME K, FERN☒NDEZ-NO I C, BARROS-VEL☒ZQUEZ J, et al. SpectraBank: an open access tool for rapid microbial identification by MALDI-TOF MS fingerprinting[J]. Electrophoresis, 2012, 33(14): 2138-2142.
[38] DU Xueli, DU Cuihong, LIU Guangming, et al. Effect of a myofibrilbound serine proteinase on the deg of giant protein titin and nebulin[J]. Journal of Food Biochemistry, 2010, 34(3): 581-594.
[39] WU Guoping, CHEN Suhua, LIU Guangming, et al. Purification and characterization of a collagenolytic serine proteinase from the skeletal muscle of red sea bream (Pagrus major)[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2010,155(3): 281-287.
[40] ADDIS M F, PISANU S, PREZIOSA E, et al. 2D DIGE/MS to investigate the impact of slaughtering techniques on postmortem integrity of fish filet proteins[J]. Journal of Proteomics, 2012, 75(12): 3654-3664.
[41] MORZEL M, CHAMBON C, LEFEVRE F, et al. Modifications of trout (Oncorhynchus mykiss) muscle proteins by preslaughter activity[J]. Journal of Agricultural and Food Chemistry, 2006, 54(8): 2997-3001.
[42] VEISETH-KENT E, GROVE H, F☒RGESTAD E M, et al. Changes in muscle and blood plasma proteomes of Atlantic salmon (Salmo salar) induced by crowding[J]. Aquaculture, 2010, 309(1): 272-279.
[43] 王彦波, 沈晓琴, 李学鹏, 等. 不同宰杀方式对鲫鱼肌肉质构和蛋白质组的影响[J]. 中国食品学报, 2010, 10(6): 145-149.
[44] KJ☒RSG☒RD I V H, N☒RRELYKKE M R, JESSEN F. Changes in cod muscle proteins during frozen storage revealed by proteome analysis and multivariate data analysis[J]. Proteomics, 2006, 6(5): 1606-1618.
[45] TEROVA G, ADDIS M F, PREZIOSA E, et al. Effects of postmortem storage temperature on sea bass (Dicentrarchus labrax) muscle protein degradation: analysis by 2-D DIGE and MS[J]. Proteomics, 2011,11(14): 2901-2910.
[46] 李学鹏. 中国对虾冷藏过程中品质评价及新鲜度指示蛋白研究[D].杭州: 浙江工商大学, 2011.
[47] 李婷婷. 大黄鱼生物保鲜技术及新鲜度指示蛋白研究[D]. 杭州: 浙江工商大学, 2012.
[48] LUND M N, HEINONEN M, BARON C P, et al. Protein oxidation in muscle foods: a review[J]. Molecular Nutrition & Food Research,2011, 55(1): 83-95.
[49] KINOSHITA Y, SATO T, NAITOU H, et al. Proteomic studies on protein oxidation in bonito (Katsuwonus pelamis) muscle[J]. Food Science and Technology Research, 2007, 13(2): 133-138.
[50] KJ☒RSG☒RD I V H, JESSEN F. Two-dimensional gel electrophoresis detection of protein oxidation in fresh and tainted rainbow trout muscle[J]. Journal of Agricultural and Food Chemistry, 2004, 52(23): 7101-7107.
[51] PAZOS M, MAESTRE R, GALLARDO J M, et al. Proteomic evaluation of myofibrillar carbonylation in chilled fish mince and its inhibition by catechin[J]. Food Chemistry, 2013, 136(1): 64-72.
Application of Proteomics in Studies of Seafood Quality and Safety
LI Xuepeng, CHEN Yang, CAI Luyun, YI Shumin, XU Yongxia, LI Jianrong*
(Food Safety Key Laboratory of Liaoning Province, Food Science Research Institute of Bohai Univ ersity, Jinzhou 121013, China)
Abstract:Proteomics has been widely applied in the field of seafood quality and safety. The pipeline of proteomics is described in this review. The application of proteomics in fish authentication, allergen detection, detection and identification of pathogenic and spoilage microorganisms, and quality change mechanisms are summarized. Finally, future directions and new potential perspectives are also discussed.
Key words:proteomics; mass spectrometry; fish authentication; allergen diction; quality and safety
中图分类号:TS254.4
文献标志码:A
文章编号:1002-6630(2015)09-0209-06
doi:10.7506/spkx1002-6630-201509039
收稿日期:2014-07-22
基金项目:国家自然科学基金青年科学基金项目(31301569;31301418);国家自然科学基金面上项目(31471639);
“十二五”国家科技支撑计划项目(2012BAD29B06);辽宁省博士启动基金项目(20131003)
作者简介:李学鹏(1982—),男,副教授,博士,研究方向为水产品贮藏加工与水产食品化学。E-mail:xuepengli8234@163.com
*通信作者:励建荣(1964—),男,教授,博士,研究方向为水产品贮藏加工与食品安全。E-mail:lijr6491@163.com