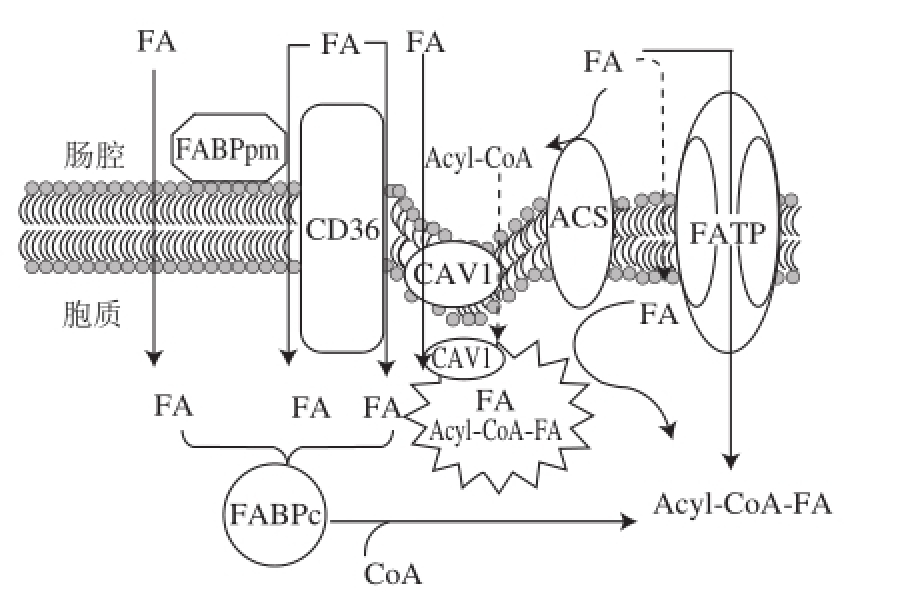
图1 肠道中游离脂肪酸进入小肠细胞的途径
Fig.1 Schematic pathways of fatty acid (FA) transport across the enterocyte membrane
ACS. 硫激酶;Acyl-CoA-FA. 乙酰辅酶A酰脂肪酸;CAV1. 陷窝蛋白1;CoA. 辅酶A;FA. 脂肪酸;FABPc. 胞质脂 肪酸结合蛋白;FABPpm. 外周质膜脂肪酸结合蛋白;FATP. 脂肪酸转运蛋白。
黄 海,米 杨,田苗苗,郭雅萍,葛逸飞,李博杰,廖 然
(上海大学生命科学学院,上海 200444)
摘 要:餐后膳食脂肪的代谢涉及到多个方面,主要包括消化道中的消化过程、细胞内乳糜微粒的形成和转运、血脂的消化和乳糜微粒残粒的清除。消化道中的多种酶将膳食脂肪消化成游离的长链脂肪酸,然后通过小肠细胞的多种蛋白将其进行跨膜转运吸收到细胞内,重新形成甘油三酯并和多种脂蛋白形成乳糜微粒。新组装的乳糜微粒携带膳食来源的甘油三酯转运 到血液中,经毛细血管内皮表面附着的脂蛋白脂肪酶的催化形成脂肪酸,游离的脂肪酸被周围组织细胞吸收,残粒和多余的脂肪酸被肝细胞吸收。研究表明脂蛋白脂肪酶是血脂清除和组织摄入脂肪酸的限速酶,它的表达在转录和转译等多个不同水平上严格控制,以应对不同的生理信号刺激。如果膳食脂肪的代谢调控出现问题,将会导致高甘油三酯血症,诱发心血管疾病、胰岛素抵抗和肥胖等相关疾病。
关键词:膳食脂肪;脂蛋白脂肪酶;乳糜微粒;脂肪酸
人们日常饮食中35%~40%的能量来自膳食脂肪,甘油三酯(triglyceride,TG)是膳食脂肪的主要形式。膳食脂肪不能直接穿过小肠细胞进入血液中,它需要首先在消化道中由脂肪酶等酶类降解为长链的游离脂肪酸和甘油,再进入小肠细胞重新合成TG,然后和脂蛋白等包装成乳糜微粒分泌出来进入血液循环 [1]。血液中乳糜微粒含有的TG的释放主要依靠毛细血管内皮表面附着的脂蛋白脂肪酶(lipoprotein lipase,LPL)将其降解为游离的脂肪酸,从而被周围组织利用。剩余的乳糜微粒残粒经血液循环被肝细胞捕获吸收到细胞内消化。餐后长时间存在于血液中的TG和游离脂肪酸容易引起高甘油三酯血症(hypertriglyceridemia),该病症也是诱发肥胖、胰岛素抵抗、Ⅱ型糖尿病和心血管疾病的主要因素之一 [2-4]。血脂水平的调控涉及多 方面的代谢路径,深入了解膳食脂肪的在体内的代谢过程有助于我们更好地预防和治疗上述疾病。本文主要围绕膳食脂肪的消化过程和外周血脂代谢相关的脂蛋白脂肪酶的研究进展进行综述。
膳食脂肪的消化在口腔中已经开始了。舌部的冯•埃布纳腺(von Ebner gland)分泌的舌脂肪酶(lingual lipase)能够分解TG [5]。胃部的胃底腺分泌胃脂肪酶对脂肪作进一步消化,并 通过胃的蠕动对膳食脂肪进行乳化。初步乳化的脂质进入十二指肠,在胆汁盐刺激的脂肪酶(bile-salt-stimulated lipase)和胰腺分泌的胰脂肪酶的作用下,膳食脂肪被进一步水解、吸收,形成微胶粒后进入到小肠 [6]。胰脂肪酶催化功能的有效发挥还需要胰脏本身分泌的辅脂肪酶(colipase)的作用,另外肝脏分泌的胆汁也有助于脂质的乳化 [7]。
膳食脂肪在小肠中继续被胰脂肪酶降解为游离脂肪酸和2-单酰甘油(2-monoacylglycerol,2-MAG),通过主动扩散或转运蛋白吸收到小肠细胞内部。参与游离脂肪酸和2-单酰甘油运送的膜转运蛋白主要可以分为三大类:脂肪酸转运蛋白(fatty acid transport proteins,FATP)、外周质膜脂肪酸结合蛋白(peripheral plasma membrane fatty acid-binding protein,FABPpm)和脂肪酸转位酶/簇决定蛋白36( fatty acid translocase/cluster determinant 36,FAT/CD36) [8]。FATP1~6存在于细胞膜和细胞器上,具有长链脂肪酰辅酶A合成酶(long chain fatty acyl-CoA synthetase)活性,对脂肪酸的摄入 利用起重要作用。FABP pm被证实是线粒体 天冬氨酸氨基转移酶,主要参与维持胞质和线粒体之间NADH/NAD的比例,可能携带游离脂肪酸进入脂质氧化代谢中。CD36最初作为膜上的脂肪酸转位酶被发现,它由多种细胞分泌,参与多种生理活动,如凋亡信号、吞噬、脂蛋白的吸附和氧化等过程,它对脂肪酸的摄取功能主要通过构建基因敲除和过表达的转基因小鼠而被发现 [9]。
除了上述三类主要的脂肪酸转运蛋白外,还有一些蛋白参与脂肪酸跨膜运输。介导内吞作用的细胞小窝中富含陷窝蛋白(caveol in,CAV),陷窝蛋白主要有3种,其中陷窝蛋白1(CAV1)在 脂肪细胞中表达丰富,参与对脂肪酸的吸附和内吞小泡的形成。CAV1对CD36转译后的稳定和膜表达起重要作用,它还能够将细胞补充更新的CD36集中到小肠绒毛的细胞陷窝(caveolae)处,从而提高脂肪酸的吸收率。肌肉的收缩、胰岛素的刺激和葡萄糖与葡萄糖转运蛋白4的结合都会显著刺激CD36加速从胞内室膜定位到细胞膜上。位于膜表面的硫激酶(acyl-CoA syntase,ACS)也和脂肪酸的吸收有关,该蛋白通过在脂肪酸末端追加辅酶A,从而捕获肠腔中游离脂肪进入细胞窝进而胞内小室进入细胞内,ACS还可以对胞内游离的脂肪酸尾部追加辅酶A来加速脂肪酸的代谢。胞质脂肪酸结合蛋白(cytoplasmic fatty acid-binding protein,FA BPc)通过及时运送脂肪酸,也能够加速细胞对胞外脂肪酸的吸收 [10]。

图1 肠道中游离脂肪酸进入小肠细胞的途径
Fig.1 Schematic pathways of fatty acid (FA) transport across the enterocyte membrane
ACS. 硫激酶;Acyl-CoA-FA. 乙酰辅酶A酰脂肪酸;CAV1. 陷窝蛋白1;CoA. 辅酶A;FA. 脂肪酸;FABPc. 胞质脂 肪酸结合蛋白;FABPpm. 外周质膜脂肪酸结合蛋白;FATP. 脂肪酸转运蛋白。
膳食脂肪在消化道中 被多种脂肪酶和辅脂肪酶主要降解为2-单酰甘油(2-MAG)和游离脂肪酸(free fatty acid,FFA),它们通过主动 和被动运输的方式被小肠细胞吸收(图1),然后通过单酰甘油途径(monoacylglycerol pathway,MA G pathway)重新合成TG并参与形成乳糜微粒。肠道中的单酰甘油可被胰脂肪酶和胆固醇酯酶(cholestero l esterase)进一步降解为甘油和FFA,也被小肠细胞吸收,只有少量的 FFA和甘油可直接进入血液循环。
进入到小肠细胞中的游离脂肪酸将会被运送到内质网重新合成TG并被包装进乳糜微粒中(图2)。小肠细胞内的脂肪酸结合蛋白家族包括FABP1~9和维甲酸结合蛋 白(retinoid binding protein,RBP) [11-12]。其中FABP1、FABP2在小肠内高度表达的。游离脂肪酸与FABP结合后被运送到内质网作进一步酯化。催化该酯化反应的是单酰甘油酰基转移酶(monoacylgycerol acyltransferase,MGAT)和二酰甘油酰基转移酶(diacylgycerol acyltransferase,DGAT)。MGAT将长链脂肪酸和单酰甘油二者重新合成甘油二酯 [13]。MGAT主要有3 种形式,小肠组织中高表达的主要是MGAT2和MGAT3,其他组织主要表达MGAT1 [14]。新合成的甘油二酯再被DGAT酰化形成TG。DGAT1和DGAT2主要表达在小肠细胞的内质网上,DGAT1大约承担小肠内85%的二酰甘油酰基转移酶活力。

图2 富含TG的乳糜微粒的组装过程
Fig.2 triglyceride (TG)-rich chylomicron assembl y
ApoA. 载脂蛋白A;ApoB48. 载脂蛋白B48;ApoC2. 载脂蛋白C2;ApoE.载脂蛋白E;COP2. 外壳蛋白复合物2;DGAT. 二酰甘油酰基转移酶;FABPc. 胞质脂肪酸结合蛋白;2-MAG. 2-单酰甘油;MGAT. 单酰甘油酰基转移酶;MTP. 微粒体甘油三酯转运蛋白;P CTV. 前乳糜微粒转运囊泡;RBP. 维甲酸结合蛋白;SNARE. 可溶性N-乙基马来酰亚胺-敏感因子附着蛋白膜受体;TG. 甘油三酯;VAMP7. 囊泡相关膜蛋白7。
新合成的TG与载脂蛋白B的一段ApoB48形成 最初的乳糜微粒,这个过程需要微粒体甘油三酯转运蛋白(microsomal triglyceride transfer protein,MTP)的参与。MTP是异质二聚体蛋白,含有相对分子质量97的蛋白亚单位和相对分子质量55的内质网分子伴侣蛋白质二硫键异构酶(pro tein disulfide isomerase,PDI)。ApoB48的新生多肽链在内质网内腔中脂质化并形成原初脂质颗粒,MTP与之结合促使颗粒融合扩大。新合成的TG与MTP结合进入颗粒,从而形成初始的乳糜微粒。随后更多的胆固醇酯、视黄醇酯和VE也在MTP的帮助下进入乳糜微粒 [15]。形成的乳糜微粒的表面主要由单层磷脂(主要是磷酯酰胆碱)、游离的胆固醇和蛋白质构成。最初的乳糜微粒还非常大,往往还含有其他载脂蛋白如ApoA 1、ApoA4和ApoCs,这些载 脂蛋白主要帮助TG包装进入乳糜微粒。由于原初乳糜微粒形成过程中不断吸收TG,因此其体积不断增大,最后由内质网分泌出来时直径大约为250 nm [16]。
由内质网分泌出来的原初乳糜被包裹在 囊泡中,该囊泡称为前乳糜微粒转运囊泡(prechylomicron transport vesicles,PCTVs),因为它们和蛋白质分泌形成的囊泡不同。此时的PCTV含有多种蛋白,如:外壳蛋白复合物2(coat protein complex 2,COP2),内质网膜蛋白GTP酶家族的Sar1、Sec23、Sec24、Sec13和Sec31等。此外囊泡相关膜蛋白7(vesicle-associated membrane protein 7,VAMP7)、CD36和FABP1也是转运囊泡的组成成分,研究还发现PCTV的形成需要蛋白激酶C催化的ATP参与磷酸化过程 [17-18]。VAMP7作为囊泡可溶性N-乙基马来酰亚胺-敏感因子附着蛋白膜受体(vesiclesoluble N-ethylmaleimide sensitive factor attachment protein receptors,v-SNARE)家族成员,是小肠细胞特异蛋白,它在内质网集中表达后包涵PCTV中与高尔基体顺式面的靶膜相关SNARE(target-SNARE,t-SNARE),主要是Syntaxin5、Rbet1和Vit1a相互作用后形成SNARE复合物,促进PCTV和高尔基体膜融合,释放乳糜微粒进入高尔基体。乳糜微粒运输到高尔基体后,ApoB48还将进行糖基化 [19]。
食物中的胆固醇大都呈游离形式,但是仍然有10%~15%以胆固醇酯的形式存在。摄入的胆固醇主要来源于动物食品,如蛋、奶制品和肉类。酯化的胆固醇在消化道中被 胆固醇酯酶(cholesterol esterase)分解为胆固醇和脂肪酸。随胆汁和脂肪一起形成微团进入小肠。尼曼匹克症C1类似蛋白1(Niemann-Pick C1 like prot ein,NPC1L1)是跨膜转运游离胆固醇到内质网的重要蛋白。ATP结合盒蛋白G5/8(ATP-binding cassette protein G5/8,ABCG5/8)作为异源双体蛋白,控制胆固醇流出,它们在肝细胞和小肠细胞表面表达量很高 [20]。胆固醇在内质网内被胆固醇酰基转移酶(cholesterol acyltransferase 1/2,ACAT 1/2)酰化加上脂肪酸。微粒体TG转运蛋白也帮助胆固醇转运并与载脂蛋白ApoB48结合进入乳糜微粒 [21]。
乳糜颗粒由小肠细胞高尔基体转运到细胞膜表面分泌出来,具体分子机制还不是十分清楚。肠腔的磷脂酰胆碱和小肠细胞ApoA4表达对乳糜微粒的分泌显得非常重要。分泌到胞外基底部的乳糜微粒和周围组织液形成淋巴液,由毛细淋巴管汇入乳糜池,进入胸导管,由左锁骨下静脉导入血液循环系统。当乳糜微粒进入血液中后,通过相互作用交换,捕获其他的载脂蛋白,主要是ApoC2、ApoE,同时脱去ApoA1、ApoA4 [22]。
乳糜微粒携带的TG通过血液循环运送到脂肪组织、心脏和骨骼肌,供给这些组织和器官作为能量物质消耗或贮存起来(图3)。负责降解乳糜微粒中TG的是LPL,它主 要分布在这些组织器官附近的小毛细血管内皮细胞管腔面。血管表面的硫酸肝素聚糖(heparan sulphate proteoglycan,HSPG)和乳糜微粒表面的载脂蛋白相互作用,将乳糜微粒附着在小毛细血管腔。血管表面的LPL与乳糜微粒中富含TG的脂蛋白作用,将微粒中的TG降解成游离的脂肪酸。游离脂肪酸被血管内皮细胞膜蛋白CD36拾获,传递给毛细血管底部周围的组织细胞完全降解掉,释放能量或贮存起来 [23]。大约5%~35%的游离脂肪酸作为溢出(spillover)成分仍然停留在血液循环中,最终进入肝脏细胞形成低密度或极低密度脂蛋白的成分,也有部分脂肪酸形成异位脂肪沉积在胰脏,导致胰岛素抵抗病症的发生。LPL的催化过程发生很快,大约几分钟内即可完成,被LPL降解后的乳糜微粒的残粒(remnant)最终由肝脏处理掉 [24]。
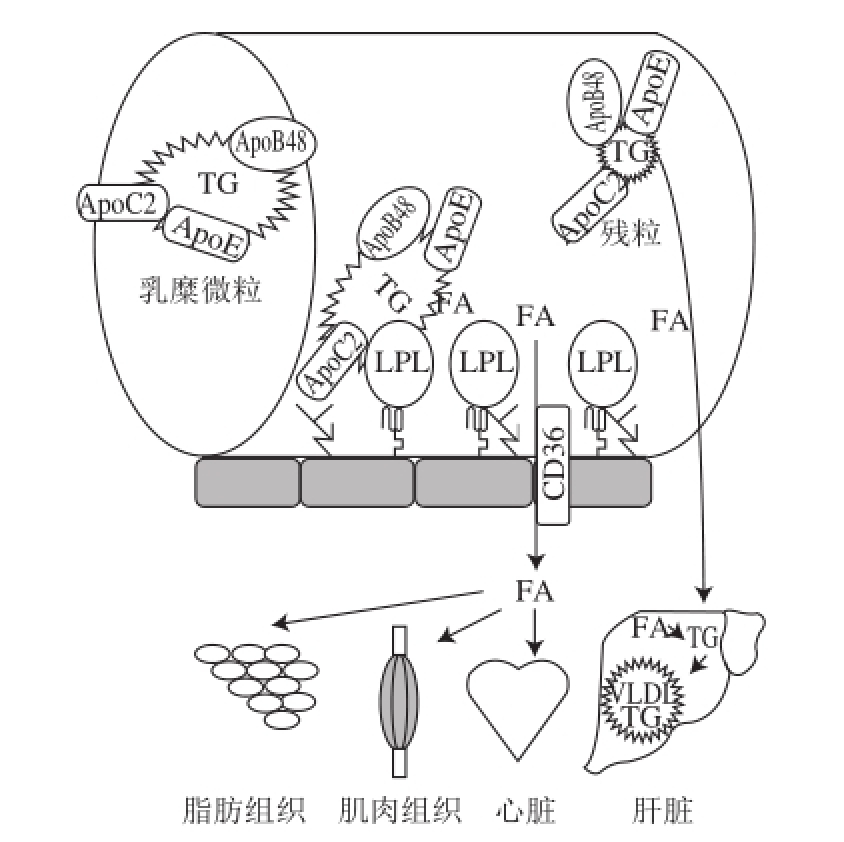
图3 外周TG在毛细血管中被降解的过 程
Fig.3 Lipolysis of peripheral TG in capillary
ApoB48. 载脂蛋白B48;ApoC2. 载脂蛋白C2;ApoE. 载脂蛋白E;FA. 脂肪酸;LPL. 脂蛋白脂肪酶;TG. 甘油三酯;VLDL. 极低密度脂蛋白。
正常情况下每天膳食脂肪中的8%~12%通过肝脏处理,糖尿病患者则达到10%~16% [25]。肝脏细胞能够高表达肝脂肪酶,该酶大约有40%的氨基酸和LPL相同。脂肪酶通过HSPG锚定在肝血窦内皮细胞和窦周间隙的肝实质细胞表面。肝脂肪酶对乳糜微粒的整体水解能力较弱,但是对乳糜微粒残粒中TG、中密度脂蛋白、富含TG的高密度脂蛋白水解能力较强 [26]。肝脏处理残粒的机制还有许多未清楚的地方。一般认为位于肝细胞膜微纤毛表面的受体与残粒表面的蛋白相互作用,固定残粒,进而吞噬消化。这些受体包括低密度脂蛋白受体(low de nsity lipoprotein receptor,LPLR)、低密度受体相关蛋白1(LDL receptor related protein 1,LRP1)和HSPG。残粒表面的ApoE带有阳离子 残基,能够与肝细胞受体的阴离子结构域相互作用,加速结合的过程。肝脂肪酶和LPL二者与HSPG、LRP1的结合也是通过配体和受体的形式进行的 [27]。
5.1 LPL的合成与转运
LPL主要在心脏、骨骼肌、白色脂肪和棕色脂肪组织合成。部分含有较低活力LPL的组织如肺、脾脏和肝脏中的LPL主要由分散在 其中的巨噬细胞合成。不过LP L只在胎儿的肝脏中短暂表达,在成人肝脏中并不表达。肝脏血窦中可以检测到许多LPL,估测是从血液中回收的。乳腺周围的脂肪细胞也分泌许多LPL,并和乳汁一起混合形成乳脂微粒 [28]。
LPL以非共价键进行头尾相接形成同源双聚体,并分泌到胞外并作为酶活性表达的主要形式。该双聚体的形成依赖于内质网的膜蛋白-脂肪酶成熟因子1(lipase maturation factor 1,LMF1)。若缺失该蛋白,LPL不能被正确折叠和组装,也不能形成双聚体,并且L PL在细胞内很快被降解。LPL以双聚体的形成存在很可能有利于细胞对其活性的调节,研究表明抑制LPL活性的血管生成素样蛋白4(angiopoetin-like 4,Angptl4)能够将双聚体形式的LPL转化为单体。这种调节机制在脂肪细胞应激反应时起重 要作用 [29]。
虽然LPL对于加工富含 TG的脂蛋白起到重要作用,但是LPL是如何到达 毛细血管管腔仍然有许多令人疑惑的地方。早期的研究者认为LPL通过电荷吸附作用与HSPG作用结合到毛细血管的内皮细胞上,肝素可以破坏这种结合,释放LPL到血液中,从而在临床上得以测定血浆中LPL的活性 [30]。但是这种解释无法令人满意,因为HSPG缺乏组织表达的特异性,LPL也无法依靠该蛋白从细胞表面到达小毛细血管的管腔面。也有报道认为极低密度脂蛋白受体能够将LPL运输到毛细血管管腔表面,但是该受体缺陷的小鼠血脂水平却表现正常 [31]。最终糖基磷酸酰肌醇锚定高密度脂蛋白结合蛋白1(glycosylphosphatidylinositol anchored high density lipoprotein binding protein 1,GPIHBP1)被发现,该蛋白隶属于淋巴细胞抗原6家族(lymphocyte antigen 6,Ly6),该基因被敲除后的小鼠发生严重的高甘油三酯血症,即使是喂食低脂食物也不能例外 [32]。该蛋白在心脏和棕色脂肪组织表达量很高,含有两个结构域,其中N端为富含天冬氨酸和谷氨酸的酸性结构域,该部位能够与LPL的肝素结合结构域相互作用。另外含有一个含10 个半胱氨酸的Ly6结构域,这些半胱氨酸直接的二硫键使得该区域出现三指的模序结构,也与LPL的结合有关 [33]。目前认为位于血管内皮表面的GPIHBP1通过其酸性结构域以套索手段捕获锚定在内皮细胞附近实质细胞表面HSPG上的LPL,通过肽链的扭转和Ly6结构域将LPL从HSPG上“拧”下来,由组织空隙中转移到毛细血管腔面。GPIHBP1-LPL复合体具体是如何穿梭到内皮细胞的外侧面还不清楚。当LPL的C端与TG乳化颗粒间浸润后,部分LPL可从GPIHIBP1上脱离 [34]。
位于小毛细血管表面的LPL还需要一个特殊的辅助因子ApoC2才能完全发挥催化作用。该结合部位主要位于LPL氨基端结构域,包含两个结合位点:65~68残基和73~79残基。这两个结合部位相互配合,与ApoC2作用激活LPL,功能缺失、突变的ApoC2都会导致高甘油三酯血症。ApoC3对LPL有抑制作用 [35]。
LPL对血液中的脂肪降解非常重要,如果突变造成酶活力缺失,将引起高甘油三酯血症。L PL基因敲除的小鼠由于无法代谢乳脂,将在出生后24 h内死亡。分别对心肌、骨骼肌、脂肪组织进行组织特异性敲除LPL,也会对小鼠的血脂代谢造成巨大的影响 [36-37]。
5.2 LPL的表达调控
LPL的组织表达调控对于机体充分利用主要能量物质、保持能量稳定、应对胰岛素刺激和脂蛋白代谢来 说非常重要。而机体对于能量需求和激素变动又使得调控过程变得非常复杂。LPL的调控可以发生在转录、转录后、转译和转译后 等多个不同环节水平,并且具有组织特异性 [38]。
人的LPL的cDNA于1987年被克隆 [39],基因位于第8号染色体8p22,全长大约30 kb,具有10个外显子,初始翻译的LPL全长474 个氨基酸,去掉先导信号肽后剩余448 个氨基酸,相对分子质量约为55 000。LPL可以分为两个独立的结构域,其中N 端312 个氨基酸为主要形成起催化作用的结构域,其活性中心的3 个氨基酸(Ser132、Asp156、His241)起酯解作用。C端主要结合脂水界面的TG。靠近C端的3 个色氨酸残基(Trp390、Trp393、Trp394)对于TG、脂蛋白和TG乳化颗粒的结合起重要作用,突变后LPL对TG的催化效率大幅度下降94%。LPL对肝素的结合部位主要有两个,一个位于C端403~407残基,另外一个位于292~304残基 [35]。
LPL基因的5’端拥有大约4 000 个碱基对长度的转录调控区,含有大量顺式调控元件,例如固醇调节元件2(sterol regulatory element 2)、干扰素应答元件(interferon response element)、过氧化物增殖子活化受体应答元件(peroxisome proliferator-activated receptor(PPAR)-responsive element)、激活蛋白1元件(activator protein 1 element)、八聚体结合转录因子1(octamer binding proteins1,Oct-1)等。大部分顺式元件都是正调节LPL的启动子 [40]。调高小RNA miR-29a表达将抑制LPL的转录和转译水平 [41]。
一些与LPL相互作用的蛋白,如脂肪酶成熟因子1、受体相关蛋白(receptor associated protein,RAP)是低密度脂蛋白受体家族成员,与LPL有高度亲和力,它能够阻止未成熟的LPL与HSPG或与低密度脂蛋白受体相关蛋白结合进入分泌途径。
一些细胞外的蛋白也对LPL活性起调节作用,如载脂蛋白ApoC1、ApoC2、ApoC3、ApoA5和ApoE,血管生成素样蛋白家族成员Angpt l3、Angptl4和Angptl8。ApoC1、ApoC2和ApoC3都是由肝细胞产生释放到血液中,其中ApoC2能够促进LPL的活力,但是过量表达则出现抑制作用。ApoC1、ApoC3能够抑制LPL的活性,它们主要干扰LPL与乳糜微粒的集合,也会影响细胞代谢路径,间接影响LPL的活力。血浆中载脂蛋白ApoA5能够提高乳糜微粒和极低密度脂蛋白与蛋白多糖的结合力,提高LPL的水解能力 [42]。ApoE在体外能够抑制LPL的活力,在体内能够降低LPL对TG的清除速率。Angptl蛋白N端的卷曲螺旋结构域(coiled-coil domain)能够短暂结合到LPL,将LPL由双聚体变为无活力的单体。在饥饿和运动时,Angptl4的表 达上升,有可能是机体调节LPL的主要手段,其中Angptl3和Angptl8对LPL有抑制作用 [43-44]。A型重复分拣相关受体(sorting-related receptor with A-type repeats,SorLA)介导LPL在细胞内和细胞间的运输,该受体在大脑中表达非常高并且和LPL具有高亲和性,可能与LPL囊泡运输定位有关 [45]。
对于脂肪细胞来说,禁食会降低LPL表达,恢复进食后4 h得以恢复。高碳水化合物比高脂食物更容易促进脂肪细胞中LPL的表达。在禁食期间心脏部位肝素血浆中LPL活力增加了几倍。胰岛素也可以提高脂肪细胞中的LPL的表达。葡萄糖也有促进脂肪细胞中LPL活力的作用,当然这可能与LPL的糖基化水平有关。有实验表明 [43],大鼠的甲状腺素通过负调控Angptl3的表达来调控LPL的活力,高甲状腺素会降低骨骼肌和脂肪的LPL活力。睾酮和雌激素能够抑制脂肪组织的LPL活力,但却能提高心脏和骨骼肌的LPL活力。
5.3 与LPL相关的疾病
5.3.1 与LPL相关的遗传缺陷
LPL基因直接突变造成LPL功能缺失是引起高甘油三酯血症的重要因素,主要突变发生在外显子4、5、6。除此之外还有些其他基因缺陷也会影响到LPL的活性。联合脂肪酶缺陷(combined lipase deficiency,CLD)主要是LPL的成熟过程受到阻碍,目前认为主要是与LPL成熟相关蛋白LMF1基因的突变有关,CLD小鼠患有严重的高甘油三酯血症,出生后3 d即死亡 [46]。
5.3.2 肥胖
游离脂肪酸的摄取和富含TG的脂蛋白的运输和摄入对胰岛素应答、能量平衡、体质量调节和组成起重要作用。LPL作为餐后血脂消耗的主要成员,对体质量的调控无疑显得十分重要。近年来,LPL的活力也作为代谢综合征的一个生物指标,主要涉及肥胖、胰岛素抵抗和血脂异常。利用单核苷酸多态性(single nucleotide polymorphism,SNP)分析表明LPL启动子区域的核酸突变对肥胖、Ⅱ型糖尿病和血脂水平有很强的相关性 [47]。
肥胖人群脂肪细胞中的LPL含量升高,对胰岛素和食物无应答。在体质量下降期,脂肪组织中LPL含量也升高。胰岛素对骨骼肌的作用不明显。持续性的体质量下降伴随骨骼肌中高于70% LPL的下降。不过持续性的体质量下降时,脂肪组织的LPL下降却不明显,甚至升高到体质量减轻前的水平 [35]。实际上,短时间内体质量的增加和减少并不困难,困难的是长期保持下去。这涉及机体对能量的消耗分配、贮存和氧化等一系列过程,进而对机体的体质量和脂肪组织进行调控。
5.3.3 动脉粥样硬化
动脉粥样硬化主要是因为脂质在动脉内积聚造成炎症,诱导动脉内皮细胞分泌趋化因子,导致T细胞和单核细胞浸润。单核细胞后来分化为巨噬细胞,巨噬细胞吞入脂蛋白后,最终变成泡沫细胞。吞噬作用又促进了更多富含TG的脂蛋白进入动脉壁。利用cre-loxP定向缺失巨噬细胞LPL的小鼠与ApoE基因敲除小鼠杂交的后代MLpLKO/ApoEKO小鼠进行研究发现,该转基因杂交鼠的巨噬细胞内TG、CD36和肉毒碱棕榈酰转移酶(carnitine palmitoyltransferase 1,CPT1)表达水平显著降低,并显著降低饮食引起的小鼠动脉粥样硬化的形成 [48],这说明巨噬细胞LPL在动脉粥样硬化过程中起重要作用。
5.3.4 糖尿病、癌症和阿兹海默症
血脂紊乱也和糖尿病、胰岛素抵抗、感染和癌症有关。研究表明Ⅰ型和Ⅱ糖尿病患者以及胰岛素抵抗患者的脂肪组织中LPL酶活力下降。中度糖尿病患者的心肌和冠状动脉的LPL酶活力下降,并伴随高甘油三酯血症 [49]。当药物控制病情后,LPL酶活力开始上升。乳腺癌、脂肪肉瘤、前列腺癌和慢性淋巴细胞白血病等患者的癌细胞中都检测到了LPL的表达 [24]。LPL在大脑细胞中分布很广,与炎症和神经元分化有关。阿兹海默症患者海马齿状回部位的粒细胞和周围突触中的LPL免疫组化检出量显著减少,具体成因还有待进一步研究 [50-51]。
膳食脂肪的消化主要在小肠中进行,然后被 小肠细胞包装成乳糜微粒进入血液循环,在心脏、肌肉和脂肪组织附近小毛细血管内被LPL降解为脂肪酸而被周围组织细胞吸收。由于机体的生理和营养状况不同,不同的组织细胞对脂肪酸的摄入需求变动很大,LPL对血脂的水解、脂肪酸的摄入和胞内脂质的稳定起重要调控作用。因此,LPL本身表达和催化活性也受到不同的调节蛋白和激素信号调控。了解膳食脂肪的代谢过程可以帮助我们控制食物中脂肪的合理摄入以及餐后脂肪的有效消化吸收,保持健康的血脂水平,防 治血脂紊乱、肥胖、心血管疾病和肥胖等疾病。
参考文献:
[1] ARMAND M. Lipases and lipolysis in the human digestive tract: where do we stand?[J]. Current Opinion in Clinical Nutrition & Metabolic Care, 2007, 10(2): 156-164.
[2] MITTENDORFER B. Origins of metabolic complications in obesity: adipose tissue and free fatty acid trafficking[J]. Current Opinion in Clinical Nutrition and Metabolic Care, 2011, 14(6): 535-541.
[3] SUBRAMANIAN S, CHAIT A. Hypertriglyceridemia secondary to obesity and diabetes[J]. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids, 2012, 1821(5): 819-825.
[4] BOULLART A, de GRAAF J, STALENHOEF A, et al. Serum t riglycerides and risk of cardiovascular disease[J]. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids, 2012,1821(5): 867-875.
[5] MOUNAYAR R, SEPTIER C, CHABANET C, et al. Oral fat sensitivity in humans: links to saliva composition before and after stimulation by oleic acid[J]. Chemosensory Perception, 2013, 6(3): 118-126.
[6] MU H, H☒Y C E. The digestion of dietary triacylglycerols[J]. Progress in Lipid Research, 2004, 43(2): 105-133.
[7] CASAS-GODOY L, DUQUESNE S, BORDES F, et al. Lipases: an overview[M]//SANDOVAL G. Lipases and phospholipases. Totowa: Humana Press, 2012: 3-30.
[8] SU Xiong, ABUMRAD N A. Cellular fatty acid uptake: a pathway under construction[J]. Trends in Endocrinology & Metabolism, 2009,20(2): 72-77.
[9] SCHWENK R W, HOLLOWAY G P, LUIKEN J J. Fatty acid transport across the cell membrane: regulation by fatty acid transporters[J]. Prostaglandins, Leukotrienes and Essential Fatty Acids (PLEFA), 2010, 82(4): 149-154.
[10] GLATZ J F, LUIKEN J J, BONEN A. Membrane fatty acid transporters as regulators of lipid metabolism: implications for metabolic disease[J]. Physiological Reviews, 2010, 90(1): 367-417.
[11] STORCH J, MCDERMOTT L. Structural and functional analysis of fatty acid-binding proteins[J]. Journal of Lipid Research, 2009,50(Suppl 4): 126-131.
[12] BUTTET M, TRAYNARD V, TRAN TTT, et al. From fatty-acid sensing to chylomicron synthesis: role of intestinal lipid-binding proteins[J]. Biochimie, 2014, 96: 37-47.
[13] YEN C L E, STONE S J, KOLIWAD S, et al. Thematic review series: glycerolipids. DGAT enzymes and triacylglycerol biosynthesis[J]. Journal of Lipid Research, 2008, 49(11): 2283-2301.
[14] MANSBACH C M, SIDDIQI S A. The biogenesis of chylomicrons[J]. Annual Review of Physiology, 2010, 72: 315-333.
[15] XIAO C, LEWIS G F. Regulation of chylomicron production in humans[J]. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids, 2012, 1821(5): 736-746.
[16] NAKAJIMA K, NAKANO T, TOKITA Y, et al. Postprandial lipoprotein metabolism: VLDL vs chylomicrons[J]. Clinica Chimica Acta, 2011, 412(15): 1306-1318.
[17] HESSE D, JASCHKE A, CHUNG B, et al. Trans-Golgi proteins participate in the control of lipid droplet and chylomicron formation[J]. Bioscience Reports, 2013, 33(1). doi: 10.1042/BSR20120082.
[18] WONG D M, WEBB J P, MALINOWSKI P M, et al. Proteomic profiling of intestinal prechylomicron transport vesicle (PCTV)-associated proteins in an animal model of insulin res istance (94 char)[J]. Journal of Proteomics, 2010, 73(7): 1291-1305.
[19] VARELA L M, ORTEGA-GOMEZ A, LOPEZ S, et al. The effects of dietary fatty acids on the postprandial triglyceride-rich lipoprotein/ apoB48 receptor axis in human monocyte/macrophage cells[J]. The Journal of Nutritional Biochemistry, 2013, 24(12): 2031-2039.
[20] GRIFFIN J D, LICHTENSTEIN A H. Dietary cholesterol and plasma lipoprotein profiles: randomized controlled trials[J]. Current Nutrition Reports, 2013, 2(4): 274-282.
[21] KARPE F. Chylomicron production as a feature of atherogenic lipoproteins[J]. Current Opinion in Lipidology, 2012, 23(4): 398-399.
[22] IQBAL J, HUSSAIN M M. Intestinal lipid absorption[J]. American Journal of Physiology-Endocrinology and Metabolism, 2009, 296(6): E1183-E1194.
[23] GOLDBERG I J, ECKEL R H, ABUMRAD N A. Regulation of fatty acid uptake into tissues: lipoprotein lipase-and CD36-mediated pathways[J]. Journal of Lipid Research, 2009, 50(Suppl 4): 86-90.
[24] YOUNG S G, ZECHNER R. Biochemistry and pathophysiology of intravascular and intracellular lipolysis[J]. Genes & Development,2013, 27(5): 459-484.
[25] LAMBERT J E, PARKS E J. Postprandial metabolism of meal triglyceride in humans[J]. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids, 2012, 1821(5): 721-726.
[26] CHATTERJEE C, SPARKS D L. Hepatic lipase, high density lipoproteins, and hypertriglyceridemia[J]. The American Journal of Pathology, 2011, 178(4): 1429-1433.
[27] FOLEY E M, GORDTS P L, STANFORD K I, et al. Hepatic remnant lipoprotein clearance by heparan sulfate proteoglycans and lowdensity lipoprotein receptors depend on dietary conditions in mice[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2013, 33(9): 2065-2074.
[28] DAVIES B S, BEIGNEUX A P, FONG L G, et al. New wrinkles in lipoprotein lipase biology[J]. Current Opinion in Lipidology, 2012,23(1): 35-42.
[29] SANTULLI G. Angiopoietin-like proteins: a comprehensive look[J]. Frontiers in Endocrinology, 2014, 5: 4. doi: 1 0.3389/ fendo.2014.00004.
[30] di FILIPPO M, MAR☒AIS C, CHARRI☒RE S, et al. Post-heparin LPL activity measurement using VLDL as a substrate: a new robust method for routine assessment of plasma triglyceride lipolysis defects[J]. PLoS One, 2013, 9(5): e96482. doi: 10.1371/journal.pone.0096482.
[31] OBUNIKE J C, LUTZ E P, LI Z, et al. Transcytosis of lipoprotein lipase across cultured endothelial cells requires both heparan sulfate proteoglycans and the ve ry low density lipoprotein receptor[J]. Journal of Biological Chemistry, 2001, 276(12): 8934-8941.
[32] YOUNG S G, DAVIES B S, VOSS C V, et al. GPIHBP1, an endothelial cell transporter for lipoprotein lipase[J]. Journal of Lipid Research, 2011, 52(11): 1869-1884.
[33] DAVIES B S, GOULBOURNE C N, BARNES R H, et al. Assessing mechanisms of GPIHBP1 and lipoprotein lipase movement across endothelial cells[J]. Journal of Lipid Research, 2012, 53(12): 2690-2697.
[34] ADEYO O, GOULBOURNE C, BENSADOUN A, et al. Glycosylphosphatidylinositol-anchored high-density lipoproteinbinding protein 1 and the intravascular processing of triglyceride-rich lipoproteins[J]. Journal of Internal Medicine, 2012, 272(6): 528-540.
[35] WANG Hong, ECKEL R H. Lipoprotein lipase: from gene to obesity[J]. American Journal of Physiology-Endocrinology and Metabolism, 2009, 297(2): E271-E288.
[36] GOLDBERG I J, TRENT C M, SCHULZE P C. Lipid metabolism and toxicity in the heart[J]. Cell Metabolism, 2012, 15(6): 805-812.
[37] WANG Hong, KNAUB L A, JENSEN D R, et al. Skeletal musclespecific deletion of lipoprotein lipase enhances insulin signaling in skeletal muscle but causes insulin resistance in liver and other tissues[J]. Diabetes, 2009, 58(1): 116-124.
[38] KERSTEN S. Physiological regulation of lipoprotein lipase[J]. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids, 2014, 1841(7): 919-933.
[39] WION K L, KIRCHGESSNER T G, LUSIS A J, et al. Human lipoprotein lipase complementary DNA sequence[J]. Science, 1987,235: 1638-1641.
[40] PREISS-LANDL K, ZIMMERMANN R, H☒MMERLE G, et al. Lipoprotein lipase: the regulation of tissue specific expression and its role in lipid and energy metabolism[J]. Current Opinion in Lipidology,2002, 13(5): 471-481.
[41] SACCO J, ADELI K. MicroRNAs: emerging roles in lipid and lipoprotein metabolism[J]. Current Opinion in Lipidology, 2012,23(3): 220-225.
[42] SHARMA V, FORTE T M, RYAN R O. Influence of apolipoprotein AV on the metabolic fate of triacylglycerol[J]. Current Opinion in Lipidology, 2013, 24(2): 153-159.
[43] DIJK W, KERSTEN S. Regulation of lipoprotein lipase by Angptl4[J]. Trends in Endocrinology & Metabolism, 2014, 25(3): 146-155.
[44] MATTIJSSEN F, KERSTEN S. Regulation of triglyceride metabolism by angiopoietin-like proteins[J]. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids, 2012, 1821(5): 782-789.
[45] KLINGER S C, GLERUP S, RAARUP M K, et al. SorLA regulates the activity of lipoprotein lipase by intracellular trafficking[J]. Journal of Cell Science, 2011, 124(7): 1095-1105.
[46] P☒TERFY M. Lipase maturation factor 1: a lipase chaperone involved in lipid metabolism[J]. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids, 2012, 1821(5): 790-794.
[47] MEAD J R, IRVINE S A, RAMJI D P. Lipoprotein lipase: structure,function, regulation, and role in disease[J]. Journal of Molecular Medicine, 2002, 80(12):753-769.
[48] TAKAHASHI M, YAGYU H, TAZOE F, et al. Macrophage lipoprotein lipase modulates the development of atherosclerosis but not adiposity[J]. Journal of Lipid Research, 2013, 54(4): 1124-1134.
[49] KIM M S, WANG Ying, RODRIGUES B. Lipoprotein lipase mediated fatty acid delivery and its impact in diabetic cardiomyopathy[J]. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids, 2012, 1821(5): 800-808.
[50] WANG Hong, ECKEL R H. Lipoprotein lipase in the brain and nervous system[J]. Annual Review of Nutrition, 2012, 32: 147-160.
[51] GONG Huilin, DONG Weijiang, ROSTAD S W, et al. Lipoprotein lipase (LPL) is associated with neurite pathology and its levels are markedly reduced in the dentate gyrus of Alzheimer’s disease brains[J]. Journal of Histochemistry & Cytochemistry, 2013, 61(12): 857-868.
Metabolism of Postprandial Dietary Fat and Lipoprotein Lipase
HUANG Hai, MI Yang, TIAN Miaomiao, GUO Yaping, GE Yifei, LI Bojie, LIAO Ran
(School of Life Sciences, Shanghai University, Shanghai 200444, China)
Abstract:The metabolism of postprandial fat is complex. It involves several processes of dietary fat including digestion in alimentary canal, cellular synthesis and translocation of chylomicron, hydrolysation of plasma triglyceride and clearance of remnant. Fat-digesting enzymes in the digestive tract catalyze the hydrolysis of triacylglycerol to free long-chain fatty acids that are transported across the plasma membrane of enterocytes by many kinds of proteins. In enterocytes, long-chain fatty acids are esterificated to form triacylglycerol and packed into chylomicron with some lipoproteins. The newly assembled chylomicrons carry the triacylglycerol from the diet and translocate into blood circulation. The plasma triacylglycerol is hydrolyzed into fatty acids by lipoprotein lipase attached to the capillary endothelium and utilized by surrounded tissue. The remnant and residual fatty acids will be recycled by hepatic cells. Because lipo protei n lipase (LPL) is the rate-limiting enzyme for plasma triglyceride clearance and tissue uptake of fatty acids, the activity of which is carefully controlled at the transcriptional and translatio nal levels in the response to diverse physiological stimuli. The dysregulation of dietary fat metabolism will initiate postprandial hypertriglyceridemia, which is associated with cardiovascular disease, insulin resistance and obesity.
Key words:dietary fat; lipoprotein lipase; chylomicron; fatty acid
中图分类号:Q556.1
文献标志码:A
文章编号:1002-6630(2015)09-0235-07
doi:10.7506/spkx1002-6630-201509044
收稿日期:2014-05-23
基金项目:国家自然科学基金面上项目(81171190);国家级大学生创新创业训练计划项目(CXGJ-13-038)
作者简介:黄海(1971—),男,讲师,博士,研究方向为生化药物、神经退行性病变和心血管疾病。E-mail:huanghai@staff.shu.edu.cn