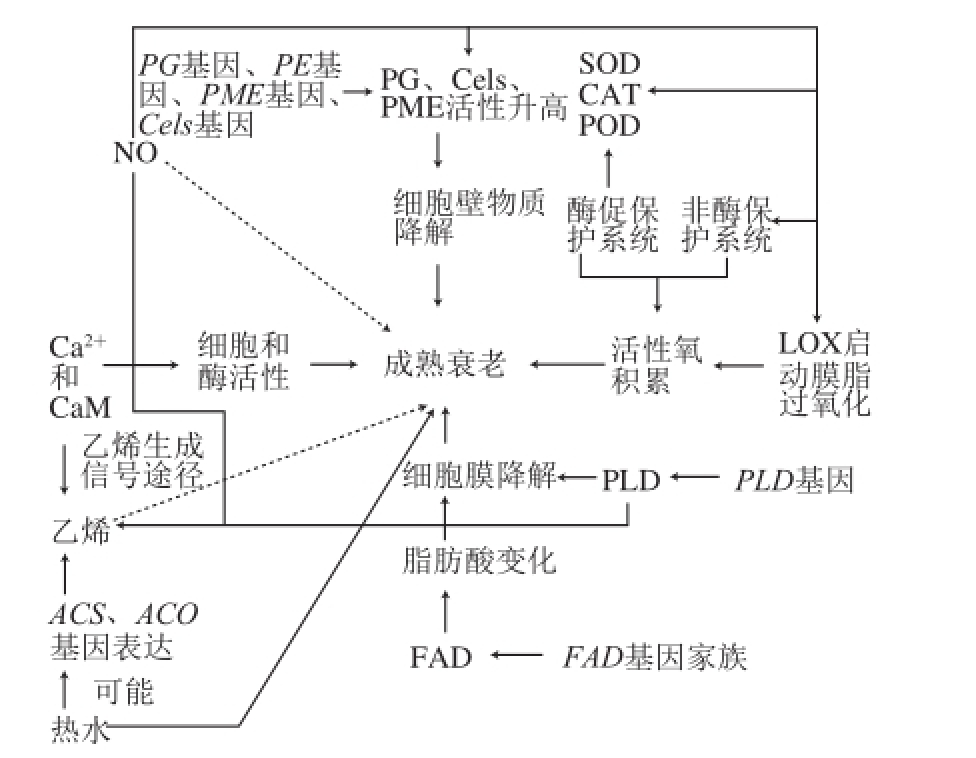
图1 草莓果实成熟衰老影响因子及其可能作用机制
Fig.1 Factors affecting strawberry fruit ripening and senescence and the probable mechanisms
程 然,生吉萍 *
(中国人民大学农业与农村发展学院,北京 100872)
摘 要:草莓味道可口,营养丰富,是世界上栽培最广泛的水果之一,但其 生育周期短,采后极易衰老腐烂,不耐贮藏。因此,研究草莓果实成熟衰老相关影响因子及其调控机制意义重大。本文就近年来草莓果实成熟衰老过程中植物激素(乙烯、脱落酸)、相关酶类(脂肪氧合酶、抗氧化酶类、软化酶类)、外源物质(Ca 2+、钙调素、NO、热水)和成熟衰老相关基因(PLDa基因、FAD基因家族、细胞壁水解酶相关基因)及其调控机制进行综述,认为内源激素和酶类等在不同层次上发挥着作用,直接或间接通过影响乙烯、NO等小分子物质发挥作用,相互影响,共同调控着果实的成熟衰老进程。基因层面的研究尚处于起步阶段,可能是通过编码细胞膜和细胞壁的合成分解相关酶类来发挥作用。本文旨在为草莓采后生理、贮藏保鲜的研究提供综合信息。
关键词:草莓;成熟衰老;影响因子;基因
草莓果实酸甜适口,老少咸宜,极具营养价值和经济价值。它不仅富含维生素、矿物质和膳食纤维等营养性成分,一些功能性成分,尤其是多酚类植物化学物质(酚酸、类黄酮、单宁、木酚素等)的含量也很高,具有良好的清除自由基和抗氧化能力 [1-5]。草莓是典型的非跃变型果实,采后极易衰老腐烂,不耐贮藏。果实成熟衰老是一个复杂有序的生化过程,不仅色泽、质地、风味、香气及其他代谢会发生变化,而且组织外观性状还受其内在遗传基因的高度协调控制 [6-9]。目前对于跃变型果实成熟衰老的机理研究较深入,而对非跃变型果实的研究则相对较少。本文在前人研究的基础上,以草莓这种非跃变型果实为典型材料,对其成熟衰老相关的植物激素(乙烯、脱落酸)、相关酶类(脂肪氧合酶、抗氧化酶类、软化酶类)、外源物质(Ca 2+、钙调素(calmodulin,CaM)、NO、热水)和成熟衰老相关基因(PLDa基因、FAD基因家族、细胞壁水解酶相关基因)及其调控机制进行综述(图1)。

图1 草莓果实成熟衰老影响因子及其可能作用机制
Fig.1 Factors affecting strawberry fruit ripening and senescence and the probable mechanisms
1.1 乙烯
乙烯是目前研究最多的一种调控成熟衰老的植物激素,它作为成熟衰老的启动因子,影响着许多相关基因的转录和翻译 [7]。呼吸速率和乙烯释放速率作为果蔬采后成熟衰老的热点研究内容,一直以来多数集中在跃变型果实,而对于非跃变型果实的研究则较少 [10]。有研究表明,非跃变型果实的采后呼吸速率也呈上升趋势 [11-13]。用乙烯作用抑制剂1-甲基环丙烯(1-methylcyclopropene,1-MCP)处理草莓,可以降低草莓呼吸速率、维持采后草莓果实的硬度和颜色、抑制苯丙氨酸解氨酶(phenylalnine ammonialyase,PAL)酶活性、提高了超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase,CAT)活性、减缓花青苷和酚类物质含量的增加,延缓衰老进程 [14-17]。但也有研究发现,在 0 ℃和5 ℃条件下贮藏的草莓,外源乙烯和1-MCP处理后基本不影响果实品质及其腐烂速度 [16]。史兰等 [17]认为乙烯对草莓成熟衰老的调节作用受到草莓成熟度的影响,1-MCP处理能减缓成熟初期果实的呼吸作用而对成熟后期的果实不起作用。
不同的环境因素、成熟度等都有可能影响乙烯对于草莓成熟衰老的调控。随着分子生物学的进一步发展,从基因表达的角度或许可以为研究乙烯在非跃变型果实成熟衰老中的作用提供新的思路。
1.2 脱落酸
在草莓果实的成熟衰老过程中,脱落酸(abscisic acid,ABA)的生成迅速增长,并且用ABA处理后提高了果实呼吸作用和纤维素酶活性 [11,18]。对于非跃变型果实而言,ABA可能与成熟的启动有关。李春丽等 [19]研究表明,草莓发育过程中瘦果和花托中ABA积累既有同步也有区别,相关性不显著,而花托中可溶性糖与ABA的相关性极为显著,表明二者之间可能有着密切的关系。尽管ABA受体及其信号转导机制的确立较晚,但近年来脱落酸受体鉴定工作在模式植物上取得了实质性突破 [20]。草莓从绿熟到果实着色启动,ABA受体基因FaABAR/ CHLH表达量呈M型趋势,ABA和高pH值能促进FaABAR/ CHLH基因在转录水平上的表达,进一步证实了ABA在草莓成熟衰老过程中的重要作用 [20]。
酶类在果实采后物质代谢中起着关键的作用,目前研究较多的在草莓成熟衰老过程中起主要作用的酶类如下。
2.1 脂肪氧合酶
脂肪氧合酶(lipoxygenase,LOX),又称脂肪氧化酶(liposidase)或胡萝卜素氧化酶(carotene oxidase),是一种含非血红素铁的蛋白质,它专一性地催化分子中具有顺,顺-l,4-戊二烯结构的不饱和脂肪酸加氧反应,在植物中的底物主要是亚油酸和亚麻酸,其主要产物是过氧化氢基脂肪酸 [7,21]。LOX的作用机理是破坏磷脂双分子层,大大增加细胞膜透性,引起组织降解,最终导致代谢紊乱和机体衰老 [22]。LOX启动的膜脂质过氧化是启动果实后熟软化的主要因素 [23-24]。LOX在番茄等果实成熟衰老中的调控作用已有大量研究报道 [21-25],在少数以草莓为材料的研究中,发现在草莓成熟和衰老过程中LOX活性显著增加,增加的快慢与草莓品种特性有关 [21]。
2.2 抗氧化酶类
自由基学说认为,活性氧的积累与代谢失衡即造成了衰老。果蔬中活性氧物质主要有H 2O 2、羟自由基(·OH)和超氧阴离子自由基(O 2¯·)等,与之相对应的细胞内有酶促和非酶促两大自由基清除系统,超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(peroxidase,POD)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)等属于酶促保护系统,而非酶促保护系统包括抗坏血酸(ascorbic acid,ASA)、VE、类胡萝卜素(carotenoids,Car)等。SOD、CAT、POD等酶活性的高低可以作为判断果实耐贮性指标和成熟衰老的标志 [21]。
有研究表明,草莓采后衰老过程中,常温和低温条件下O 2¯·和H 2O 2的总体变化趋势为增加,表明草莓果实采后衰老过程中有活性氧参与 [26-27]。保护系统SOD和GSH的变化较为复杂,这与清除机制的多样性及相互影响有关 [26]。关军锋等 [27]研究表明,随草莓果实成熟度提高,前期SOD活性变化不大,粉红期果实SOD活性开始降低,全红期果实SOD活性则显著降低,相关分析显示,草莓果实中的O 2¯·产生速率与SOD活性呈极明显负相关,说明果实成熟衰老进程与O 2¯·的积累以及SOD清除超氧自由基能力的下降有关。对很多果实的研究表明,随着贮藏时间的延长,POD活性增强,因此认为POD活性升高可作为果实衰老的指标 [21]。CAT在不同果实的衰老进程中也伴随着不同的变化 [21]。
2.3 软化相关酶类
果实硬度对于草莓自身品质和采后生理都非常重要。草莓在贮藏期间硬度迅速下降,果实的软化涉及复杂的生理生化过程,细胞壁物质的降解和果胶-纤维素-半纤维素结构的破坏,是细胞分离和果实软化的开端 [25]。已发现细胞壁中的酶有近30 种 [28],大多数属于水解酶类,如果胶酶、多聚半乳糖醛酸酶、纤维素酶、糖基水解酶、葡萄糖苷酶、葡聚糖苷酶、半乳糖苷酶等。其余则多属于氧化还原酶类。
很多研究表明,多聚半乳糖醛酸酶(polygalacturonase,PG)、果胶甲酯酶(pectin methylesterase,PME)和纤维素酶(cellulase,Cels)与草莓果实软化有关,采后PG、PME、Cels活性都有不同程度的上升,是破坏细胞壁结构的主要酶类 [29-34]。对草莓等多种水果的研究发现,Cels活性与果实硬度呈显著负相关;也有学者的研究证实了PG和Cels活性的提高可促进果胶和纤维素降解,在果实成熟软化中起着关键作用 [25]。
草莓果实在成熟衰老的过程中,不仅受内源物质的调控,许多研究表明,一些外源物质也可能通过调控乙烯来间接发挥作用,目前研究较多的有以下几种。
3.1 Ca 2+和CaM
Ca是植物生长发育所必须的大量元素之一。Ca 2+作为植物细胞信号转导过程中的第二信使,由钙信使介导的生理过程几乎涉及到细胞的各种代谢和发育过程中 [35-36]。CaM是高度保守和普遍存在于真核生物中的一种Ca 2+受体蛋白,它与Ca 2+结合后调节细胞内多种酶的活性,进而影响细胞功能 [37-39]。在果实成熟衰老过程中,可溶性Ca 2+含量呈下降趋势 [27]。
有研究表明,用质膜C a 2+通道阻断剂异博定(verapamil hydrochloride tablets,Vp)、钙通道Ca 2+竞争性抑制剂氯化镧(LaCl 3)以及Ca 2+专一性螯合剂乙二醇双(2-氨基乙基醚)四乙酸(ethylenebis(oxyethylenenitrilo)tetraacetic acid,EGTA)与乙烯一起处理白熟期草莓果实,可抑制乙烯诱导的草莓内源乙烯的生成及可溶性蛋白的分解,可见阻断质膜Ca 2+通道或螯合胞外Ca 2+来减少胞内Ca 2+能抑制乙烯对果实的催熟作用,进而可通过调节胞质Ca 2+浓度以影响乙烯对果实的催熟作用 [40]。用CaM拮抗剂三氟拉嗪(trifluoperazine,TFP)、氯丙嗪(chlorpromazine,CPZ)与乙烯一起处理草莓果实,可抑制草莓乙烯释放率上升以及可溶性蛋白的分解,表明乙烯生成信号途径中有CaM参与,进一步推断CaM介导乙烯对草莓果实主要成熟衰老指标的诱导作用 [26,40]。
3.2 NO
1996年Ya’acov等 [41]发现植物体内能产生NO,随后NO作为一种生物活性分子和信号分子通过抑制乙烯产生来抑制植物衰老的作用得到了广泛研究。李雄彪 [28]以硝普钠(sodium nitroprusside,SNP)为NO供体研究了室温条件下NO对草莓成熟衰老效应的影响,发现在室温条件下NO可以通过抑制乙烯产生和保持细胞膜的完整性来延缓草莓果实衰老程序的启动,减轻果实衰老过程中的自由基伤害,从而维持果实的良好品质。朱树华等 [42]研究表明,NO可以抑制纤维素酶和LOX活性,提高CAT活性,表现出延缓草莓果实软化衰老的生理作用。李卫琼等 [43]发现使用NO熏蒸对于延长草莓货架期具有显著作用。上述研究都表明,NO延缓草莓果实衰老的能力与其浓度有关。
3.3 热水
热激处理作为一种安全性良好的物理性果蔬保鲜手段,已经在多种果品贮藏过程中得以有效证实 [44]。有研究表明,热水处理能够明显抑制草莓果实花青素、类黄酮和总酚的积累,增加氨基酸含量,延缓可溶性固形物和可滴定酸含量下降,降低果实腐烂指数、质量损失率和呼吸速率,抑制过氧化物的积累及其对果实造成的伤害,从而延缓草莓果实的衰老 [10,45]。还有研究发现,热水处理对草莓的颜色、硬度、可溶性固形物、可滴定酸、细胞膜透性等未产生不良影响,有利于提高其货架期 [46-48]。杜正顺等 [10]采用反转录聚合酶链式反应(reverse transcription polymerase chain reaction,RT-PCR)技术研究了热水处理对草莓果实贮藏过程中乙烯合成相关基因及乙烯受体基因表达的影响,发现热水处理显著抑制草莓果实乙烯合成酶基因ACS、ACO等的表达,推测热水延缓草莓果实衰老的作用可能与之有关。但到目前为止,热水延缓果实衰老的作用机理仍不明确。
近年来,与草莓果实成熟衰老相关的多个基因得到了深入研究,总结如表1所示。
表1 与草莓果实成熟衰老相关的基因
Table 1 Genes related to strawberry fruit ripening and senescence

注:PE.果胶甲酯酶(pectin esterases);Pectate lyase. 果胶裂解酶。
相关基因分类编码合成可能作用机制FAD基因家族PpFAD1和PpFAD2等 [49-54]不饱和脂肪酸影响细胞膜结构PLD基因家族PLDα、PLDβ、PLDγ、PLDε、PLDδ等 [55]磷脂酶DPLD催化起始磷脂的降解PG基因sPG、FaPG1和FaPG2等 [56]多聚半乳糖醛酸酶PE基因FaPE1、FaPE2、FaPE3、FaPE4等 [56]果胶酯酶Cels基因Cel1和Cel2、FAEG1和FAEG13等 [56]纤维素酶(EG、BG、CBH)Pectate lyase基因plA和plB等 [56]果胶裂解酶破坏细胞壁结构
4.1 PLDα基因
磷脂酶D(phospholipase D,PLD)即磷脂酰胆碱磷脂水解酶,是催化磷酸二脂酯键水解和碱基交换反应的一类酶的总称,广泛存在于各种植物体中 [57]。在成熟初期的种子、萌发初期的幼苗、生长和代谢活跃的部位含量最为丰富 [55]。PLD对果实成熟衰老的作用机理主要体现在以下几方面:1)膜脂的降解起始于PLD,PLD催化分解磷脂形成磷脂酸;2)PLD在乙烯信号转导途径中起作用;3)PLD参与脱落酸的信号传导途径 [58-60]。
目前的研究发现,PLD是一个多基因家族,具有多分子的异质性,其cDNA序列具有高度保守性 [61]。而且PLD在植物中至少有5 种类型:PLDα、PLDβ、PLDγ、PLDε、PLDδ,它们的编码基因及功能各不相同。PLDα与草莓果实的成熟有关,其活性的增加是细胞膜衰老时受损的第一步反应 [55]。Duxbury等 [62]利用放射性标记的磷脂侵入膜内,在不同时间间隔检测其代谢产物,验证了PLD催化起始磷脂的降解。袁海英等 [63]对草莓果实PLD生化特性进一步研究后认为PLD也参与调节草莓果实的发育成熟。卢秀丽 [55]通过草莓PLDα cDNA克隆及其反义基因遗传转化,并获得该基因表达的缺陷型植株,也确定了其在草莓成熟衰老过程中的调控作用。
4.2 FAD基因家族
脂肪酸去饱和酶(fatty acid desaturase,FAD)是一种膜结合蛋白,参与催化不饱和脂肪酸的生物合成。FAD通常以基因家族的形式存在,植物FAD基因家族主要分为四大类,第Ⅰ类主要包括拟南芥AtFAD2基因等,属于ω-6型FAD基因,定位于内质网;第Ⅱ类主要包括AtFAD6基因等,也属于ω-6型FAD基因,定位于叶绿体;第Ⅲ类主要包括拟南芥AtFAD3基因等,属于ω-3型FAD基因,定位于内质网;第Ⅳ类主要包括拟南芥AtFAD7基因等,也属于ω-3型FAD基因,定位于叶绿体。FAD基因家族成员参与植物胁迫反应,在果实成熟衰老进程中表达和功能具有多样性 [64-65]。通过对一些水果的研究显示,在果实成熟衰老进程中,FAD基因家族的一些成员(如PpFAD1和PpFAD2)表达显著加强,与亚麻酸和亚油酸等脂肪酸的积累量呈正相关 [49-50],而脂肪酸组分的变化会影响细胞膜结构,导致电导率上升,从而加剧果实衰老 [51]。此外,脂肪酸还是很多水果香味物质形成的重要前体物质,FAD基因家族成员在果实成熟衰老过程中能够介导一些芳香物质生物合成底物脂肪酸的积累 [3,52-53],进而影响果实香气的形成。在对草莓的研究中也得到类似结果 [54]。
4.3 细胞壁水解酶相关基因
纤维素是细胞壁的骨架物质,它的破坏直接导致细胞壁的降解和果实软化。有研究发现,随着草莓的成熟,纤维素酶的活性提高了6 倍 [66]。目前已分离出编码纤维素酶(主要包括内切葡聚糖酶(endo-1,4-β-D-glucanase,EG)、外切葡聚糖酶(exo-1,4-β-D-glucanase,CBH)、β-葡萄糖苷酶(β-1,4-glucosidase,BG)等)的基因,如Cel1和Cel2、FAEG1和FAEG2等 [56]。果胶是水果细胞壁中的主要黏结物质,而果胶裂解酶通过降解果胶物质而导致果实软化,目前已分离出推测为果胶裂解酶基因plA和plB等 [56]。多聚半乳糖醛酸酶通过降解果实细胞壁中多聚半乳糖醛酸而破坏细胞壁,导致果实软化,目前已分离出编码PG的基因sPG、FaPG1和FaPG2等 [56]。PE通过催化果胶酯酸转化为果胶酸,导致果实的软化。目前已分离出编码PE的基因FaPE1、FaPE2、FaPE3和FaPE4等 [56]。上述的几种基因均是通过编码相应酶的表达来降解细胞壁成分,进而导致果实软化,最终促进了果实的成熟衰老。
在草莓果实成熟衰老过程中,不同因子之间既有其自身独特的作用机理,又相互交叉渗透。深入探究草莓成熟衰老过程中相关因子的作用机制及相互关系,对于保持草莓采后营养品质和改善其贮藏性有着至关重要的作用,同时也为非跃变型果实采后成熟衰老调控提供更多理论支撑。
越来越多的研究表明,乙烯在非跃变型果实成熟衰老的调控中扮演着重要的角色,但对其调控机制的研究仍然没有得到一致的结论,缺乏强有力的直接证据,随着科技的进步及分子生物学的发展,上述问题或许能够从基因水平找到新的突破。ABA及其受体基因转录变化趋势都证实了ABA在草莓果实成熟过程中的重要作用。现在已经发现了多种与草莓成熟衰老相关的酶类和外源物质,对它们的研究也取得了一定的进展,但是由于其复杂多样性,对其作用机理的研究仍然任重而道远。当前对于成熟衰老相关基因的研究仍处于探索阶段,尽管部分基因及基因家族已经浮出水面,但都有其局限性,毕竟基因的数量庞大,但在基因角度对于成熟衰老的研究必将是最有说服力和权威性的证据,有关于这方面的探究亟待加强。
参考文献:
[1] BATTINO M, BEEKWILDER J, DENOYES-ROTHAN B, et al. Bioactive compounds in berries relevant to human health[J]. Nutrition Reviews, 2009, 67(Suppl 1): 145-150.
[2] GIAMPIERI F, ALVAREZ-SUAREZ J M, MAZZONI L, et al. The potential impact of strawberry on human health[J]. Natural Product Research, 2013, 27(4/5): 448-455.
[3] GIAMPIERI F, TULIPANI S, ALVAREZ-SUAREZ J M, et al. The strawberry: composition, nutritional quality, and impact on human health[J]. Nutrition, 2012, 28(1): 9-19.
[4] TULIPANI S, MEZZETTI B, BATTINO M. Impact of strawberries on human health: insight into marginally discussed bioactive compounds for the Mediterranean diet[J]. Public Health Nutrition, 2009, 12(9A): 1656-1662.
[5] GIAMPIERI F, ALVAREZ-SUAREZ J M, BATTINO M. Strawberry and human health: effects beyond antioxidant activity[J]. Journal of Agricultural and Food Chemistry, 2014, 62(18): 3867-3876.
[6] 陈昆松, 张上隆. 果实成熟衰老功能基因研究与调控[C]//中国园艺学会第四届青年学术讨论会, 2000.
[7] 左进华, 陈安均, 孙爱东, 等. 番茄果实成熟衰老相关因子研究进展[J].中国农业科学, 2010, 43(13): 2724-2734.
[8] ALEXANDER L, GRIERSON D. Ethylene biosynthesis and action in tomato: a model for climacteric fruit ripening[J]. Journal of Experimental Botany, 2002, 53(377): 2039-2055.
[9] 潘永贵, 谢江辉. 现代果蔬采后生理[M]. 北京: 化学工业出版社, 2009: 51-95.
[10] 杜正顺, 巩惠芳, 王荣华, 等. 热水处理对草莓果实的保鲜效应及其与乙烯相关基因表达的关系[J]. 园艺学报, 2009, 36(5): 647-654.
[11] 吴有梅, 顾采琴, 邰根福, 等. ABA和乙烯在草莓采后成熟衰老中的作用[J]. 植物生理学报, 1992, 18(2): 167-172.
[12] 杜正顺, 巩惠芳, 汪良驹, 等. 热水预处理对草莓室温贮藏品质的影响[J]. 保鲜与加工, 2008, 8(1): 28-32.
[13] 杜正顺, 巩惠芳, 汪良驹, 等. 热水预处理对草莓果实采后生理与品质的影响[J]. 江西农业学报, 2008, 20(1): 52-55.
[14] 李志强, 汪良驹, 巩文红, 等. 1-MCP对草莓果实采后生理及品质的影响[J]. 果树学报, 2006, 23(1): 125-128.
[15] JIANG Yueming, JOYCE D C, TERRY L A. 1-Methylcyclopropene treatment affects strawberry fruit decay[J]. Postharvest Biology and Technology, 2001, 23(3): 227-232.
[16] BOWER J H, BIASI W V, MITCHAM E J. Effects of ethylene and 1-MCP on the quality and storage life of strawberries[J]. Postharvest Biology and Technology, 2003, 28(3): 417-423.
[17] 史兰, 生吉萍, 于萌萌, 等. 1-MCP处理对贮藏后草莓的货架期品质的影响[J]. 食品工业科技, 2007, 28(2): 224-226.
[18] 顾采琴, 张百超. 脱落酸, 乙烯利对草莓后熟和衰老的影响[J]. 西南农业大学学报, 1992, 14(2): 113-116.
[19] 李春丽, 柴叶茂, 王志忠, 等. 草莓果实发育过程中糖, pH值及ABA水平变化趋势[J]. 果树学报, 2011, 28(1): 72-76.
[20] 贾海锋, 柴叶茂, 李春丽, 等. 草莓果实中脱落酸受体基因FaABAR/CHLH表达变化及其影响因素分析[J]. 园艺学报, 2011, 38(9): 1650-1656.
[21] 魏云潇, 叶兴乾. 果蔬采后成熟衰老酶与保护酶类系统的研究进展[J].食品工业科技, 2009, 30(12): 427-431.
[22] PETERMAN T K, SIEDOW J N. Behavior of lipoxygenase during establishment, senescence, and rejuvenation of soybean cotyledons[J]. Plant Physiology, 1985, 78(4): 690-695.
[23] CARRINGTON C M S, GREVE L C, LABAVITCH J M. Cell wall metabolism in ripening fruit (Ⅵ. Effect of the antisense polygalacturonase gene on cell wall changes accompanying ripening in transgenic tomatoes)[J]. Plant Physiology, 1993, 103(2): 429-434.
[24] SMITH C J S, WATSON C F, RAY J, et al. Antisense RNA inhibition of polygalacturonase gene expression in transgenic tomatoes[J]. Nature, 1988, 334: 724-726.
[25] 魏娜. 预温处理对草毒采后细胞壁降解的影响[D]. 重庆: 西南大学, 2008: 17-24.
[26] 高敏. 草莓(Fragaria ananassa)和桃(Prunus persica)采后衰老过程中乙烯与活性氧的变化及其与钙信使关系的研究[D]. 杨凌: 西北农林科技大学, 2002: 29-33.
[27] 关军锋, 高敏, 樊秀彩, 等. 草莓果实成熟衰老与Ca 2+, CaM, Ca 2+-ATPase和活性氧代谢的关系[J]. 中国农业科学, 2002, 35(11): 1385-1389.
[28] 李雄彪. 植物细胞壁酶的分子结构与生理功能[J]. 植物生理学通讯, 1991, 27(4): 246-252.
[29] 薛炳烨, 毛志泉, 束怀瑞. 草莓果实发育成熟过程中糖苷酶和纤维素酶活性及细胞壁组成变化[J]. 植物生理与分子生物学学报, 2006, 32(3): 363-368.
[30] BARNES M F, PATCHETT B J. Cell wall degrading enzymes and the softening of senescent strawberry fruit[J]. Journal of Food Science, 1976, 41(6): 1392-1395.
[31] HUBER D J. The role of cell wall hydrolases in fruit softening[J]. Horticultural Reviews, 1983, 5: 169-219.
[32] WALLNER S J, WALKER J E. Glycosidases in cell wall-degrading extracts of ripening tomato fruits[J]. Plant Physiology, 1975, 55(1): 94-98. [33] PRESSEY R. Endo-β-mannanase in tomato fruit[J]. Phytochemistry, 1989, 28(12): 3277-3280.
[34] ROSS G S, WEGRZYN T, MACRAE E A, et al. Apple β-galactosidase: activity against cell wall polysaccharides and characterization of a related cdna clone[J]. Plant Physiology, 1994, 106(2): 521-528.
[35] BUSH D S. Calcium regulation in plant cells and its role in signaling[J]. Annual Review of Plant Biology, 1995, 46(1): 95-122.
[36] POOVAIAH B W. Biochemical and molecular aspects of calcium action[C]//International Symposium on Pre- and Postharvest Physiology of Pome-fruit 326. 1992: 139-148.
[37] ROBERTS D M, HARMON A C. Calcium-modulated proteins: targets of intracellular calcium signals in higher plants[J]. Annual Review of Plant Biology, 1992, 43(1): 375-414.
[38] SNEDDEN W A, FROMM H. Calmodulin, calmodulin-related proteins and plant responses to the environment[J]. Trends in Plant Science, 1998, 3(8): 299-304.
[39] MARME D. The role of calcium and calmodulin in signal transduction[J]. Plant Biology (USA), 1989, 6: 57-80.
[40] 顾采琴. Ca 2+、CaM及其目标酶与乙烯诱导番茄和草莓果实成熟衰老关系的研究[D]. 杭州: 浙江大学, 2003: 41-46.
[41] YA’ACOV Y L. Nitric oxide in biological systems[J]. Plant Growth Regulation, 1996, 18(3): 155-159.
[42] 朱树华, 周杰, 束怀瑞. 一氧化氮对草莓果实衰老的影响[J]. 园艺学报, 2005, 32(4): 589-593.
[43] 李卫琼, 李自强, 吴增程. 一氧化氮薰蒸对延长草莓货架期的影响[J].云南农业大学学报: 自然科学版, 2008, 23(5): 719-722.
[44] 胡美姣, 李敏, 高兆银, 等. 热处理对果蔬采后品质及病虫害的影响[J].果树学报, 2005, 22(2): 143-148.
[45] 关军锋, 彭永宏. 热水处理对草莓果实贮藏品质与生理变化的影响[J].应用基础与工程科学学报, 2005, 8(2): 143-147.
[46] 张红印, 王雷, 姜松, 等. 热水处理对草莓采后病害的抑制作用及对贮藏品质的影响[J]. 农业工程学报, 2007, 23(8): 270-273.
[47] 静玮, 屠康, 邵兴锋, 等. 热水喷淋处理对草莓果实采后腐烂和品质的影响[J]. 食品科学, 2008, 29(3): 481-485.
[48] 陈莉, 屠康, 潘秀娟. 采后热处理对草莓果实货架品质的影响[J]. 食品科学, 2004, 25(9): 187-191.
[49] HERŃ NDEZ M L, PADILLA M N, MANCHA M, et al. Expression analysis identifi es FAD2-2 as the olive oleate desaturase gene mainly responsible for the linoleic acid content in virgin olive oil[J]. Journal of Agricultural and Food Chemistry, 2009, 57(14): 6199-6206.
[50] BANILAS G, NIKIFORIADIS A, MAKARITI I, et al. Discrete roles of a microsomal linoleate desaturase gene in olive identified by spatiotemporal transcriptional analysis[J]. Tree Physiology, 2007, 27(4): 481-490.
[51] 魏雯雯, 张波, 徐昌杰, 等. 脂肪酸去饱和酶基因家族与果实成熟衰老研究进展[J]. 果树学报, 2011, 28(4): 662-667.
[52] CAÑOLES M A, BEAUDRY R M, LI C, et al. Defi ciency of linolenic acid in Lefad7 mutant tomato changes the volatile profi le and sensory perception of disrupted leaf and fruit tissue[J]. Journal of the American Society for Horticultural Science, 2006, 131(2): 284-289.
[53] WANG Chunlin, CHIN C K, HO C T, et al. Changes of fatty acids and fatty acid-derived flavor compounds by expressing the yeast Δ-9 desaturase gene in tomato[J]. Journal of Agricultural and Food Chemistry, 1996, 44(10): 3399-3402.
[54] LEONE A, BLEVE-ZACHEO T, GERARDI C, et al. Lipoxygenase involvement in ripening strawberry[J]. Journal of Agricultural and Food Chemistry, 2006, 54(18): 6835-6844.
[55] 卢秀丽. 草莓PDLα cDNA克隆及其反义基因遗传转化的研究[D].乌鲁木齐: 新疆农业大学, 2009: 11-18.
[56] 钱春, 张兴国, 梁国鲁. 草莓果实成熟软化相关基因研究进展[J]. 中国蔬菜, 2009(22): 6-12.
[57] HELLER M. Phospholipase D[J]. Advances in Lipid Research, 1978, 16: 267-326.
[58] MCCORMAC D J, TODD J F, PALIYATH G, et al. Modulation of bilayer fl uidity affects lipid catabolism in microsomal membranes of tomato fruit[J]. Plant Physiology and Biochemistry, 1993, 31(1): 1-8.
[59] GRITTLE PINHERO R, ALMQUIST K C, NOVOTNA Z, et al. Developmental regulation of phospholipase D in tomato fruits[J]. Plant Physiology and Biochemistry, 2003, 41(3): 223-240.
[60] 尹金华, 高飞飞, 胡桂兵, 等. ABA和乙烯对荔枝果实成熟和着色的调控[J]. 园艺学报, 2001, 28(1): 65-67.
[61] WANG Xuemin. The role of phospholipase D in signaling cascades[J]. Plant Physiology, 1999, 120(3): 645-652.
[62] DUXBURY C L, LEGGE R L, PALIYATH G, et al. Alterations in membrane protein conformation in response to senescence-related changes[J]. Phytochemistry, 1991, 30(1): 63-68.
[63] 袁海英, 陈力耕, 李疆. 草莓果实磷脂酶D活性的测定[J]. 果树学报, 2006, 22(5): 579-581.
[64] KLAUS D, HÄRTEL H, FITZPATRICK L M, et al. Digalactosyldiacylglycerol synthesis in chloroplasts of the Arabidopsis dgd1 mutant[J]. Plant Physiology, 2002, 128(3): 885-895.
[65] ZHANG Bao, SHEN Jiyuan, WEI Wenwen, et al. Expression of genes associated with aroma formation derived from the fatty acid pathway during peach fruit ripening[J]. Journal of Agricultural and Food Chemistry, 2010, 58(10): 6157-6165.
[66] ABELES F B, TAKEDA F. Cellulase activity and ethylene in ripening strawberry and apple fruits[J]. Scientia Horticulturae, 1990, 42(4): 269-275.
Recent Progress in Research on Influencing Factors and Regulation Mechanisms of Strawberry Fruit Ripening and Senescence
CHENG Ran, SHENG Jiping*
(School of Agricultural Economics and Rural Development, Renmin University of China, Beijing 100872, China)
Abstract:Strawberry is one of the most widely cultivated plants all over the world and its fruits are very delicious and rich in nutrients. However the fruits have a short life cycle, and are extremely susceptible to postharvest decay and not shelf stable. Therefore, the studies on the factors regulating the ripening and senescence of strawberry fruits are of great significance. The major objective of this paper is to review the current information about plant hormones such as ethylene and abscisic acid (ABA), related enzymes such as lipoxygenase (LOX), superoxide dismutase (SOD) and catalase (CAT),exogenous substances such as Ca 2+, calmodulin, NO and hot water and related genes such as PLDa gene and the FAD gene family, and the potential mechanisms involved in strawberry ripening and senescence. Endogenous substances and enzymes not only exert their own functions at different levels by directly or indirectly influencing the functions of ethylene and NO,but also interact with each other to regulate and control the process of ripening and senescence. Studies at the gene level are still at the initial stage, although it has been revealed that they function by regulating the genes encoding enzymes related to the synthesis and decomposition of the cell wall and cell membrane. This paper will hopefully provide comprehensive information to study postharvest physiology and storage of strawberries.
Key words:strawberry; ripening and senescence; influencing factors; gene
中图分类号:N19
文献标志码:A
文章编号:1002-6630(2015)09-0242-06
doi:10.7506/spkx1002-6630-201509045
收稿日期:2014-03-19
基金项目:国家重点基础研究发展计划(973计划)项目(2013CB127106)
作者简介:程然(1988—),女,硕士研究生,研究方向为食品科学。E-mail:crcybaby@126.com
*通信作者:生吉萍(1967—),女,教授,博士,研究方向为食品科学、食品安全与管理。E-mail:shengjiping@126.com