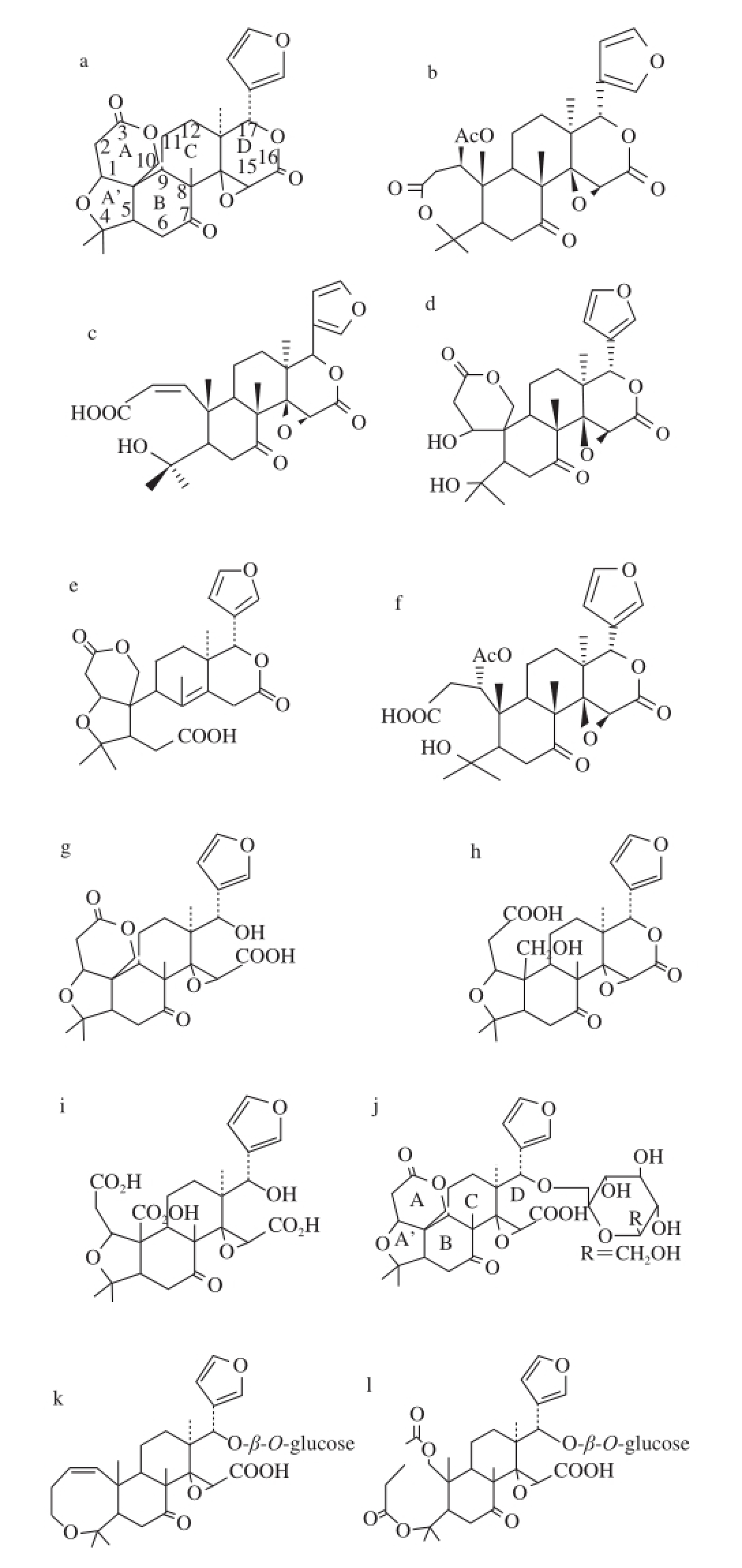
图1 几种重要类柠檬苦素的结构式
Fig.1 Several important limonoi ds
a. 柠檬苦素;b. 诺米林;c. 黄柏酮酸;d. 宜昌素;e. 脱氧柠檬苦酸;f. 诺米林酸;g. 柠檬苦酸A环内酯;h. 柠檬苦酸D环内酯;i. 柠檬苦酸;j. 柠檬苦素糖苷;k. 诺米林糖苷;l. 黄柏酮糖苷。
王松林 1,彭 荣 1,崔 榕 2,殷钟意 3,郑旭煦 1,3,*
(1.重庆工商大学环境与生物工程学院,重庆 400067;2.重庆工商大学教务处,重庆 400067;3.催化与功能有机分子重庆市重点实验室,重庆 400067)
摘 要:类柠檬苦素中柠檬苦素的苦味是世界柑橘属果汁加工业的一大障碍,类柠檬苦素生物脱苦法是目前改善苦味的首选方法。本文主要概述类柠檬苦素的结构与分类、自然生物转化与“后苦”现象、酶法脱苦、固定化细胞脱苦和基因工程脱苦等方面的国内外研究进展。
关键词:柑橘;类柠檬苦素;柠檬苦素;自然生物转化;生物脱苦法
柑橘类水果是世界最重要的水果之一,目前总年产量超过10 300万t。柑橘果实营养丰富,富含单糖、VC、类胡萝卜素、类黄酮、类柠檬苦素、单萜、香豆素、吖啶酮、叶酸和甘油糖脂质等,这些物质对调节人体新陈代谢、保护人 体健康大有裨益 [1-2]。几乎一半左右柑橘类水果被加工成果汁、果酱等食品,但苦味一直是柑橘产业的重要问题之一。引起苦味的物质主要来自两大类不同的植物化学家族:类黄酮(以柚皮苷为主)和类柠檬苦素(以柠檬苦素为主) [3]。柠檬苦素苦味阈值很低,在水溶液中为1.0 mg/L,在果汁中约为3.4 mg/L。柠檬苦素比柚皮苷约苦20 倍 [4],且柑橘榨汁过程中出现的“后苦”现象,也是由柠檬苦素前体物在酶催化下转化为柠檬苦素而引起的。因此,研究如何改善柠檬苦素的苦味显得尤为重要。
类柠檬苦素(limonoids)是一类高度氧化的四环三萜类植物次生代谢物质,主要存在于芸香科(Rutaceae)和楝科(Meliaceae)植物的组织中,在叶柄花科(Cneoraceae)和苦木科(Harrisoniasp)中亦有分布 [5]。迄今已分 离出大约300多种类柠檬苦素化合物。1841年,首次分离得到柠檬苦素(又称柠碱,limonin);20世纪60年代Arigoni等 [6]用化学和X射线衍射的方法确认了柠檬苦素的结构,得到其分子式为C 26H 30O 8,相对分子质量为470 [7];1989年研究者发现类柠檬苦素的糖苷存在形式 [8]。目前已从柑橘属植物中分离出38 种类柠檬苦素苷元和20 种类柠檬苦素糖苷 [9]。类柠檬苦素是立体结构的配位化合物,其原型结构包含或源自一种具有4,4,8-三甲基-17-呋喃固醇骨架的前体 [5]。自然形成的类柠檬苦素结构为D环的C17位上连有一个呋喃环,其C3、C4、C7、C16和C17上连有含氧官能团,除脱氧柠檬苦素外,C14和C15位上均有环氧结构 [10-11](图1)。

图1 几种重要类柠檬苦素的结构式
Fig.1 Several important limonoi ds
a. 柠檬苦素;b. 诺米林;c. 黄柏酮酸;d. 宜昌素;e. 脱氧柠檬苦酸;f. 诺米林酸;g. 柠檬苦酸A环内酯;h. 柠檬苦酸D环内酯;i. 柠檬苦酸;j. 柠檬苦素糖苷;k. 诺米林糖苷;l. 黄柏酮糖苷。
在分离获得的38 种类柠檬苦素苷元中,只有6 种是具有苦味的 [9,12-14],包括柠檬苦素 [5]、诺米林(nomilin) [15]、黄柏酮酸(obacunone acid) [16]、宜昌素(ichangin) [17]、脱氧柠檬苦酸(deoxylimonoic acid) [18]和诺米林酸(nomilin acid) [19]。柠檬苦素是发现的6 种天然苦味物质中最苦的一种,诺米林次之,而宜昌素和诺米林酸等因含量较低而苦味不明显 [10,20],6 种苦味物质分子结构式如图1a~1f所示。
类柠檬苦素苷元又可分为中性和酸性两种类型 [8-9],其中酸性苷元结构式如图1g~1i所示。类柠檬苦素糖苷的结构均是苷元在C17位与一分子葡萄糖以糖苷键的形式结合,如图1j~1l所示。苷元与糖苷结构的差别导致了性质的差异,苷元的水溶性差且具有明显苦味,而糖苷具有良好的水溶性且几乎没有苦味。
脱乙酰诺米林酸(角鲨烯,squalene)被认为是已知的芸香科柑橘属中类柠檬苦素的前体物 [21-22],它是在茎的韧皮部由醋酸、甲羟戊酸以及法尼醇磷酸等生物合成的,放射性示踪实验发现,脱乙酰诺米林酸转化成了诺米林 [23]。脱乙酰诺米林酸和诺米林都在茎的韧皮部合成,然后转移到植物的其他组织中,如叶、果实、种子等。在种 子和果实中脱乙酰诺米林酸至少会通过4 种独立的代谢途径 [2,24-26],如柠檬苦素途径(limonin pathway)、卡拉敏途径(calamin pathway)、宜昌素途径(ichangensin pathway)和7-醋酸酯类柠檬苦素途径(7-acetatelimonoi d pathway)等转化成类柠檬苦素。在果实成熟过程中,类柠檬苦素苷元会大量转化成没有苦味的类柠檬苦素糖苷,其自然生物转化途径详见图2 [5]。
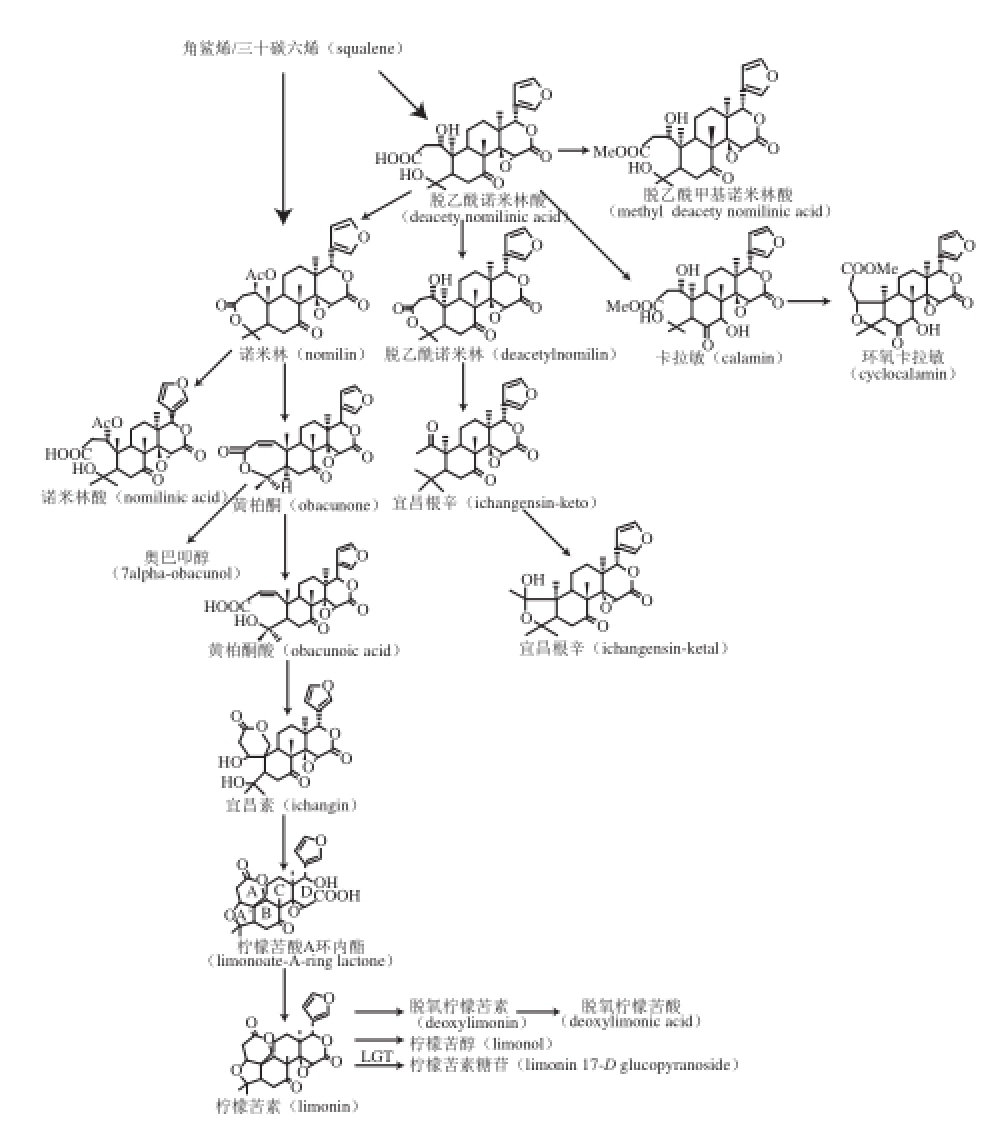
图2 柑橘属植物中类柠檬苦素的生物转化途径
[5]
Fig.2 Proposed biosynthetic pathways of limonoids in citrus
[5]
柑橘属类植物体内主要有5 种酶参与到柠檬苦素的生物合成及转化过程中 [24]。乙酰基裂解酶(acetyllyase)促进脱乙酰诺米林酸转化为脱乙酰诺米林,只存在于韧皮部。柠檬苦素脱氢酶(limolin dehydrogenase)将柠檬苦素转化成17-脱氢柠檬苦酸A环内酯,其含量非常少。另一类酶存在于柑橘属生长的各阶段,如茎、叶、果汁、果皮和种子中,并将柠檬苦素转化成对应的柠檬苦素糖苷;如柠檬苦素D环内酯水解酶(limonoid D-ring lactone hydrolase,LDRLase)在种子中促进D环的内酯化,且新生成的单内脂衍生物(monolactones)在这种酶的作用下继续 转化为双内酯(dilactones);柠檬苦素-尿苷二磷酸(uridine diphospha te,UDP)-糖基转移酶(limonoid-UDP-glycosyltransferase,LGTase)在果肉组织及种子中将柠檬苦酸A环内酯(1imonoate A-ring lactone,LARL)转化成不具苦味的柠檬苦素配糖体(1imonoid glucosides,LG) [8-10,26];柠檬苦素β-葡萄糖苷酶在种子萌发过程中催化柠檬苦素苷元水解成柠檬苦素糖苷和糖。
成熟柑橘果实中柠檬苦素的含量极少,但由于在柑橘果实中含有大量的柠檬苦素前体物质——非苦味的LARL,榨汁后果汁在pH<6.0、加热、冰冻或机械损伤等逆境条件下,LARL在柠檬苦素D环内酯水解酶的催化下迅速转化为具有强烈苦味的柠檬苦素,产生“后苦”(delayed bitterness)或“延迟苦味”的现象 [14,26-27]。柑橘果实中存在的柠檬苦素D环内酯水解酶受反应体系的pH值影响很大,在pH<6.0时,促进柠檬 苦素D环内酯化;在pH>8.0时,水解柠檬苦素D环内酯成柠檬苦酸A环内酯,其转化过程见图3。
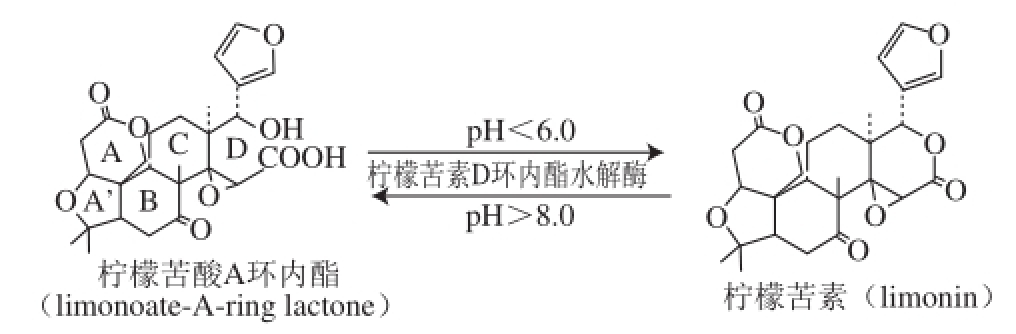
图3 “后苦”现象的转化途径
Fig.3 Mechanism of delayed bitterness
脱除类柠檬苦素苦味物质的方法主要有物理法和生物法。物理脱苦法主要包括吸附脱苦、膜分离脱苦、超临界CO 2脱苦、屏蔽法脱苦和添加苦味抑制剂脱苦等。生物脱苦法主要包括自然生物转化脱苦(如类柠檬苦素苷元转化为类柠檬苦素糖苷等)、酶法脱苦、固定化细胞脱苦和基因工程脱苦等。已有的研究表明,生物脱苦法是当前改善类柠檬苦素苦味的首选方法 [3,8,28-30]。
4.1 酶法脱苦
生物酶法脱苦具有专一性强、对柑橘果汁风味和营养成分无破坏、条件温和、效果好等特点,是较为理想的脱苦方法。作用于类柠檬苦素的脱苦酶主要有:柠檬苦素环氧酶、柠檬苦素脱氢酶、柠檬苦醇脱氢酶、反式消除酶(transeliminase)、乙酰基裂解酶(acetyl-lyase)等。Puri等 [31]报道酶促柠檬苦素还原为非苦衍生物通过3 条路线实现,并且转化程度的大小取决于酶的分解代谢水平。3 条转化途径如图4 [32]所示。

图4 柠檬苦素在酶作用下的转化途径
[32]
Fig.4 Biotransformation pathway of limonin under the action of enzymes
[32]
柠檬苦素脱氢酶可在不同微生物如球形节杆菌、假单胞菌321-18和束红球菌中分离纯化得到,该酶可以防止新鲜提取的柑橘果汁中柠檬苦素的产生,通过促进柠檬苦酸A环内酯转化成相应的无苦味衍生物17-脱氢柠檬苦酸A环内酯,而不会被转换成柠檬苦素 [28]。不同类型微生物中的脱苦酶及其转化途径如表1所示。
表1 不同类型微生物中脱苦酶及其转化柠檬苦素的途径
Table 1 Debittering enzyme types in microorganisms responsible for transformation pathways of limonin

微生物脱苦酶转化途径参考文献球形节杆菌(Arthrobactor globiformis)柠檬苦素D环内酯水解酶、柠檬苦酸A环内酯脱氢酶17-脱氢柠檬苦酸A环内酯[33]假单胞菌321-18(Pseudomonas 321-18)柠檬苦素环氧酶、柠檬苦素脱氢酶脱氧柠檬苦素、17-脱氢柠檬苦酸A环内酯[33-34]细菌342-152-1(Bacterium 342-152-1)柠檬苦素环氧酶、柠檬苦素脱氢酶、脱氧柠檬苦素水解酶脱氧柠檬苦素、17-脱氢柠檬苦酸A环内酯、脱氧柠檬苦酸[35] Acinetobacter sp.柠檬苦素环氧酶脱氧柠檬苦素[36]球形节杆菌Ⅱ(Arthrobactor globiformisⅡ)柠檬苦醇脱氢酶 柠檬苦醇[37]棒状杆菌(Corynebacterium fascians)柠檬苦素脱氢酶、乙酰基裂解酶17-脱氢柠檬苦酸A环内酯、反-19-羟基黄柏酮酸[38]束红球菌柠檬苦醇脱氢酶、柠檬苦醇、[39](Rhodococcus facians)乙酰基裂解酶反-19-羟基黄柏酮酸[40]
4.2 固定化细胞脱苦
适用于类柠檬苦素生物转化的酶在实际应用中因果汁的低pH值而易失活,且生产成本高,因此在工业生产中受到很大程度的限制。利用固定化细胞脱苦技术,不仅可省去复杂的酶分离提纯步骤,保持细胞内酶活性的稳定性,还可将菌种连续培养复壮使用。
固定化细胞常用菌有假单胞菌、束红球菌、球形节杆菌、球形节杆菌Ⅱ等,其固定化材料的选择也非常重要。Iborra等 [40]将束红球菌的细胞固定在κ-角叉藻聚糖上,可脱除大约60%的柠檬苦素;Hasegawa等 [33,37]还将厌氧棒状杆菌固定在丙烯酰胺上,含有20~50 mg/kg诺米林的柑橘汁一次通过便可完全脱除苦味,该系统连续使用15 次后仍然有效。罗自生等 [41]将醋酸杆菌于固定化细胞生物反应器中,以2 mL/min流速处理柑橘汁,柠檬苦素脱苦率达58.3%,该反应器每次处理柑橘汁120 mL,可连续使用11 次,脱苦率仍可达到51.08%。Vaks等 [42]从土壤中分离出鲍曼不动杆菌,将该菌装入渗透性囊袋,置于高柠檬苦素果汁中处理2 h,柠檬苦素含量降低了50%,而果汁 中其他营养成分没有损失。
固定化细胞利用的菌株中恶臭假单胞菌G7的柠檬苦素生物转化能力也被证实 [43-44]。恶臭假单胞菌株是公认的一种卓越的营养机会主义和 范式代谢多功能的微生物,能利用柠檬苦素进行代谢。Chatterjee等 [22]也报道称,恶臭假单胞菌MTCC1072可分解代谢单萜柠檬烯为非苦衍生物紫苏醇和反式-对薄荷-6-烯-2,8-二醇。
然而固定化细胞由于细胞膜对基质和产物的渗透性屏障会导致反应速率较低。Kondo等 [45]提出通过减少渗透性屏障以提高固定化细胞催化的有效性,已验证了可通过使用有机溶剂、清洁剂、盐、酶、化学品和电脉冲的方法来增加细胞通透性 [43,46-48]。透化作用简化了细胞的通透性屏障,使物质穿过细胞膜的自由流动过程变得更加容易。这样微生物细胞保留其内在的组织及必要的几种辅酶因子而发挥作用 [46,49-50]。
4.3 基因工程脱苦
固定化细胞代谢柠檬苦素的生物转化率很低,而阻碍了其实际应用的可行性。微生物具有耐酸和代谢柠檬苦素酶基因这两种生存优势,而遗传基因操纵工具的不成熟也阻碍了微生物的充分开发。
目前,关于柠檬苦素D环内酯水解酶及其基因的研究很少,研究主要集中在提高柠檬苦素D环内酯水解酶活性的方法以及在假单胞菌中D环内酯水解酶的活性方面 [13,51]。而通过基因工程技术增强柠檬苦素-UDP-糖转移酶活性的研究已成为培植脱苦转基因柑橘和高类柠檬苦素糖苷转基因柑橘果树的重要突破口 [2,27]。Kita等 [52]分离出了能编码翻译LGTase的cDNA克隆基因(CitLGT),研究表明CitLGT是柑橘基因组中的一个单拷贝基因,在脐橙果实发育过程中,CitLGT mRNA转录物含量的变化与柠檬苦素苷元含量的波动变化一致,说明CitLGT转录调节柠檬苦素类似物苷元转化为其糖配体。Karim等 [53]提出,柑橘类水果中的苦味物质含量可以通过在分子水平上操纵酶的活性而得到降低,他们还建议LGTase 基因可被引入到细菌细胞,用来作用于固定化细胞以转换类柠檬苦素为其配糖体。基因工程的植株再生系统已有 报道,且已被证明通过改变胚胎的愈伤组 织培养基,用根癌农杆菌介导的方法可以获得愈伤组织胚胎。因此可以有针对性地通过柑橘基因遗传工程最大限度地获取柠檬苦素配糖体,通过自然生物转化将柠檬苦素等苦味物质转化成非苦衍生物,以解决柑橘类果汁的苦味问题。
用于柠檬苦素生物转化的酶因其稳定性差、易变性失活、成本较高而不便于工业连续化生产。固定化细胞省去了酶的分离提纯步骤,保持细胞内酶的稳定性,可连续发酵用于生产,但细胞膜对基质和产物的渗透性屏障导致反应速率较低。通过选育优质高产酶菌株提高酶活性,以及通过物理化学和生物方法来增加全细胞通透性,选择合适的固定化材料等是目前酶法脱苦及固定化细胞脱苦的主要研究方向。在脱苦研究中,同时也发现类柠檬苦素具有多种生物活性,如具有抗癌、抗人类免疫缺陷病毒(human immunodefi ciency virus,HIV)、抗炎、抗氧化性、抗菌、镇痛、除虫、调节血糖等作用 [12,54]。摄取类柠檬苦素的最好途径是饮用果汁或食用鲜果,然而柠檬苦素等苦味物质又大大降低了人们的食欲,如何既不损失原有果汁的风味和营养成分,又能实现高效脱苦,既简便又低成本地消除柑橘果汁中的苦味物质将是今后研究的重要方向。 研究表明,无苦味的类柠檬苦素配糖体的生物学活性及药理作用等同于柠檬苦素等苦味物质 [54-55]。因此,在保证果实中类柠檬苦素应用价值的前提条件下,如何利用分子生物学的手段和方法将柠檬苦素等苦味物质转化成类柠檬苦素配糖体或17-脱氧柠檬苦素 等非苦衍生物,从根本上消除柠檬苦素等苦味物质,将具有广阔的应用前景。
参考文献:
[1] 靖丽, 周志钦. 论果品营养学[J]. 果树学报, 2011, 28(1): 114-123.
[2] 丁晓波, 张华, 刘世尧, 等. 柑橘果品营养学研究现状[J]. 园艺学报, 2012, 39(9): 1687-1702.
[3] 郑亚凤, 王琦. 葡萄柚汁树脂脱苦工艺的研究[J]. 中国农学通报, 2010, 26(24): 95-98.
[4] 孙志高, 黄学根, 焦必宁. 柑橘果实主要苦味成分的分布及橙汁脱苦技术研究[J]. 食品科学, 2005, 26(6): 146-148.
[5] ROY A, SARAF S. Limonoids: overview of significant bioactive triterpenes distributed in plants kingdom[J]. Biological and Pharmaceutical Bulletin, 2006, 29(2): 191-201.
[6] ARIGONI D, BARTON D H R, COREY E J, et al. The constitution of limonin[J]. Cellular and Molecular Life Sciences, 1960, 16(2): 41-49.
[7] 王贱荣, 董美玲, 郭跃伟. 芸香科柠檬苦素类化合物及其生物活性研究进展[J]. 国际药学研究杂志, 2009, 36(5): 321-331.
[8] HASEGAWA S, BENNETT R D. Limonoid glucosides in citrus[J]. Phytochemistry, 1989, 28(6): 1717-1720.
[9] 沈雯, 许健. 柠檬苦素类似物及其D环内酯酶研究进展[J]. 医学研究杂志, 2010, 39(4): 111-113.
[10] MAIER V P, BENNETT R D, HASEGAWA S. Preparation of citrus juices, concentrates and dried powders which are reduced in bitterness: US, 4439458 A[P]. 1984-03-27.
[11] MORIGUCHI T, KITA M, HASEGAWA S, et al. Molecular approach to citrus flavonoid and limonoid biosynthesis[J]. Journal of Food Agriculture and Environment, 2003, 1: 22-25.
[12] MANNERS G D. Citrus limonoids: analysis, bioactivity, and biomedical prospects[J]. Journal of Agricultural and Food Chemistry, 2007, 55(21): 8285-8294.
[13] BREKSA A P, MANNERS G D. Determination of limonin D-ring lactone hydrolase activity by solid phase extraction with indirect fl uorescence detection[J]. Journal of Agricultural and Food Chemistry, 2004, 52(12): 3772-3775.
[14] 王志国. 微生物与柑桔汁脱苦[J]. 食品科学, 2000, 21(11): 10-14.
[15] HASEGAWA S. Biochemistry of limonoids in citrus[M]//BERHOW M A, HASEGAWA S, MANNERS G D. Citrus limonoids: functional chemicals in agric ulture and food. Washington DC: American Chemical Society, 2000: 9-30.
[16] BERNAY S. Limonin[J]. Justus Liebigs Annalen der Chemie, 1841, 40: 317-319.
[17] H IGBY R H. The bitter constituents of navel and Valencia oranges[J]. Journal of the American Chemical Society, 1938, 60(12): 3013-3018.
[18] EMERSON O H. The bitter principle in Navel oranges[J]. Food Technology, 1949, 3(7): 248-250.
[19] ARNOTT S, ROBERTSON J M, WATSON D G, et al. The structure of limonin-X-ray analysis of epilimonol iodoacetate[J]. Journal of the Chemical Society, 1961. doi: 10.1039/JR9610004183.
[20] 吴长青, 何国庆. 柑桔果汁中的苦味物质及其去除方法[J]. 中国商办工业, 2000(2): 53-54.
[21] MAIER V P, BEVERLY G D. Limonin monolactone, the nonbitter precursor responsible for delayed bitterness in certain citrus juices[J]. Journal of Food Science, 1968, 33(5): 488-492.
[22] CHATTERJEE T, BHATTACHARYYA D. Biotransformation of limonene by Pseudomonas putida[J]. Applied Microbiology and Biotechnology, 2001, 55(5): 541-5 46.
[23] OU P, HASEGAWA S, HERMAN Z, et al. Limonoid biosynthesis in the stem of Citrus limon[J]. Phytochemistry, 1988, 27(1): 115-118.
[24] HASEGAWA S, HERMAN Z, ORME E D, et al. Biosynthesis of limonoids in citrus: sites and translocation[J]. Phytochemistry, 1986, 25(12): 2783-2785.
[25] HASEGAWA S, MIYAKE M. Biochemistry and biological functions of citrus limonoids[J]. Food Reviews International, 1996, 12(4): 413-435.
[26] 刘亮, 戚向阳, 董绪燕. 柑橘中柠檬苦素类似物的研究新进展[J]. 农产品加工: 学刊, 2007(7): 37-41.
[27] 丁帆, 刘宝贞, 邓秀新, 等. 6个甜橙品种果汁的后苦昧分析[J]. 华中农业大学学报, 2010, 29(4): 497-501.
[28] PURI M, KAUR L, MARWAHA S S. Partial purification and characterization of limonoate dehydrogenase from Rhodococcus fascians for the degradation of limonin[J]. Journal of Microbiology and Biotechnology, 2002, 12(4): 669-673.
[29] SINGH S V I R, JAIN R K, GUPTA A K, et al. Debittering of citrus juices: a review[J]. Journal of Food Science and Technology, 2003, 40(3): 247-253.
[30] 白卫东, 刘晓艳. 柑桔汁脱苦方法研究进展[J]. 食品工业科技, 2006, 27(9): 202-206.
[31] PURI M, MARWAHA S S, KOTHARI R M, et al. Biochemical basis of bitterness in citrus fruit juices and biotech approaches for debittering[J]. Critical Reviews in Biotechnology, 1996, 16(2): 145-155.
[32] SHARMA M. Transposon mutagenesis of gene involved in limonin degradation in Pseudomonas putida[D]. Patiala: Thapar Institute of Engineering and Technology, 2005: 1-49.
[33] HASEGAWA S, BENNETT R D, MAIER V P. Metabolism of limonin and limonoate by microorganisms. Conversion to nonbitter compounds[J]. Journal of Agricultural and Food Chemistry, 1972, 20(2): 435-437.
[34] HASEGAWA S, MAIER V P, KING A D. Isolation of new limonoate dehydrogenase from Pseudomonas[J]. Journal of Agricultural and Food Chemistry, 1974, 22(3): 523-526.
[35] HASEGAWA S, KIM K. Biochemistry of limonoids. A new limonoiddebittering enzyme[C]//Citrus Research Conference. Agricultural Research Service, Fruit and Vegetable Chemistry Laboratory, United States, 1975.
[36] HASEGAWA S, MAIER V P. Solutions to the limonin bitterness problem of citrus juices [triterpene derivatives][J]. Food Technology (USA), 1983, 37(6): 73-77.
[37] HASEGAWA S, PELTON V A, BENNETT R D. Metabolism of limonoids by Arthrobacter globiformis Ⅱ: basis for a practical means of reducing the limonin content of orange juice by immobilized cells[J]. Journal of Agricultural and Food Chemistry, 1983, 31(5): 1002-1004.
[38] HASEGAWA S, KING A D, Jr. A species of bacterium-producing constitutive enzymes for limonoid metabolism[J]. Journal of Agricultural and Food Chemistry, 1983, 31(4): 807-809.
[39] MARTINEZ-MADRID C, MANJON A, IBORRA J L. Degradation of limonin by entrapped Rhodococcus fascians cells[J]. Biotechnology Letters, 1989, 11(9): 653-658.
[40] IBORRA J L, MANJON A, CANOVAS M, et al. Continuous limonin degradation by immobilized Rhodococcus fascians cells in κ-carrageenan[J]. Applied Microbiology and Biotechnology, 1994, 41(4): 487-493.
[41] 罗自生, 张惟广. 醋酸菌脱除柑桔汁柠碱苦味的研究[J]. 食品与机械, 2001, 17(1): 18-19.
[42] VAKS B, LIFSHITZ A. Debittering of orange juice by bacteria which degrade limonin[J]. Journal of Agricultural and Food Chemistry, 1981, 29(6): 1258-1261.
[43] GHOSH M, GANGULI A, MALLIK M. Evidence of indigenous NAH plasmid of naphthalene degrading Pseudomonas putida PpG7 strain implicated in limonin degradation[J]. Journal of Microbiology (Seoul, Korea), 2006, 44(5): 473-479.
[44] VERMA J P, SINGH S, GHOSH M, et al. Identification and characterization of cellular locus of limonin biotransforming enzyme in Pseudomonas putida[J]. International Journal of Food Science & Technology, 2010, 45(2): 319-326.
[45] KONDO A, LIU Yan, FURUTA M, et al. Preparation of high activity whole cell biocatalyst by permeabilization of recombinant fl occulent yeast with alcohol[J]. Enzyme and Microbial Technology, 2000, 27(10): 806-811.
[46] CHENG Shiwei, WEI Dongzhi, SONG Qingxun, et al. Immobilization of permeabilized whole cell penicillin G acylase from Alcaligenes faecalis using pore matrix crosslinked with glutaraldehyde[J]. Biotechnology Letters, 2006, 28(14): 1129-1133.
[47] GECKIL H, ATES B, GENCER S, et al. Membrane permeabilization of gram-negative bacteria with a potassium phosphate/hexane aqueous phase system for the release of L-asparaginase: an enzyme used in cancer therapy[J]. Process Biochemistry, 2005, 40(2): 573-579.
[48] CHEN R R. Permeability issues in whole-cell bioprocesses and cellular membrane engineering[J]. Applied Microbiology and Biotechnology, 2007, 74(4): 730-738.
[49] FELIX H. Permeabilized cells[J]. Analytical Biochemistry, 1982, 120(2): 211-234.
[50] GOUGH S, DESHPANDE M, SCHER M, et al. Permeabilization of Pichia pastoris for glycolate oxidase activity[J]. Biotechnology Letters, 2001, 23(18): 1535-1537.
[51] 柳志强, 孙志浩, 郑璞, 等. D-泛解酸内酯水解酶的定向进化[J]. 生物工程学报, 2005, 21(5): 773-781.
[52] KITA M, HIRATA Y, MORIGUCHI T, et al. Molecular cloning and characterization of a novel gene encoding limonoid UDP-glucosyltransferase in citrus[J]. FEBS Letters, 2000, 469(2): 173-178.
[53] KARIM M R, HASHINAGA F. Pr eparation and properties of immobilized pummelo limonoid glucosyltransferase[J]. Process Biochemistry, 2002, 38(5): 809-814.
[54] 张虹, 张艳萍. 柠檬苦素类似物的研究进展[J]. 食品与发酵工业, 2002, 28(2): 80-83.
[55] 葛维, 李小定, 吴谋成. 柠檬苦素类似物及其配糖体的研究与应用进展[J]. 湖北农业科学, 2009(4): 1000-1003.
Biotransformation and Debittering of Limonoids: an Overview
WANG Songlin
1, PENG Rong
1, CUI Rong
2, YIN Zhongyi
3, ZHENG Xuxu
1,3,*
(1. School of Environmental and Biological Engineering, Chongqing Technology and Business University, Chongqing 400067,China; 2. Educational Administration, Chongqing Technology and Business University, Chongqing 400067, China; 3. Chongqing Key Laboratory of Catalysis and Functional Organic Molecules, Chongqing 400067, China)
Abstract:The occurrence of the limonoid aglycone limonin, responsible for bitterness in citrus juice, remains a major impediment to the development of citrus juice industry worldwide. Biotransformation of limonin for ameliorating bitterness has been unequivocally suggested to be the current method of choice. This article mainly focuses on the recent progress in the structure and classification, natural biotransformation and delayed bitterness of limonoids as well as debittering by enzymatic methods, immob ilized cells a nd genetic engineering.
Key words:citrus; limonoids; limonin; natural biotransformation; biological debittering
中图分类号:Q819
文献标志码:A
文章编号:1002-6630(2015)09-0279-05
doi:10.7506/spkx1 002-6630-201509051
收稿日期:2014-06-22
基金项目:重庆市高校优秀成果转化资助重点项目(KJZH11212)
作者简介:王松林(1990—),男,硕士研究生,主要从事环境生物工程研究。E-mail:WSL9090@163.com
*通信作者:郑旭煦(1964—),女,教授,博士,主要从事生物质资源开发利用研究。E-mail:xuxuzheng@ctbu.edu.cn