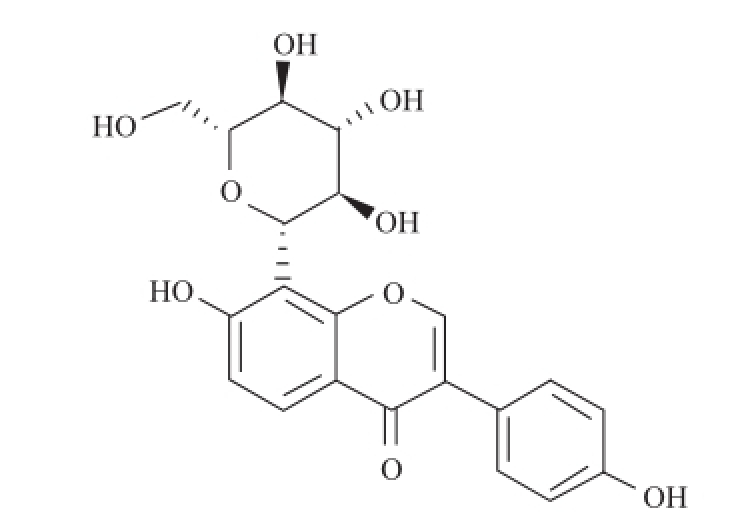
图1 葛根素的分子结构[27
]
Fig.1 Molecular structure of puerarin[2
7]
许苗苗 1,王素素 1,李 辉 1,2,*,黄宇琳 1,逯翠梅 1,蒋剑波 1
(1.吉首大学化学化工学院,湖南 吉首 416000;2.吉首大学植物资源保护与利用湖南省高校重点实验室,湖南 吉首 416000)
摘 要:以葛根素为模板分子,甲基丙烯酸为功能单体,乙二醇二甲基丙烯酸酯为交联剂沉淀聚合法制备葛根素印迹聚合物微球。用扫描电镜观察微球形貌,静态吸附法测试聚合物的吸附行为。探讨分子印迹聚合物(molecularly imprinted polymers,MIPs)对葛根粗提液中葛根素的吸附、解吸附及固相萃取效能。结果表明,优化的葛根素MIP3对纯模板的静态吸附量达37.9 mg/g;对粗提液中目标化合物的吸附率为(96.3±1.81)%,以水、甲醇-醋酸(9∶1,V/V)及50%甲醇溶液为洗脱剂的单次解吸率为27%~34%,用水从MIP3上解吸出的总溶液经脱除溶剂后,所获粗品葛根素含量最高,达(37.4±2.87)%。在优化条件下,通过MIP3固相萃取葛根粗提液,葛根素回收率达71.6%,产品纯度高于75%。
关键词:分子印迹聚合物;葛根素;沉淀聚合法;吸附;固相萃取
分子印迹聚合物(molecularly imprinted polymers,MIPs)是在目标分子存在下,通过交联聚合制备而成的对目标化合物具有记忆功能的高分子材料 [1]。因其基体中含有与目标分子在大小、空间结构及化学基团等方面相匹配的结合孔穴,而对特定化合物具有选择识别能力 [2]。分子印迹结合位点与模板分子间高选择、可逆、较高容量地相互作用,赋予印迹材料在分离分析及复杂样品选择萃取方面的巨大优越性 [3-4]。迄今,MIPs已经广泛应用在色谱分离分析、仿生传感、固相萃取、抗体模拟和催化等领域 [5-10]。葛根素是可食用植物材料葛根中的一种生物活性化合物 [11],有增加脑血流、提高免疫力、改善记忆、抗肿瘤、降血糖及解酒等药食兼备功效 [12-14]。近年来,葛根素注射液在临床上被广泛应用。葛根素主要从葛根中提取分离得到,然而,葛根提取液中由于存在大量结构与葛根素相似的化合物,其中主要有大豆苷、大豆苷元、大豆苷元-4,7-二葡萄糖苷。一些常规分离纯化技术,包括大孔吸附树脂法、β-环糊精键合固定相法、络合萃取技术、离子交换纤维法和聚酰胺柱层析吸附法等 [15-20]被用于对葛根素进行分离和纯化,虽然获得的葛根素纯度较高,但由于分离材料对目标化合物的选择性差,致使操作步骤繁琐,溶剂消耗量大,效率较低 [21-23]。研究和开发对葛根素具有高选择识别作用的分离材料对于高效分离和纯化此化合物具有重要意义。葛根素印迹聚合物是以目标产物葛根素为模板制备的印迹材料,其中印迹位点与模板分子的匹配性显示了该种材料在分离纯化方面的应用前景 [24]。王琳等 [25]制备的葛根素印迹聚合物电化学传感器对模板分子显示了高度的选择性和良好敏感度,程邵玲等 [26]探究了葛根素印迹聚合物的结合位点特征并用于提取葛根异黄酮。
本实验以葛根素为模板分子,采用沉淀聚合法制备了葛根素印迹聚合物微球,考察了MIPs对纯模板的吸附容量及对葛根粗提液中葛根素的吸附能力,并对吸附有葛根素的聚合物使用不同洗脱剂进行解吸附,探讨分子印迹固相萃取葛根粗提液中葛根素的提取和分离纯化效能。实验通过纯化,获得了纯度高于75%的葛根素产品。
1.1 材料、试剂与仪器
葛根从湖南省吉首农产品市场购买。葛根洗涤干净,自然风干后粉碎。为制备葛根粗提液,称取葛根粉10 g,加入40 mL乙醇,回流提取2 h,过滤,固体再用相同体积的乙醇提取2 次,过滤后合并提取液,即得葛根粗提液。
葛根素(纯度高于98%,分子结构见图1) 中国食品药品检定研究院;乙二醇二甲基丙烯酸酯(ethyleneglycol dimethacrylate,EGDMA)、α-甲基丙烯酸(methacrylic acid,MAA) 美国Sigma公司;二甲亚砜(dimethyl sulfoxide,DMSO)、偶氮二异丁腈(α,α’-azoisobutyronitrile,AIBN)、乙腈、丙酮、甲醇、乙酸 中国医药集团上海化学试剂公司。所有试剂均为分析纯。

图1 葛根素的分子结构[27
]
Fig.1 Molecular structure of puerarin[2
7]
LC-20A型高效液相色谱 日本岛津公司;KQ-250E型超声波清洗器 昆山市超声仪器有限公司;DF-101B集热式恒温磁力搅拌器 浙江乐清市乐成电器厂;FA2104N型电子分析天平 上海民桥精密科学仪器有限公司;S-3400N型扫描电镜 河南贝尔伟业仪器有限公司。
1.3 方法
1.3.1 MIPs的制备和表征
1.3.1.1 沉淀聚合法制备MIPs
使用沉淀聚合法制备MIPs时,准确称取41.6 mg葛根素(模板)于20 mL圆底烧瓶中,加入10.0 mL乙腈和1.0 mL DMSO,加入功能单体MAA和交联剂EGDMA,再加入12 mg引发剂AIBN,超声处理2 min,通氩气除氧15 min后。设置烧瓶转速10 r/min,于60 ℃水浴中反应20 h。将反应所得固体颗粒用20 mL丙酮沉降4 次,以除去细小粒子。过滤,干燥得葛根素印迹聚合物。聚合物产率为聚合物质量与加入的单体(模板、功能单体、交联剂)总质量之比。非印迹聚合物的合成方法与印迹聚合物合成方法一致,但在合成时不加入模板分子。
1.3.1.2 扫描电镜分析
取少量分子印迹及非印迹聚合物样品于1.5 mL无菌离心管,分别加入一定量甲醇密封,于超声波清洗器中超声5 min,各取一滴置于盖玻片上,待甲醇挥发后制样,用S-3400N型扫描电镜观看聚合物颗粒大小。
1.3.1.3 MIPs的静态吸附
称取10.0 mg MIPs,加入到5.0 mL质量浓度为0.15 mg/mL葛根素-乙腈溶液中,静态吸附4 h后,过滤,滤液中葛根素质量浓度用高效液相色谱分析,并计算吸附量。其他聚合物的静态吸附按同样的方法进行。聚合物的静态吸附量Q(mg/g)按式(1)计算:
式中:ρ 0为初始质量浓度/(mg/mL);ρ e为平衡质量浓度/(mg/mL);V为溶液体积/mL;m为聚合物质量/g。
1.3.2 吸附与解吸
1.3.2.1 吸附
分别称取各种聚合物0.5 g于三角瓶中,加入10 mL葛根粗提液,室温振荡吸附4 h后,过滤,高效液相色谱法测定滤液中葛根素含量,按式(2)计算吸附率(A)。
式中:ρ 0和ρ分别为粗提液和吸附后滤液中的葛根素质量浓度/(mg/mL)。
1.3.2.2 解吸附
将吸附有葛根素的聚合物,分别用乙腈、水、甲醇-醋酸(9∶1,V/V)、50%甲醇溶液为洗脱剂进行解吸附。将1.3.1节步骤中吸附有葛根素的聚合物过滤,于60 ℃真空干燥,称取各种固体0.2 g,分别加入到5.0 mL洗脱剂中,室温振荡解吸2 h后,过滤,高效液相色谱测定滤液中葛根素质量浓度。按式(3)计算葛根素解吸率(D)。
式中:ρ’为解吸液中葛根素质量浓度/(mg/mL);V为解吸液体积/mL;m’为初始质量/g。
1.3.3 分子印迹固相萃取
称取0.5 g葛根素印迹聚合物(MIP3),装填到5.0 mL的固相萃取器中,出口端连接真空泵。将2.0 mL葛根粗提液上样后,开启真空泵,收集流出液。先用2.0 mL乙腈洗脱非选择性吸附,再用9×2.0 mL水为洗脱剂进行洗脱,收集每次的洗脱液,各洗脱液中葛根素含量用高效液相色谱分析。
1.3.4 高效液相色谱分析
高效液相色谱法分析葛根素含量。色谱柱为ODS柱(200 mm×4.6 mm,5 μm),流动相为甲醇-水(1∶3,V/V)溶液,流速1.0 mL/min,检测波长250 nm,柱温25 ℃,进样量5 μL。标准曲线法进行定性定量分析。
2.1 MIPs的制备和表征
改变功能单体及交联剂用量,采用沉淀聚合法制备了3 种葛根素印迹聚合物(MIP1~3)及非印迹聚合物(NIP1~3)。由表1可以发现,随着功能单体及交联剂用量的增加,MIPs及非印迹聚合物的产率增加。当2 种单体的用量分别为0.8 mmol和12 mmol时,MIPs及非印迹聚合物产率分别为55.8%和70.2%。表1也给出了6 种聚合物对葛根素-乙腈溶液(0.15 mg/mL)的静态吸附结果,显示MIP3对模板的吸附量最高。
表1 3种葛根素印迹聚合物及其非印迹聚合物的制备
Table1 Preparation of three puerarin imprinted and non-imprinteed polymers
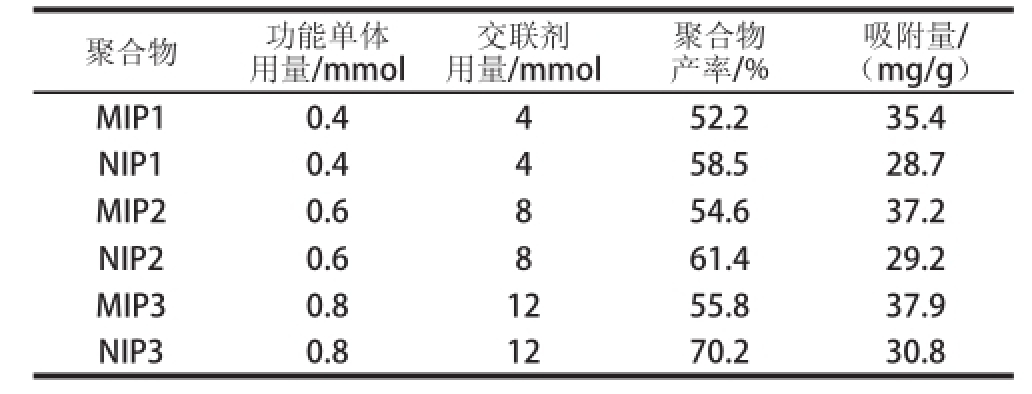
聚合物功能单体用量/mmol交联剂用量/mmol聚合物产率/%吸附量/(mg/g)MIP10.4452.235.4 NIP10.4458.528.7 MIP20.6854.637.2 NIP20.6861.429.2 MIP30.81255.837.9 NIP30.81270.230.8

图2 3 种葛根素印迹聚合物及其非印迹聚合物的扫描电镜图
Fig.2 SEM photographs of puerarin imprinted and non-imprinted polymer microspheres
图2给出了3 种葛根素印迹及非印迹聚合物的扫描电镜图。显示非印迹聚合物(NIP1~3)均为粒径约10 μm的均匀微球,而MIPs微球粒径分散,在5~30 μm范围变化。沉淀聚合法中,分子印迹微球粒径的分散性可能是由于模板分子的存在影响沉淀生成而引起的。
2.2 MIPs对葛根素的吸附及解吸附
图3示出了6 种聚合物对葛根粗提液中葛根素的吸附率。结果表明MIPs对葛根素的吸附率明显高于非印迹聚合物,其中MIP3对葛根素的吸附率最高,为(96.3±1.81)%。印迹聚合物对目标物强的吸附能力是由于MIPs基体中除了具有与模板分子在大小、空间结构及化学基团相匹配的高选择识别位点,还有大量非选择性结合位点,而非印迹聚合物仅有非选择性识别位点。

图3 6种聚合物对葛根粗提液中葛根素的吸附率(n=3)
Fig.3 Adsorption percentage of puerarin fromcrude pueraria extract by six polymers (n=3)
将吸附有葛根素的聚合物过滤,然后分别用乙腈、水、甲醇-醋酸(9∶1,V/V)、50%甲醇溶液为洗脱剂进行解吸附,解吸2 h后,各种聚合物上葛根素的解吸率见表2。可以发现,葛根素在非印迹聚合物上的解吸率高于相应的印迹聚合物,这是由于非印迹聚合物对葛根素的结合强度要比印迹聚合物弱的原故。对于MIPs上的解吸附而言,除了用乙腈解吸效果稍差之外,用水、甲醇-醋酸(9∶1,V/V)及50%甲醇溶液为洗脱剂解吸效果相差不大,解吸率在27%~34%范围内变化,这是因为它们均为质子洗脱剂,容易破坏模板分子与印迹位点的氢键作用而解吸目标化合物。
表2 不同洗脱剂对聚合物的静态解吸率
Table2 Desorption percentage of puerarin from ploymers by different solvents
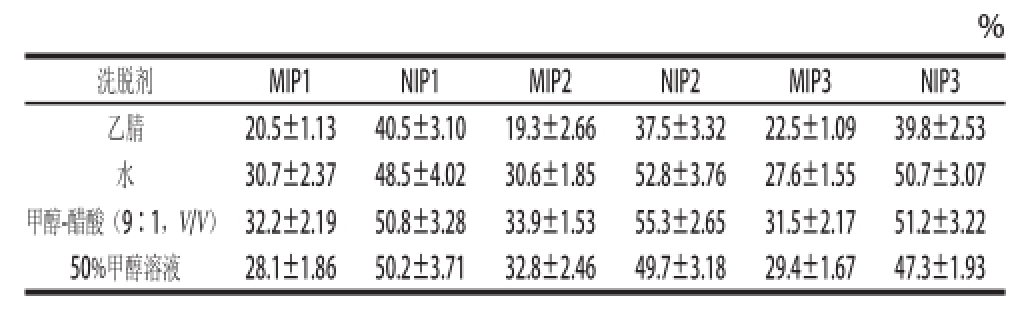
?
将各种聚合物上使用不同洗脱剂解吸后的溶液过滤,滤液减压蒸馏脱除溶剂后,得葛根素粗品。再用少量甲醇分别溶解这些葛根素粗品,用高效液相色谱测定粗品中葛根素含量,测试结果见表3。可以发现,虽然印迹聚合物的静态解吸率低于非印迹聚合物(表2),但从MIPs中萃取出的粗品中葛根素含量明显高于从非印迹聚合物中萃取的粗品。特别是从吸附有葛根素的MIP3上,以水为洗脱剂萃取出的葛根素粗品纯度最高,达(37.4±2.87)%。印迹聚合物解吸产物纯度高,主要是由于目标产物在MIPs柱上能被选择性洗脱,而在非印迹柱上,使用洗脱剂洗脱时不能选择性脱附目标物。通过研究聚合物的吸附与解吸附,发现MIP3作为吸附材料,以水为洗脱剂,吸附和分离葛根粗提液中的葛根素具有较好效果。
表3 不同洗脱剂解吸后葛根素粗品纯度
Table3 Purity of puerarin product obtained by desorption using various effluents
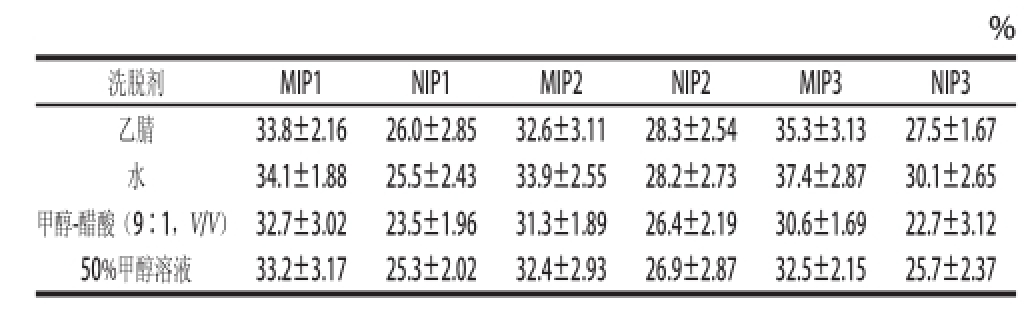
%洗脱剂MIP1NIP1MIP2NIP2MIP3NIP3乙腈33.8±2.1626.0±2.8532.6±3.1128.3±2.5435.3±3.1327.5±1.67水34.1±1.8825.5±2.4333.9±2.5528.2±2.7337.4±2.8730.1±2.65甲醇-醋酸(9∶1,V/V)32.7±3.0223.5±1.9631.3±1.8926.4±2.1930.6±1.6922.7±3.12 50%甲醇溶液33.2±3.1725.3±2.0232.4±2.9326.9±2.8732.5±2.1525.7±2.37
2.3 MIPs固相萃取分离和纯化葛根素
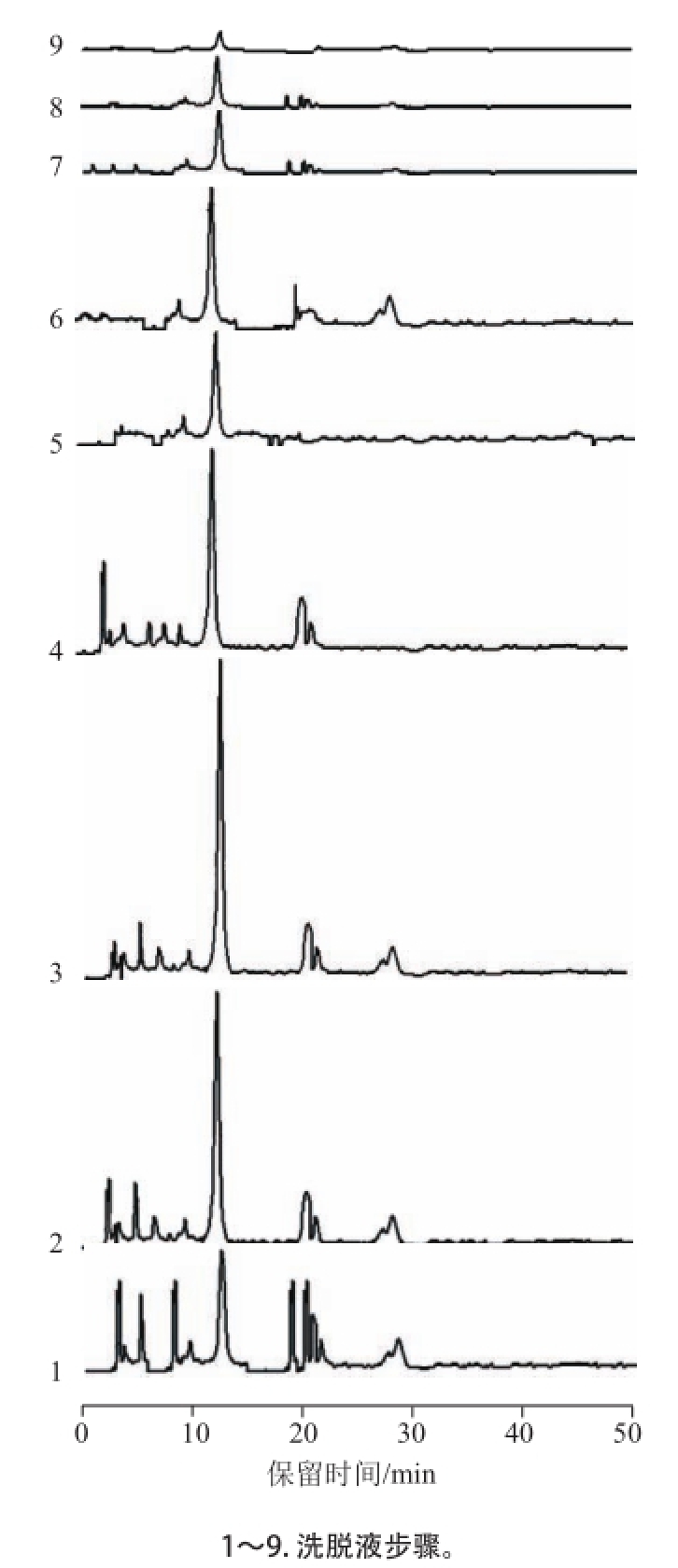
图4 分子印迹固相萃取葛根粗提物各步洗脱液的高效液相色谱
Fig.4 HPLC chromatograms of the fractions collected in each elution step for MIP3 solid phase extraction of crude pueraria extract
以MIP3为固相萃取吸附剂,以水为洗脱剂进行萃取和分离葛根粗提液中的葛根素。为此,在含有0.5 g MIP3聚合物的固相萃取器中,将2.0 mL葛根粗提液上样后,先用2.0 mL乙腈洗脱非选择性吸附,再用9×2.0 mL水为洗脱剂进行洗脱,收集每次的洗脱液。用高效液相色谱分析洗脱液组成。各步洗脱液的色谱图如图4所示。从图4可以发现,在第2、3和4步洗脱液中,葛根素(保留时间为12.7 min)的含量较高,于是,将这3步洗脱液合并,减压浓缩脱除溶剂,再用1 mL甲醇溶解,用0.45 μm的微孔滤膜过滤后,高效液相色谱分析所获产品中葛根素含量。结果如图5所示,可见产品中葛根素含量高于75%,此3步操作所得葛根素的回收率为71.6%。
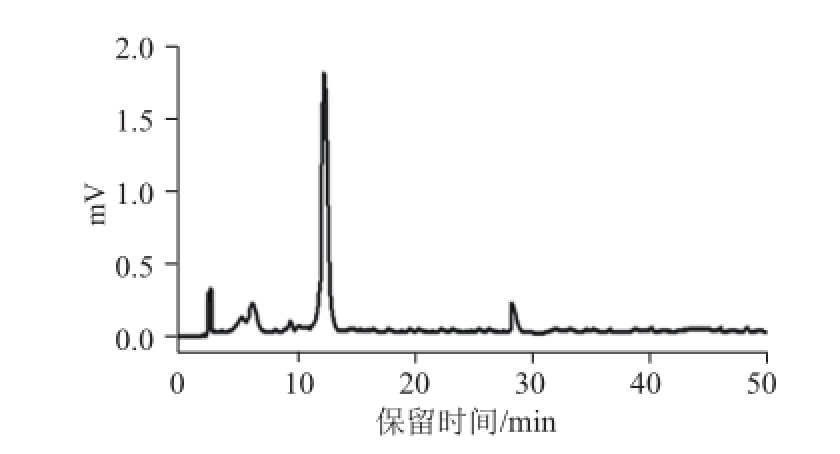
图5 分子印迹固相萃取所获葛根素产品的高效液相色谱
Fig.5 HPLC chromatogram of puerarin product obtained by MIP3 solid phase extraction
MIPs是一种对目标化合物的分子大小、形状及化学基团具有记忆功能的高分子材料。本实验使用不同制备条件获得了几种葛根素印迹及其非印迹聚合物微球,考察了这些聚合物对葛根粗提液中葛根素的吸附和解吸性能,以葛根素含量为指标,优化解吸附溶剂。在优化条件下通过MIP3单次固相萃取葛根粗提液,葛根素回收率达71.6%,产品纯度高于75%。
参考文献:
[1] CACHO C, TURIEL E, MARTIN ESTEBAN A, et al. Characterisation and quality assessment of binding sites on a propazine-imprinted polymer prepared by precipitation polymerisation[J]. Journal of Chromatography B, 2004, 802: 347-353.
[2] TAMAYO F G, CASILLAS J L, MARTIN ESTEBAN A. Evaluation of new selective molecularly imprinted polymers prepared by precipitation polymerisation for the extraction of phenylurea herbicides[J]. Journal of Chromatography A, 2005, 1069: 173-181.
[3] HU Xiaogang, PAN Jialiang, HU Yuling, et al. Preparation and evaluation of solid-phase microextraction fiber based on molecularly imprinted polymers for trace analysis of tetracyclines in complicated samples[J]. Journal of Chromatography A, 2008, 1188: 97-107.
[4] LUO Wei, ZHU Lihua, YU Chen, et al. Synthesis of surface molecularly imprinted silica micro-particles in aqueous solution and the usage for selective off-line solid-phase extraction of 2,4-dinitrophenol from water matrixes[J]. Analytica Chimica Acta, 2008, 618: 147-156.
[5] MASHAALAH Z, PETRAFIEDLER P, MONIKAMODER H. Selective mixed-bed solid phase extraction of atrazine herbicide from environmental water samples using molecularly imprinted polymer[J]. Talanta, 2014, 129: 132-138.
[6] CHEN Ligang, LI Bin. Magnetic molecularly imprinted polymer extraction of chloramphenicol from honey[J]. Food Chemistry, 2013, 141: 23-28.
[7] LI Hui, LI Yuzhuo, LI Zhiping, et al. Preparation and adsorption behavior of berberine hydrochloride imprinted polymers by using silica gel as sacrificed support material[J]. Applied Surface Science, 2012, 258: 4314-4321.
[8] PAOLO L, DELPHINE D, FLORENT A, et al. Molecularly imprinted polymer solid-phase extraction for detection of zearalenone in cereal sample extracts[J]. Analytica Chimica Acta, 2010, 672(1/2): 15-19.
[9] GREENE N T, MORGAN S L, SHIMIZU K D, et al. Molecularly imprinted polymer sensor arrays[J]. Chemical Communications, 2004, 10: 1172-1173.
[10] LI Hui, LIU Yingju, ZHANG Zhaohui, et al. Separation and purification of chlorogenic acid by molecularly imprinted polymer monolithic stationary phase[J]. Journal of Chromatography A, 2005, 1098(1/2): 66-74.
[11] 顾志平. 中药葛根资源的调查研究[J]. 中药材, 1993, 10(8): 13-14.
[12] 马文红, 龚军英, 闫享福, 等. 葛根素的现代应用概况综述[J]. 求医问药, 2011, 9(10): 349-354.
[13] 宋卉, 李银花, 郑晖, 等. 葛根素的药理研究与临床作用进展[J]. 现代医药卫生, 2011, 27(19): 2936-2937.
[14] 李佳, 江培. 葛根素的研究进展[J]. 黑龙江医药, 2014(1): 51-56.
[15] 徐刚, 何照范. 利用大孔吸附树脂分离纯化葛根素[J]. 山地农业生物学报, 2005, 24(1): 63-66.
[16] 贺湘凌, 谭天伟. 利用β-环糊精键合固定相分离纯化葛根素[J]. 色谱, 2003, 21(6): 610-613.
[17] 刘廷岳, 聂素双, 彭露婷, 等. 离子交换纤维对葛根素静态吸附和解吸作用的考察[J]. 沈阳药科大学学报, 2008, 25(2): 148-152.
[18] 蔡鹰, 陆晓和, 魏群利. 聚酰胺柱层析法分离回心草总黄铜的研究[J].药学实践杂志, 2009, 27(1): 58-60.
[19] 贺云, 张尊听, 刘谦光, 等. Fe 3+络合萃取法从野葛中分离葛根素[J].天然产物研究与开发, 2002, 14(5): 21-23.
[20] 孙术国, 麻成金, 黄群, 等. 高速剪切与微波辅助偶联提取鲜葛中葛根素[J]. 食品科学, 2009, 30(22): 50-53.
[21] 周红英, 王建华, 闫凤云. RP-HPLC分离测定甘葛藤茎叶中葛根素、大豆苷和大豆苷元的含量[J]. 中国中药杂志, 2007(10): 248-253.
[22] 潘娓婕, 刘谦光. 酸水解法从葛根中提取分离葛根素和大豆苷元[J].天然产物研究与开发, 2000, 12(6): 66-70.
[23] 吴向阳, 仰玲玲, 仰榴青, 等. RP-HPLC法同时测定野葛的根、茎和叶中葛根素、大豆苷和大豆苷元的含量[J]. 食品科学, 2009, 30(14): 248-252.
[24] 陈立娜, 都述虎, 马坤芳, 等. 分子印记技术在葛根素分离中的应用及溶剂对聚合物识别能力的影[J]. 林产化学与工业, 2008, 28(3): 18-22.
[25] 王琳, 谭学才, 龚琦, 等. 葛根素分子印迹电化学传感器的制备及研究[J]. 分析试验室, 2012, 31(6): 16-19.
[26] 程绍玲, 杨迎花. 利用分子印迹技术分离葛根异黄酮[J]. 中成药, 2006, 28(10): 1484-1488.
[27] 胡双修, 李于善, 杨光明. 高效液相色谱与化学发光分析联用检测葛根素[J]. 时珍国医国药, 2010, 21(5): 1156-1157.
Preparation of Puerarin-Imprinted Polymer Microspheres by Precipitation Polymerization Technique for Use in Solid Phase Extraction of Flavonoids from Pueraria Root Powder
XU Miaomiao
1, WANG Susu
1, LI Hui
1,2,*, HUANG Yulin
1, LU Cuimei
1, JIANG Jianbo
1
(1. College of Chemistry and Chemical Engineering, Jishou University, Jishou 416000, China; 2. Key Laboratory of Plant Resource Conservation and Utilization, Jishou University, Jishou 416000, China)
Abstract:Puerarin-imprinted polymer microspheres (MIPM) were prepared by precipitation polymerization technique using puerarin, methacrylic acid (MAA) and ethylene glycol dimethylacrylate (EGDMA) as the template, functional monomer and cross-linker, respectively. Scanning electron microscope (SEM) was used for evaluating the morphology of polymer and a static method was used for characterizing the adsorption behavior. The application of the MIPM for adsorption, desorption and solid phase extraction of puerarin from crude pueraria root extract was explored. Results indicated that the adsorption capacity for the optimized MIPM (MIP3) toward the pure template reached 37.9 mg/g, with an adsorption percentage of (96.3 ± 1.81)% toward the target compound in the crude extract. The desorption percentage varied within the range of 27%-34% when water, methanol-acetic acid (9:1, V/V) and 50% aqueous methanol were used as the eluents, respectively. Furthermore, the product desorbed from the MIP3 using water as the eluent contained the highest content of puerarin (37.4 ± 2.87)%. Puerarin product with 75% purity can be obtained by MIP3 using single-step solid phase extraction with a puerarin recovery of 71.6%.
Key words:molecularly imprinted polymer; puerarin; precipitation polymerization; adsorption; solid phase extraction
中图分类号:TS202.3
文献标志码:A
文章编号:
doi:10.7506/spkx1002-6630-201510003
收稿日期:2014-09-20
基金项目:国家自然科学基金面上项目(21077042);湖南省科技厅计划项目(2012SK3145)
作者简介:许苗苗(1987—),女,硕士研究生,研究方向为植物化学成分分离分析。E-mail:xumiaomiao2011@126.com
*通信作者:李辉(1968—),男,教授,博士,研究方向为生命科学中的分离分析新方法。E-mail:lihuijsdx@163.com