杨 喆,万 山,张乔会,宁亚萍,董施彬,王建中 *
(北京林业大学 林业食品加工与安全北京市重点实验室,北京 100083)
摘 要:以山杏核壳为原料,采用大孔树脂纯化山杏核壳提取液中的总黄酮,利用单因素试验和正交试验优化D101大孔树脂纯化山杏核壳总黄酮的工艺条件。结果表明:在上样溶液质量浓度0.3 mg/mL、pH 2、流速2 mL/min的条件下进行纯化实验,大孔树脂对山杏核壳总黄酮的平均吸附率为75.20%。山杏核壳总黄酮的质量分数可达51.63%,表明D101大孔树脂对山杏核壳总黄酮有较好的纯化效果,且工艺重复性和稳定性良好。
关键词:山杏核壳;总黄酮;大孔树脂;纯化
山杏(Prunus armeniaca)属蔷薇目、蔷薇科、杏属植物,是亚洲特有的生态经济性树种,主要分布在我国黑龙江、吉林、辽宁、内蒙古、甘肃、河北、山西等地,资源蕴藏量大 [1-2]。山杏核壳约占杏核质量的60%,据统计,我国每年山杏产量达250万 t,加工过程约产生山杏核壳150万 t [3-6]。这些核壳在加工利用过程中作为废料被大量丢弃,造成极大的资源浪费。总黄酮化合物在植物中分布广泛,是植物的次级代谢产物。研究 [7-8]表明,黄酮类化合物是一类具有生物活性的物质,在延缓衰老、防治心脑血管疾病等方面具有积极作用,广泛应用于医药、食品等领域。目前对山杏核壳的利用研究主要是黑色素提取 [9]、活性炭制备 [10]及其总黄酮提取工艺 [11]方面的报道,还未见采用大孔树脂对其黄酮类物质纯化的报道。大孔树脂是20世纪70年代逐渐发展起来的一类具有多孔结构的有机高分子聚合物吸附剂 [12-14]。大孔树脂具有性质稳定、吸附容量大、选择性好、吸附速度快等优点,因而被广泛应用于天然产物的纯化 [15]。本实验选取4 种不同类型的大孔树脂,通过静态吸附与解吸筛选出相对较优的大孔树脂,通过单因素试验和正交试验优化山杏核壳总黄酮的纯化工艺条件,实验结果能为山杏核壳资源综合利用提供依据。
1.1 材料与试剂
山杏核壳购自北京延庆。
芦丁标准品 国药集团化学试剂有限公司;大孔树脂D101、AB-8、D001、HPD400 科百奥生物技术有限公司;无水乙醇、盐酸、亚硝酸钠、氢氧化钠、硝酸铝均为分析纯。
1.2 仪器与设备
FA2004电子天平 上海上平仪器有限公司;TD5A台式低速离心机 湖南赫西仪器装备有限公司;DZF真空干燥箱 上海龙跃仪器设备有限公司;SHZ-Ⅲ循环水式多用真空泵 上海知信实验仪器技术有限公司;R-210旋转蒸发仪 上海申顺生物科技有限公司;SHA-BA水浴恒温振荡器 金坛市荣华仪器制造有限公司;T6新世纪型紫外分光光度计 北京普析通用仪器有限责任公司;BS-100A自动部分收集器 上海沪西分析仪器厂有限公司。
1.3 方法
1.3.1 山杏核壳提取液的制备
将山杏核壳用粉碎机粉碎,过60 目筛,制成山杏核壳粉。称取一定量山杏核壳粉末,按液料比12∶1(mL/g)加入60%乙醇溶液,用闪式提取器闪提4 min,多次提取合并滤液,将所得滤液经旋转蒸发仪减压蒸馏浓缩后,采用真空干燥箱干燥,再将干品用蒸馏水溶解,备用。
1.3.2 标准曲线的制作
按参考文献:[16],芦丁标准品10 mg,用70%乙醇溶液溶解,定容至50 mL,摇匀,得到质量浓度为0.2 mg/mL的芦丁标准品溶液。采用亚硝酸钠-硝酸铝-氢氧化钠显色法,通过紫外分光光度计在509 nm波长处测定上述样品的吸光度,以各样品中芦丁质量浓度(ρ,mg/mL)为横坐标,以芦丁标准溶液吸光度A为纵坐标,绘制标准曲线。经线性回归的回归方程和相关系数为: ρ = 12.393A-0.031 3,R 2= 0.999 2。
1.3.3 山杏核壳提取液总黄酮质量浓度测定
取1 mL山杏核壳提取液于25 mL容量瓶中,以制备标准曲线的方法,即亚硝酸钠-硝酸铝-氢氧化钠显色法显色,采用紫外分光光度计在509 nm波长处测定吸光度,并利用回归方程计算提取液中总黄酮质量浓度,并按公式(1)计算山杏核壳提取液总黄酮含量。
式中:ρ为提取液中总黄酮质量浓度/(mg/mL);n为提取液的稀释倍数。
1.3.4 大孔树脂的预处理
按参考文献[17-18],将D101、HPD400、D001、AB-8 4 种大孔树脂用无水乙醇进行洗涤,并不断搅拌,以除去气泡,静置24 h,充分溶胀。以乙醇湿法装柱,用93%乙醇溶液在柱上流动淋洗,后用蒸馏水冲洗树脂至无醇味。再分用2% NaOH溶液和5%盐酸溶液洗涤,最后用蒸馏水洗至中性,备用。
1.3.5 大孔树脂的筛选
按参考文献[19-22],通过静态吸附与解吸及静态吸附动力学实验,对大孔树脂进行筛选。
1.3.5.1 不同大孔树脂对山杏核壳黄酮的静态吸附与解吸
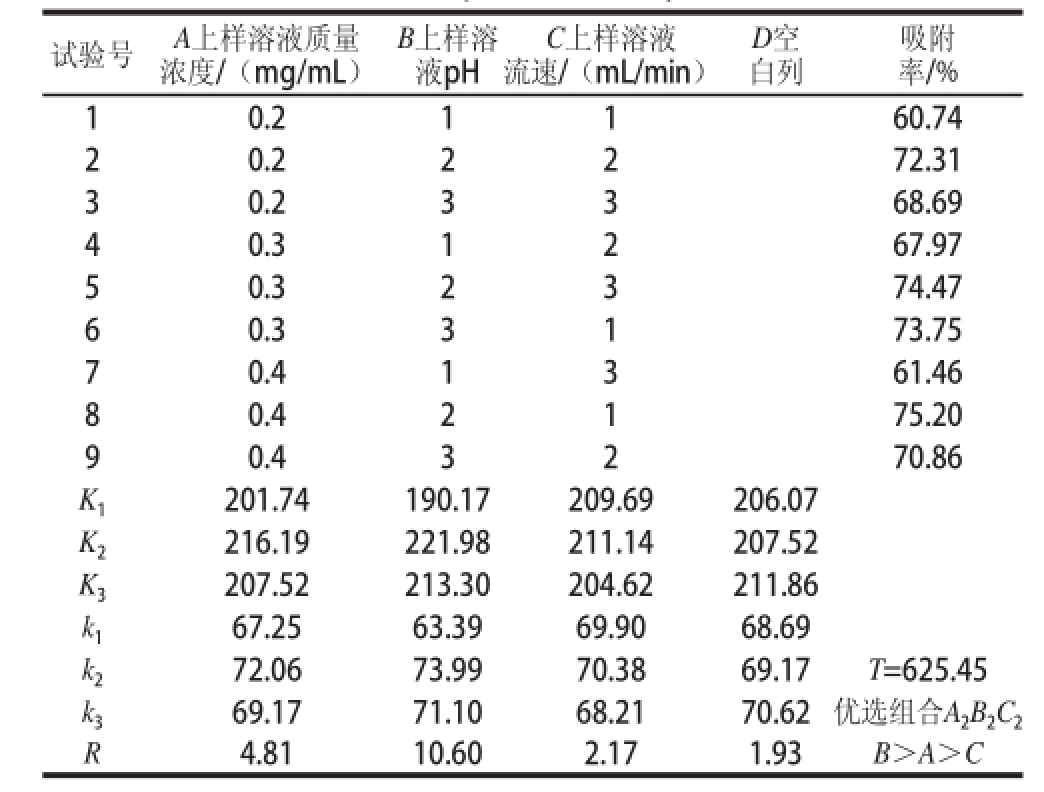
精密称取4 种预处理过的大孔树脂1.5 g分别置于50 mL锥形瓶中,准确加入已知黄酮质量浓度样品溶液30 mL,于30 ℃恒温水浴振荡2 h,取出后静置24 h,使4 种大孔树脂达到饱和吸附,吸取上层清液测定黄酮质量浓度。充分洗涤后过滤得到上述达到饱和吸附的4 种大孔树脂,分别加入95%乙醇溶液30 mL进行解吸,每隔10 min振荡20 s,持续2 h,吸取上层清液测定黄酮质量浓度,按照式(2)~(4)分别计算4种大孔树脂对山杏核壳总黄酮的吸附量、吸附率及解吸率。
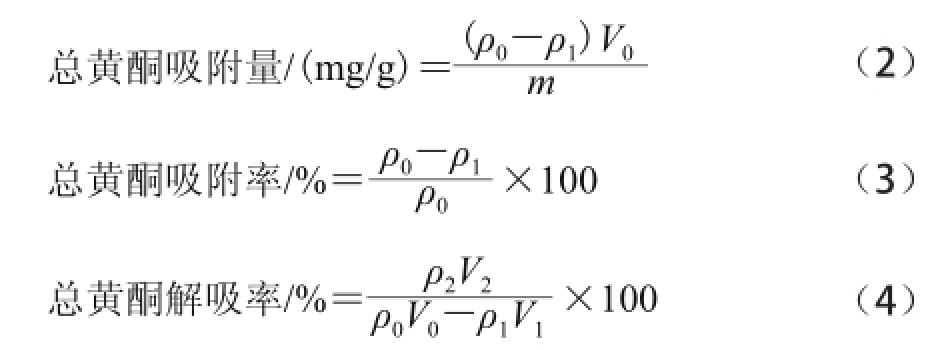
式(2)~(4)中:ρ 0为上样溶液初始黄酮质量浓度/(mg/mL);V 0上样溶液体积/mL;ρ 1为过柱液和水洗液中黄酮质量浓度/(mg/mL);V 1为过柱液和水洗液总体积/mL;ρ 2为洗脱液中黄酮质量浓度/(mg/mL);V 2为洗脱液体积/mL;m为大孔树脂质量/g。
1.3.5.2 大孔树脂静态吸附动力学特征
吸附动力学特征反映随时间的延长大孔树脂对样品分子吸附量的变化趋势。由于大孔树脂的吸附动力学特征与生产率密切相关,因此取吸附和解吸效果相对较优的D101、HPD400、AB-8 3 种大孔树脂进行动力学特性测定。精密称取3 种大孔树脂2 g,置于50 mL锥形瓶中,准确加入已知总黄酮质量浓度的样品溶液30 mL,于30 ℃恒温水浴振荡吸附,后静置24 h,使其达到饱和吸附,期间每隔一定时间吸取上层清液测定总黄酮质量浓度,计算其吸附量,以大孔树脂的吸附量为纵坐标,时间为横坐标,绘制3 种大孔树脂静态吸附动力学曲线。
1.3.6 大孔树脂动态吸附单因素试验及正交试验
按参考文献[23-25],以上样溶液质量浓度、pH值、流速3 个因素为研究对象,以大孔树脂对山杏核壳黄酮类化合物的吸附率为指标,进行单因素试验,并通过正交试验选取最优条件。通过公式(5)计算大孔树脂动态吸附率:
式中:ρ 0为上样溶液黄酮质量浓度/(mg/mL);V 0上样溶液体积/mL;ρ 1为过柱液和水洗液中黄酮质量浓度/(mg/mL);V 1为过柱液和水洗液总体积/mL。
1.3.7 样品中总黄酮含量的计算
准确称取一定质量干样品,用溶剂溶解成样品溶液,利用紫外分光光度计测其吸光度,并通过1.3.2节中回归方程得到总黄酮质量浓度,通过公式(6)计算样品质量分数计算:
式中:ρ为分光光度计测定样品的总黄酮质量浓度/(mg/mL);n为样品溶液稀释倍数;V为样品溶液体积/mL;m为干样品质量/mg。
2.1 大孔树脂的选择
取一定量D101、AB-8、HPD400、D001 4 种大孔树脂,按1.3.5节方法进行静态吸附和解吸实验,考察4 种大孔树脂对总黄酮的吸附与解吸性能,结果如表1所示。
表1 4种大孔树脂对样品中总黄酮的静态吸附与解吸结果
Table1 Adsorption and desorption rates of four types of macroporous resins for total flavonoids

树脂类型吸附量/(mg/g)吸附率/%解吸量/(mg/g)解吸率/% AB-85.23±0.1957.42±0.744.82±0.1690.26±1.33 D1015.86±0.2263.01±0.925.44±0.2592.83±1.04 HPD4004.48±0.1552.47±1.033.92±0.1387.50±1.16 D0011.62±0.1117.42±0.381.38±0.1485.19±1.09
从表1可以看出,D101、AB-8、HPD400 3 种大孔树脂对样品吸附量和吸附率均较高,说明这3 种大孔树脂对样品有较好的吸附作用,均适合用来纯化样品,而D001大孔树脂对样品吸附量和吸附率均非常低,说明其对样品吸附作用不好,不适合用来纯化样品,因此只选取D101、AB-8、HPD400 3 种大孔树脂进行静态吸附动力学实验。
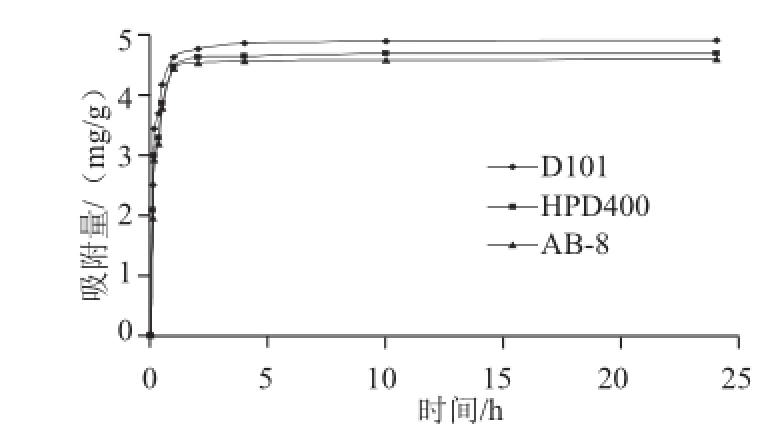
图1 D101、AB-8、HPD400大孔树脂静态吸附动力学曲线
Fig.1 Static adsorption curve of D101 macroreticular resin
如图1所示,3 种大孔树脂对山杏核壳黄酮类物质的吸附均为快速平衡型,静态吸附2 h后基本达到吸附平衡,之后无明显变化。综合比较静态吸附、解吸实验与静态吸附动力学实验结果,D101大孔树脂对山杏核壳总黄酮吸附率和解吸率均比其他树脂高,且具有良好的静态吸附动力学特征,因此最终选取D101大孔树脂对山杏核壳总黄酮进行纯化,并进行动态吸附的研究。
2.2 动态吸附实验结果
大孔树脂实际纯化过程是一个动态过程,因此不能完全通过静态吸附、解吸过程来直接分析大孔树脂对样品的吸附、解吸能力和结果,有必要进行动态吸附、解吸实验。对通过上述实验筛选出来的D101大孔树脂进行湿法装柱,柱床体积为20 mL,分别就影响吸附、解吸的各个因素进行动态实验,并分析实验结果,选择最优纯化工艺。
2.2.1 上样溶液质量浓度的选择
为了考察上样溶液质量浓度对动态吸附的影响,分别配制黄酮质量浓度为0.1、0.2、0.3、0.4、0.5 mg/mL的上样溶液,各取50 mL,在pH 5的条件下上样,控制流速为3 mL/min,结果见图2。结果表明,随着上样溶液质量浓度的增大,D101大孔树脂对山杏核壳总黄酮的动态吸附率逐渐上升,当质量浓度达到0.3 mg/mL时,吸附率最大,随后吸附率下降,这可能是由于上样溶液质量浓度过大,杂质过多造成层析柱滤膜及大孔树脂表面的堵塞,从而影响吸附效果。因此,选择上样溶液质量浓度为0.3 mg/mL。

图2 上样溶液质量浓度对吸附的影响
Fig.2 Effects of sample concentration on adsorption efficiency
2.2.2 上样溶液pH值的选择
为了考察上样溶液pH值对动态吸附的影响,取50 mL黄酮质量浓度为0.3 mg/mL的上样溶液,分别在pH值为1、2、3、4、5的条件下上柱,控制流速为3 mL/min,结果见图3。结果表明,随着上样溶液pH值的增大,D101大孔树脂对山杏核壳总黄酮的动态吸附率上升,在pH 2时达最大值,随后不断减小。这是因为大部分黄酮类化合物为多羟基酚类,呈弱酸性,溶质在酸性条件下溶解度降低,从而有利于大孔树脂的吸附。当pH 1的时候吸附率又明显下降,这可能是由于酸性过强会有沉淀析出,从而影响吸附,导致吸附率明显下降。因此,选择上样溶液pH值为2。

图3 上样溶液pH值对吸附的影响
Fig.3 Effects of pH for sample loading on adsorption efficiency
2.2.3 上样溶液流速的选择
为了考察上样溶液流速对动态吸附的影响,取50 mL黄酮质量浓度为0.3 mg/mL的上样溶液,在pH 2的条件下上柱,控制流速分别为1、2、3、4、5 mL/min,结果见图4。结果表明,随着上样溶液流速的增大,D101大孔树脂对山杏核壳总黄酮的动态吸附率逐渐下降,这是因为上样溶液的流速越小与大孔树脂接触就更充分,能够充分地被吸附在其表面,而流速越大,其泄漏量就随之增大,从而影响吸附率。在上样溶液流速分别为1 mL/min和2 mL/min时,大孔树脂对样品中总黄酮的吸附率相差很小,但过柱速度却相差一倍,因此,综合考虑吸附率与过柱速度,选择上样溶液流速为2 mL/min。
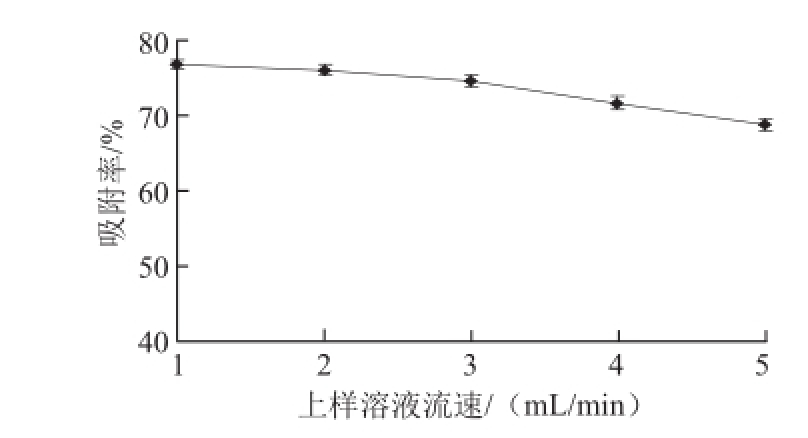
图4 上样溶液流速对吸附的影响
Fig.4 Effects of flow rate for sample loading on adsorption efficiency
2.2.4 正交试验结果
根据单因素试验结果,选取上样溶液质量浓度0.3 mg/mL、pH 2、流速2 mL/min 3 个因素,设计正交试验因素水平,设计正交试验表,并进行方差分析。正交试验设计及结果见表2。
表2 正交试验设计及结果
Table2 Orthogonal array design with experimental values of adsorption efficiency
试验号A上样溶液质量浓度/(mg/mL)吸附率/% 1 0.21160.74 2 0.22272.31 3 0.23368.69 4 0.31267.97 5 0.32374.47 6 0.33173.75 7 0.41361.46 8 0.42175.20 9 0.43270.86 K 1201.74190.17209.69206.07 K 2216.19221.98211.14207.52 K 3207.52213.30204.62211.86 k 167.2563.3969.9068.69 k 272.0673.9970.3869.17T=625.45 k 369.1771.1068.2170.62优选组合A 2B 2C 2R 4.8110.602.171.93B>A>C B上样溶液pH C上样溶液流速/(mL/min)D空白列
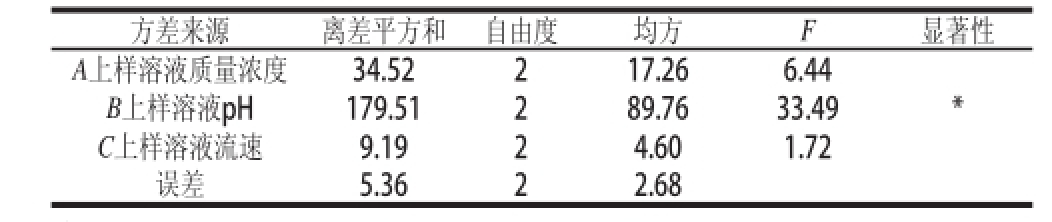
根据表2试验数据,进行显著性检验,列出方差分析表,结果见表3。
表2直观分析和表3方差分析结果表明,影响D101大孔树脂对山杏核壳总黄酮吸附能力的各个因素影响力大小为B>A>C,上样液的pH值对吸附效果影响显著(P<0.05),上样液的质量浓度和流速对吸附效果影响不显著。结果显示,D101大孔树脂吸附山杏核壳总黄酮的最优工艺条件为A 2B 2C 2,即上样液黄酮质量浓度0.3 mg/mL、pH 2、控制流速2 mL/min。
表3 正交试验方差分析表
Table3 Analysis of variance of orthogonal array experiments
注:F 0.05(2,2)=19.0;F 0.01(2,2)=99.0。
方差来源离差平方和自由度均方F显著性A上样溶液质量浓度34.52217.266.44 B上样溶液pH179.51289.7633.49* C上样溶液流速9.1924.601.72误差5.3622.68
2.2.5 最优吸附工艺的验证
正交试验优化得到D101大孔树脂吸附山杏核壳总黄酮的最优工艺条件A 2B 2C 2,在上述实验条件下进行组合验证实验,平行实验3 次取平均值,得到总黄酮吸附率平均值为75.20%,大于或等于正交试验中各条件下的结果,相对标准偏差为2.55%,该工艺条件可靠。
2.3 大孔树脂重复利用检验
一般情况大孔树脂在多次使用后,由于不可逆吸附了一些杂质而导致吸附能力降低,图5为D101大孔树脂重复多次使用后的吸附能力检验情况。
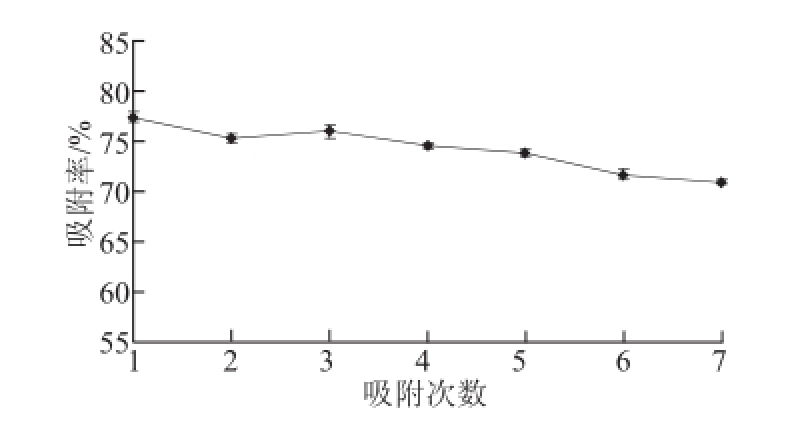
图5 D101大孔树脂的重复使用性能
Fig.5 Reusability of D101 macroreticular resin
图5结果表明,大孔吸附树脂在经过7 次重复使用后,吸附能力稍有降低,但变化并不明显,运用SPSS分析,通过方差齐性检验和方差分析得到,随着吸附次数的增加,吸附率变化不显著,说明D101大孔树脂适合该工艺下的山杏核壳总黄酮的重复纯化。
2.4 纯化前后样品总黄酮含量对比
分别准确称取一定量纯化前与纯化后干品,用60%乙醇溶液溶解,利用紫外分光光度计分别测其总黄酮含量,结果显示,纯化前样品中山杏核壳总黄酮质量分数为36.20%,经大孔树脂纯化后的样品中山杏核壳总黄酮质量分数为51.63%。说明上述纯化工艺效果明显,具有实际应用性。
本实验采用大孔树脂对山杏核壳提取物中的总黄酮进行纯化。通过静态吸附、解吸以及动力学特征分析,选择D101大孔树脂作为理想树脂,对山杏核壳总黄酮进行纯化。通过动态吸附,得到最优纯化工艺条件为:上样液质量浓度0.3 mg/mL、pH 2、控制流速2 mL/min。在此条件下,大孔树脂对山杏核壳总黄酮的平均吸附率为75.20%。
经验证实验表明,本纯化工艺稳定可靠,此条件下大孔树脂纯化后的山杏核壳总黄酮质量分数为51.63%,相比于纯化前质量分数36.20%有较大提高,说明用D101大孔树脂对纯化山杏核壳总黄酮的方法是可行且有效的。D101大孔树脂经过多次重复吸附,效果依然良好,重复利用性好,适合工业化生产。
参考文献:
[1] 杨庆仙. 我国山杏种质资源研究现状[J]. 北方园艺, 2008(2): 44-47.
[2] 崔洁, 顾欣, 黄昆, 等. 山杏果肉可溶性膳食纤维的抗氧化活性与红外光谱分析[J]. 食品与发酵工业, 2012, 38(1): 123-127.
[3] 李明, 赵忠, 杨吉安. 黄土高原山杏种质资源分类研究[J]. 西北林学院学报, 2011, 26(1): 8-12.
[4] 佟汉林. 山杏的经济价值及良种造林关键技术[J]. 现代园艺, 2014(2): 31-31.
[5] 张加延, 张钊. 中国果树志·杏卷[M]. 北京: 中国林业出版社, 2003.
[6] 王利兵. 山杏开发与利用研究进展[J]. 浙江林业科技, 2008, 28(6): 76-80.
[7] ERCISLI S. Chemical composition of fruits in some rose (Rosa spp.) species[J]. Food Chemistry, 2007, 104(4): 1379-1384.
[8] CHUNG H S, CHANG L C, LEE S K, et al. Flavonoid constituents of Chorizanthe diffusa with potential cancer chemopreventive activity[J]. Journal of Agricultural and Food Chemistry, 1999, 47(1): 36-41.
[9] 齐高强, 赵忠, 马希汉, 等. 山杏壳制备活性炭的最佳工艺研究[J].林业实用技术, 2013(4): 49-52.
[10] 李军, 张乔会, 蓝晶晶, 等. 响应面法对山杏核壳黑色素提取工艺的研究[J]. 食品工业科技, 2012, 33(2): 295-299.
[11] 杨喆, 万山, 张乔会, 等. 响应面法优化山杏核壳总黄酮提取工艺及其抗氧化性研究[J]. 食品工业科技, 2015, 36(6): 279-284.
[12] 周桃英, 罗登宏, 李国庆, 等. AB-8 大孔树脂纯化荷叶总黄酮的工艺研究[J]. 中国食品添加剂, 2009(5): 113-119.
[13] 马荣锴. 大孔树脂纯化菥蓂水提物黄酮的研究[D]. 南宁: 广西大学, 2012.
[14] SANNOMIYA M, RODRIGUES C M, COELHO R G, et al. Application of preparative high-speed counter-current chromatography for the separation of flavonoids from the leaves of Byrsonima crassa Niedenzu (IK)[J]. Journal of Chromatography A, 2004, 1035(1): 47-51.
[15] IGNAT I, VOLF I, POPA V I. A critical review of methods for characterisation of polyphenolic compounds in fruits and vegetables[J]. Food Chemistry, 2011, 126(4): 1821-1835.
[16] 田建平, 李娟玲, 胡远艳, 等. 冬青属苦丁茶叶总黄酮含量测定与资源评价[J]. 食品科技, 2014, 39(1): 278-281.
[17] 李春美, 钟朝辉, 窦宏亮, 等. 大孔树脂分离纯化柚皮黄酮的研究[J].农业工程学报, 2006, 22(3): 153-157.
[18] 高梓淳. 蓝莓花色苷提取与纯化工艺初探[D]. 杭州: 浙江大学, 2014.
[19] 马伟雄, 郭育晖, 吕涛, 等. AB-8大孔吸附树脂纯化苦槛蓝黄酮的工艺研究[J]. 广东农业科学, 2014, 41(7): 97-100.
[20] 李颖畅, 孟宪军, 李小红. 大孔树脂纯化蓝莓叶总黄酮的工艺研究[J].食品与发酵工业, 2008, 34(1): 133-137.
[21] MOURA S C S R, ROCHA TAVARES P E, GERMER S P M, et al. Degradation kinetics of anthocyanin of traditional and low-sugar blackberry jam[J]. Food and Bioprocess Technology, 2012, 5(6): 2488-2496.
[22] CAO Shaoqian, LIU Liang, LU Qi, et al. Integrated effects of ascorbic acid, flavonoids and sugars on thermal degradation of anthocyanins in blood orange juice[J]. European Food Research and Technology, 2009, 228(6): 975-983.
[23] 李淑珍, 李进, 杨志江, 等. 大孔树脂分离纯化黑果枸杞总黄酮的研究[J]. 食品科学, 2009, 30(1): 19-24.
[24] 李明瑾, 林松毅, 王二雷. 笃斯越橘花青素的分离纯化研究[J]. 食品科学, 2007, 28(11): 139-141.
[25] LIU W, ZHANG S, ZU Y G, et al. Preliminary enrichment and separation of genistein and apigenin from extracts of pigeon pea roots by macroporous resins[J]. Bioresource Technology, 2010, 101(12): 4667-4675.
Purification of Total Flavonoids from Shells of Wild Apricot with Macroreticular Resin
YANG Zhe, WAN Shan, ZHANG Qiaohui, NING Yaping, DONG Shibin, WANG Jianzhong
*
(Beijing Key Laboratory of Forest Food Processing and Safety, Beijing Forestry University, Beijing 100083, China)
Abstract:The purification of total flavonoids extracted from the shells of wild apricot using D101 macroreticular resin was optimized using combination of single factor and orthogonal array experiments. The results showed that the optimum purification conditions were determined as follows: sample concentration, 0.3 mg/mL; pH 2; flow rate for elution, 2 mL/min. With these parameters, the purity of total flavonoids was 51.63%. Therefore, D101 macroreticular resin was effective in purifying total flavonoids from the shells of wild apricot with good stability and repetition.
Key words:shells of wild apricot; total flavonoids; macroreticular resin; purification
中图分类号:TS201.1
文献标志码:A
文章编号:
doi:10.7506/spkx1002-6630-201510008
收稿日期:2014-10-14
基金项目:林业公益性行业科研专项(201004081)
作者简介:杨喆(1990—),男,硕士研究生,研究方向为天然产物提取。E-mail:yangz0719@163.com
*通信作者:王建中(1951—),男,教授,硕士,研究方向为林产品加工利用。E-mail:w62338221@163.com