表1 正交试验因素水平表
Table1 Factors and levels used in orthogonal array design

因素水平1 2 3 A BSA质量/mg404550 B无水乙醇体积/mL152025 C灵芝三萜质量/mg81012 D 0.25%戊二醛溶液体积/☒L100125150
黄 婷 1,范远景 1,*,孟 静 1,张 帆 1,耿保玉 1,刘培志 2,王明和 2
(1.合肥工业大学生物与食品工程学院,安徽 合肥 230009;2.安徽刘郎食品有限公司,安徽 宣城 242000)
摘 要:研究用牛血清白蛋白(bovine serum albumin,BSA)为载体包裹灵芝三萜制备纳米体的工艺与其分子表征;采用去溶剂化-化学交联法制备灵芝三萜白蛋白纳米体,以白蛋白纳米体包封率为主要评价指标,采用正交试验设计法优化灵芝三萜白蛋白纳米体的配方。结果表明:将BSA 50 mg溶于5 mL去离子水中,取灵芝三萜8 mg溶于25 mL无水乙醇中,水相以400 r/min持续搅拌的同时以1 mL/min的速率滴加灵芝三萜乙醇溶液,加入0.25%的戊二醛溶液125 ☒L,室温条件下固化12 h,减压浓缩除去乙醇,得到的灵芝三萜白蛋白纳米体粒径为(189±11.13)nm,多分散指数为0.227±0.016,Zeta电位为(-31.4±6.74)mV,包封率为(80.10±1.05)%,载药量为(11.36±0.13)%,纳米体溶液于4 ℃放置30 d,稳定性良好。
关键词:灵芝三萜;牛血清白蛋白;纳米体;稳定性
灵芝(Ganoderma lucidum)是一种食药兼用的真菌,被誉为“不朽的蘑菇”,其主要的两大活性成分是三萜和多糖 [1-3]。灵芝三萜类化合物具有广泛的生理活性和药理作用,如:降血脂、降血糖、镇痛、抗炎、保肝护肝、提高免疫力、抗衰老、抑制癌细胞生长、毒杀肿瘤细胞等 [4-11]。但灵芝三萜难溶于水,能溶于氯仿、乙醇、甲醇等有机溶剂,文献 [12]报道灵芝三萜生物利用度低,特别是酸性三萜入血较快,口服灵芝酸A(50 mg/kg),18 min血药浓度就达到最高峰 [13]。为了增强灵芝三萜的溶解度及改善吸收,提高生物利用度,可将灵芝三萜制成白蛋白载药微粒。牛血清白蛋白(bovine serum albumin,BSA)是生命体血浆中含量最丰富的蛋白质,较容易得到纯度高的BSA蛋白样品,白蛋白分子中的氨基酸相互扭曲成团状或蜂窝状,具有大量的空隙,空间结构有利于携带药物 [14]。BSA可以通过物理或化学手段与药物结合,起到重要的贮存和运输的作用,并能使药物在体内缓慢释放 [15-18]。用白蛋白纳米体包封研究的药物主要有阿霉素、紫杉醇等。紫杉醇白蛋白纳米粒的问世避免了以往紫杉醇注射剂因溶解问题带来的一系列副作用,并大大提高了紫杉醇的溶解性。多项研究已证实,其在多种肿瘤的治疗中取得突破性进展 [19-20]。本研究采用去溶剂化-化学交联法制备灵芝三萜白蛋白纳米体,优化其制备工艺,并初步研究了其理化性质。
1.1 材料与试剂
牛血清白蛋白 上海源聚生物科技有限公司;灵芝三萜(纯度80%) 郑州荔诺生物科技有限公司;香草醛、无水乙醇、戊二醛、高氯酸、冰醋酸 国药集团化学试剂有限公司。
1.2 仪器与设备
78-1型加热磁力搅拌器 杭州仪表及电厂;JEM-2100场发射透射电子显微镜 日本电子制造公司;Nano-ZS90 Zeta电位仪 英国Malvern公司;Nicolet5700傅里叶红外光谱仪 美国Thermo公司;紫外-可见分光光度计 上海菁华科技仪器有限公司;R-201旋转蒸发仪 上海胜申生物技术有限公司;TGC-16C台式离心机 上海安亭科学仪器厂。
1.3 方法
1.3.1 灵芝三萜标准曲线的绘制
精确称取灵芝三萜标准样品5 mg,置于25 mL容量瓶中,加无水乙醇定容至刻度。分别吸取标准溶液0.00、0.20、0.30、0.40、0.50、0.60 mL于试管中,在100 ℃水浴上蒸干。然后加入5%香草醛-冰醋酸溶液0.40 mL和高氯酸1.6 mL,迅速混合均匀。再将试管置于70 ℃水浴加热15 min后移入冰水浴中,冷却至室温后,加入8 mL冰醋酸摇匀置于室温。15 min后用分光光度计在545 nm波长条件下测定其吸光度。以灵芝三萜质量(mg)为横坐标,以吸光度为纵坐标绘制标准曲线。
1.3.2 灵芝三萜白蛋白纳米体的制备
取一定量的BSA溶于去离子水中,使其充分溶解。再取处方量灵芝三萜溶于一定量的无水乙醇中。水相以400 r/min持续搅拌的同时以1 mL/min的速率滴加灵芝三萜乙醇溶液,至乳白色胶状液形成。滴加结束以后迅速滴入一定量的0.25%戊二醛溶液,继续搅拌固化12 h。在40 ℃条件下旋转蒸发除去乙醇,剩余胶状液12 000 r/min冷冻离心20 min。除去上清液,沉淀部分用去离子水复溶,并定容至10 mL,即得到负载灵芝三萜的白蛋白纳米体混悬液。
1.3.3 单因素试验
白蛋白纳米体的评价指标有很多,如载药量、包封率、粒径分布、理化稳定性等 [21],其中包封率是衡量白蛋白纳米体的重要指标,故以包封率为评价指标进行处方筛选。以灵芝三萜白蛋白纳米体的制备方法为基础,采用单因素试验系统考察BSA质量(30、40、50、60 mg)、无水乙醇体积(10、15、20、25 mL)、灵芝三萜质量(4、8、10、12 mg)、0.25%戊二醛溶液体积(100、125、150、175 ☒L)这4 个因素对白蛋白纳米体包封率的影响。试验中考察主要因素时其余因素全部选择水平3。
1.3.4 正交设计法优化灵芝三萜白蛋白纳米体配方
在单因素试验的基础上,拟定了L 9(3 4)正交表进行试验,因素水平见表1。
表1 正交试验因素水平表
Table1 Factors and levels used in orthogonal array design

因素水平1 2 3 A BSA质量/mg404550 B无水乙醇体积/mL152025 C灵芝三萜质量/mg81012 D 0.25%戊二醛溶液体积/☒L100125150
1.3.5 灵芝三萜白蛋白纳米体包封率和载药量的测定
取搅拌均匀的纳米体混悬液分装到离心管中,12 000 r/min离心15 min,取上清液0.5 mL置于试管中,在100 ℃水浴上蒸干。然后加入5%香草醛-冰醋酸溶液0.40 mL和高氯酸1.6 mL,迅速混合均匀。再将试管置于70 ℃水浴加热15 min后移入冰水浴中,冷却至室温后,加入8 mL冰醋酸摇匀置于室温。以空白白蛋白纳米体作为对照组,15 min后用分光光度计在545 nm波长条件下测吸光度,并代入标准曲线方程,计算其所对应的灵芝三萜质量作为M 游。按式(1)、(2)计算包封率和载药量。
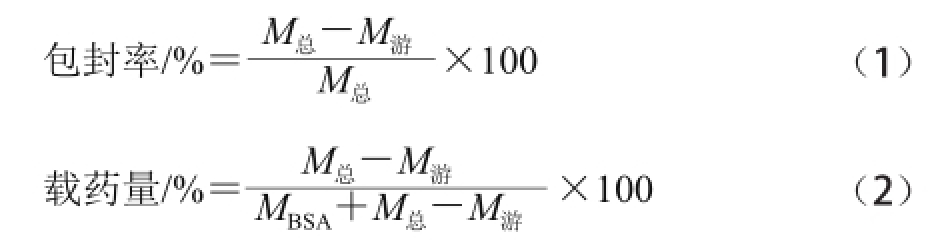
式中:M 总为总的灵芝三萜加入量/mg;M 游为未被包裹的灵芝三萜质量/mg;M BSA为BSA的加入量/mg。
1.3.6 傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FT-IR)分析
分别取干燥的灵芝三萜、空白白蛋白纳米体、灵芝三萜白蛋白纳米体和空白白蛋白纳米体与灵芝三萜混合物各2.0 mg,加入100~200 mg溴化钾晶体,用石英研钵研细,将粉末装入模具内,用压片机压制成片,在4 000~400 cm -1波数范围内扫描得到FT-IR分析。
1.3.7 灵芝三萜白蛋白纳米粒的形态、Zeta电位、粒径及粒径分布测定
1.3.7.1 透射电子显微镜观察纳米体的形态
取灵芝三萜白蛋白纳米体混悬液稀释到适当倍数,取一滴滴在铜网上,自然挥干,干燥后用JEM-2100透射电子显微镜观察并拍摄照片。
1.3.7.2 纳米体电势和粒径测定
取灵芝三萜白蛋白纳米体混悬液稀释到适当倍数,用Zeta电位仪测定纳米体电位、粒径及粒径分布。
1.3.8 灵芝三萜白蛋白纳米体稳定性初步考察
将制备好的纳米体分装到小瓶内,密封,置于冰箱中(4 ℃)。分别于0、10、20、30 d取样,用Zeta电位仪测样品粒径和多分散指数,用测包封率的方法测游离灵芝三萜的量 ,并计算贮存过程中的渗透率。如式(3)所示。
式中:M 0为制备刚完成时游离灵芝三萜的量/mg;M 包封为制备刚完成时被包封灵芝三萜的量/mg;M n为储存n d后游离灵芝三萜的量/mg。
2.1 标准曲线绘制
按1.3.1节的步骤进行实验,根据灵芝三萜的含量(mg)和吸光度的关系,建立线性回归方程: Y= 3.308 6X-0.002 6,R 2为0.999 5,表明灵芝三萜在0~0.12 mg范围内呈良好的线性关系。
2.2 单因素试验结果
固定其他条件,改变BSA质量、无水乙醇体积、灵芝三萜质量、0.25%戊二醛溶液体积,考察其对白蛋白纳米体包封率的影响。
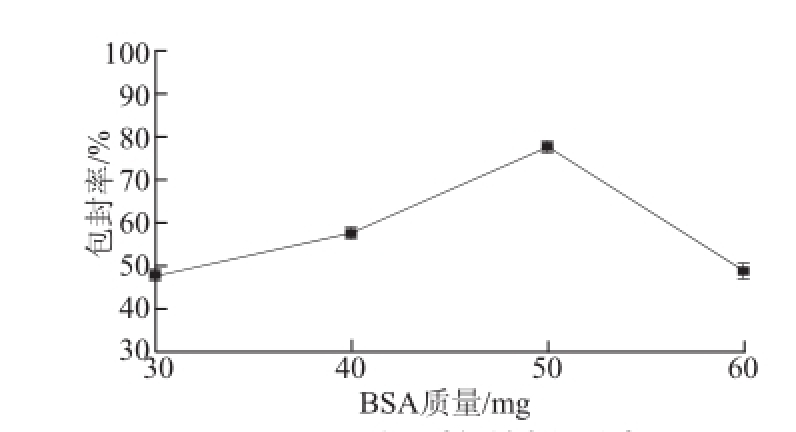
图1 BSA质量对包封率的影响
Fig.1 Effect of BSA concentration on encapsulation efficiency
由图1可见,随着BSA质量的增大,包封率先增大后减小。由此可见在一定范围内增大BSA的用量可使包封的灵芝三萜量随之增大,但是由于交联剂戊二醛的体积一定,所以当BSA的用量增加到50 mg以上时,它不能很好的交联成球,故使包封率下降。
由图2可见,当灵芝三萜质量和水的体积一定时,随着无水乙醇体积增大,包封率先增大而后又减小。说明在一定范围内,灵芝三萜质量浓度越小包封效果越好,之后出现下降的趋势可能是受乙醇和水比例的影响。
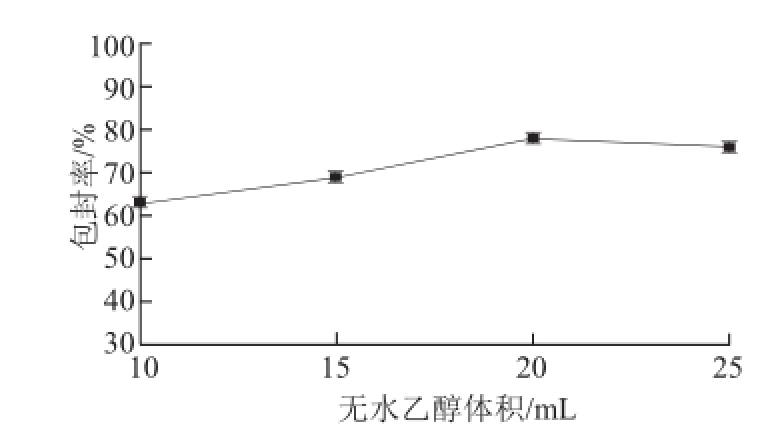
图2 无水乙醇体积对包封率的影响
Fig.2 Effect of absolute ethanol volume on encapsulation efficiency
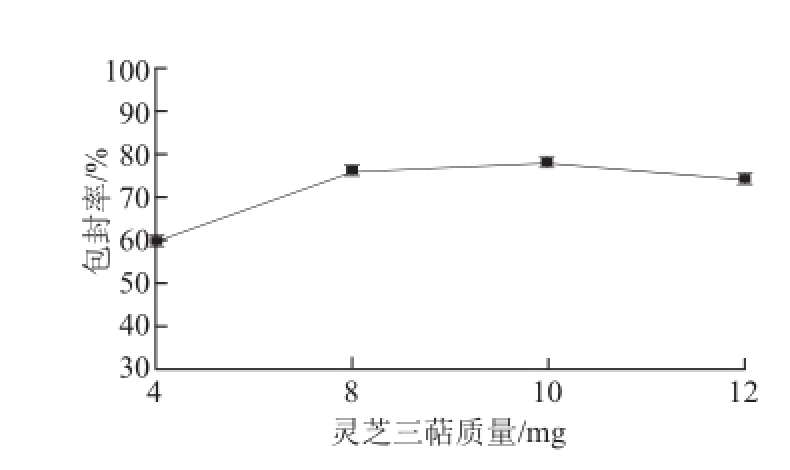
图3 灵芝三萜质量对包封率的影响
Fig.3 Effect of Ganoderma lucidum triterpenoids concentration on encapsulation efficiency
由图3可见,随着灵芝三萜加入量的增加,包封率也随之增加,但当灵芝三萜的加入量增至10 mg,再增加加入量时包封率出现下降,这是由于纳米体对芯材物质的包埋有饱和性,并非芯材物质的加入量越多包封率越大。

图4 0.25%戊二醛溶液体积对包封率的影响
Fig. 4 Effect of volume of 0.25% glutaraldehyde on encapsulation efficiency
由图4可见,在一定范围内戊二醛的使用量增加可使包封率有所增加。戊二醛用量增加使纳米体的内部交联度增高,交联速率加快,从而抑制了药物向油相的扩散,使药物包封率增加。与其他因素相比较,戊二醛的使用量对白蛋白纳米体包封率的影响较小。
2.3 正交试验设计与结果
由表2可见,在本实验所选用的因素和水平条件下,最优组合条件为A 3B 3C 1D 2,各因素对包封率影响的程度为A>C>B>D。即BSA的质量为50 mg溶于5 mL水中,灵芝三萜的加入量8 mg、无水乙醇的体积25 mL、0.25%戊二醛溶液加入体积125 ☒L。可以看出,最优组合在9 次试验中没有出现,其中9 次试验中8号A 3B 2C 1D 3所制备的纳米体的包封率最高。将组合A 3B 3C 1D 2和A 3B 2C 1D 3同时进行验证,结果按组合方案A 3B 3C 1D 2制备的纳米体包封率为(80.10±1.05)%,载药量为(11.36±0.13)%。所以A 3B 3C 1D 2为最优组合方案。
表2 正交试验设计与结果
Table2 Orthogonal array design and results

试验号A BSA质量/mg B无水乙醇体积/mL包封率/% 14015810059.41 2 40201012560.47 340251215058.20 4 45151015066.01 545201210063.66 64525812574.93 7 50151212574.35 85020815078.92 950251010077.40 k 159.36066.59071.08766.823 k 268.20067.68367.96069.917 k 376.89070.17765.40367.710 R17.5303.5875.6843.094 C灵芝三萜质量/mg D 0.25%戊二醛溶液体积/☒L
2.4 FT-IR分析
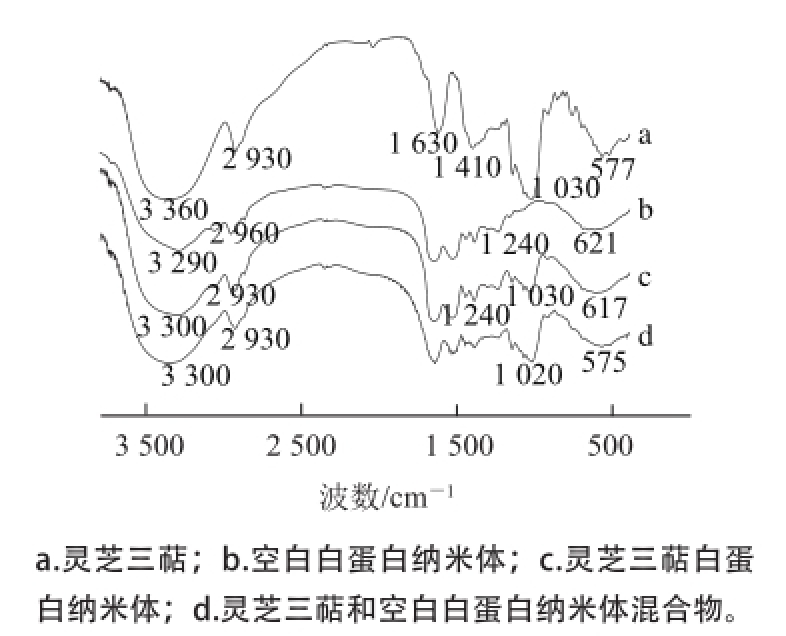
图5 FT-IIRR图
Fig.5 FT-IR profiles of Ganoderma lucidum triterpenoids, blank BSA nanoparticles, Ganoderma lucidum triterpenoids-BSA nanoparticles and physical mixture of Ganoderma lucidum triterpenoids and BSA
FT-IR可以高效快速地测定被分析物中分子的吸收光谱,不同的物质有不同的特征吸收峰,可表征其基本化学结构和组成 [22]。从图5可看出,3 360 cm -1是灵芝三萜中O—H伸缩振动吸收峰,2 930 cm -1为饱和C—H伸缩振动,1 630 cm -1是灵芝三萜的α、β不饱和酮的特征吸收峰,1 410 cm -1为—CH 2—的变角振动,1 030 cm -1为C—O伸缩振动。从谱图中可以看出,灵芝三萜在1 030 cm -1有明显的C—O峰,而空白白蛋白纳米体在1 030 cm -1处无此峰,空白白蛋白纳米体在1 240 cm -1处有C—N峰,灵芝三萜白蛋白纳米体的红外图谱中均出现灵芝三萜和空白白蛋白纳米体的特征峰,说明白蛋白纳米体中有灵芝三萜;灵芝三萜白蛋白纳米体在1 240 cm -1处有明显的C—N峰,而灵芝三萜与空白白蛋白纳米体的混合物在此处峰不明显,由此推断灵芝三萜白蛋白纳米体的表面主要为蛋白分子,说明灵芝三萜被白蛋白包埋;此外,灵芝三萜在1 030 cm -1处有C—O伸缩振动,此峰在灵芝三萜白蛋白纳米体中吸收强度明显弱于在混合物中的吸收强度,进一步说明灵芝三萜被白蛋白包裹成功。
2.5 白蛋白纳米粒的形态、电位、粒径及粒径分布测定结果
由透射电镜拍摄的照片可显示灵芝三萜白蛋白纳米粒呈现规整的圆球形,边缘光滑,在水中的分散性较好,粒径分布基本匀称。通过单个纳米粒放大图片可以观察到明显的包裹结构,结合红外图谱的分析可推断纳米体内层为灵芝三萜,外壳为白蛋白球,结果见图6。

图6 灵芝三萜白蛋白纳米体的透射电镜图
Fig.6 TEM diagram of Ganoderma lucidum triterpenoids-BSA nanoparticles

图7 灵芝三萜白蛋白纳米体的粒径分布图
Fig.7 Size distribution of Ganoderma lucidum triterpenoids-BSA nanoparticles
多指数分散系数(polydispersity index,PDI)是反映纳米体系中粒径分布范围的指标,PDI值越小,说明粒径分布范围越窄,即体系中粒子的粒径具有较好的规整度 [23]。用Zeta电位仪测定纳米体的平均粒径是(189±11.13)nm,PDI为0.227±0.016,结果见图7。实验制备的灵芝三萜白蛋白纳米体的Zeta电势为(-31.4±6.74)mV,与Peters [24]报道在自然状态下BSA分子表面电势为-18 mV相比较,BSA乳化交联后形成的牛血清白蛋白纳米体表面的电势升高,纳米体之间的静电斥力增加,有利于阻止纳米体之间的聚集。结合PDI、Zeta电势值和电镜拍摄的结果可初步说明所制备的纳米体混悬液稳定性良好。
2.6 稳定性实验结果
表3 灵芝三萜白蛋白纳米体贮藏稳定性检测结果
Table3 Storage stability of Ganoderma lucidum triterpenoids-BSA nanoparticles
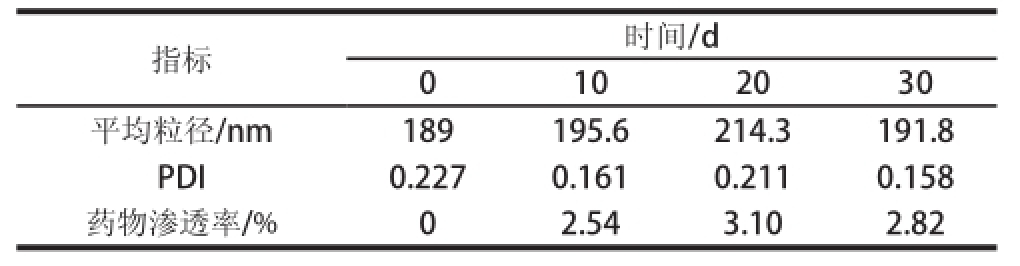
指标时间/d 0102030平均粒径/nm189195.6214.3191.8 PDI0.2270.1610.2110.158药物渗透率/%02.543.102.82
灵芝三萜白蛋白纳米体存放期间的物化稳定性是其应用的一个非常重要的方面,因为纳米体在体内的循环过程中为了保持芯材的活性以及达到缓释和靶向释放的功能必须能保证纳米体球形结构的完整性 [25]。灵芝三萜白蛋白纳米体混悬液在4 ℃条件下放置30 d后外观上未见分层、絮凝、沉淀、变色等明显变化。从表3可见,随着存放时间的延长药物的渗透率呈增大的趋势,但总体渗透率较低,不超过4%,平均粒径基本保持在200 nm左右,变化较小;PDI始终显示较低,纳米粒具有均一的分散性。由此说明灵芝三萜白蛋白纳米体在4 ℃贮存条件下能保持良好的稳定性。
本实验研究以去溶剂化-化学交联法成功制备了灵芝三萜白蛋白纳米体,通过正交优化试验制得包封率较高产品的同时,可以使灵芝三萜白蛋白纳米体的平均粒径不超过200 nm。放置30 d后纳米体外观、PDI、粒径以及渗透率变化很小,具有良好的稳定性。结果表明灵芝三萜白蛋白纳米体的最佳配方为将BSA 50 mg溶于5 mL去离子水中,取灵芝三萜8 mg溶于25 mL无水乙醇中,水相以400 r/min持续搅拌的同时以1 mL/min的速率滴加灵芝三萜乙醇溶液,加入0.25%的戊二醛溶液125 ☒L,室温条件下固化12 h,减压浓缩除去乙醇。
参考文献:
[1] KO H H, HUNG C F, WANG J P, et al. Anti-inflammatory triterpenoids and steroids from Ganoderma lucidum and G. tsugae[J]. Phytochemistry, 2008, 69: 234-239.
[2] 赵继鼎, 张小青. 中国真菌志: 第十八卷[M]. 北京: 科学出版社, 2000: 116-119.
[3] 蔺丽, 方能虎, 吴旦. 灵芝的主要生物活性研究概况[J]. 中国食用菌, 1998, 21(3): 38-40.
[4] 黄艳娟, 肖桂林. 灵芝三萜药理学作用研究进展[J]. 中医药导报, 2008, 14(9): 87-88.
[5] CARMEN W H, XIN D. Chromatographic and electrophoretic methods for Lingzhi pharmacologically active components[J]. Journal of Chromatography B, 2004, 812: 241-257.
[6] LIU Jie, SHIMIZU K, KONISHI F, et al. Anti-androgenic activities of the triterpenoids fraction of Ganoderma lucidum[J]. Food Chemistry, 2007, 100(4): 1691-1696.
[7] 林志彬. 灵芝抗肿瘤和免疫调节作用的研究进展[J]. 北京大学学报:医学版, 2002, 34(5): 493-498.
[8] STANLEY G, HARVEY K, SLIVOVA V, et al. Ganoderma lucidum suppresses angiogenesis through the inhibition of secretion of VEGF and TGF-1 from prostate cancer cells[J]. Biochemical and Biophysical Research Communications, 2005, 330(1): 46-52.
[9] ZHANG Guoliang, WANG Yehong, NI Wei, et al. Hepatoprotective role of Ganoderma lucidum polysaccharide against BCG-induced immune liver injury in mice[J]. World Journal Gastroenterology, 2002, 8(4): 728-733.
[10] YUE Qingxi, CAO Zhiwei, GUAN Shuhong, et al. Proteomics characterization of the cytotoxicity mechanism of ganoderic acid D and computer-automated estimation of the possible drug target network[J]. Molecular and Cellular Proteomics, 2008, 7(5): 949-961.
[11] YUE Qingxi, SONG Xiaoyi, MA Chao, et al. Effects of triterpenes from Ganoderma lucidum on protein expression profile of HeLa cells[J]. Phytomedicine, 2010, 17(8): 606-613.
[12] ZHANG Qun, ZUO Feng, NAKAMURA N, et al. Metabolism and pharmacokinetics in rats of ganoderiol F, a highly cytotoxic and antitumor triterpene from Ganoderma lucidum[J]. Journal of Natural Medicines, 2009, 63(3): 304-310.
[13] WANG Xiaoming, LIU Rongxia, SUN Jianghao, et al. HPLC method for the determination and pharmacokinetic studies of four triterpenoids in rat plasma after oral administration of Ganoderma lucidum extract[J]. Biomedical Chromatography, 2007, 21(4): 389-396.
[14] TARR B D, SAMBANDAN T G, YALKOWSKY S H. A new parenteral emulsion for the administration of taxol[J]. Pharmaceutical Research, 1987, 4(2): 162-165.
[15] 罗俊, 林志彬. 灵芝三萜类化合物药理作用研究进展[J]. 药学学报, 2002, 37(7): 574-578.
[16] JAYABHARATHI J, THANIKACHALAM V, PERUMAL M V. A study on the binding interaction between the imidazole derivative and bovine serum albumin by fluorescence spectroscopy[J]. Journal of Luminescence, 2012, 132(3): 707-712.
[17] MUSTHABA S, BABOOTA S, AHMED S, et al. Status of novel drug delivery technology for phytotherapeutics[J]. Expert Opinion on Drug Delivery, 2009, 6(6): 625-637.
[18] COOMBES A G A, BREEZE V, LIN Wu, et al. Lactic acid-stabilised albuminfor microsphere formulation and biomedical coatings[J]. Biomaterials, 2001, 22(1): l-8.
[19] GRADISHAR W J, TJULANDIN S, DAVIDSON N, et al. PhaseⅢ trial of nanoparticle albuminbound paclitaxel compared with polyethylated castor oil-based paclitaxel in women with breast cancer[J]. Journal of Clinical Oncology, 2005, 23(31): 7794-7803.
[20] HALEY B, FRENKEL E. Nanoparticles for drug delivery in cancer treatment[J]. Urologic Oncologic, 2008, 26(1): 57-64.
[21] 樊继波, 陈永斌, 周杰. 白蛋白微球的制备方法及评价的研究进展[J].天津药学, 2009, 21(3): 58-61.
[22] 范雪芳, 徐淼, 侯晓涛, 等. 红外光谱分析技术及其应用[J]. 成都医学院学报, 2009, 4(3): 217-219.
[23] RUOZI B, TOSI G, FORNI F, et al. Atomic force microscopy and Photon correlation spectroscopy: two techniques for rapid characterization of liposomes[J]. European Journal of Pharmaceutical Sciences, 2005, 25(1): 81-89.
[24] PETERS T. Serum albumin[J]. Advances in Protein Chemistry, 1985, 37: 161-245.
[25] BENITA S. Microencapsulation: methods and industrial applications[M]. New York: Marcel Dekker, 1996: 299-305.
Optimization of the Preparation Procedure and Molecular Characterization of Ganoderma lucidum Triterpenoids-Bovine Serum Albumin Nanoparticles by Orthogonal Array Design
HUANG Ting
1, FAN Yuanjing
1,*, MENG Jing
1, ZHANG Fan
1, GENG Baoyu
1, LIU Peizhi
2, WANG Minghe
2
(1. School of Biotechnology and Food Engineering, Hefei University of Technology, Hefei 230009, China; 2. Anhui Liu Lang Food Co. Ltd., Xuancheng 242000, China)
Abstract:Purpose: To prepare and characterize Ganoderma lucidum triterpenoids-bovine serum albumin (BSA) nanoparticles. Methods: Ganoderma lucidum triterpenoids-BSA nanoparticles were prepared by desolvation-chemical crosslinking method and the preparation conditions were optimized with respect to entrapment efficiency by orthogonal array design. Results: Nanoparticles with an average particle size of (189 ± 11.13) nm, a polydispersity index (PDI) of 0.227 ± 0.016, a zeta potential of (-31.4 ± 6.74) mV, an entrapment efficiency of (80.10 ± 1.05)%, and a drug-loading efficiency of (11.36 ± 0.13)% were obtained by dropwise addition of 8 mg of Ganoderma lucidum triterpenoids dissolved in 25 mL of absolute ethanol to 50 mg/mL aqueous solution of BSA while constantly stirring the mixture at a speed of 400 r/min and subsequent prompt addition of 125 ☒L of 0.25% glutaraldehyde. The nanoparticles were stable at 4 ℃ for 30 d.
Key words:Ganoderma lucidum triterpenoids; bovine serum albumin; nanoparticles; stability
中图分类号:TS201.4
文献标志码:A
文章编号:
doi:10.7506/spkx1002-6630-201510010
收稿日期:2014-11-18
基金项目:安徽省鸭肉制品工程技术研究中心项目(201306G01054);皖江禽产业研究院公共服务平台项目(1401032006)
作者简介:黄婷(1989—),女,硕士研究生,研究方向为食品生物技术。E-mail:huangtinganhui@sina.com
*通信作者:范远景(1958—),男,教授,博士,研究方向为食品科学。E-mail:swf89105@hfut.edu.cn