白生文,汤 超,田 京,闫宏斐,许晓莎,范惠玲 *
(河西学院农业与生物技术学院,甘肃 张掖 734099)
摘 要:利用超声波辅助提取技术对河西走廊沙棘榨汁提油后的果渣下脚料总黄酮提取工艺进行优化,同时考察果渣黄酮提取液的还原力和清除羟自由基和超氧阴离子自由基的能力。通过单因素试验和L 9(3 4)正交试验,得到影响黄酮得率的主要因素及其影响力大小为乙醇体积分数>提取时间>料液比;确定最佳提取条件为乙醇体积分数60%、提取时间40 min、料液比1∶50(g/mL);此条件下,河西走廊沙棘果渣中总黄酮提取率为2.55%,果皮渣中总黄酮提取率为0.651%,沙棘籽粕中总黄酮提取率为1.901%。当质量浓度大于0.151 4 mg/mL时,沙棘果渣黄酮提取液的还原力大于VC的还原力;沙棘果渣黄酮提取液对羟自由基和超氧阴离子自由基均有一定的清除作用,其对羟自由基的清除率为39.07%~42.01%,大于同等质量浓度VC的清除作用,而对超氧阴离子自由基的清除率为47.17%~60.38%,小于同等质量浓度VC的清除作用,说明沙棘果渣黄酮提取液对羟自由基有更强的清除能力。
关键词:沙棘果渣;黄酮;提取工艺;抗氧化性
沙棘(Hippopphae rhamnoides L.)又名醋柳、酸刺、黑刺,为胡颓子科沙棘属落叶灌木或小乔木 [1]。沙棘黄酮是沙棘的主要药用成分 [2],具有清除超氧阴离子自由基及羟自由基 [3]、防癌抗癌 [4]、抗肿瘤 [5]、抗心血管疾病 [6]、抗骨质疏松 [7]、雌激素样与抗雌激素样的作用 [8]以及调节免疫系统 [9],广泛存在于沙棘果、叶、茎、根等不同器官中 [10]。
甘肃省现有沙棘林面积416多万亩,其中河西走廊的沙棘林主要分布在张掖市各县区 [11]。目前,甘肃省各沙棘加工企业主要是为国内外加工沙棘浓缩汁、沙棘果酱、沙棘油等原料产品,同时也产生了大量的沙棘果渣。据测定,沙棘果渣中含有大量的营养物质 [12],高玲 [13]的研究表明沙棘果渣中黄酮的含量也相当高,有些品种甚至高于其在沙棘汁与沙棘油中的含量 [14]。若将总黄酮含量较高的果渣弃去不用或作为饲料低价销售,这无疑是资源浪费。至今,从沙棘果渣中提取黄酮类化合物的研究已有不少报道 [15-18],而采用超声波辅助法分别从河西走廊沙棘籽粕和沙棘果皮渣中提取黄酮类化合物的研究至今未见报道。因此,研究沙棘果渣总黄酮的提取对延伸沙棘加工产业链,提升沙棘开发利用的经济价值具有积极意义。
近年来,关于氧自由基的生理功能和毒性,以及清除自由基的抗氧化剂的研究普遍受到人们的关注 [19-20],而且由于合成抗氧化剂的潜在毒副作用,使得寻找安全、高效的天然抗氧化剂已成为人们研究的热点之一。目前有关沙棘果渣黄酮提取液抗氧化性能的研究报道很少。鉴于此,本研究利用沙棘果渣下脚料为原料,采用单因素及正交设计试验方法,对超声波辅助提取沙棘果渣中黄酮类化合物的提取条件进行了研究,以确定最佳的工艺条件。同时,以VC为对照,对沙棘果渣黄酮提取液的还原性和氧自由基的清除效果进行了测定,评价其在体外抗氧化活性的强弱,以期为开发新的天然抗氧化剂和合理利用沙棘资源提供科学依据。
1.1 材料与试剂
沙棘果渣 张掖市某生物科技开发有限公司。
芦丁标准品、亚硝酸钠、硝酸铝、三氯化铁、双氧水、铁氰化钾、邻苯三酚、VC、三氯乙酸、水杨酸等均为国产分析纯。
1.2 仪器与设备
KQ-250B型超声波清洗器 昆山市超声仪器有限公司;UV-1750紫外-可见分光光度计 苏州岛津仪器有限公司;TGL-16G高速台式离心机 上海贤德实验仪器有限公司;HH-4数显恒温水浴锅 常州国华电器有限公司;电热恒温鼓风干燥箱 浙江玺袁科学仪器有限公司。
1.3 方法
1.3.1 标准曲线的制作和回归方程的建立
精确称取200 mg经120 ℃烘干至恒质量的芦丁标准品,用30%乙醇溶解并定容至100 mL即为标准液。
精密量取芦丁标准溶液0.0、0.5、1.0、1.5、2.0、2.5、3.0 mL于7 支25 mL容量瓶中,再分别加入0.7 mL 5% NaNO 2溶液,摇匀,放置6 min后加入0.7 mL 10% Al(NO 3) 3溶液,6 min后再加入10 mL 1 mol/L的NaOH溶液,混匀,用30%乙醇稀释至刻度,15 min后于波长510 nm处测定吸光度,0.0 mL为空白对照,测得不同质量浓度的吸光度。以吸光度为纵坐标,标准溶液质量浓度为横坐标,绘制标准曲线 [21],并以吸光度对质量浓度进行运算,得到回归方程:y=10.157x,R 2=0.999 8。
1.3.2 沙棘果渣黄酮提取及含量测定
沙棘果渣、果皮渣和籽粕样品的制备:张掖市某生物科技开发有限公司生产沙棘果汁后的果渣下脚料,分成2 份,其中一份烘干粉碎,过60 目筛,装瓶后置干燥器中备用。另一份将果皮渣和籽粕分开,烘干粉碎,过60 目筛,装瓶后置干燥器中备用。
准确称取沙棘果渣干粉0.08 g于10 mL离心管中,按一定料液比的乙醇溶液,一定功率超声和一定时间提取类黄酮。提取液在20 ℃条件下8 000×g离心10 min,滤渣以同样条件提取、离心、合并上清液,然后用乙醇溶液定容为25 mL。取定容后样品各0.5 mL检测,每个实验在相同条件下提取3 个平行样。
用制作标准曲线同样方法测定沙棘果类黄酮的吸光度,根据标准曲线的回归方程计算得黄酮质量浓度,再根据公式(1)计算类黄酮提取率:
1.3.3 单因素试验设计
乙醇体积分数为30%、40%、50%、60%、70%和80%共6 个水平;料液比(g/mL)为l∶20、1∶30、l∶40、1∶50、1∶60和1∶70共6 个水平;超声波浸提时间为10、20、30、40、50 min和 60 min共6 个水平;提取次数为1、2、3次和4 次共4 个水平,以沙棘果渣干粉为原料,分别进行单因素试验。
1.3.4 正交试验设计
在单因素试验的基础上,选择乙醇体积分数、料液比、浸提时间,分别设计3 个水平,以沙棘果渣为原料进行正交试验,每个试验重复3 次,确定沙棘果渣黄酮提取的最佳工艺条件。
1.3.5 沙棘果渣黄酮还原力测定 [22]
普鲁士兰法测定样品的还原力:取一定体积(0.05、0.1、0.2、0.3、0.4 mL)的沙棘果渣样品液于10 mL棕色容量瓶中,加入质量浓度1 g/100 mL的铁氰化钾和磷酸盐(pH 6.5)溶液各1.0 mL,摇匀,混合液于50 ℃水浴20 min,取出后急速冷却。加入1.0 mL质量浓度10 g/100 mL的三氯乙酸溶液,摇匀,静置10 min后,再加入质量浓度0.1 g/100mL的三氯化铁与蒸馏水各1.0 mL,无水乙醇定容,静置10 min,分光光度计于700 nm波长处测定吸光度。重复3 次,取平均值。
1.3.6 沙棘果渣黄酮对羟自由基清除率的测定 [23]
将沙棘果渣黄酮提取液依次按1∶5、1∶10、1∶15、1∶20和1∶25稀释,得到不同质量浓度的样品醇溶物。精确吸取3 mL不同质量浓度(0.498、0.623、0.830 7、1.246、2.49 mg/L)样品醇溶物于试管中,依次向试管中加入2 mL 0.1 mol/L FeSO 4、2 mL 0.1 mol/L水杨酸、2 mL 0.1 mol/L H 2O 2,用蒸馏水定容至10 mL并摇匀,在37 ℃条件下恒温加热30 min后在510 nm波长处测定其吸光度A a;将体系中样品用3 mL无水乙醇代替,在相同条件下测定其吸光度A 0;将体系中H 2O 2用蒸馏水代替在相同条件下测定其吸光度A b。用等质量浓度的VC代替样品做对照,按式(2)计算清除率(E):
1.3.7 沙棘果渣黄酮对超氧阴离子自由基清除率的测定 [22]
取6 支10 mL离心管各加入pH 8.2的50 mmol/L Tris-HC1缓冲液4.5 mL,再分别加入果渣提取液0.0、0.2、0.4、0.6、0.8、1.0 mL,然后依次加蒸馏水1.0、0.8、0.6、0.4、0.2、0.0 mL,混匀后在25 ℃恒温水浴中保温20 min,取出后立即加入在25 ℃预热过的3 mmol/L邻苯三酚溶液0.3 mL启动反应。5 min后加10 mol/L盐酸溶液0.2 mL终止反应。同时另取6 支离心管,按上述步骤依次加入Tris-HCl缓冲液、黄酮提取液和蒸馏水,然后分别加10 mmol/L盐酸溶液0.3 mL,5 min后加10 mol/L盐酸溶液0.2 mL终止反应,摇匀。在325 nm波长处检测吸光度。按照式(3)计算沙棘果渣黄酮提取液对超氧阴离子自由基的清除率:
式中:A 1为不含样品的吸光度;A 2为不含样品和邻苯三酚的吸光度;A 3为含样品的吸光度;A 4为含样品,但不含邻苯三酚的吸光度。
2.1 沙棘果渣黄酮提取单因素试验结果
2.1.1 料液比对黄酮提取率的影响
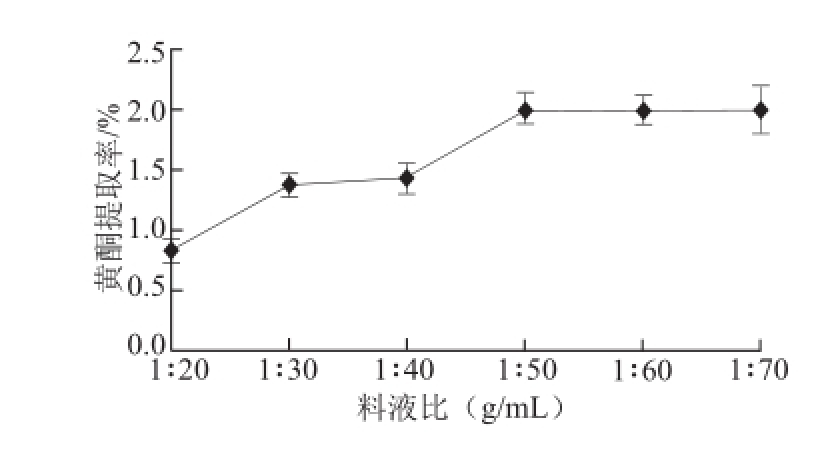
图1 料液比对沙棘果渣黄酮提取率的影响
Fig.1 Effect of solid-to-solvent ratio on the extraction efficiency of total flavonoids
准确称取一定量的沙棘果渣粉末,固定乙醇体积分数60%、超声功率250 W、提取时间30 min,分别选择料液比为1∶20、1∶30、1∶40、1∶50、1∶60、1∶70进行实验。图1显示,当料液比小于1∶40时,黄酮提取率上升较缓慢,而当继续增大溶剂用量比例,使其达到1∶50时,黄酮提取率达到2.004%;但当料液比超过1∶50时,随提取液用量增大,类黄酮提取率变化很小。
料液比实际上是溶剂的用量大小。一般来说,溶剂的用量越大,提取率也越大。但当料液比增加到一定程度后,一定比例的溶剂将有效成分基本溶出,因此提取率不再上升或趋于稳定。而且乙醇用量过多,会造成有机溶剂的浪费,并使后续样品浓缩时间耗时过长。因此,从提取率、溶剂用量和生产成本等角度综合考虑,选择料液比1∶50~1∶70作为进一步优化的范围。
2.1.2 乙醇体积分数对黄酮提取效果的影响
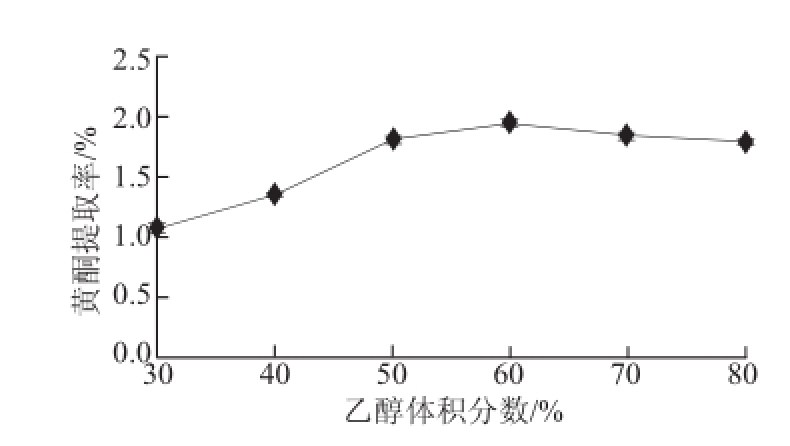
图2 乙醇体积分数对沙棘果渣黄酮提取率的影响
Fig.2 Effect of ethonal concentration on the extraction efficiency of total flavonoids
准确称取一定量的沙棘果渣粉末,固定料液比1∶50、超声功率250 W、提取时间30 min,分别选择乙醇体积分数30%、40%、50%、60%、70%和80%进行试验。图2显示,当乙醇体积分数较低时,沙棘果渣黄酮提取率随着乙醇体积分数的增大而逐渐增加;当乙醇体积分数为60%时,提取率达到最大(1.942%);而后随着乙醇体积分数的继续增大,黄酮提取率缓慢降低。
沙棘果渣黄酮提取率随乙醇体积分数的增大先增加后降低,其原因可能在于乙醇溶解性好,细胞穿透力强,当用较高体积分数的乙醇处理材料时,组织细胞内外的浓度差变大,有利于黄酮的溶出。但是,当乙醇体积分数过高时,会使有些醇溶性的色素,亲脂性强的成分溶出量增加,这些成分会竞争同乙醇-水分子结合,导致黄酮与乙醇-水分子结合的可能性下降,使提取率呈现出降低的趋势。综上,在正交试验中应选择50%~70%的乙醇作为优化的参考范围。
2.1.3 浸提时间对黄酮提取效果的影响
准确称取一定量的沙棘果渣粉末,固定乙醇体积分数60%、料液比1∶50、超声功率250 W,分别选择10、20、30、40、50、60 min进行试验。
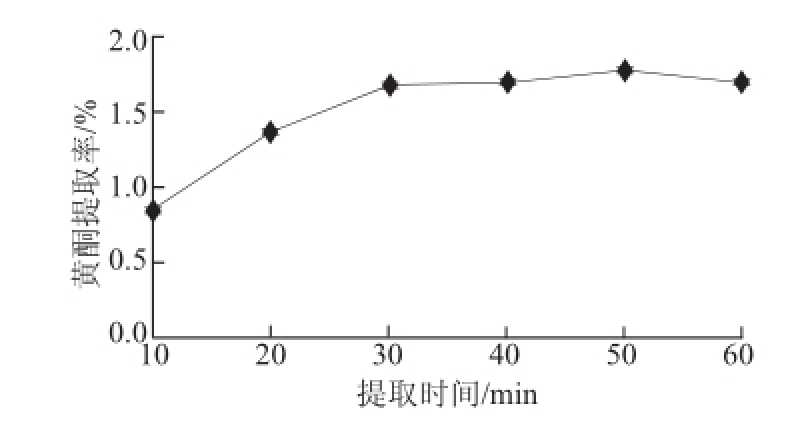
图3 提取时间对沙棘果渣黄酮提取率的影响
Fig.3 Effect of extraction time on the extraction efficiency of total flavonoids
从图3可知,随着提取时间的延长,黄酮提取率逐渐增加,且增幅明显。当浸提时间为30 min时,黄酮提取率达到1.674%。当继续延长浸提时间,提取率以平缓的幅度增加,在浸提50 min时的提取率比30 min的仅提高了0.104%。这可能是由于:1)在提取的初始阶段,由于原料和提取液2个体系间存在浓度差,提取率随浸提时间的延长而增加,当达到一定时间后,原料内外黄酮质量浓度达到相对平衡的状态,原料内的黄酮不容易被继续浸出,提取率趋于稳定。2)由于提取时间的延长,造成其他醇溶性物质的溶解,从而影响了黄酮类化合物的提取。综上,考虑到浸提时间越长,能耗及经济成本越大,因此在进行正交试验时,选择30~50 min进行优化。
2.1.4 提取次数对提取效果的影响
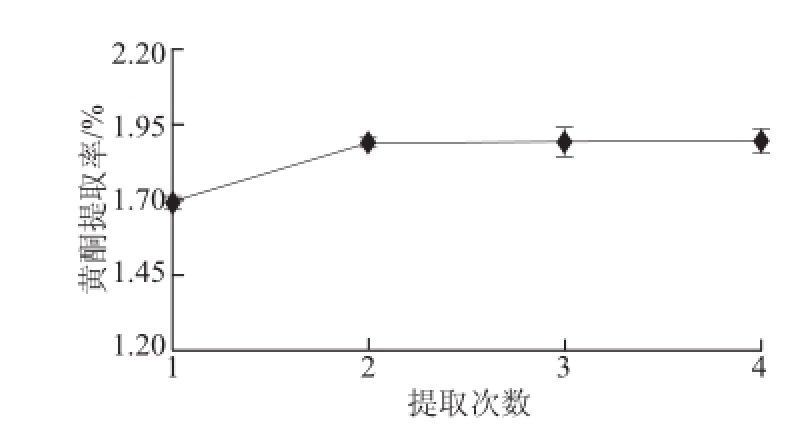
图4 提取次数对沙棘果渣黄酮提取率的影响
Fig.4 Effect of extraction cycles on the extraction efficiency of total flavonoids
在以上最佳单因素条件下,将原料进行多次浸提比较黄酮提取率。由图4可知,随着提取次数的增多,沙棘果渣黄酮提取率逐渐上升。当提取2 次后,提取率随提取次数的增加上升幅度缓慢,浸提3、4 次的黄酮提取率分别比2 次的仅提高了0.028%、0.009%。这可能是由于随着提取次数的增加沙棘果渣中黄酮类物质已基本溶出。同时,提取次数过多会给后续的滤液浓缩带来困难。因此,正交试验中采用2 次浸提。
2.2 沙棘果渣黄酮提取正交试验结果及分析
表1 沙棘果渣黄酮提取L
9
(3
4
)正交试验设计及结果
Table1 Orthogonal array design and results
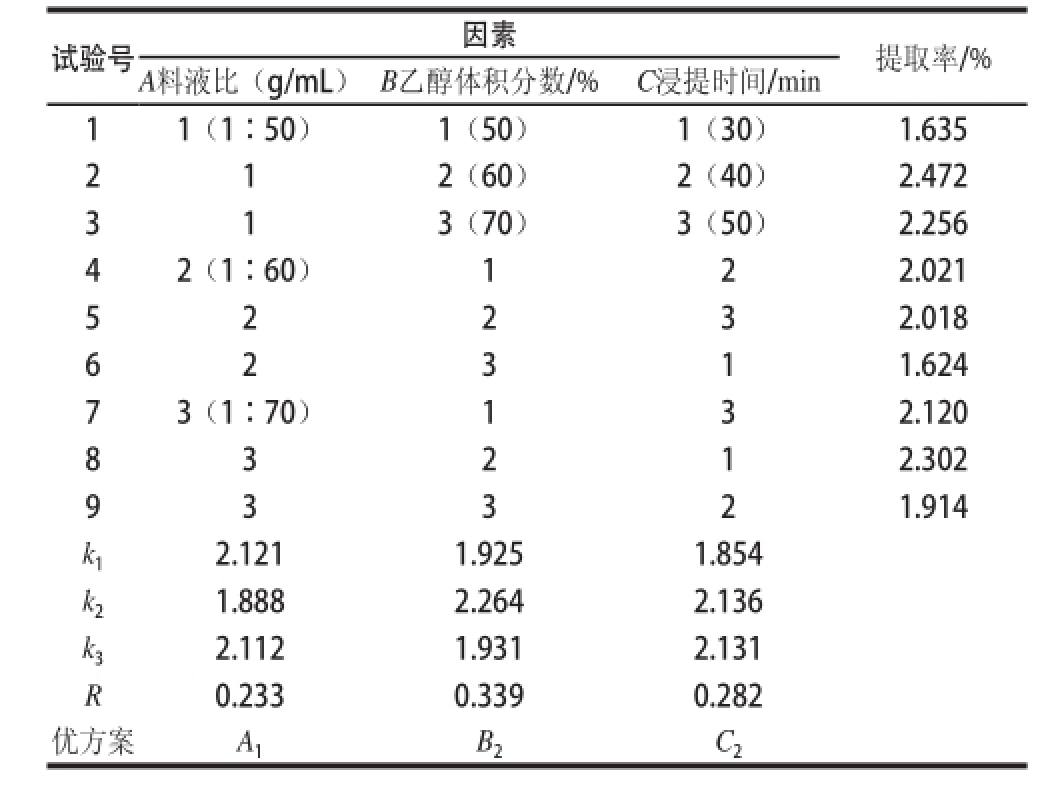
试验号因素提取率/% A料液比(g/mL)B乙醇体积分数/%C浸提时间/min 11(1∶50)1(50)1(30)1.635 2 1 2(60)2(40)2.472 3 1 3(70)3(50)2.256 42(1∶60)122.021 5 2 2 3 2.018 6 1.624 73(1∶70)132.120 8 3 2 1 2.302 2 3 1 9 3 3 2 1.914 k 12.1211.9251.854 k 21.8882.2642.136 k 32.1121.9312.131 R0.2330.3390.282优方案A 1B 2C 2
由表1的极差分析结果可知,各因素对沙棘果渣黄酮提取率的影响程度各不相同,主次顺序为B>C>A,即乙醇体积分数对黄酮提取率的影响最大,其次是提取时间,而料液比对黄酮提取率的影响最小。由直观分析确立的最佳组合为A 1B 2C 2,即料液比1∶50、乙醇体积分数60%、浸提时间40 min,最大提取率可达2.472%。由表1还可知,当采用同样的提取条件时,沙棘籽粕中黄酮提取率近乎是果皮渣中的2 倍,说明河西走廊沙棘果渣中的黄酮类化合物主要在沙棘籽中存在。
根据获得的最佳提取工艺条件,首先对沙棘果渣中的黄酮进行了提取,提取率达2.55%,均大于表1中9 个试验的提取结果。然后采用上述最佳提取工艺分别提取了沙棘籽粕、果皮渣中的黄酮,提取率分别为1.901%、0.651%。
2.3 沙棘果渣黄酮提取液的还原力和抗氧化活性
2.3.1 沙棘果渣黄酮提取液铁离子还原力分析

图5 沙棘果渣黄酮提取液还原能力
Fig.5 Reducing power of flavonoids and VC
由图5可知,沙棘果渣黄酮提取液与VC的吸光度都随质量浓度的增大而上升,吸光度越高,说明这种反应混合物的还原性越强。当质量浓度很低(0.075 7 mg/L)时,沙棘果渣黄酮提取液的铁离子还原力小于VC的,但当质量浓度介于0.151 4~0.605 6 mg/L范围内时,沙棘果渣黄酮还原力较VC还原力强。
2.3.2 沙棘果渣黄酮提取液清除羟自由基能力分析

图6 沙棘果渣黄酮提取液对羟自由基的清除能力
Fig.6 Hydroxyl radical-scavenging activity of flavonoids and VC
羟自由基是最活泼、毒性最大的自由基,可与活细胞中的任何分子发生反应,引发组织细胞病变,导致各种疾病的发生和机体衰老,且反应速度非常快 [24]。黄酮类抗氧化作用是通过酚羟基与自由基反应,形成共振稳定的半锟式自由基而中断链式反应 [25]。由图6可知,在所选质量浓度范围内,沙棘果渣黄酮提取液和VC清除羟自由基的能力均与质量浓度呈正相关,黄酮提取液对羟自由基的清除率为39.07%~42.01%,大于VC对羟自由基的清除率(37.78%~39.25%)。在0.498~0.831 mg/L质量浓度范围内,沙棘果渣黄酮清除率增幅缓慢,当其质量浓度为2.49 mg/L时,清除率达到42.01%,明显大于同等质量浓度VC的清除率(39.25%)。
2.3.3 沙棘果渣黄酮提取液清除超氧阴离子自由基能力分析
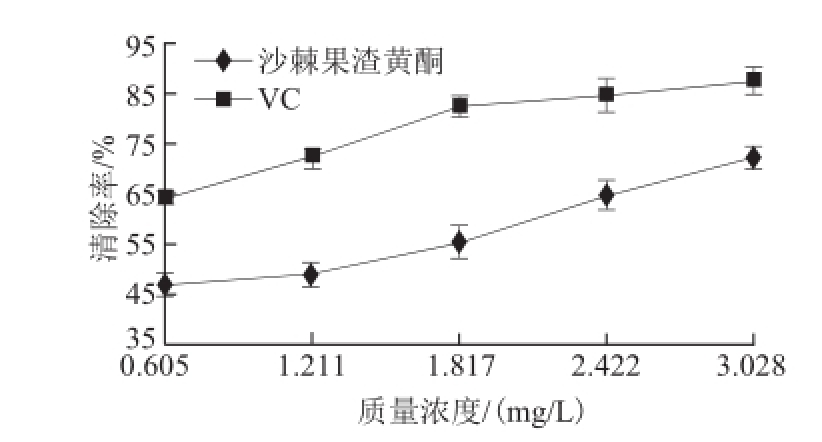
图7 沙棘果渣黄酮提取液对超氧阴离子自由基的清除能力
Fig.7 Superoxide radical scavenging activity of flavonoids and VC
生物体内的氧化还原反应中,大致有2%~5%的氧会产生超氧阴离子自由基,其是机体内寿命最长的自由基,通常作为自由基链式反应的引发剂,产生活性更强的羟自由基,进一步对机体造成危害 [24]。由图7可知,在所选质量浓度范围内,体系中加入不同质量浓度的沙棘果渣黄酮提取液、VC后,清除率均呈现上升趋势。这说明沙棘果渣黄酮提取液对超氧阴离子自由基有抑制作用,抑制率与质量浓度有关,加入样品的质量浓度越大,对超氧阴离子自由基的抑制作用越强。沙棘果渣黄酮提取液对超氧阴离子自由基的清除率为47.17%~60.38%,明显小于同等质量浓度VC对超氧阴离子自由基的清除率(64.78%~87.42%)。
图6和图7的结果还表明,沙棘果渣黄酮提取液对两种自由基的清除率明显不同,其对超氧阴离子自由基的清除能力明显大于对羟自由基的清除能力。
通过沙棘果渣黄酮提取单因素试验,确定比较好的因素水平为料液比1∶50、乙醇体积分数60%、浸提时间30 min、提取2 次。
采用超声波辅助提取法对沙棘果渣黄酮进行了提取,通过正交试验,得到影响黄酮提取率的提取因素的影响力大小为:乙醇体积分数>提取时间>料液比。通过单因素试验和正交试验对沙棘果渣黄酮超声辅助提取工艺进行优化,得到最佳提取条件为料液比为1∶50、乙醇体积分数60%、提取时间40 min。在此条件下得到河西走廊沙棘果皮渣中黄酮提取率为0.651%,沙棘籽粕中黄酮提取率为1.901%。
黄酮类化合物存在于沙棘的所有部位,其中果汁为365 mg/100 g,沙棘叶为876 mg/100 g,沙棘油为1 065.2 mg/100 g,沙棘果泥中黄酮含量达到2 080 mg/100 g [26],含量极其丰富。本实验的研究结果发现,河西走廊沙棘果渣中的总黄酮提取率达到了2.55%,与已有研究结果相比,达到了提取沙棘果渣中黄酮的目的。
张颖等 [27]的研究结果表明,泰山沙棘黄酮能有效清除羟自由基和超氧阴离子自由基,且随着黄酮质量浓度的升高,对羟自由基的清除率和对超氧离子自由基的抑制率也增大。本研究通过还原力和自由基清除率测定实验,表明河西走廊沙棘果渣黄酮类化合物对生物体内常见的2 种氧自由基都具有一定的清除作用,随着黄酮质量浓度的增大,对自由基的清除能力也增强;研究结果还表明其对超氧阴离子自由基的清除作用强于对羟自由基的清除作用,这可能与黄酮对2 种氧自由基的作用机理不一样有关。
总之,本研究结果表明,河西走廊沙棘果渣中含有较丰富的黄酮类化合物。由于黄酮类化合物既能作为食品添加剂延缓脂肪的氧化,又可用于防治自由基引发的多种疾病。因此,河西走廊沙棘果渣在天然抗氧化剂和功能食品的开发方面,医学产品的研制方面都有良好的应用前景,这将为利用该资源进行工业化生产黄酮类药物提供参考依据,也为进一步深入研究河西走廊沙棘的应用价值提供理论支持。
参考文献:
[1] 何士敏, 袁小娟, 汪建华. 中国沙棘属植物资源及其开发利用现状[J].现代农业科学, 2008, 15(11): 87-92.
[2] 延玺, 刘会青, 邹永青, 等. 黄酮类化合物生理活性及合成研究进展[J].有机化学, 2008, 28(9): 1534-1544.
[3] SADIK C D, SIES H, SCHEWE T. Inhibition of 15-lipoxygenases by flavonoids: structure- activity relations and mode of action[J]. Biochemical Pharmacology, 2003, 65(5): 773-781.
[4] 张氽, 阚建全, 陈宗道. 生物类黄酮抗癌作用研究进展[J]. 中国食品添加剂, 2003, 24(3): 38-41.
[5] 黄华艺, 查锡良. 黄酮类化合物抗肿瘤作用研究进展[J]. 中国新药与临床杂志, 2002, 21(7): 428-433.
[6] WOODMAN O L, MEEKER W F, BOUJAOUDE M. Vasorelaxant and antioxidant activity of flavonols and flavones: structure-activity relationships[J]. Journal of Cardiovascular Pharmacology, 2005, 46(3): 302-309.
[7] 杨茂区, 陈伟, 冯磊. 大豆异黄酮的生理功能研究进展[J]. 大豆科学, 2006(3): 320-324.
[8] KIM Y W, HACKETT J C, BRUEGGEMEIER R W. Synthesis and aromatase inhibitory activity of novel pyridine-containing isoflavones[J]. Journal of Medicinal Chemistry, 2004, 47(16): 4032-4040.
[9] 袁媛, 张浩, 郑苗. 沙棘果中总黄酮苷类的提取工艺研究[J]. 华西药学杂志, 2012, 27(1): 70-72.
[10] 赵文杰, 敬思群, 热那汗, 等. 响应面法沙棘果渣总黄酮提取条件的优化[J]. 食品工业, 2013, 34(2): 86-89.
[11] 薛高文, 蒋悦, 郭劲玲, 等. 我省沙棘资源发展现状及其对策[J]. 甘肃林业, 2006(3): 26-27.
[12] 赵文娟, 马齐, 陈卫锋, 等. 吴起野生沙棘不同部位总黄酮含量测定[J].陕西林业科技, 2010(3): 39-40.
[13] 高玲. 沙棘化学成分的提取与分离方法研究进展[J]. 赤峰学院学报:自然科学版, 2008, 24(5): 17-19.
[14] 张冬雪. 水浸提沙棘果渣总黄酮工艺研究[J]. 国际沙棘研究与开发, 2008, 6(4): 10-13.
[15] 陈丽娜, 吴琼, 石矛, 等. 沙棘籽及果皮渣黄酮提取工艺[J]. 食品科技, 2010, 35(10): 211-213.
[16] 裴轶琨. 响应面法优化高压脉冲电场提取沙棘果皮渣黄酮[J]. 中国酿造, 2012, 31(10): 57-60.
[17] 侯霄. 正交实验法优化沙棘黄酮的提取工艺[J]. 国际沙棘研究与开发, 2010, 9(3): 21-24.
[18] 罗丽, 梁琪, 毕阳, 等. 沙枣与沙棘果实乙醇提取物抗氧化性的比较分析[J]. 甘肃农业大学学报, 2012(4): 130-135.
[19] TAUBERT D, BREITENBACH T, LAZAR A, et al. Reaction rate constants of superoxide scavenging by plant antioxidants[J]. Free Radical Biology and Medicine, 2003, 35(12): 1599-1607.
[20] 赵二劳, 韩永花. 沙棘营养保健功能与开发利用[J]. 食品研究与开发, 2005, 26(4): 182-184.
[21] 古丽巴哈尔·阿巴拜克力. 新疆琐琐葡萄叶总黄酮提取工艺及抗氧化活性[J]. 食品科学, 2013, 34(12): 104-108. doi: 10.7506/ spkx1002-6630-201312022.
[22] 陈虎, 蒲俊松, 向仲怀, 等. 药桑葚总黄酮的提取工艺及其抗氧化活性分析[J]. 食品科学, 2014, 35(12): 7-12. doi: 10.7506/spkx1002-6630-201412002.
[23] 杨志刚, 张燕萍, 杨海定. 常熟黑米类黄酮超声波辅助提取及抗氧化活性分析[J]. 食品科学, 2013, 34(18): 7-16. doi: 10.7506/ spkx1002-6630-201318024.
[24] 吴雪辉, 黄永芳, 高强, 等. 肉桂精油的抗氧化作用研究[J]. 食品科技, 2007, 32(4): 85-88.
[25] 王宪楷. 天然药物化学[M]. 北京: 人民卫生出版社, 1988: 272-275.
[26] 黄铨, 于倬德. 沙棘研究[M]. 北京: 科学出版社, 2006: 102.
[27] 张颖, 张立木, 李同德, 等. 泰山沙棘果中总黄酮与槲皮素含量测定及其抗氧化性探讨[J]. 中国医院药学杂志, 2011, 31(8): 644-645.
Extraction and Antioxidant Activity of Total Flavonoids from Sea Buckthorn Pomace
BAI Shengwen, TANG Chao, TIAN Jing, YAN Hongfei, XU Xiaosha, FAN Huiling
*
(College of Agriculture and Biotechnology, Hexi University, Zhangye 734099, China)
Abstract:The aim of the current study was to optimize the extraction conditions for total ☒avonoids from sea buckthorn (Hippopphae rhamnoides L.) pomace (the leftover residue from juice making) by orthogonal array design. The antioxidant activity of the total flavonoids extracted was assessed by hydroxyl radical and superoxide anion radical scavenging, and reducing power assays, respectively. Ethanol concentration, extraction time and the ratio of material to solvent were identi☒ed as three main variables that affect extraction ef☒ciency by signal factor experiments, and these factors were further optimized to be 60%, 40 min and 1:50 (g/mL), respectively, using orthogonal array design. Under the optimized conditions, the predicted extraction yield of total flavonoids from sea buekthom pomace was 2.55%. The total ☒avonoids had strong reducing power, and exhibited a more powerful scavenging effect against superoxide anion radical than against hydroxyl radical.
Key words:sea buckthorn pomace; flavonoids; extraction process; antioxidation
中图分类号:Q586
文献标志码:A
文章编号:
doi:10.7506/spkx1002-6630-201510012
收稿日期:2014-09-24
基金项目:河西学院大学生科技创新项目(2013-124)
作者简介:白生文(1975—),男,副教授,硕士,研究方向为植物抗性生理生化、生物质资源开发与利用。
E-mail:bsw4588384@163.com
*通信作者:范惠玲(1980—),女,副教授,硕士,研究方向为生物化学。E-mail:qianjing05@163.com