朱素英
(菏泽学院生命科学系,山东 菏泽 274015)
摘 要:目的:探究三七花多酚的提取优化工艺以及其抗氧化性。方法:利用单因素试验,选择提取温度、提取时间、乙醇体积分数3 个因素,采用响应面的中心组合试验设计,得到三因素及其交互作用对三七花多酚提取量影响的多元回归方程、响应面图及三七花多酚提取量与1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl, DPPH)自由基清除能力的相关性。结果:三七花多酚提取的最佳条件为提取温度75 ℃、提取时间47 min、乙醇体积分数48%,多酚提取量(以没食子酸当量计)预测值可达58.95 mg/g,且实际值为预测值的98.44%,抗氧化性与三七花多酚提取量的相关系数为0.757 208。结论:最佳条件下实际值与预测值相符,说明预测结果可靠,可作为三七花多酚提取的优化条件;三七花多酚提取量与DPPH自由基清除率高的相关性说明三七花多酚具有较强的抗氧化性。
关键词:三七花;多酚;响应面;提取工艺;抗氧化
三七花为名贵传统中药三七(Panax notoginseng (Burk) F.H.Chen)的花蕾,三七花与根均可药食两用。三七花性甘凉,具有活血化瘀、抗炎、抗癌、降血压血脂、护肝等作用 [1-4],同时三七花也作为保健品应用于食品、家庭烹饪等 [5]。目前从三七花中获得的有效成分主要为皂苷类 [6-7],另外还有些挥发油类 [8]、多糖类等 [9]成分。酚类物质在三七花中还未见报道,多酚类物质具有较强的抗自由基 [10]、抗氧化性 [11-15]、抗肿瘤 [15-16]以及预防神经退行性疾病的能力 [17-18],笔者实验研究表明三七花亦含有丰富的多酚成分,本实验利用响应面法对三七花多酚进行提取优化,并对三七花提取液多酚提取量与清除DPPH自由基能力相关性抗氧化性进行探讨,为三七花进一步加工利用提供理论支持。
1.1 材料与试剂
三七花购于云南文山,经菏泽学院植物学教研室周长路副教授鉴定为五加科人参属三七的干燥花蕾。
Folin-Ciocalteu试剂 上海荔达有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 美国Sigma公司;没食子酸、碳酸钠、乙醇等均为分析纯。
1.2 仪器与设备
DZF-6050型真空干燥箱 上海博讯实业公司;HH-8数显恒温水浴锅 江苏省金坛市江南仪器厂;FW-100型高速万能粉碎机 北京市永光明医疗仪器厂;TU-1810型紫外-可见分光光度计 北京普析通用仪器有限责任公司。
1.3 方法
1.3.1 三七花前处理及提取
将三七干花蕾粉碎机粉碎后过40 目筛,置于真空干燥箱60 ℃干燥至质量恒定,分别称取2 g按照液料比15∶1 (mL/g)置于三角烧瓶中,按照实验设计条件于水浴锅中进行浸提,过滤,重复2 次后合并3 次提取液,定容至50 mL,于4 ℃保存,以备后用。
1.3.2 三七花多酚提取量的测定
采用Folin-Ciocalteu法 [19]:移液枪移取提取液0.5 mL,加入5 mL的稀释10 倍Folin-Ciocalteu试剂,摇匀后,静置反应5 min,再加入7.5%的Na 2CO 3溶液4 mL,加入1.5 mL蒸馏水至反应体系为11 mL,摇匀,室温放置60 min,在波长765 nm处测定吸光度。采用没食子酸为对照品,获得没食子酸的标准曲线,根据标准曲线算出三七花提取液多酚的质量浓度,以没食子酸当量表示,根据以式(1)算出三七花多酚提取量(Y)。
式中:ρ为提取液多酚质量浓度(以没食子酸当量计)/(mg/mL);V为提取液定容后体积/mL;m为三七花粉末干质量/g。
1.3.3 抗氧化性测定
选用DPPH自由基清除法 [20],取0.5 mL样品,加入3 mL 0.1 mmol/L DPPH溶液和2.5 mL的无水乙醇,混匀,暗处静置30 min,517 nm波长处测定吸光度。DPPH自由基清除率(S)可以用式(2)计算:
式中:A c为3 mL无水乙醇与3 mL DPPH溶液的吸光度;A s为0.5 mL提取液与2.5 mL无水乙醇与3 mL DPPH溶液的吸光度。
1.3.4 单因素试验设计
选取影响多酚的提取条件有液料比、提取时间、提取温度、乙醇体积分数4 个变量,研究变量对三七花多酚提取的影响,选择合适的变量范围。单因素变量设计如表1所示,当其中一项作为变量时,选取其他提取条件作为固定提取条件,固定提取条件:液料比20∶1、提取时间40 min、提取温度60 ℃、80%乙醇溶液。
表1 单因素试验变量设计
Table1 Single factor design
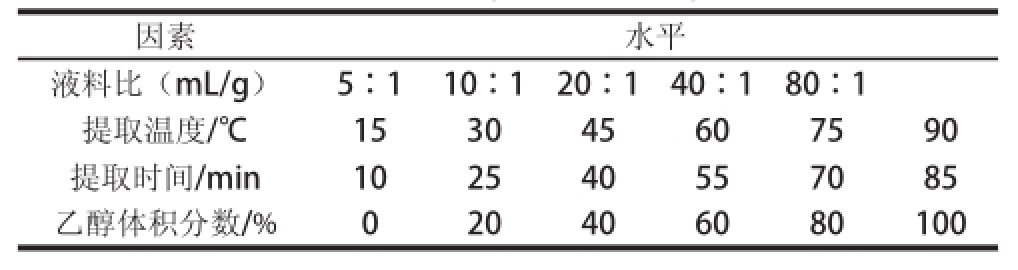
因素水平液料比(mL/g)5∶110∶120∶140∶180∶1提取温度/℃153045607590提取时间/min102540557085乙醇体积分数/%020406080100
1.3.5 响应面试验设计
在单因素试验基础上,选取提取温度、提取时间、乙醇体积分数3 个变量,利用Design-Expert软件进行响应面中心组合试验设计。
2.1 单因素试验结果
进行响应面设计之前要进行相关单因素的范围的确定,本着安全经济的原则,选用一定比例的乙醇作为提取剂。考察液料比、提取时间、提取温度、乙醇体积分数4 个单因素对三七花多酚提取的影响。
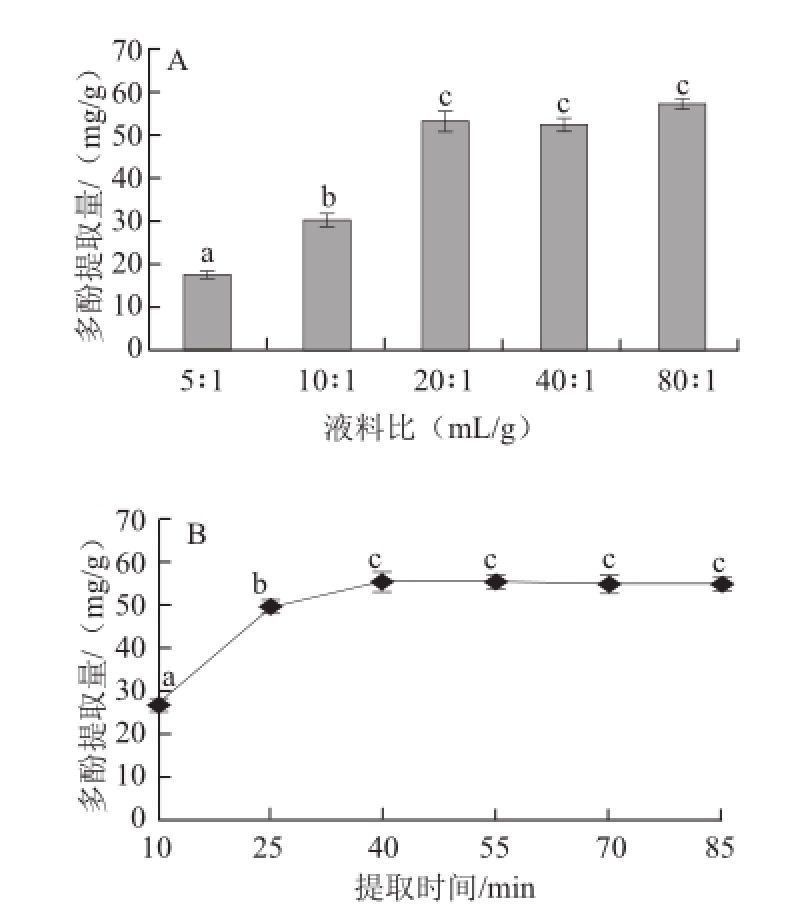
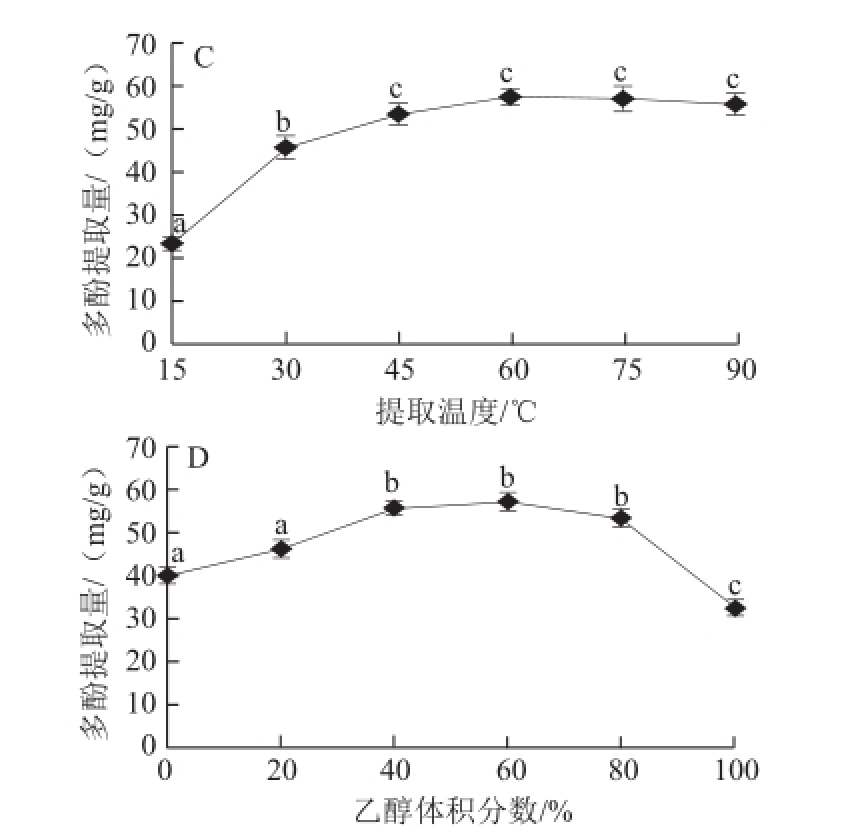
图1 液料比(A)、提取时间(B)、提取温度(CC))和乙醇体积分数(D)对三七花多酚提取量的影响
Fig.1 Effects of single factors on polyphenol yield from Panax notoginseng flowers
如图1A所示,三七花多酚提取量随着液料比增加而增加,液料比20∶1时多酚提取量趋于平稳,液料比20∶1、40∶1、80∶1多酚提取量无显著差异(P>0.05),液料比5∶1、10∶1三七花粉末不能完全溶解,从液料比20∶1开始,三七花多酚基本溶出完全,增大液料比不能增加多酚提取量,且液料比越大,会增加多酚浓缩所用时间,增大多酚被氧化的几率 [21]。因此20∶1可作为进一步试验的最佳液料比。
如图1B所示,随着提取时间从10 min延长至40 min,多酚提取量逐渐增加,提取时间达到40 min时多酚提取量达到55.312 mg/g,提取时间继续延长多酚提取量差异不显著(P>0.05),且延长提取时间会使多酚提取量稍有降低 [22],很可能延长提取时间使多酚降解,同时使一些蛋白质、多糖的等成分溶出 [23]。因此选择25、40、55 min作为响应面设计的低点、中点、高点。
如图1C所示,提取温度对三七花多酚提取量影响显著,在提取温度较低时,15~60 ℃三七多酚提取量随着提取温度的升高逐渐增加,60 ℃时达到最大值,超过60 ℃,75~90 ℃多酚提取量略有降低。温度升高增大多酚的溶解度和扩散系数,可以提高多酚提取量 [24],但由于有些酚类,特别是类黄酮类为热敏性,当温度过高时,会造成降解。
由图1D可以看出,用水提取多酚提取量高于100%乙醇,水醇混合物可以提高多酚的得率,在乙醇体积分数为0%~60%时,多酚提取量随着乙醇体积分数增加逐渐增加,乙醇体积分数60%多酚提取量达到最大56.74 mg/g,乙醇体积分数80%时多酚提取量下降,100%时下降至低于水提取物。因此选择40%、60%、80%作为响应面设计的乙醇体积分数的低点、中点和高点。
2.2 响应面试验设计与结果
根据中心组合试验设计步骤进行多酚的提取以及提取液DPPH自由基清除能力测定,结果见表2,试验结果利用Design-Expert进行分析。
表2 三七花多酚提取的中心组合试验设计与结果
Table2 Central composite design and results
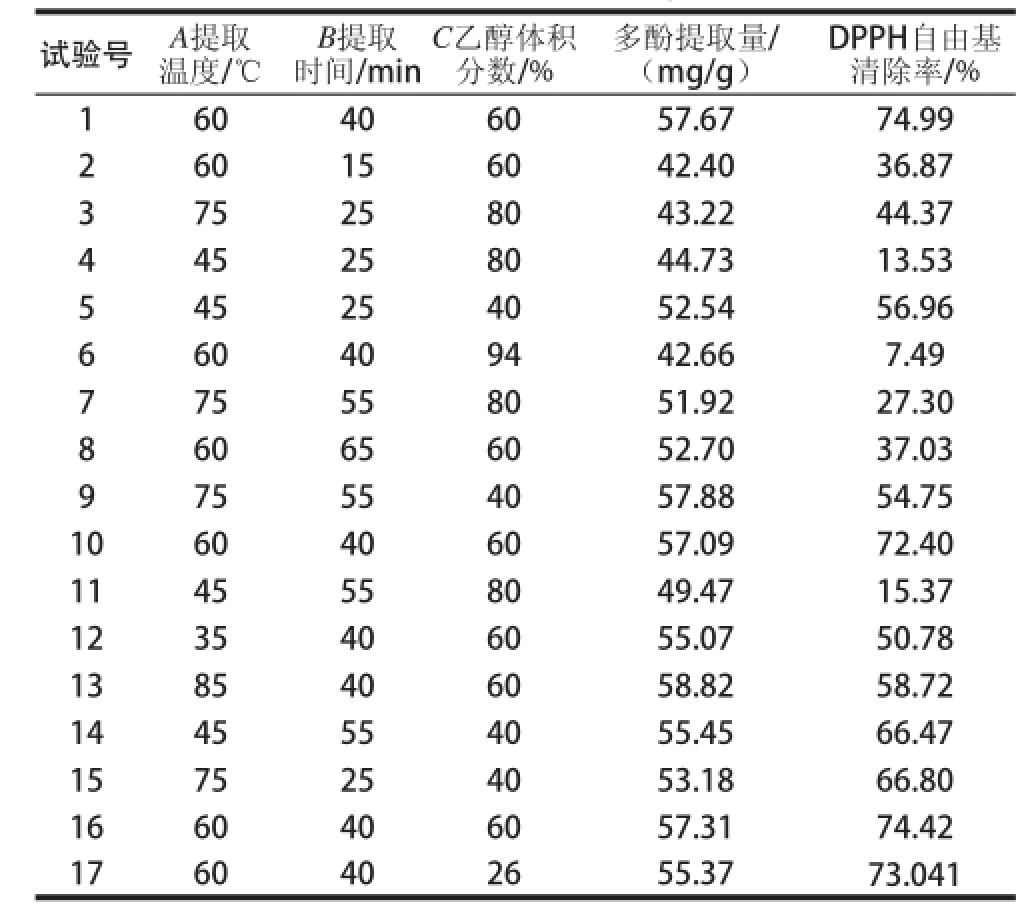
试验号A提取温度/℃(mg/g)DPPH自由基清除率/% 160406057.6774.99 260156042.4036.87 375258043.2244.37 445258044.7313.53 545254052.5456.96 660409442.667.49 775558051.9227.30 860656052.7037.03 975554057.8854.75 1060406057.0972.40 1145558049.4715.37 1235406055.0750.78 1385406058.8258.72 1445554055.4566.47 1575254053.1866.80 1660406057.3174.42 1760402655.3773.041 B提取时间/min C乙醇体积分数/%多酚提取量/
2.3 三七花多酚提取工艺优化
根据中心组合试验结果,进行回归分析,得多元二次回归方程:
Y=16.617 96+0.023 389A+1.062 81B+0.637 56C+ 0.003 197 69AB-0.000 886 630AC+0.002 427 49BC-0.000 397 771A 2-0.015 163B 2-0.007 238 02C 2
表3 二次回归的方差分析
Table3 Analysis of variance of regression model
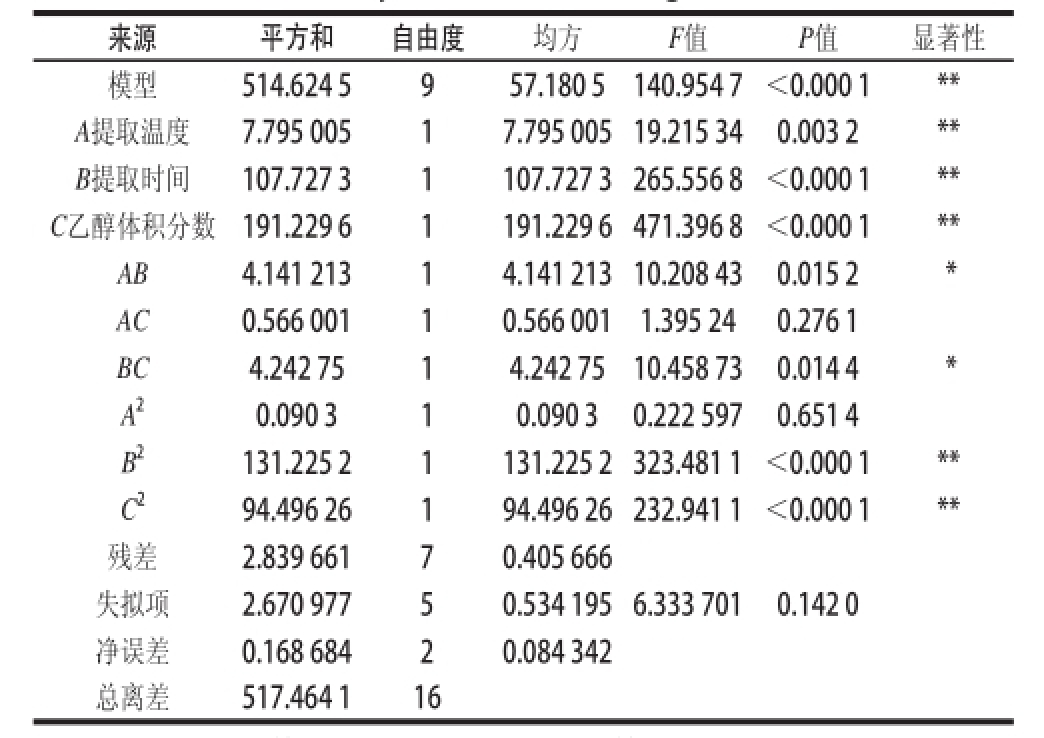
注:*. P<0.05,差异显著;**. P<0.01,差异极显著。
来源平方和自由度均方F值P值显著性模型514.624 5957.180 5140.954 7<0.000 1** A提取温度7.795 00517.795 005 19.215 340.003 2** B提取时间107.727 31107.727 3 265.556 8<0.000 1** C乙醇体积分数191.229 61191.229 6 471.396 8<0.000 1** AB4.141 21314.141 213 10.208 430.015 2 * AC0.566 00110.566 0011.395 240.276 1 BC4.242 7514.242 7510.458 730.014 4 * A 20.090 310.090 30.222 5970.651 4 B 2131.225 21131.225 2 323.481 1<0.000 1** C 294.496 26194.496 26 232.941 1<0.000 1**残差2.839 66170.405 666失拟项2.670 97750.534 195 6.333 7010.142 0净误差0.168 68420.084 342总离差517.464 116
根据表3统计结果可以看出,该模型在P<0.01水平上极显著,失拟项0.142 0不显著(P>0.05),说明该模型可以用于三七花多酚提取的优化分析,相关系数R
2=0.994 5,校正系数
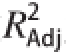 为0.987 5,说明该模型拟合度较高,可以用于预测三七花多酚的优化。因素A、B、C、B
2、C
2影响极显著(P<0.01),AB、BC影响显著(P<0.05)。AC、A
2不显著,剔除不显著相,多元回归方程优化为:
为0.987 5,说明该模型拟合度较高,可以用于预测三七花多酚的优化。因素A、B、C、B
2、C
2影响极显著(P<0.01),AB、BC影响显著(P<0.05)。AC、A
2不显著,剔除不显著相,多元回归方程优化为:
Y=21.553 39-0.077 541A+1.053 40B+0.576 43C+ 0.003 197 69AB+0.002 427 49BC-0.015 046B 2-0.007 171 92C 2
响应面图等高线越扁则说明两因素的交互作用对提取得率影响越大,响应面呈峰形,有极大值。综合图2与表3,C对多酚提取影响最大,其次是B 2、B、C 2、A,在P<0.01水平上均达到极显著。交互效应对多酚提取的影响BC>AB,影响显著(P<0.05),各因素对三七花多酚影响从大到小依次为:C>B 2>B>C 2>A>BC>AB>AC>A 2。

图2 各因素交互作用对三七花多酚提取量影响的响应面图
Fig.2 Response surface plots for the effects of three variables on the extraction rate of polyphenols from Panax notoginseng flower
利用Design-Expert软件对多元二次方程模型进行提取条件优化,三七花多酚的提取优化最佳条件为提取温度75 ℃、提取时间46.85 min、乙醇体积分数48.11%,多酚提取量为59.90 mg/g。
在实验室条件下,为了便于操作,优化条件修改为提取温度75 ℃、提取时间47 min、乙醇体积分数48%,在液料比20∶1的条件下进行验证实验,多酚提取量可达58.95 mg/g,为预测值的98.44%,与预测值符合度较高,因此此实验条件可以用于三七花多酚提取的优化。
2.4 多酚提取量与其DPPH自由基清除能力的关系
表2中中心组合试验设计条件下,DPPH自由基的清除能力最大可达74.99%,结合表2分析多酚提取量与DPPH自由基清除率相互关系,如图3所示,在P>0.01水平上,三七花多酚提取量与DPPH自由基清除能力大小相关性显著,且相关系数达到r值为0.757 208,说明三七花多酚在抗氧化中起到重要作用。
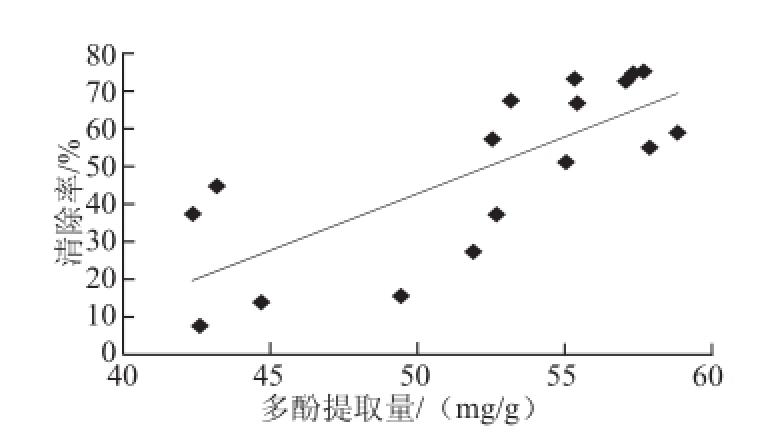
图3 三七花多酚提取量与DPPH自由基清除率的相关性
Fig.3 Correlation between extraction rate and DPPH radical scavenging rate
利用响应面试验设计优化了三七花多酚的提取工艺,建立其多元二次优化模型,并对三七花多酚提取量与DPPH自由基清除率之间的关系进行研究,结果显示乙醇体积分数对多酚提取量影响最大,三七多酚提取的最佳条件为在温度75 ℃水浴中提取47 min、提取溶剂为48%乙醇溶液,多酚提取量为58.95 mg/g,实际值与预测值相符。因此利用响应面法对三七花多酚进行提取和优化可行,且提取条件简便,节能有效。另外根据目前的文献可知,三七花多酚的含量要高于三七根 [25],很可能是三七花中含有较多花青素的缘故。三七花多酚提取量与三七花提取液DPPH自由基清除能力较高的相关性,表明三七花水醇提取液多酚具有较强的抗氧化性。
参考文献:
[1] 高明菊, 崔秀明, 曾江, 等. 三七花的研究进展[J]. 人参研究, 2009, 21(2): 5-7.
[2] 廖文琴, 可燕, 蒋嘉烨, 等. 三七花总皂苷抑制人乳腺癌细胞侵袭的体外研究[J]. 上海中医药大学学报, 2010, 24(5): 77-81.
[3] 可燕, 蒋嘉烨, 王现珍, 等. 三七根及花总皂苷抗肿瘤细胞诱导的血小板聚集研究[J]. 中药材, 2010, 33(1): 96-99.
[4] 曹敏, 楼丹飞, 王国印, 等. 三七花总皂苷对自发性高血压大鼠的降压作用研究[J]. 中华中医药学刊, 2014, 32(2): 367-369.
[5] 殷勤红, 朱艳琴, 虞泓, 等. 三七花化学成分和药理作用的研究进展[J].光谱实验室, 2011, 28(3): 1194-1197.
[6] 朱艳琴, 殷勤红, 虞泓, 等. HPLC法同时测定三七花中3 种皂苷[J].中成药, 2013, 35(2): 339-341.
[7] 李先. 三七花皂苷的化学成分研究[D]. 长春: 吉林大学, 2009.
[8] 吕晴, 秦军, 章平, 等. 同时蒸馏萃取三七花挥发油成分的气相色谱-质谱分析[J]. 药物分析杂志, 2005, 25(3): 284-287.
[9] 宫德瀛, 黄建, 王红, 等. 三七花多糖的分离纯化及结构初步研究[J].天然产物研究与开发, 2013, 25(12): 1676-1679.
[10] 于敏, 杨春荣, 陈帅. 五倍子中多酚类物质对DPPH自由基清除作用的电子自旋共振研究[J]. 时珍国医国药, 2007(12): 3058-3059.
[11] 韩爱芝, 黄军海, 孟庆艳, 等. 大花罗布麻不同部位酚类物质含量及其抗氧化活性比较研究[J]. 食品科学, 2014, 35(13): 127-131. doi: 10.7506/spkx1002-6630-201413024.
[12] 邵芳芳, 尹卫平, 梁菊. 重要的植物多酚及其抗氧化性能的研究概况[J]. 西北药学杂志, 2010, 25(1): 66-68.
[13] 张红城, 赵亮亮, 胡浩, 等. 蜂胶中多酚类成分分析及其抗氧化活性[J]. 食品科学, 2014, 35(13): 59-65. doi: 10.7506/spkx1002-6630-201413011.
[14] ATOUI A K, MANSOURI A, BOSKOU G, et al. Tea and herbal infusions: their antioxidant activity and phenolic profile[J]. Food Chemistry, 2005, 89(1): 27-36.
[15] 陆雪莹, 肖向文, 李晓波. 新疆石榴皮总多酚有效部位抗氧化、抗菌及抗肿瘤活性[J]. 食品科学, 2012, 33(9): 26-30.
[16] VATTEM D A, GHAEDIAN R, SHETTY K. Enhancing health benefits of berriesthrough phenolic antioxidant enrichment: focus on cranberry[J]. Asia Pacific Journal of Clinical Nutrition, 2005, 14(2): 120-130.
[17] 陈伟强, 程义勇. 绿茶多酚对神经退行性变作用的研究进展[J]. 生理科学进展, 2008(4): 355-358.
[18] FRATIANNI F, CARDINALE F, COZZOLINO A, et al. polyphenol composition and antioxidant activity of two autochthonous brassicaceae of the Campania region, southern Italy[J]. Food and Nutrition Sciences, 2014, 5(1): 66-70.
[19] DUAN Xiaojuan, ZHANG Weiwei, LI Xiaoming, et al. Evaluation of antioxidant property of extract and fractions obtained from a red alga, Polysiphonia urceolata[J]. Food Chemistry, 2006, 95(1): 37-43.
[20] ☒ZT☒RK M, AYDOĞMUŞ-☒ZT☒RK F, DURU M E, et al. Antioxidant activity of stem and root extracts of Rhubarb (Rheum ribes): an edible medicinal plant[J]. Food Chemistry, 2007, 103(2): 623-630.
[21] 李西柳, 庞明, 王俊儒, 等. 柿子渣中多酚的提取工艺及其抗氧化性研究[J]. 西北植物学报, 2010, 30(7): 1475-1480.
[22] LIYANA-PATHIRANA C, SHAHIDI F. Optimization of extraction of phenolic compounds from wheat using response surfacemethodology[J]. Food Chemistry, 2005, 93(1): 47-56.
[23] BEY M B, LOUAILECHE H, ZEMOURI S. Optimization of phenolic compound recovery and antioxidant activity of light and dark dried fig (Ficus carica L.) varieties[J]. Food Science and Biotechnology, 2013, 22(6): 1613-1619.
[24] YANG Tao, ZHANG Zhihang, SUN Dawen. Kinetic modeling of ultrasound-assisted extraction of phenolic compounds from grape marc: influence of acoustic energy density and temperature[J]. Ultrasonics Sonochemistry, 2014, 21(4): 1461-1469.
[25] 朱素英. 响应曲面法优化三七根多酚的提取工艺[J]. 食品工业科技, 2014, 35(11): 278-281.
Optimization of Extraction Process for Polyphenolics from Panax notoginseng Flowers by Response Surface Methodology and Its Antioxidant Activity
ZHU Suying
(Department of Life Science, Heze University, Heze 274015, China)
Abstract:Objective: To optimize the extraction of polyphenol from Panax notoginseng flowers and examine its antioxidant activity. Methods: Ethanol concentration, and extraction temperature and time were identified as main variables influencing the extraction yield of polyphenols. The levels of the three variables were optimized by response surface methodology with central composite design. As a result, a polynomial regression and response surface plots were established indicating the effects of the studied variables on extraction efficiency. Moreover, the correlation between polyphenol concentration from Panax notoginseng flowers and 1,1-diphenyl-2-picrylhydrazyl (DPPH) free radical scavenging ability was examined. Results: The optimal conditions for polyphenol extraction were determined as follows: extraction temperature, 75 ℃; extraction time, 47 min; and ethanol concentration, 48%. Under these conditions, the actual extraction rate of polyphenols was 58.95 mg/g, representing 98.44% of the predicted value. The correlation coefficient between DPPH radical scavenging ability and polyphenol yield was 0.757 208. Conclusion: Under the optimal conditions, the good agreement between predicted and observed extraction rates of polyphenols suggests the reliability of the predicted results. The strong correlation between DPPH radical scavenging ability and polyphenol yield demonstrates potent antioxidant activity of polyphenols from Panax notoginseng flowers.
Key words:Panax notoginseng flowers; polyphenol; response surface methodology; extraction; antioxidant
中图分类号:TS201.1
文献标志码:A
文章编号:
doi:10.7506/spkx1002-6630-201510013
收稿日期:2014-10-23
基金项目:菏泽学院植物学重点实验室建设项目
作者简介:朱素英(1980—),女,讲师,硕士,研究方向为中草药的活性成分。E-mail:zhu_suying@126.com