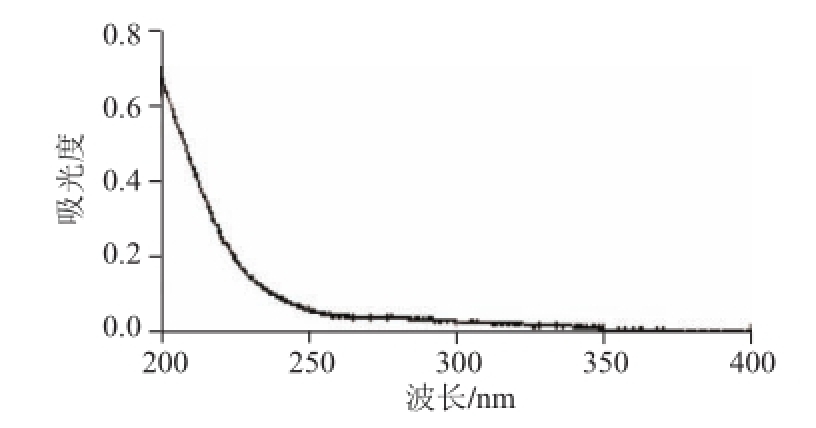
图1 MCP紫外光谱图
Fig.1 UV spectrum of MCP Ⅱa
陈红漫,郭龙伟,章少在,刘姜曼,张海彦,阚国仕 *
(沈阳农业大学生物科学技术学院,辽宁 沈阳 110866)
摘 要:利用酶解结合水溶醇沉提取水溶性的苦瓜多糖(Momordica charantia polysaccharide,MCP),经Sevag法除蛋白、DEAE-纤维素离子交换、Sephadex G-100凝胶过滤获得活性多糖MCPⅡa。由高效凝胶渗透色谱检测可知MCPⅡa为均一多糖,平均分子质量为13.0 kD,单糖组分分析显示其单糖组成为鼠李糖、半乳糖醛酸、半乳糖、木糖和阿拉伯糖(各组分物质的量比为12∶3.05∶19.89∶5.95∶56)。傅里叶红外光谱、核磁共振及刚果红实验发现其存在C1、C2、C3、C5连接,在水溶液中具有稳定的β-三股螺旋构象,扫描电镜下显示其为菱形晶体颗粒。
关键词:苦瓜;多糖;分离纯化;结构特征
近年来,由于多糖类化合物的重要生物学活性如免疫、抗氧化、降血糖及降血脂等,其研究受到了国内外学者的青睐 [1]。随着多糖研究技术迅速改进和完善,国际科学界视多糖的研究为生命科学的前沿领域。苦瓜(Momordica charantia)为葫芦科(Curcubitaceae)苦瓜属植物,广泛分布于热带、亚热带地区,不仅有良好的食用价值,而且在亚洲许多国家和地区均有降脂和降糖的入药记载 [2-5]。目前研究 [6-7]表明,苦瓜有显著的降血糖作用,其重要活性成分之一是苦瓜多糖。苦瓜多糖能够减弱和改善链脲霉素对胰岛β-细胞的损伤,并提高糖尿病小鼠的葡萄糖耐量与肝糖原含量,说明其有益于缓解糖尿病症状及促进肝糖原合成或抑制肝糖原降解而发挥降糖作用 [8]。本实验室前期研究表明,具有抗氧化活性的水溶苦瓜多糖(Momordica charantia polysaccharide, MCP)Ⅱa能够显著降低由四氧嘧啶诱导的小鼠血糖升高 [9-10]。然而,尽管苦瓜多糖降血糖活性相关报道较多,但大都集中于分离提取方法、抗氧化活性、动物学实验等 [11-12],其活性结构的生物学信息尚不清晰,因而限制了其作为血糖功能性食品的应用研究。本实验以层析等分离纯化技术明确苦瓜多糖降血糖活性组分,并利用高效凝胶渗透色谱(high performance gel permeation chromatography,HPGPC)结合高效液相色谱(high performance liquid chromatograph y,HPLC)、红外光谱、核磁共振(nuclear magnetic resonance,NMR)、刚果红实验、扫描电镜观察等方法对其平均分子质量范围、单糖组成、糖苷键构型、高级结构、样貌特征等进行解析,为开发新型天然降糖活性药物及苦瓜资源的深加工利用提供重要的理论依据。
1.1 材料与试剂
鲜苦瓜 市售;纤维素酶、DEAE-52、Sephadex G-100、标准单糖:甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖、岩藻糖美国Sigma公司。
1.2 仪器与设备
Sorvall高速冷冻离心机 凯特试验仪器公司;LGJ-10型冷冻干燥机 北京四环科学仪器厂;UNIC7200型可见分光光度计、UNIC9100型紫外-可见分光光度计尤尼柯(上海)仪器有限公司;Nexus670FT-IR红外光谱仪 美国Nicolet公司;DRX-400核磁共振仪 美国Brüker公司;2410示差折光检测器、515型高效液相色谱仪、515型凝胶色谱仪 美国Waters公司;SU1510型扫描电子显微镜 日本日立公司。
1.3 方法
1.3.1 MCP的制备
将鲜苦瓜切片后于50 ℃烘箱内烘干,粉碎成干粉,称取苦瓜干粉10 g,加入40 倍水,30 mg纤维素酶,50 ℃条件下浸提5 h。收集提取液,离心,上清液再减压浓缩至原体积的1/3,加入3 倍体积的体积分数95%乙醇溶液,静置过夜后离心。将沉淀冷冻干燥后用蒸馏水复溶,采用Sevag法脱蛋白,至游离蛋白质完全去除,浓缩、醇沉、洗涤、真空冷冻干燥,得淡黄色粗MCP 0.76 g。
称取MCP 600 mg溶于20 mL蒸馏水,高速离心后取上清液,过DEAE-52纤维素柱层析,依次用0.1、0.3、0.5、0.7 mol/L NaCl溶液洗脱分部收集,苯酚-硫酸法检测,绘制洗脱曲线。合并洗脱高峰部分,减压浓缩、透析、冷冻干燥,得各部分MCP。
称取0.1 mol/L NaCl溶液洗脱下的多糖组分(MCPⅡ)50 mg溶于10 mL蒸馏水,高速离心后取上清液,于室温条件下进行Sephadex G-100柱层析,0.05 mol/L NaCl溶液洗脱,苯酚-硫酸法跟踪检测。合并单一高峰部分,减压浓缩、透析、高速离心、冷冻干燥,得白色MCP纯品(MCPⅡa)21.17 mg。
1.3.2 MCPⅡa紫外光谱分析
将冷冻干燥后的MCPⅡa样品配制成质量浓度0.5 mg/mL溶液,在波长200~400 nm处紫外扫描,扫描间距为1 nm。
1.3.3 MCPⅡa平均分子质量测定
取10 mg MCPⅡa溶于1 mL超纯水中,采用HPGPC法分析。色谱柱:Ultharydorgel TMLinear凝胶柱(7.8 mm id ×30.0 cm);流动相:超纯水;洗脱流速:1 mL/min;柱温:50 ℃;样品与标准品进样量各20 ☒L。根据HPGPC的洗脱峰形确定纯度,由标准多糖Dextran T-2000、T-500、T-70、T-10、T-5(分子质量分别为2 000、500、70、10、5 kD)的分子质量对数与保留时间制得标准曲线,由标准曲线及GPC软件计算样品平均分子质量。
1.3.4 MCPⅡa单糖组成分析
称取10 mg样品,加入2 mol/L三氟乙酸溶液2 mL,120 ℃条件下密封水解1 h,减压浓缩。取减压蒸干的多糖样品分别依次加入0.5 mol/L的(1-苯基-3-甲基-5-吡唑啉酮)-甲醇溶液0.5 mL和0.3 mol/L NaOH溶液1 mL,混匀,70 ℃反应30 min。待冷却至室温,用0.3 mol/L盐酸溶液1 mL中和。减压蒸干,然后再溶解于1 mL水中,加入2 mL氯仿萃取,离心,吸弃下层溶液,同法重复操作2 次。取上层水相,用0.45 μm微孔滤膜过滤,取滤液供HPLC进样分析。
供HPLC检测分析同时,用经1-苯基-3-甲基-5-吡唑啉酮衍生化后的标准单糖作参照。HPLC检测条件: SunFire TMC 18色谱柱(4.6 mm id×25.0 cm);示差折光检测器;柱温26 ℃;流动相:V(乙腈)∶V(水)= 80∶20;检测波长254 nm;进样体积20 μL。
1.3.5 MCPⅡa红外光谱分析
取冷冻干燥后的MCPⅡa 1 mg与300 mg干燥的KBr混匀,研磨,压片,于红外光谱仪波数400~4 000 cm -1中红外区扫描,测定透光率。
1.3.6 刚果红实验
配制质量浓度为0.5 mg/mL的多糖样品溶液,8.39×10 -4mol/L的刚果红溶液,浓度分别为0~0.5 mol/L NaOH溶液,取1 mL的样品溶液加入1 mL刚果红溶液、2 mL NaOH溶液,混匀,室温条件下静置15 min,于波长400~600 nm处进行光谱扫描,记录刚果红在不同浓度NaOH溶液中的最大吸收波长。
1.3.7 NMR分析
精密称取充分干燥的MCPⅡa 15 mg,溶于0.5 mL重水中,冷冻干燥,如此重复用重水交换3 次,再溶于0.5 mL重水后,用微孔滤膜(0.45 μm)滤过后在DRX-400 NMR仪上进行 13C-NMR分析。
1.3.8 扫描电镜实验
将适量样品溶于超纯水中,取1~2 滴溶液滴于盖玻片上,置于30 ℃烘箱内烘干备用。将盖玻片粘于样品台,喷金后,在高真空模式下观察样品表面形貌。
2.1 MCPⅡa的紫外扫描分析
MCPⅡa脱蛋白后其水溶液在紫外-可见光波长200~400 nm范围内扫描显示,经脱蛋白后,在波长260 nm(核酸的特征吸收峰)和波长280 nm处(蛋白的特征吸收峰)吸收峰不明显,说明MCPⅡa中几乎不含有蛋白质和核酸(图1)。

图1 MCP紫外光谱图
Fig.1 UV spectrum of MCP Ⅱa
2.2 MCPⅡa纯度和平均分子质量
标准曲线线性回归方程为:lgM w=-0.119 0t R+ 8.479 6,式中:M w为平均分子质量/kD;t R为保留时间/min;相关系数R 2为0.997 3。根据线性回归方程计算得MCPⅡa的平均分子质量为13 kD。图2中色谱峰形单一,均匀对称,可确认MCPⅡa为均一多糖。

图2 MCPⅡa的HPGPC图谱
Fig.2 HPGPC profile of MCP Ⅱa
2.3 MCPⅡa的单糖组成分析
经HPLC分析后,用面积归一化法得MCPⅡa的单糖组成及其物质的量比为鼠李糖∶半乳糖醛酸∶半乳糖∶木糖∶阿拉伯糖=12∶3.05∶19.89∶5.95∶56,色谱图见图3。
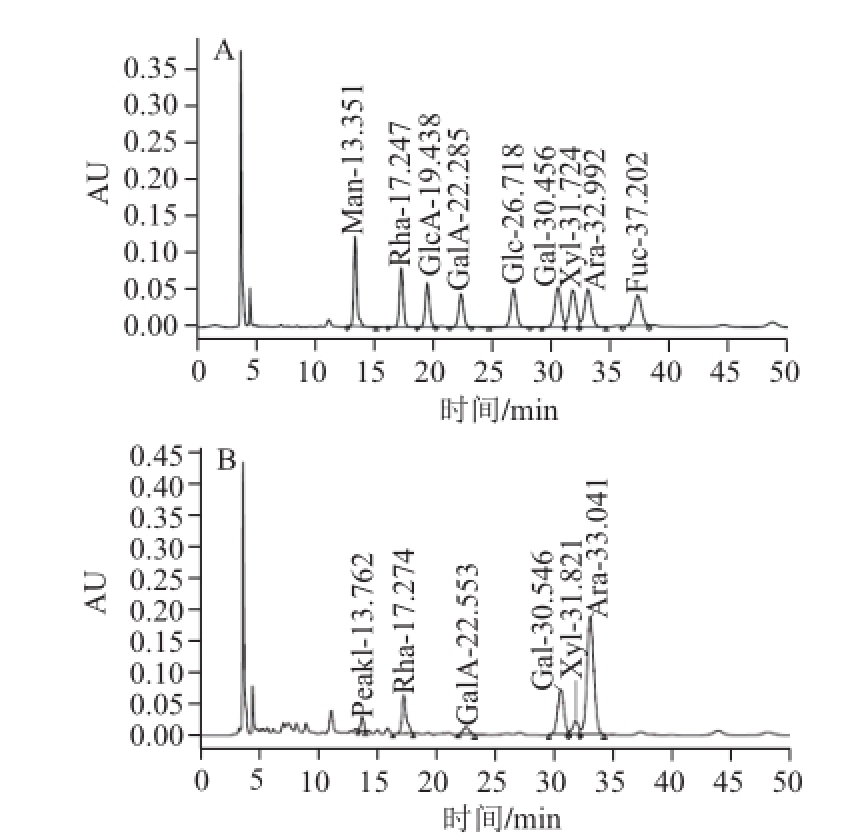
图3 单糖标准品(A)、MCPⅡa水解产物(B)1-苯基-3-甲基-5-吡唑啉酮衍生化后RP-HPLC图谱
Fig.3 Chromatograms of PMP derivatives of monosaccharide standards and hydrolyzed MCPⅡa
2.4 MCPⅡa的红外光谱分析
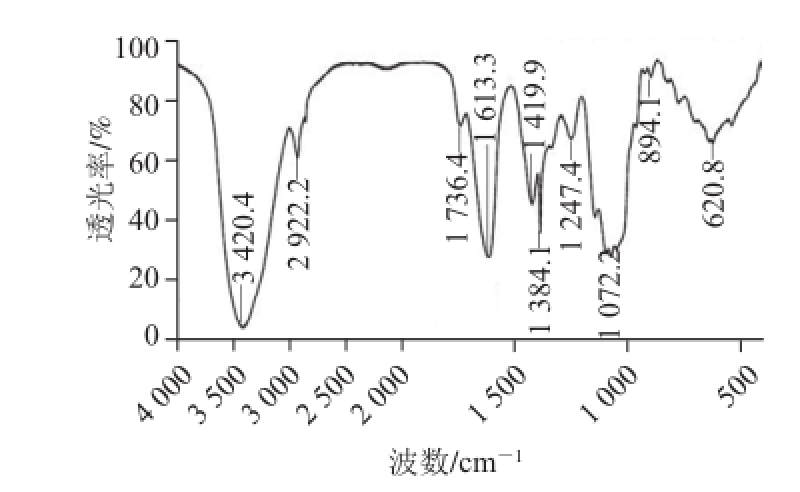
图4 MCPⅡa红外光谱图
Fig.4 FI-IR spectrum of MCP Ⅱa
从图4可以看出,3 420.4 cm -1处的强吸收峰是糖分子中O—H键的伸缩振动吸收。2 922.2 cm -1处的吸收峰是—CH 2—次甲基的C—H伸缩振动引起的。在1 736.4 cm -1处出现了甲氧酯基的—C=O伸缩振动的吸收峰。1 419.9 cm -1处的吸收峰是C—O伸缩振动引起的 [13]。1 384.1 cm -1处吸收峰是=CH 2的变形吸收峰。1 247.4 cm -1处的吸收峰是C—H的变角振动。在1 100 cm -1与1 010 cm -1之间的吸收峰(1 072.2 cm -1),提示中可能含有吡喃糖 [14]。894.1 cm -1处的吸收峰是β-D-吡喃葡萄糖的特征吸收峰 [15]。620.8 cm -1为吡喃型糖环特征吸收峰。由以上分析,可推知该多糖组分含有β-D-吡喃糖环,分子以β-糖苷键连接。
2.5 13C-NMR图谱分析

图5 MCPⅡa的
1133
C-NMR图谱
Fig.5
13
C-NMR spectrum of MCP Ⅱa
对于 13C-NMR图谱,α型的化学位移为δ 97~101,β型的化学位移为δ 103~105。由图5分析可知,MCPⅡa糖链主要是β构型(δ C104.92),有少量为α构型(δ C99.61)。δ 170~180范围的低场信号δ C176.31反映有己糖醛酸的羧基或乙酰基的存在。δ 90~112为异头碳(C1)的共振区,糖端基碳化学位移的信号区。一般还原末端的C1出现在δ 90~98间,取代碳水化合物的C1(非还原单糖)出现在δ 98~112,据此可推断多糖的聚合程度。由图5可看出,在δ 96.83~107.23的低磁场领域,出现了多个异头碳信号峰,说明MCPⅡa中的聚合度较高,糖链比较复杂。δ 60~78为己碳糖环上其他位碳(C2、C3、C4、C5和C6)的共振区,非端基碳的信号区。
2.6 MCPⅡa的构象分析
刚果红可以与具有三股螺旋构象的多糖形成配合物,配合物的最大吸收波长同刚果红相比会发生红移,且在一定的NaOH浓度范围内呈现亚稳性,即最大吸收波长的特征变化 [16-17]。从图6可以看出,MCPⅡa与刚果红发生络合作用,在NaOH浓度0~0.5 mol/L范围内表现为最大吸收波长的特征变化,且吸收波长并没有出现大幅度改变,可以推断出MCPⅡa具有较为稳定的三股螺旋结构。

图6 多糖刚果红复合物的最大吸收波长变化
Fig.6 Maximum absorption wavelengths of Congo-red and its complex with MCP Ⅱa
2.7 MCPⅡa扫描电镜

图7 MCPⅡa扫描电镜照片
Fig.7 SEM image of MCP Ⅱa
由图7可知,当放大倍数为17 000 倍时,MCPⅡa结构较为规则,在电镜下呈现为菱形颗粒 状。扫描 电镜结果为MCPⅡa在微米尺度的显微形貌特征提供了直观的信息。
本实验采用纤维素酶法提取MCP,通过Sevag法脱蛋白后,经DEAE-52分离纯化得到0.1 mol/L NaCl溶液洗脱组分MCPⅡ,通过SephadexG-100凝胶柱纯化后,得到MCPⅡa。实验表明,MCPⅡa为均一多糖,平均分子质量为13.0 kD,由鼠李糖、半乳糖醛酸、半乳糖、木糖、阿拉伯糖5 种单糖组成,其中阿拉伯糖含量占50%以上,可初步推断MCPⅡa是以阿拉伯糖为主,可能带有多个分支的酸性杂多糖。光谱分析表明,MCPⅡa其糖链构型主要为β构型,分子以β-糖苷键连接,含有β-D-吡喃葡萄糖环,且存在C1、C2、C3、C5连接。空间构象研究表明,MCPⅡa在水溶液中具有较为稳定三股螺旋结构。电镜结果显示,MCPⅡa呈现为外形规整的菱形颗粒状晶体。
有关多糖的研究表明,多糖的结构与生物学活性有着密切的关系 [18-21]。例如,分子质量与多糖的溶解度和黏度有关,而溶解度和黏度影响着多糖的生物活性及实际应用;大分子质量多糖体积较大,不利于跨越多重细胞膜障碍进入生物体内发挥生物学活性 [22]。MCPⅡa为小分子质量苦瓜多糖,其生物活性更容易在体内发挥,适宜开发利用。多糖主链的构型有α构型和β构型2 种。对于葡聚多糖而言,α-葡聚糖一般没有活性,主要是因为人体内存在α-葡萄糖苷酶,能使α-糖苷键发生水解;而对于其他类型的多糖,具有生物学活性者也多是β构型 [23]。一般认为,空间构像比初级结构对多糖活性的影响更大,多糖的特定空间构像是其产生生物学活性所必需的,如具有抗肿瘤活性的香菇多糖呈三股螺旋结构 [24];经硫酸酯化的岩藻低聚糖表现出明显的抗HSV病毒活性,且随着硫酸酯化程度的增加而增强 [25];从金钗石斛茎中提取的果胶多糖DNP-W5的免疫活性的表达,与其分支结构及乙酰基有着重要关系 [26-27]。而刚果红实验研究表明,MCPⅡa在水溶液中具较为稳定的三股螺旋结构,进一步说明苦瓜多糖具有着潜在的开发价值。
参考文献:
[1] NAGWA M A, NASSER B S, SHERWEIT H E, et al. Phytochemical and biological studies of some polysaccharides isolated from Aloe, Tamarindus, Opuntia and Citrus[J]. Journal of the Arab Society for Medical Researches, 2010, 5(2): 141-152.
[2] IZHARUL H, SHABNAM K. Effect of Momordica charantia (bitter gourd) tablets in diabetes mellitus: type 1 and type 2[J]. Prime Research on Medicine, 2012, 2(2): 72-74.
[3] NERURKARP V, LEEY K, MOTOSUE M, et al. Momordica charantia (bitter melon) reduces plasma apolipoprotein B-100 and increases hepatic insulin receptor substrate and phosphoinositide-3 kinase interactions[J]. British Journal of Nutrition, 2008, 100(4): 751-759.
[4] SRIDHAR M G, VINAYAGAMOORTHI R, ARUL S V, et al. Bitter gourd (Momordica charantia) improves insulin sensitivity by increasing skeletal muscle insulin-stimulated IRS-1 tyrosine phosphorylation in high-fat-fed rats[J]. British Journal of Nutrition, 2008, 99(4): 806-812.
[5] TOSHIHIRO M, CHISA I, NAOKI I. Hypoglycemic activity of the fruit of the Momordica charantia in type 2 diabetic mice[J]. Journal of Nutritional Science and Vitaminology, 2001, 47(5): 340-344.
[6] 何新益, 刘仲华. 苦瓜多糖降血糖活性的高通量筛选研究[J]. 食品科学, 2007, 28(2): 313-316.
[7] 徐斌, 董英, 张慧慧, 等. 苦瓜多糖对链脲佐菌素诱导糖尿病小鼠的降血糖效果[J]. 营养学报, 2006, 28(4): 401-408.
[8] 宋金平. 苦瓜多糖对糖尿病小鼠的降血糖作用和胰岛素水平的影响[J]. 中国实用医药, 2012, 7(3): 250-251.
[9] 吴笳迪, 陈红漫. 水溶性苦瓜多糖的提取及生物活性研究[J]. 食品科学, 2006, 27(3): 82-86.
[10] WANG Huihui, ZHANG Shaozai, CHEN Hongman, et al. Study on correlation between antioxidant and hypoglycemic activity polysaccharide isolation from Momordica charantia[J]. Bothalia Joural, 2013, 43(11): 117-128.
[11] 焦宇知. 苦瓜多糖的提取与分离纯化[J]. 食品科技, 2007, 32(4): 59-61.
[12] 董加宝, 李芳. 苦瓜多糖的制备及其抗氧化性质研究[J]. 湖南科技学院学报, 2008, 29(8): 51-54.
[13] MAO Wenjun, LI Bafang, GU Qianqun, et al. Preliminary studies on the chemical characterization and antihyper lipidemic activity of polysaccharide from the brown alga Sargassum fusiforme[J]. Hydrobiologia, 2004, 512: 263-266.
[14] 路国兵, 任春久, 崔为正, 等. 桑叶多糖MLP Ⅱ的基本结构及对糖尿病模型大鼠的降血糖作用[J]. 蚕业科学, 2010, 37(6): 1053-1060.
[15] KACURAKOVA M, CAPEK P, SASINKOVA V, et al. FT-IR study of plant cell wall model compounds: pectic polysaccharides and hemicelluloses[J]. Carbohydrate Polymers, 2000, 43(2): 195-203.
[16] 刘微微, 刘旭, 曹学丽, 等. 白背三七多糖的结构表征及α-葡萄糖苷酶的抑制活性[J]. 食品科学, 2013, 34(7): 115-120.
[17] BAO Xingfeng, LIU Guiping, FANG Jinian, et al. Structural and immunological studies of a major polysaccharide from spores of Ganoderma lucidum (Fr.) Karst[J]. Carbohydrate Research, 2001, 332(1): 67-74.
[18] HROM☒DKOV☒ Z, PAULSEN B S, POLOVKA M, et al. Structural features of two heteroxylan polysaccharide fractions from wheat bran with anti-complementary and antioxidant activities[J]. Carbohydrate Polymers, 2013, 93(1): 22-30.
[19] WIJESEKARA I, PANGESTUTI R, KIM S K. Biological activities and potential health benefits of sulfated polysaccharides derived from marine algae[J]. Carbohydrate Polymers, 2011, 84(1): 14-21.
[20] COSTA L S, FIDELIS G P, CORDEIRO S L, et al. Biological activities of sulfated polysaccharides from tropical seaweeds[J]. Biomedicine & Pharmacotherapy, 2010, 64(1): 21-28.
[21] JIAO Guangling, YU Guangli, ZHANG Junzeng, et al. Chemical structures and bioactivities of sulfated polysaccharides from marine algae[J]. Marine Drugs, 2011, 9(2): 196-223.
[22] ZHANG Xuehong, LIU Lina, LIN Guiwu. Structural features, antioxidant and immunological activity of a new polysaccharide (SP1) from sisal residue[J]. International Journal of Biological Macromolecules, 2013, 59(6): 184-191.
[23] 王兆梅, 李琳, 郭杞远, 等. 多糖结构修饰研究进展[J]. 中国医药工业杂志, 2002, 33(12): 616-620.
[24] MISAKI A, KAKUTA M, SASAKI T M, et al. Studies on interrelation of structure and antitumor effects of polysaccharides: antitumor action of periodate modified, branched (1→3) β-D-glucan of Auricularia auricular judee, and other p olysaccharides containing (1→3) β-glucosidic linkages[J]. Carbohydrate Research, 1981, 92(1): 115-129.
[25] SINHA S, ASTANI A, GHOSH T, et al. Polysaccharides from Sargassum tenerrimum: structural features, chemical modification and anti-viral activity[J]. Phytochemistry, 2010, 71(2): 235-242.
[26] HRICOVINI M, GUERRINI M, BISIO A, et al. Conformation of heparin pentasaccharide bound to antithrombin Ⅲ[J]. Biochemical Journal, 2001, 59: 265-272.
[ 27] WANG J, GONG X. Advancesin the studies on the antitumor activity and immunomodulating action of polysacchrides[J]. Chinese Journal of Biochemical Pharmaceutics, 2001, 22(1): 52-54.
Purification and Structural Analysis of a Polysaccharide from Bitter Gourd (Momordica charantia)
CHEN Hongman, GUO Longwei, ZHANG Shaozai, LIU Jiangman, ZHANG Haiyan, KAN Guoshi
*
(College of Bioscience and Biotechnology, Shenyang Agricultural University, Shenyang 110866, China)
Abstract:In this research, a water-soluble polysaccharide (MCP Ⅱa) w as extracted from Momordica charantia by cellulase hydrolysis, precipitated with ethanol, and then puri☒ed by DEAE-52 cellulose anion-exchange and Sephadex G-100 gel☒ltration chromatography. The high performance gel permeation chromatography (HPGPC) analysis showed that the average molecular weight of MCP Ⅱa was 13.0 kD. Monosaccharides analysis revealed that the MCP Ⅱa was composed of Rha, GalA, Gal, Xyl and Ara with a relative molar ratio of 12:3.05:19.89:5.95:56. Infrared (IR) spectrum, 13C-nuclear magnetic resonance (NMR) and Cango-red tests indicated that MCP Ⅱa formed a β-triple helix in aqueous solution and the C1, C2 and C3, C5 positions were its binding sites. Moreover, it existed as a rhombus crystal under a scanning electron microscope.
Key words:Momordica charantia; polysaccharide; purification; structural analysis
中图分类号:O629.12
文献标志码:A
文章编号:
doi:10.7506/spkx1002-6630-201510018
收稿日期:2014-04-14
基金项目:国家自然科学基金面上项目(31271842)
作者简介:陈红漫(1969—),女,副教授,博士,主要从事食品生物化学研究。E-mail:chenhm99@sina.com
*通信作者:阚国仕(1971—),男,副教授,硕士,主要从事酶学与生物活性物质研究。E-mail:kanguoshi@163.com