
图1 混合对照品(A)和样品(B)色谱图
Fig.1 Chromatograms of standard mixture (A) and real sample (B)
陈军华,周光明 *,秦红英,程洪梅,沈 洁
(西南大学化学化工学院,发光与实时分析教育部重点实验室,重庆 400715)
摘 要:目的:建立高效液相色谱法分离测定翻白草中绿原酸、咖啡酸、金丝桃苷、槲皮素、柚皮素、山柰酚和芹菜素7 种成分的方法。方法:采用Phenomenex C 18色谱柱(150 mm×4.6 mm,5 μm)分离7 种成分;流动相为甲醇和pH 3的乙酸溶液,梯度洗脱;流速1.0 mL/min,紫外检测波长350 nm,柱温40 ℃。结果:7 种成分在20 min内均达到基线分离,线性关系良好(r>0.999 5),平均回收率为84.61%~104.06%(相对标准偏差小于4.77%,n=3)。结论:翻白草中7 种活性成分的最佳提取条件为80%甲醇溶液、固液比1∶50(g/mL)、超声功率160 W、超声时间20 min。实际样品的测定结果表明,翻白草中7 种活性成分的含量为:绿原酸121.5 μg/g、咖啡酸60.5 μg/g、金丝桃苷127.2 μg/g、槲皮素108.6 μg/g、柚皮素294.0 μg/g、山柰酚61.1 μg/g和芹菜素114.0 μg/g。
关键词:高效液相色谱;翻白草;黄酮类化合物;有机酸
翻白草(Potentilla discolor Bunge)为蔷薇科植物翻白草的带根全草,始载于《救荒本草》,其根肥厚,去皮色白,叶面青背白,故名翻白草。其味甘、微苦、性平,归肝、胃大肠经,具有清热解毒、凉血止血的功效,可用于治疗肺热咳喘、泻痢、疟疾、咳血、吐血、便血、崩漏、痈肿疮毒等疾病 [1]。国内外关于翻白草化学成分的研究 [2-11]表明其主要成分为萜类、甾体、多酚类及黄酮类化合物。近几年很多实验 [12-19]表明翻白草中的黄酮类化合物具有降血糖、治疗糖尿病等功效,其中黄酮类化合物主要有槲皮素、山柰酚、芹菜素、金丝桃苷和柚皮素 [20]等。目前,鲜有关于翻白草中黄酮类化合物定量测定的报道,石磊等 [21]采用索氏提取法提取并测定了翻白草中的总黄酮,但该提取方法繁琐且耗时;刘思曼等 [22]用反相高效液相色谱仅仅测定了其中的槲皮素和山柰酚,本实验首次实现了同时分离和测定其中的多种黄酮类化合物。另据文献[23-26]报道绿原酸和咖啡酸具有保护DNA活性和抗氧化等多种药理作用,故本实验也对翻白草中的绿原酸和咖啡酸进行了分离和测定。本研究以高效液相色谱-紫外检测(high performance liquid chromatography-ultraviolet,HPLC-UV)法作为分离测定手段,采用超声波提取法前处理样品,实现对翻白草中5 种黄酮类化合物和2 种有机酸的分离及含量测定,以期为翻白草的开发和利用提供实验依据。
1.1 材料与试剂
翻白草购于重庆药房。
绿原酸、咖啡酸、金丝桃苷、槲皮素、柚皮素、山柰酚、芹菜素对照品(纯度均≥98.5%) 上海晶纯实业有限公司;甲醇(色谱纯)、乙酸(分析纯) 重庆川东化工有限公司化学试剂厂;二次蒸馏水(实验室自制)。
1.2 仪器与设备
LC-20A HPLC仪(包括SPD-20A紫外检测器、CTO-10AS柱温箱、LC-20AT泵) 日本岛津公司;KH-3200B型超声波清洗器 昆山禾创超声仪器有限公司;SZ-2自动双重纯化水蒸馏器 上海泸西分析仪器厂有限公司;XY型电热恒温干燥箱 上海精宏实验设备有限公司;FA2004A型分析天平 上海精天电子仪器有限公司。
1.3 方法
1.3.1 色谱条件
色谱柱为Phenomenex C 18(150 mm×4.6 mm, 5 μm);流动相:以甲醇为流动相B,乙酸(pH 3.0)为流动相A,进行梯度洗脱(0~5 min,30%→57% B;5~10 min,57%→57% B;10~15 min,57%→30% B;15~20 min,30%→30% B);流速:1.0 mL/min;进样量:20 μL;检测波长:350 nm;柱温:40 ℃。
1.3.2 对照品溶液的制备
精确称取绿原酸、咖啡酸、金丝桃苷、槲皮素、柚皮素、山柰酚和芹菜素对照品适量分别置于10 mL容量瓶中,甲醇溶解稀释至刻度,得到质量浓度分别为500、500、742、550、680、570、560 μg/mL的对照品溶液。分别精确吸取绿原酸、咖啡酸、金丝桃苷、槲皮素、山柰酚和芹菜素对照品溶液0.8 mL和柚皮素对照品溶液1.2 mL于10 mL容量瓶中,用甲醇稀释至刻度,制成混合对照品溶液,置于冰箱(4 ℃)内避光保存备用。
1.3.3 供试品溶液的制备
精确称取干燥粉碎的翻白草粉末(60 目筛)0.1 g,加入5 mL体积分数为80%甲醇溶液,超声(160 W, 4 kHz)萃取20 min,萃取液离心(3 500 r/min)10 min,取上清液经0.45 μm有机滤膜过滤,取续滤液作为供试品溶液,按1.3.1节条件测定混合对照品和样品。
2.1 混合对照品和样品的色谱图
混合对照品和样品的色谱图见图1。

图1 混合对照品(A)和样品(B)色谱图
Fig.1 Chromatograms of standard mixture (A) and real sample (B)
2.2 单因素试验结果
2.2.1 流动相的选择
比较乙腈-水、乙醇-水、甲醇-水、四氢呋喃-水作为流动相的分离效果。用乙腈和乙醇分别与水作为流动相时,槲皮素和柚皮素的分离效果很差;四氢呋喃-水作为流动相不能很好地分离山柰酚和芹菜素。当用甲醇-水作为流动相时各物质能够彼此分离,但是绿原酸和咖啡酸的峰对称性不好;进一步实验了不同pH值的流动相以改善峰形,当用pH 3的乙酸溶液代替纯水时,乙酸能抑制绿原酸和咖啡酸的解离从而有效改善其峰的前延和拖尾。开始尝试用50%甲醇比例等度洗脱,7 种被测成分出峰时间太早,并且槲皮素和柚皮素以及山柰酚和芹菜素无法分开,逐渐减小甲醇比例,山柰酚和芹菜素勉强能够分开,但是出峰时间太晚且峰形展宽严重。故最终选择甲醇和pH 3的乙酸溶液作为流动相按1.3.1节中的梯度洗脱程序进行梯度洗脱。
2.2.2 提取溶剂的选择
比较甲醇、乙醇和环己烷3 种提取溶剂的提取效果,发现甲醇的提取量明显高于另外2种溶剂,故选择甲醇作为提取溶剂。同时进一步考察不同比例的甲醇-水溶液对有效成分提取量的影响,实验结果见图2。甲醇的体积分数由60%增大至100%时,柚皮素的提取量明显增大,其余6 种被测成分的提取量变化比较平缓。
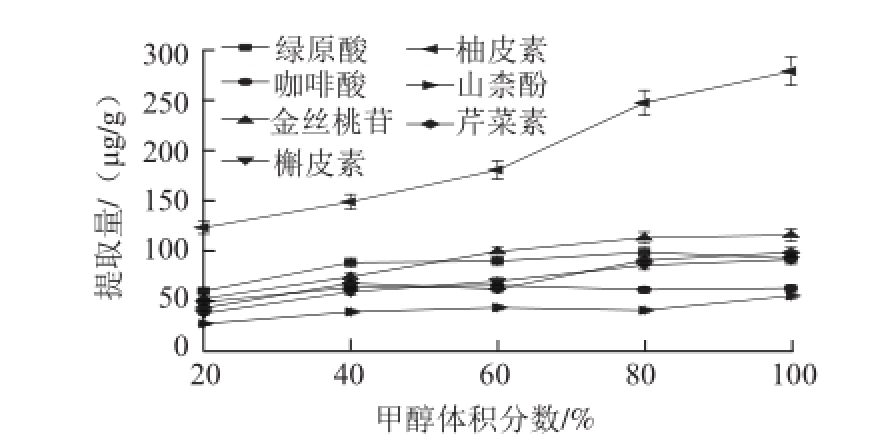
图2 甲醇体积分数对提取量影响
Fig.2 Effect of methanol concentration on the extraction efficiencies of flavonoids and organic acids
2.2.3 超声时间和功率的影响
超声萃取时间和功率是影响提取量的重要因素,实验比较了甲醇超声10、20、30、40 min和50 min被测成分的提取量,结果见图3。随着超声时间的延长,7 种被测成分的提取量不断增大;超声时间大于30 min后提取率增加不明显。同时也考察了不同超声提取功率对7 种被测成分提取量的影响。从图4可以看出,超声功率对各成分的提取量影响不是很大,在功率大于120 W时,除了柚皮素的提取量不大外,其余各成分基本达到最大的提取量。
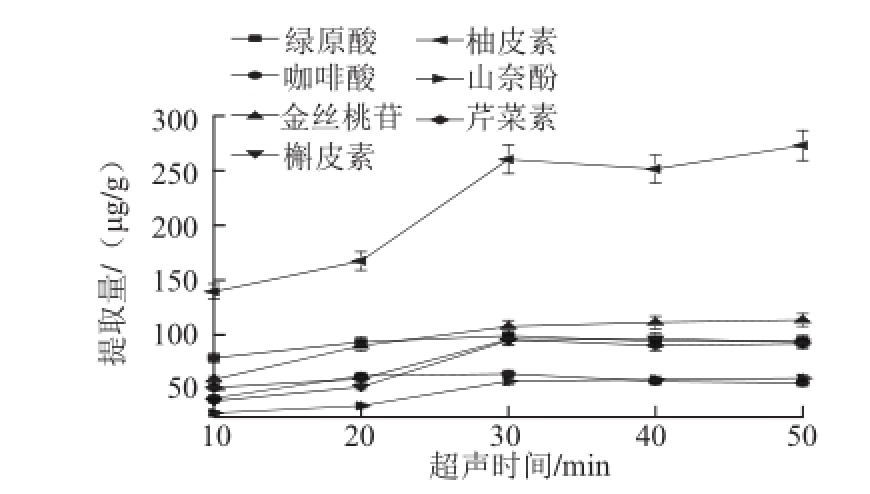
图3 超声时间对提取量的影响
Fig.3 Effect of sonication time on the extraction efficiencies of flavonoids and organic acids

图4 超声功率对提取量的影响
Fig.4 Effect of sonication power on the extraction efficiencies of flavonoids and organic acids
2.2.4 波长和固液比的选择
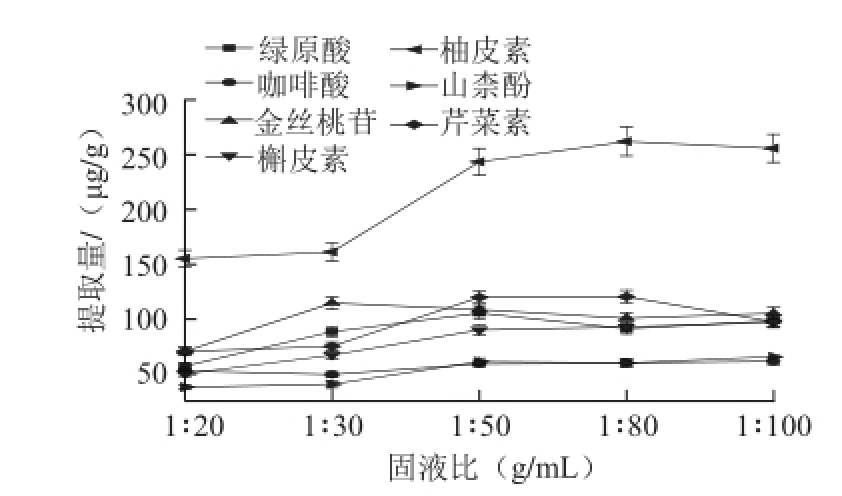
图5 固液比对提取量的影响
Fig.5 Effect of solid to liquid ratio on the extraction efficiencies of flavonoids and organic acids
对比5 种黄酮类化合物在360 nm波长处都有较强的紫外吸收,再结合绿原酸和咖啡酸的测定波长,综合考虑后确定350 nm作为检测波长。比较固液比为1∶20、1∶30、1∶50、1∶80和1∶100(g/mL)的提取效果。图5结果表明,不同成分随固液比的变化趋势不一样,从1∶20~1∶100的变化中,绿原酸、金丝桃苷。柚皮素和芹菜素的提取量先增大后减小;另外3 种成分的提取量一直增大;在固液比为1∶50和1∶80的条件下,7 种成分的提取量相当。
2.3 正交试验结果
综合考虑单因素试验结果,本实验采用L 9(3 4)正交试验进一步优化各参数,其中主要考察甲醇体积分数、固液比、超声时间和超声功率4 个影响因素,各取3个水平。试验中利用7 种成分的总提取量来评价萃取性能。正交试验设计的结果及直观分析见表1。
表1 正交试验设计及结果分析
Table1 Orthogonal array design and range analysis of experimental results
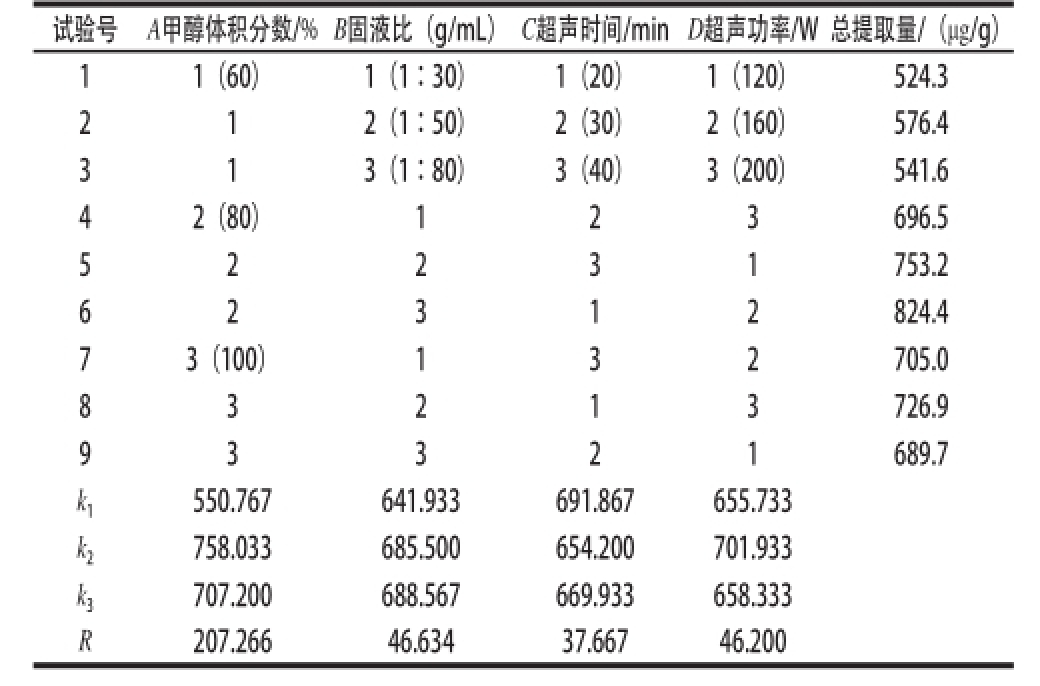
试验号A甲醇体积分数/%B固液比(g/mL)C超声时间/min D超声功率/W总提取量/(μg/g) 11(60)1(1∶30)1(20)1(120)524.3 2 1 2(1∶50)2(30)2(160)576.4 3 1 3(1∶80)3(40)3(200)541.6 42(80)123696.5 5 2 2 3 1 753.2 6 824.4 73(100)132705.0 8 3 2 1 3 726.9 2 3 1 2 9 3 3 2 1 689.7 k 1550.767641.933691.867655.733 k 2758.033685.500654.200701.933 k 3707.200688.567669.933658.333 R207.26646.63437.66746.200
从表1极差R可知,各因素对7 种成分总提取量的影响程度依次为A>B>D>C,即甲醇体积分数是影响总提取量的主要因素,固液比和超声功率的影响次之,超声时间的影响最小。比较k 1、k 2、k 3的值可得提取7种成分的最佳条件为:A 2B 3C 1D 2,即甲醇体积分数80%、固液比1∶80、超声时间20 min、超声功率160 W。另外对比因素固液比的k 2和k 3的值发现两者相差甚微(分别为685.500和688.567),即固液比为1∶50和1∶80的提取量相当,为了节约提取溶剂,选择固液比为1∶50。故优化最终条件为:A 2B 2C 1D 2,即甲醇体积分数80%、固液比1∶50、超声时间20 min、超声功率160 W。
2.3 线性关系考察
精确吸取1.3.2节混合对照品溶液,以甲醇逐步稀释成7 个不同质量浓度的混合对照品溶液。取不同质量浓度的混合对照品溶液按质量浓度由低到高依次进样20 μL,在1.3.1节色谱条件进行分析。以对照品质量浓度为横坐标X(μg/mL)、峰面积为纵坐标Y(10 -3mV)进行线性回归。7 种被测成分的线性关系考察结果见表2。
表2 7种被测成分的线性方程、线性范围和相关系数
Table2 Regression equations with linear range and correlation coefficients for 7 compounds
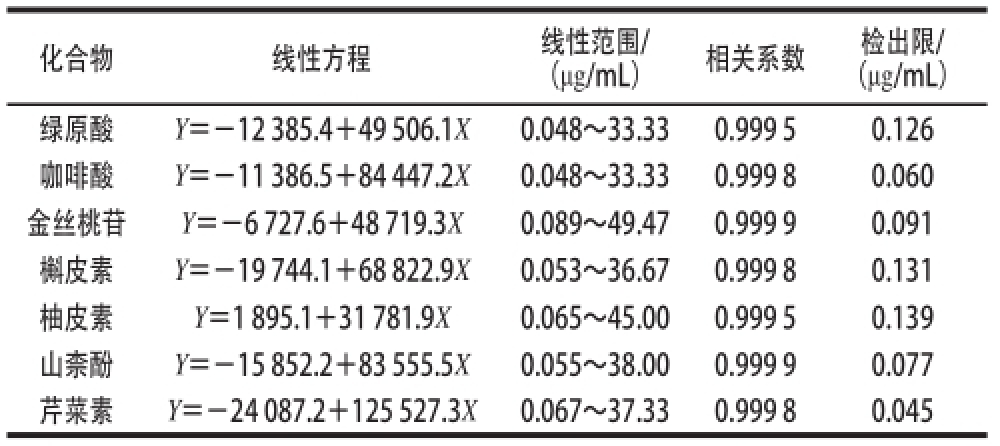
(μg/mL)相关系数检出限/ (μg/mL)绿原酸Y=-12 385.4+49 506.1X0.048~33.330.999 50.126咖啡酸Y=-11 386.5+84 447.2X0.048~33.330.999 80.060金丝桃苷Y=-6 727.6+48 719.3X0.089~49.470.999 90.091槲皮素Y=-19 744.1+68 822.9X0.053~36.670.999 80.131柚皮素Y=1 895.1+31 781.9X0.065~45.000.999 50.139山柰酚Y=-15 852.2+83 555.5X0.055~38.000.999 90.077芹菜素Y=-24 087.2+125 527.3X0.067~37.330.999 80.045化合物线性方程线性范围/
2.4 精密度
取混合对照品溶液重复进样6 次,测定各个对照品的峰面积,结果绿原酸、咖啡酸、金丝桃苷、槲皮素、柚皮素、山柰酚和芹菜素峰面积的相对标准偏差(relative standard deviation,RSD)分别为1.37%、1.86%、1.91%、2.38%、1.03%、1.50%、2.65%,表明仪器精确度良好。
2.5 稳定性
精确吸取同一供试品溶液2 d内每间隔4 h进样测定,结果绿原酸、咖啡酸、金丝桃苷、槲皮素、柚皮素、山柰酚和芹菜素峰面积的RSD分别为2.52%、2.19%、0.66%、1.49%、2.13%、2.08%、2.19%,表明供试品溶液稳定性良好。
2.6 重复性
取同批样品粉末5 份,按1.3.3节制备供试品溶液,重复进样测定,计算绿原酸、咖啡酸、金丝桃苷、槲皮素、柚皮素、山柰酚和芹菜素峰面积的RSD(n=5)分别为1.27%、2.50%、1.97%、2.01%、2.16%、1.60%、1.22%,表明仪器具有良好的重复性。
2.7 样品的含量测定及回收率
称取0.1 g样品粉末3 份,按1.3.3节的方法制备供试品溶液,每份供试品溶液进样分析3 次,根据表2中对应的线性方程计算样品含量,结果见表3。称取9 份翻白草样品各0.1 g,分为3 组,每组按低、中、高分别加入一定量的对照品溶液,然后均依供试品制备方法、测定方法分析,每份重复进样3 次,计算平均回收率,结果见表3。
表3 样品含量测定及加标回收率实验(n=3)
Table3 Spiked recoveries of real samples (n = 3)

化合物样品中含量/μg加入量/μg测得量/μg回收率/%平均回收率/%RSD/% 10.0021.6795.14绿原酸12.1512.0023.4093.73 14.0025.2293.33 94.071.01 5.0011.09100.85咖啡酸6.056.0012.45106.69 7.0013.37104.65 104.062.85 10.0022.98102.63金丝桃苷12.7212.0024.3997.26 14.0026.0795.39 98.423.82 8.0018.5896.51槲皮素10.8610.0020.2393.71 12.0022.1694.14 94.791.59 8.0036.0182.57柚皮素29.4010.0038.2188.10 12.0039.3883.17 84.613.59 5.0011.33104.36山柰酚6.116.0012.0699.14 7.0012.7594.89 99.464.77 10.0020.9695.60芹菜素11.4012.0022.0989.06 14.0024.9696.84 93.834.45
本实验利用HPLC-UV法,实现了翻白草中绿原酸、咖啡酸、金丝桃苷、槲皮素、柚皮素、山柰酚和芹菜素7 种活性成分的同时分离及含量测定,取得了满意的效果,实际样品的测定结果表明:翻白草中7 种活性成分的含量为绿原酸121.5 μg/g、咖啡酸60.5 μg/g、金丝桃苷127.2 μg/g、槲皮素108.6 μg/g、柚皮素294.0 μg/g、山柰酚61.1 μg/g和芹菜素114.0 μg/g。采用超声萃取前处理样品,方法快速、简单、经济。分别考察了不同流动相、甲醇体积分数、固液比、超声功率及时间对提取7 种被测成分的影响,优化得到最佳提取条件,为药用植物翻白草的质量控制提供了实验依据。
参考文献:
[1] 国家中医药管理局. 中华本草[M]. 上海: 上海科学技术出版社, 2005: 178 -179.
[2] 李杨, 高贺, 谷晓策, 等. 翻白草化学成分及药理活性研究进展[J].时珍国医国药, 2011, 22(3): 612-614.
[3] 毕博, 牛春林, 包京姗, 等. 翻白草化学成分研究[J]. 吉林农业大学学报, 2010, 32(4): 425-427.
[4] 张莉, 杨杰, 陈筱清, 等. 翻白草的化学成分[J]. 植物资源与环境学报, 2010, 19(2): 94-96.
[5] 张俭, 李胜华, 胡浩, 等. 翻白草活性成分的萃取[J]. 食品工业科技, 2008, 29(3): 159-160.
[6] 张巍巍, 张鹏, 程伟, 等. 翻白草中多酚类化学成分研究[J]. 中国药学杂志, 2011, 46(1): 20-23.
[7] 王琦, 徐德然, 石心红, 等. 翻白草中的黄酮类成分[J]. 中国天然药物杂志, 2009, 7(5): 361-364.
[8] 洪凌, 何贵锋, 高妮, 等. 翻白草黄酮类化学成分研究[J]. 中国实验方剂学杂志, 2013,19(8): 117-119.
[9] 薛培凤, 尹婷, 梁鸿, 等. 翻白草化学成分研究[J]. 中国药学杂志, 2005, 40(14): 1052-1054.
[10] 孟令云, 杨玲, 王佳祥, 等. 翻白草中黄酮类化合物的液相色谱分析[J].中草药, 2005, 36(3): 445-446.
[11] 鞠福龙, 王佳祥, 孟令云, 等. 翻白草中三萜类化合物含量的液相色谱分析[J]. 化学工程师, 2008(7): 26-27.
[12] SONG Chengwu, HUANG Long, RONG Lin, et al. Antihyperglycemic effect of Potentilla discolor decoction on obesediabetic (Ob-db) mice and its chemical composition[J]. Fitoterapia, 2012, 83: 1474-1483.
[13] ZHANG Li, YANG Jie, CHEN Xiaoqing, et al. Anti-diabetic and antioxidant effects of extracts from Potentilla discolor Bunge on diabetic rats induced by high fat diet and streptozotocin[J]. Journal of Ethnopharmacology, 2010, 132: 518-524.
[14] YANG Jie, CHEN Hong, ZHANG Li, et al. Effect of standardized extract of Potentilla discolor Bunge and identification of its active components[J]. Drug Development Research, 2010, 71: 127-132.
[15] 金泉, 南极星, 廉丽花. 翻白草诱导人肝癌细胞HepG-2凋亡的研究[J].中国天然药物杂志, 2011, 9(1): 61-64.
[16] 王琦, 周玲仙, 罗晓东, 等. 翻白草不同方法提取物对小鼠降血糖作用[J]. 中国公共卫生, 2007, 23(2): 225-226.
[17] 边树蕊, 杨葵华. 用植物翻白草中黄酮的提取工艺研究[J]. 产业与科技论坛, 2012, 11(14): 78-80.
[18] 李胜华, 伍贤进, 郁建平, 等. 超声波提取翻自草中熊果酸工艺优化研究[J]. 食品科学, 2007, 28(7): 160-163.
[19] 孟令云, 朱黎霞, 郑海洪, 等. 翻白草对高血糖动物模型的作用研究[J].中国药理学通报, 2004, 20(5): 588-590.
[20] 邹俊利. 翻白草的研究进展[J]. 黑龙江医药科学, 2006, 29(4): 104-105.
[21] 石磊, 扬红兵. 翻白草中总黄酮的提取及含量测定[C]//第七届全国中药鉴定学术研讨会暨第六届全国中药鉴定学教学研讨会. 2005: 228-231.
[22] 刘思曼, 边清泉. RP-HPLC法测定翻白草中山奈酚、槲皮素的含量[J].绵阳师范学院学报, 2006, 25(5): 37-39.
[23] YEN W J, WANG B S, CHANG L W, et al. Antioxidant properties of roasted coffee residues[J]. Jounal of Agricultural and Food Chemistry, 2005, 53: 2658-2663.
[24] TANG Youzhi, LIU Zaiqun. Chemical kinetic behavior of chlorogenic acid in protecting erythrocyte and DNA against radical-induced oxidation[J]. Jounal of Agricultural and Food Chemistry, 2008, 56: 11025-11029.
[25] XU Jianguo, HU Qingping, YU Liu. Antioxidant and DNA-protective activities of chlorogenic acid isomers[J]. Jounal of Agricultural and Food Chemistry, 2012, 60: 11625-11630.
[26] ZHAO Jun, ZHANG Zhan, DAI Jinfeng, et al. Synergistic protective effect of chlorogenic acid, apigenin and caffeic acid against carbon tetrachloride-induced hepatotoxicity in male mice[J]. RSC Advances, 2014, 4: 43057-43063.
Ultrasonic Extraction and Determination of Seven Flavonoids and Organic Acids in Potentilla discolor Bunge
CHEN Junhua, ZHOU Guangming
*, QIN Hongying, CHENG Hongmei, SHEN Jie
(Key Laboratory on Luminescence and Real-Time Analysis (Southwest University), Ministry of Education, School of Chemistry and Chemical Engineering, Southwest University, Chongqing 400715, China)
Abstract:Objective: To establish a high performance liquid chromatography (HPLC) method for separation and determination of chlorogenic acid, caffeic acid, hyperoside, quercetin, naringenin, kaempferol and apigenin in Potentilla discolor bunge. Methods: The separation of seven flavonoids and organic acids was performed on Phenomenex C 18column (150 mm × 4.6 mm, 5 μm) with gradient elution. The mobile phase was a mixture of methanol and acetic acid (pH 3.0)at a flow rate of 1.0 mL/min and the UV detection wavelength was 350 nm. Results: Baseline separation of chlorogenic acid, caffeic acid, hyperoside, quercetin, naringenin, kaempferol and apigenin was achieved within 20 min. The calibration curves of the seven components showed linear relationships (r > 0.999 5). The average recoveries were in the range of 84.61%-104.06% with a relative standard deviation (RSD) of less than 4.77%. Conclusion: The optimal extraction conditions for seven flavonoids and organic acids from Potentilla discolor Bunge were determined as follows: ethanol concentration, 80%; solid-to-liquid ratio, 1:50 (g/mL); ultrasonication power, 160 W; and ultrasonication time, 20 min. One gram of Potentilla discolor Bunge contained 121.5 μg of chlorogenic acid, 60.5 μg of caffeic acid, 127.2 μg of hyperoside, 108.6 μg of quercetin, 294.0 μg of naringenin, 61.1 μg of kaempferol, and 114.0 μg of apigenin as determined by this method.
Key words:high performance liquid chromatography (HPLC); Potentilla discolor Bunge; flavonoids; organic acids
中图分类号:TS201.2
文献标志码:A
文章编号:
doi:10.7506/spkx1002-6630-201510019
收稿日期:2014-09-22
基金项目:国家自然科学基金面上项目(21277110)
作者简介:陈军华(1989—),男,硕士研究生,研究方向为色谱分析。E-mail:chenjunh999@163.com
*通信作者:周光明(1964—),男,教授,博士,研究方向为色谱及其联用技术。E-mail:gmzhou@swu.edu.cn