
图1 标准品有机酸色谱图
Fig. 1 Chromatogram of mixed organic acid standards
杨 巍 1,高文民 2,马海仲 3,王柏松 1,和 阳 1,吕春晶 1,魏 潇 1,张素敏 1,*
(1.辽宁省果树科学研究所,辽宁 熊岳 115009;2.吉林省抚松县松江河镇农业技术推广站,吉林 抚松 134504;3.长白山森工集团安图林业有限公司,吉林 安图 133600)
摘 要:将‘澳洲青苹’样品去除果皮、果心,采用液相色谱法,研究破碎处理方式、浸提条件、测定前样品贮藏条件对其果肉组织有机酸组成与含量的影响。结果表明:人工研磨与机械匀浆都是样品破碎处理的有效手段,其选择要视实验目的、要求及具体实施情况而定。浸提温度与振荡时间对提取效果没有显著影响,以在常温(25 ℃)条件下超声波振荡提取15 min为宜。样品前处理后最好立即检测分析,如不能立即进行,则以将破碎后经离心处理的样品保存在常温、光照条件下做短期贮藏为好。‘澳洲青苹’果实中含有草酸、奎尼酸、苹果酸、莽草酸和柠檬酸5 种有机酸,含量顺序为苹果酸>奎尼酸>柠檬酸>草酸>莽草酸,苹果酸是最为主要的有机酸,同一果实中不同有机酸与不同果实中相同有机酸含量相差悬殊,实验时要注意试材的选取。
关键词:液相色谱;苹果;有机酸;前处理技术
苹果是中国北方栽培规模与产量最高的大众水果,因其味美多汁并富含多种营养成分而备受广大消费者青睐,有机酸是苹果果实中的主要营养成分和口感风味物质 [1],苹果中有机酸组成与含量分析对苹果品质评价与引导科学饮食至关重要。前人对有机酸的研究由来已久,内容含盖了不同树种、同一果树不同品种与多种栽培处理条件下果树器官尤其果实中有机酸组分及其发育生理研究等诸多方面,在此过程中逐渐摸索出了酸碱滴定法 [2-4]、气相色谱法 [5-7]与液相色谱法 [8-15]等多种有机酸检测方法,为水果营养评价与风味描述以及形成机制研究提供理论与技术参考,但3 种方法又各有不同,酸碱滴定法只能测定样品中的总酸含量,而且精确度较低,气相色谱法处理样品时需要增加衍生步骤才能完成,复杂繁琐,相比之下,液相色谱法具有操作简便、准确度高、重现性好等优点 [16-22],在同一条件下可同时检测多种有机酸,是有着广阔发展前景的方法技术。虽然前人借助液相色谱法对有机酸的研究涉及了众多方面并取得了深入进展,但大多是借鉴其他领域科研实验中所应用的现成技术,有的略加改进,大多直接照搬,较为系统完善的实验方法尤其前处理技术尚未见报道,导致具体实验过程中经常出现误差甚至错误。本研究计划以‘澳洲青苹’苹果果实为试材,通过对破碎方式、浸提时间与温度以及样品贮藏条件的筛查、比对,建立利用液相色谱进行有机酸分析检测的一整套较为科学的、行之有效的前处理技术,为苹果中有机酸组分精准定性、定量分析提供技术参考。
1.1 材料与试剂
采用成熟的‘澳洲青苹’苹果果实,于2012年10月取自辽宁省果树科学研究所实验区。草酸、奎尼酸、苹果酸、莽草酸、柠檬酸 美国Sigma公司。
1.2 仪器与设备
十万分之一电子天平 瑞士梅特勒-托利多公司;超纯水系统 美国密理博公司;制冰机 日本三洋公司;KQ 5200型超声波提取器 中国江苏昆山舒美超声仪器有限公司;离心机 上海安亭科学仪器厂;U-3000型液相色谱仪(配有紫外检测器) 美国赛默飞世尔科技公司。
1.3 方法
1.3.1 样品前处理
取大小相似、成熟度相近的‘澳洲青苹’苹果果实,去除果皮、果心,纵向切成月牙形果块,以偏磷酸为浸提液,样液比为1∶4(g/mL),于同一果实中取材进行人工研磨和机械匀浆、超声波处理温度与时间、贮藏条件的研究,材料破碎后转移至离心管中,在转速为10 000 r/min条件下离心10 min,取上清液经0.45 μm滤头过滤保存,待上机检测。以上每处理重复3 次。
1.3.2 实验设计
样品破碎采用室温(25 ℃)条件下人工研磨与机械匀浆两种处理方式;超声波功率200 W,振荡于室温(25 ℃)条件下分别处理15、30、60 min;浸提温度设25 ℃和0 ℃两个梯度;样品贮藏设不离心25 ℃光照贮藏3 d和离心25 ℃光照贮藏3 d两种方式,以前处理完成经离心后立即检测为对照;样品贮藏设置25 ℃光照、25 ℃避光和-50 ℃避光3 个条件;不同果实是由同一果园中‘澳洲青苹’成龄树上采集的果实中随机抽取的样品,可能来自于不同单株或同一单株的不同位置。
1.3.3 色谱条件
利用紫外检测器进行有机酸定量测定,采用Agilent ZOBAX C 18柱(250 mm×4.6 mm,5 μm),柱温20 ℃,流动相比例为0.2%的偏磷酸,检测波长214 nm,流速1.0 mL/min,利用戴安变色龙软件进行仪器操作程序控制与数据处理。
2.1 液相色谱分析谱图

图1 标准品有机酸色谱图
Fig. 1 Chromatogram of mixed organic acid standards
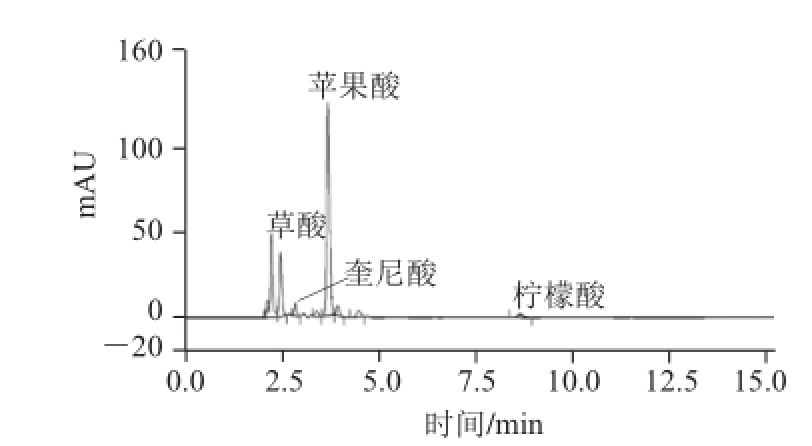
图2 样品有机酸色谱图
Fig.2 Chromatogram of organic acids in sample
图1、2分别为标准及样品中有机酸液相色谱分析谱图,保留时间分别为:草酸2.47 min、奎尼酸2.92 min、苹果酸3.87 min、莽草酸4.23 min、柠檬酸9.07 min。
2.2 破碎处理方式对有机酸提取效果的影响
表1 人工研磨与机械匀浆处理样品各种有机酸含量
Table1 Organic acid contents in ‘Granny Smith’ apple fruit pulp samples obtained by manual grinding and mechanical homogenization

注:同列大写字母不同表示差异极显著(P<0.01),小写字母不同表示差异显著(P<0.05),未标注字母表示差异不显著。下同。
mg/g破碎处理草酸奎尼酸苹果酸莽草酸柠檬酸有机酸总量人工研磨0.119 8±0.005 8 aA0.300 3± 0.033 57.454 4±0.275 20.008 2±0.000 30.156 4±0.027 28.039 0±0.244 9机械匀浆0.100 6±0.005 5 bA0.352 7±0.038 27.332 2±0.340 30.008 8±0.000 80.145 4±0.010 87.939 7±0.380 7
实验采用了人工研磨与机械匀浆两种破碎处理方式,检测结果(表1)表明,经研磨处理的样品草酸含量显著高于匀浆处理样品,但数值相差不是很大,而其他4 种有机酸含量虽也存在差别,但互有大小,相差微弱,并不显著。人工研磨与机械匀浆均为样品破碎处理的有效方法,总体来看,二者没有明显的优劣之分,实验中应依具体情况选择确定。本研究后续实验都采用机械匀浆。
2.3 超声波振荡时间对有机酸提取效果的影响
表2 不同时间超声波振荡处理样品各种有机酸含量
Table2 Organic acid contents in ‘Granny Smith’ apple fruit pulp samples extracted with different ultrasonic oscillation durations
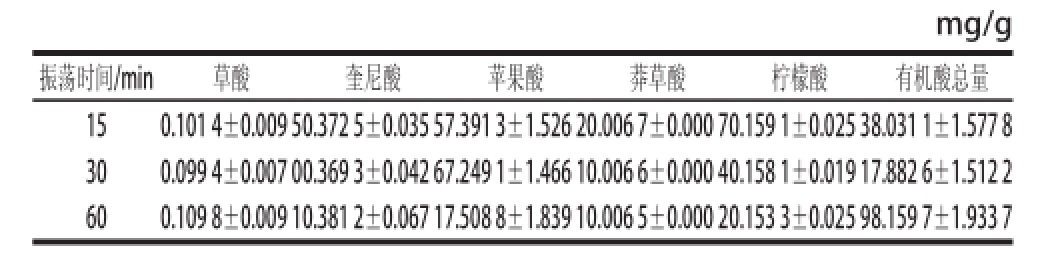
mg/g振荡时间/min草酸奎尼酸苹果酸莽草酸柠檬酸有机酸总量15 0.101 4±0.009 50.372 5±0.035 5 7.391 3±1.526 2 0.006 7±0.000 7 0.159 1±0.025 3 8.031 1±1.577 8 300.099 4±0.007 0 0.369 3±0.042 6 7.249 1±1.466 1 0.006 6±0.000 4 0.158 1±0.019 1 7.882 6±1.512 2 600.109 8±0.009 1 0.381 2±0.067 1 7.508 8±1.839 1 0.006 5±0.000 2 0.153 3±0.025 9 8.159 7±1.933 7
表2显示,在室温自然光照条件下,处理间各种有机酸获得量数值相近,不存在显著性差异,说明在本实验中,超声波提取时间对目标物质提取效果没有影响。样品前处理过程中选择室温(25 ℃)自然光照条件下超声波振荡提取15 min,既可以保证各类有机酸的获得量,又能够提高实验效率。
2.4 超声波浸提温度对有机酸提取效果的影响
表3 不同浸提温度处理样品各种有机酸含量
Table3 Organic acid contents in ‘Granny Smith’ apple fruit pulp samples extracted at different temperatures

mg/g浸提温度/℃草酸奎尼酸苹果酸莽草酸柠檬酸有机酸总量25 0.0 93 3±0.010 2 0.355 8±0.041 1 6.714 0±0.817 0 0.006 2±0.000 6 0.162 1±0.009 5 aA7.331 4±0.766 6 0 0.092 6±0.009 1 0.337 0±0.020 3 6.750 1±0.765 9 0.006 9±0.001 1 0.127 1±0.007 1 bB7.313 7±0.761 2
实验选取了室温(25 ℃)和0 ℃两个较为常用的温度条件,表3结果显示,二处理间草酸、奎尼酸、苹果酸、莽草酸与5 种有机酸总量极为相近,相差甚微,而柠檬酸含量不是很高,但不同温度获得量相差很大,存在极显著差异。由此表明,前处理过程中,温度会对柠檬酸获得量产生很大影响,在具体实验当中应尽量选择在室温条件下超声波振荡浸提处理方法,这样既能够使柠檬酸取得尽大的获得量而使其更接近真实值,也确保了其他各种有机酸含量的科学性,同时能够降低实验当中因提供低温条件而增加的成本,还可以节省时间,提高实验效率。
2.5 贮藏适宜条件筛选
2.5.1 样品贮藏形式对有机酸检测结果的影响
果实经机械匀浆处理后,经过离心处理与未进行离心处理的样品经过72 h贮藏,以破碎经离心再用0.45 μm超微滤膜过滤后立即检测样品作为对照,表4表明,两种处理方法中,奎尼酸与莽草酸均以经过离心贮藏的样品含量高,而且奎尼酸含量在两种处理间存在显著性差异,但二者大小均极显著低于对照;草酸含量以浆液共存在样品中含量最高,极显著高于浆液分离与对照样品,离心处理后贮藏与立即检测样品草酸含量几乎相同;而苹果酸、柠檬酸在三者之间含量相当,不存在显著差异,说明二者极易溶出且性质十分稳定,同时,含量极高且处理间含量相当的苹果酸也使三者间有机酸总量相近,没有显著差异。因此,利用液相色谱分析‘澳洲青苹’苹果有机酸含量,样品前处理后,最好立即进行分析,如检测不能立即实施,可以对样品进行离心分离处理,然后再进行短期贮藏。
表4 不同贮藏形式样品中各种有机酸含量
Table4 Organic acid contents in ‘Granny Smith’ apple fruit pulp samples with different further treatments
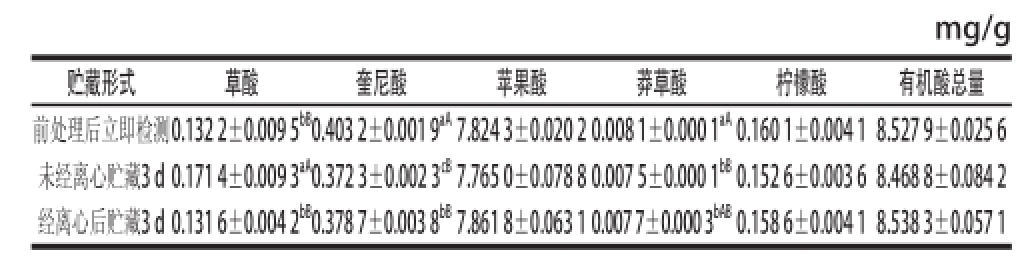
mg/g贮藏形式草酸奎尼酸苹果酸莽草酸柠檬酸有机酸总量前处理后立即检测0.132 2±0.009 5 bB0.403 2±0.001 9 aA7.824 3±0.020 2 0.008 1±0.000 1 aA0.160 1±0.004 1 8.527 9±0.025 6未经离心贮藏3 d 0.171 4±0.009 3 aA0.372 3±0.002 3 cB7.765 0±0.078 8 0.007 5±0.000 1 bB0.152 6±0.003 6 8.468 8±0.084 2经离心后贮藏3 d 0.131 6±0.004 2 bB0.378 7±0.003 8 bB7.861 8±0.063 1 0.007 7±0.000 3 bAB0.158 6±0.004 1 8.538 3±0.057 1
2.5.2 贮藏条件对有机酸检测结果的影响
表5 不同温度光照条件下贮藏样品各种有机酸含量
Table5 Organic acid contents in ‘Granny Smith’ apple fruit pulp samples at different storage temperatures and illumination conditions
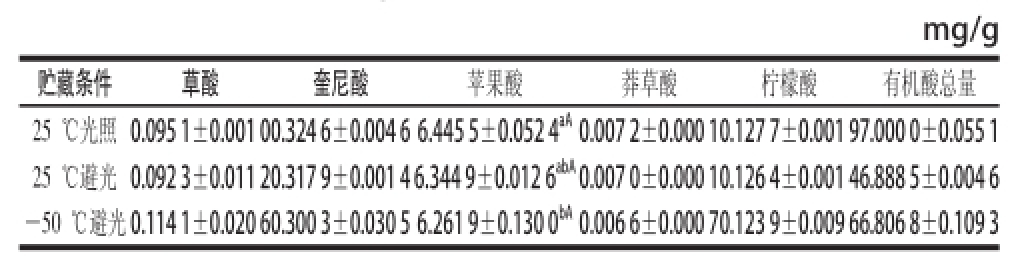
mg/g贮藏条件草酸奎尼酸苹果酸莽草酸柠檬酸有机酸总量25 ℃光照0.095 1±0.001 0 0.324 6±0.004 6 6.445 5±0.052 4 aA0.007 2±0.000 1 0.127 7±0.001 9 7.000 0±0.055 1 25 ℃避光0.092 3±0.011 2 0.317 9±0.001 4 6.344 9±0.012 6 abA0.007 0±0.000 1 0.126 4±0.001 4 6.888 5±0.004 6 -50 ℃避光0.114 1±0.020 6 0.300 3±0.030 5 6.261 9±0.130 0 bA0.006 6±0.000 7 0.123 9±0.009 6 6.806 8±0.109 3
样品经离心分离处理,在不同温度与光照条件下保存3 d,由表5可看出,在条件变化过程中,除草酸含量在冷冻避光条件下稍高一些,其他4 种有机酸均存在由上至下的递减规律,即含量值均为常温光照贮藏最高,常温避光次之,以冷冻避光最低,而且降低幅度很小,奎尼酸、莽草酸、柠檬酸在3 个处理间均不存在显著性差异,仅苹果酸在25 ℃光照与-50 ℃避光处理间存在显著性差异,这是温度与光照共同作用的结果。综上说明贮藏过程中温度与光照条件是影响各类有机酸获得量的主要因素,但影响不大,样品如需保存,应选择常温、光照条件下做短期贮藏。
2.6 ‘澳洲青苹’苹果果实有机酸组分含量
选择常温条件下浸提15 min,前处理后立即检测。图3表明,‘澳洲青苹’果实中含有草酸、奎尼酸、苹果酸、莽草酸和柠檬酸5 种有机酸,以苹果酸含量最高,为7.370 4 mg/g,占各类有机酸总量(8.003 3 mg/g)的92.09%,极显著高于其他4 种有机酸,其他4 种有机酸含量均较低,依次为奎尼酸(0.368 9 mg/g)、柠檬酸(0.154 0 mg/g)、草酸(0.102 8 mg/g),含量最低的为莽草酸(0.007 2 mg/g),仅接近苹果酸含量的1%。‘澳洲青苹’苹果果实有机酸由草酸、奎尼酸、苹果酸、莽草酸和柠檬酸5 种有机酸组成,含量顺序为苹果酸>奎尼酸>柠檬酸>草酸>莽草酸,含量差别大,苹果酸是最为主要的有机酸。
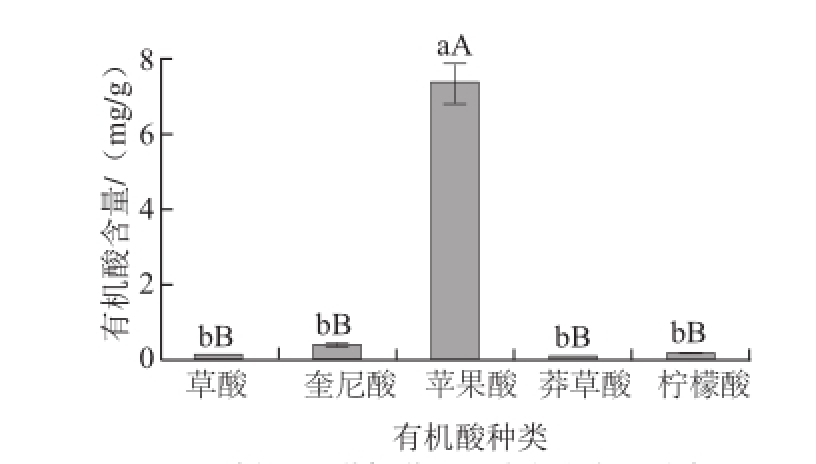
图3 ‘澳洲青苹'苹果果实各类有机酸含量
Fig.3 Organic acid contents in ‘Granny Smith’ apple fruit
2.7 ‘澳洲青苹’苹果不同果实有机酸组分含量
表6 ‘澳洲青苹'苹果不同果实各种有机酸含量
Table6 Organic acid contents in four different ‘Granny Smith’ apples

mg/g实验处理草酸奎尼酸苹果酸莽草酸柠檬酸有机酸总量果A0.100 6±0.005 5 0.352 7±0.038 2 bB7.332 2±0.340 3 bB0.008 8±0.000 8 aA0.145 4±0.010 8 bB7.939 7±0.380 7 bB果B0.098 5±0.003 5 0.333 7±0.017 3 bB6.405 1±0.202 9 cC0.007 0±0.000 5 bB0.143 2±0.006 1 bB6.987 5±0.224 1 cC果C0.100 5±0.011 4 0.425 7±0.025 2 aA9.235 0±0.343 9 aA0.006 3±0.000 1 bB0.181 5±0.007 1 aA9.949 0±0.381 6 aA果D0.111 6±0.004 6 0.363 6±0.012 2 bAB6.509 2±0.166 5 cC0.006 6±0.000 1 bB0.145 9±0.015 7 bB7.136 8±0.164 4 cBC
从表6可以看出,‘澳洲青苹’苹果不同果实中均含有草酸、奎尼酸、苹果酸、莽草酸和柠檬酸5 种有机酸,且含量均为苹果酸>奎尼酸>柠檬酸>草酸>莽草酸;不同果实中有机酸含量不同,甚至相差较大,总量较高的果实中奎尼酸、苹果酸、柠檬酸含量也比较高,只有莽草酸含量不符合该规律,总量最高的果C中莽草酸含量却最低,草酸在不同单果间含量差异并不明显。本实验当中,4 个不同果实有机酸总量以果C最高,为9.949 0 mg/g,以果B最低,为6.987 5 mg/g,相差2.961 5 mg/g,占果B有机酸总量的42.38%,其中苹果酸相差2.829 9 mg/g,占果B苹果酸含量的44.18%,奎尼酸相差0.092 0 mg/g,占果B奎尼酸含量的27.57%,均存在极显著性差异。由此可见,‘澳洲青苹’不同果实中均含有草酸、奎尼酸、苹果酸、莽草酸和柠檬酸5 种有机酸,而且苹果酸>奎尼酸>柠檬酸>草酸>莽草酸,同时各类有机酸含量差异较大,实验时要注意试材的选取。
不断优化、创新实验样品前处理技术,客观、灵活把握具体方法与时间,能够提高实验科学性。前处理是指样品在通过大型仪器设备进行指标分析检测前,对样品进行的令目标物质尽大量溶解在浸提剂中使其含量更接近原始实验材料中真实含量的处理过程,包括样品采集与选择、破碎浸提去杂以及贮藏保存等步骤,从本项研究分析来看,每一环节均会对实验结果产生影响,都至关重要。
首先,本实验中,在管理方式相同的同一果园中树龄相同的‘澳洲青苹’树上选择大小相近、颜色相似的果实作为试材进行有机酸含量的分析,结果表明,有机酸含量高低仍然相差40%以上,这可能是由于试材来自于不同单株或树上不同位置存在同化代谢的不同导致果实营养积累的差异而造成的,景延秋等 [23]在不同叶位烤烟叶片有机酸含量分析中也得到了相似的结论,可以想象,如果材料是来自不同产地、不同管理方式的不同果园中不同外观质量的果实,单个试材间的有机酸含量还将会存在更大差距,这种差异很可能超过实验所允许的误差范围甚至超出处理间的差异,至使误导科学判断甚至得到相反结论,实验选材是每项科研工作的前提和基础,每个科学工作者都应该十分注意。
其次,样品破碎、浸提、去杂过程中,要注意把握好处理的力度与时间长短和指标稳定性的关系。处理力度大、时间长、指标稳定性好的样品,实验结果指标检测获得量越高,越接近真实存在,而如果指标稳定性较差,处理力度越大、时间越长,指标检测获得量可能反而会降低,本实验中草酸和柠檬酸在研磨破碎方法及高温浸提条件下有较高的获得量,因此,实验当中要合理把握样品前处理的方法、力度、时间的搭配,高玉龙等 [24]在不同处理方式的烟叶样品中测定出有机酸含量的差异较大。
再次,处理后样品最好立即完成仪器检测过程,更为科学、真实,否则,一定经过离心去杂后再进行保存,保存时要注意贮藏条件与时间长短的搭配。贮藏过程中,不同贮藏形式样品中草酸、奎尼酸、莽草酸含量的巨大差异以及苹果酸与柠檬酸含量的几近相同,可能是由于这些酸在前处理实验过程中溶解性与稳定性不同,奎尼酸与莽草酸在样品贮藏过程中容易转化或降解,在浆、液共存的环境中发生更为严重,而贮藏过程可能有利于草酸的尽大量溶出和生成,这与人工研磨的样品中有极高草酸含量可能存在相同的原因,研磨能够使果肉破碎更细而使草酸能够尽大量的溶出,而苹果酸、柠檬酸二者极易溶出且性质十分稳定。本实验中经离心分离后的样品中去除了大量果肉碎块,使得样品中物质组分基本保持了上机检测前的原貌,因此,样品溶液内部在贮藏过程中物质间相互转化、降解的较少,各类指标含量与立即检测样品指标含量应该最为相近,是一种比较理想的贮藏形式,而未经离心处理的样品中含有大量的果肉碎块,在这种环境体系中,化学反应与变化的发生可能更为复杂和多样。因此,在苹果有机酸定量分析实验当中,如不能立即进行检测,一定要将样品离心分离,使检测结果趋近客观、真实。
参考文献:
[1] 王海波, 李林光, 陈学森, 等. 中早熟苹果品种果实的风味物质和风味品质[J]. 中国农业科学, 2010, 43(11): 2300-2306.
[2] 唐都, 高疆生, 徐崇志, 等. 阿拉尔垦区不同种植密度下骏枣果实品质的比较[J]. 新疆农业科学, 2012, 49(12): 2208-2212.
[3] 关慧敏, 石玉平, 冯瑛, 等. 大黄中总有机酸的提取工艺及含量测定[J].青海师范大学学报, 2011, 27(1): 39-44.
[4] 刘珍. 化学分析: 上册[M]. 4版. 北京: 化学工业出版社, 2004: 193-205.
[5] 杨式华, 王保兴, 许国旺, 等. 烟草中挥发性和非挥发性有机酸的快速测定[J]. 分析科学学报, 2008, 24(2): 167-172.
[6] CHEN Jiluan, FENG Zuoshan, WU Jihong, et al. Changes in the volatile compounds and physicochemical properties of Wujiuxiang pear fruits during storage[J]. Transactions of the CSAE, 2009, 25(5): 264-269.
[7] 于世林. 图解气相色谱技术与应用[M]. 北京: 科学出版社, 2010: 13-18.
[8] 赵家桔, 张新春, 李焕苓, 等. 2 个杧果品种果实品质及其构成研究[J].热带作物学报, 2010, 31(2): 182-186.
[9] 姚改芳, 张绍铃, 吴俊, 等. 10 个不同系统梨品种的可溶性糖与有机酸组分含量分析[J]. 南京农业大学学报, 2011, 34(5): 25-31.
[10] 张秀梅, 杜丽清, 孙光明, 等. 菠萝果实发育过程中有机酸含量及相关代谢酶活性的变化[J]. 果树学报, 2007, 24(3): 381-384.
[11] 郭燕, 梁俊, 李敏敏, 等. 高效液相色谱法测定苹果果实中的有机酸[J].食品科学, 2012, 33(2): 277-230.
[12] NISPEROS-CARRIEDO M O, BUSLIG B S, SHAW P E. Simultaneous detection of dehydroascorbic, ascorbic and some organic acids in fruits and vegetables by HPLC[J]. Journal of Agricultural and Food Chemistry, 1992, 40: 1127-1130.
[13] 胡志群, 王惠聪, 胡桂兵. 高效液相色谱测定荔枝果肉中的糖、酸、维生素C[J]. 果树学报, 2005, 22(5): 582-585.
[14] MING A, SVANELLA L, ROLIN D. Compositional changes during the fruit development of two peach cultivars differing in juice acidity[J]. Journal of the American Society for Horticultural Science, 1998, 123: 770-775.
[15] ETIENNE C, ROTHAN C, MOING A, et al. Candidate genes and QTLs for sugar and organic acid content in peach [Prunus persica (L.) Batsch][J]. Theoretical and Applied Genetics, 2002, 105: 145-159.
[16] 牛景, 赵剑波, 吴本宏, 等. 不同来源桃种质果实糖酸组分含量特点的研究[J]. 园艺学报, 2006, 33(1): 6-11.
[17] 沈志军, 马瑞娟, 俞明亮, 等. 桃果实发育过程中主要糖及有机酸含量的变化分析[J]. 华北农学报, 2007, 22(6): 130-135.
[18] 张秀梅, 杜丽清, 孙光明, 等. 菠萝果实发育过程中有机酸含量及相关代谢酶活性的变化[J]. 果树学报, 2007, 24(3): 381-384.
[19] KOMATSU A, MORIGUCHI T, KOYAMA K, et al. Analysis of sucrose synthase genes in citrus suggests different roles and phylogenetic relationships[J]. Journal of Experimental Botany, 2002, 53(366): 61-71.
[20] 谢小波, 求盈盈, 戚行江, 等. 杨梅果实有机酸成分及含量动态变化[J].浙江农业学报, 2013, 25(4): 787-790.
[21] 罗阳, 贺晓光, 杨军, 等. HPLC法测定贺兰山东麓酿酒葡萄中苹果酸含量[J]. 安徽农业科学, 2011, 39(33): 20541-20542; 20545.
[22] 崔婧, 段长青, 潘秋红. 反相高效液相色谱法测定葡萄中的有机酸[J].中外葡萄与葡萄酒, 2010(5): 25-30.
[23] 景延秋, 张欣华, 刘剑君, 等. 烤烟不同叶位叶片有机酸含量的差异分析[J]. 华北农学报, 2011, 26(4): 111-114.
[24] 高玉龙, 方敦煌, 吴兴富, 等. 前处理对烟叶中糖及有机酸含量的影响[J]. 作物研究, 2011, 23(4): 257-258.
Optimization of Pretreatment Conditions for Determination of Organic Acid Contents in ‘Granny Smith’ Apple Fruit Pulp by Liquid Chromatography
YANG Wei
1, GAO Wenmin
2, MA Haizhong
3, WANG Baisong
1, HE Yang
1, L☒ Chunjing
1, WEI Xiao
1, ZHANG Sumin
1,*
(1. Liaoning Institute of Pomology, Xiongyue 115009, China; 2. Songjianghe Town Agricultural Technology Promotion Station, Fusong 134504, China; 3. Changbai Mountain Forestry Group Antu Forestry Co. Ltd., Antu 133600, China)
Abstract:This study was a systematic investigation into the effects of pulping methods, extraction conditions and storage conditions before analysis by liquid chromatography on the organic acid composition and contents of ‘Granny Smith’ apple pulp. The results showed that manual grinding and mechanical homogenization were both effective means to crush apples, and the selection depended on the test purpose and requirements and the specific circumstances. Extraction temperature and oscillation time had no significant effects on extraction efficiency. We found extraction at 25 ℃ for 15 min with ultrasonic oscillation to be optimal immediately followed by the liquid chromatographic analysis; otherwise, the crushed sample was centrifuged before short-term storage at room temperature under light conditions. ‘Granny Smith’ apples were detected to contain oxalic acid, quinic acid, malic acid, shikimic acid and citric acid. Their relative contents were in the following descending order: malic acid > quinic acid > citric acid > oxalic acid > shikimic acid. Malic acid was the main organic acid in all samples although there were tremendous differences in the content of each of the organic acids among different apple fruits and among the contents of the organic acids in the same apple fruit. Thus, attention should be paid to selection of the test material.
Key words:liquid chromatography; apple; organic acids; pretreatment technologies
中图分类号:S661.1
文献标志码:A
文章编号:
doi:10.7506/spkx1002-6630-201510028
收稿日期:2014-08-18
基金项目:辽宁省百千万人才工程项目;辽宁省自然科学基金项目(20102223)
作者简介:杨巍(1972—),男,副研究员,硕士,研究方向为果树资源品质生理。E-mail:ywsys@yeah.net
*通信作者:张素敏(1972—),女,副研究员,硕士,研究方向为果品加工工艺与产品创制。E-mail:yangchunyue@163.com