方博文,齐睿婷,张 英 *
(浙江大学生物系统工程与食品科学学院,浙江省农产品加工技术研究重点实验室,浙江省食品加工技术与装备工程中心,浙江 杭州 310058)
摘 要:将常山胡柚全果分为白皮层、油胞层、籽、果渣和果汁5 部分,除果汁外其余4 部分烘干后用70%乙醇溶液热回流提取制备不同部位的醇提物,分别测定醇提物总黄酮和总酚含量,并采用4 种自由基评价体系比较其抗氧化活性的差异。研究表明,常山胡柚不同部位醇提物中总黄酮含量的高低依次为:油胞层(3.78%)>白皮层(2.38%)>籽(1.67%)>果渣(0.77%),总酚含量最高也为油胞层(21.30%),最低为果渣(1.73%);油胞层清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、O 2 -·和·OH的效果最佳,IC 50值分别为0.37、0.24 mg/mL和1.31 mg/mL;而清除ABTS +·效果最好的则是白皮层(IC 50值为0.015 mg/mL)。同时,测得胡柚果汁的总黄酮和总酚含量分别为0.021%和0.19%,清除DPPH自由基、ABTS +·、·OH和O 2 -·的IC 50值分别为8.55、18.97、35.17 mg/mL和23.30 mg/mL。研究表明,胡柚果皮含有丰富的强抗氧化成分,且其质量约占全果的1/3,对其进行深入研究和综合开发是常山胡柚这一宝贵资源高值化利用过程中不可或缺的环节。
关键词:常山胡柚;果实不同部位;醇提物;果汁;有效成分;抗氧化活性
常山胡柚(Citrus paradisi cv. Changshan Huyou)起源于常山县青石乡胡家村,是柚、宽皮柑橘、甜橙重复杂交的产物 [1],形态学、同工酶、核DNA和叶绿体DNA分析表明,常山胡柚的母本是柚,而父本则可能是橘或者橙 [2]。常山胡柚产量大、质量优、果型好、风味独特,具有清凉祛火、镇咳化痰、降低血糖、润喉醒酒、养颜益寿等诸多药理功效,是一种具有较高营养和保健价值的果品 [3],跻身于全国“名特优新”水果行列。1998年‘常山胡柚’原产地证明商标获国家商标局批准,该县被冠以“中国常山胡柚之乡”的称号。常山胡柚有两大特点尤为值得一提:一是具有调节血糖的作用 [4],糖尿病人可放心食用;二是果实极耐贮藏 [5-6],一般可贮藏到翌年四月,且风味不变,有“天然水果罐头”之美誉 [7]。目前,原产地常山胡柚的种植面积达到10万 亩,年产12~14万 t。
文献研究常山胡柚有效成分的报道较少。仅有的文献报道有:赵雪梅等 [8-9]从胡柚皮醇提物中分离得到柚皮苷等6 种黄酮类化合物;时海香等 [10-12]通过超临界二氧化碳萃取得到常山胡柚皮中的天然色素,并对其稳定性进行研究;吴倩 [13]、韩晓祥 [14]等利用超声波辅助提取柚皮,并测定了醇提物的黄酮含量和抗氧化性能;邢建荣等 [15]采用吸附法对常山胡柚汁进行脱苦处理等。
本实验研究常山胡柚的加工副产物,分析比较果实不同部位醇提物中总黄酮和总酚含量高低及其抗氧化活性,以期为常山胡柚的综合开发和高值化利用提供理论依据。
1.1 材料与试剂
常山胡柚果实采自常山县同弓乡棋盘山村,采摘时间为2013年11月18日。此种由常山县粮食局专家杨业海鉴定为芸香科柑橘属常山胡柚种。
抗坏血酸(V C) 国药集团化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、邻二氮菲、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2’-azino bis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)、邻苯三酚美国Sigma公司;其他试剂均为分析纯。
1.2 仪器与设备
HX-502榨汁机 奥克斯集团;DGX-9243B-2烘箱上海福玛实验设备有限公司;WP502B百分之一电子天平上海精科天平仪器厂;DS-1高速组织捣碎机 上海标本模型厂;3K-15实验通用离心机 上海楚柏实验室设备有限公司;R-201旋转蒸发器 上海申科机械研究所;FD-1-50冷冻干燥机 北京博医康实验仪器有限公司;T6紫外-可见分光光度计 北京普析通用仪器有限责任公司。
1.3 方法
1.3.1 常山胡柚全果不同部位的分割及其醇提物制备
取新鲜的常山胡柚果1 0 只,单果质量在274.35~334.60 g之间(其中质量小于300 g的4 只,300~320 g之间的3 只,质量大于320 g的3 只)。将其洗净、擦干、剥皮,得到果皮和果瓤;将果皮压平,从水平方向将果皮切分成两部分,得到金黄色的油胞层以及白色的白皮层;将果瓤榨汁两次,分别得籽粒、果渣和果汁。预处理完成之后得到白皮层、油胞层、籽、果渣、果汁5部分。由于果实含籽量较少,另用80 只果单独取籽。
白皮层、油胞层、籽、果渣经烘干((60±1) ℃,48 h)后粉碎,过40 目筛,备用。取一定量不同部位的粉末试样,用体积分数70%的乙醇溶液按料液比1∶5(g/mL)热回流((90±1) ℃)提取1 h,滤渣再用等比例的乙醇溶液提取0.5 h。合并滤液,40 ℃条件下减压浓缩至料液比为1∶1(g/mL)。冷冻干燥,得到果实不同部位的醇提物粉末试样。
1.3.2 总黄酮含量测定(硝酸铝-亚硝酸钠比色法 [16])
标准曲线的绘制:吸取150 μg/mL芦丁标准溶液0、0.50、1.00、2.00、3.00、4.00 mL于10 mL刻度比色管中,加30%乙醇溶液至5 mL,加0.3 mL 5%亚硝酸钠溶液,摇匀后放置5 min。加0.3 mL 10%硝酸铝溶液,摇匀后放置6 min。加2 mL 1.0 mol/L氢氧化钠溶液,用30%乙醇溶液定容至10 mL。摇匀后在510 nm波长处测定吸光度,记录数据,绘制标准曲线。
样品测定:称取一定量待测样品,用30%的乙醇溶液溶解、定容并稀释至适宜质量浓度,记录总体积;取一定体积的待测液,按标准曲线制备中的操作步骤,于510 nm波长处进行吸光度的测定。
根据标准工作曲线,求出相当于试样吸光度的芦丁含量,按式(1)求出样品总黄酮含量:
式中:m 1为依据标准曲线计算出被测液中总黄酮含量/mg;m为供试品取样量/mg;V 1为待测液分取的体积/mL;V 2为待测液的总体积/mL。
1.3.3 总酚含量测定(福林酚试剂还原比色法 [17])
标准曲线的绘制:吸取0.250 mg/mL对羟基苯甲酸标准溶液 0、0.05、0.10、0.20、0.40、0.80、1.20 mL于25 mL具塞试管中,加水稀释至10.0 mL。加入1.0 mL福林试剂和2.0 mL 20%的Na 2CO 3溶液,混匀后沸水裕加热1 min。立即用水冷却并稀释至25 mL。混匀后放置30 min,在745 nm波长处测定吸光度,记录数据,绘制标准曲线。
样品测定:称取一定量待测样品,用水溶解、定容并稀释至适宜质量浓度,记录总体积;取一定体积的待测液,按标准曲线制备中的操作步骤,于745 nm波长处进行吸光度的测定。
根据标准工作曲线,求出相当于试样吸光度的对羟基苯甲酸含量,按式(2)求出样品总酚含量:
式中:m 1为依据标准曲线计算出被测液中总酚含量/mg;m为供试品取样量/mg;V 1为待测液分取的体积/mL;V 2为待测液的总体积/mL。
差量法得出样品的酚酸含量,如式(3)所示。
1.3.4 抗氧化性能评价
选用4 种体外自由基评价体系(DPPH自由基、
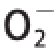 ·、·OH和ABTS
+·),测定胡柚果实不同部位醇提物的自由基清除能力,用半数抑制浓度(IC
50值)进行比较,以VC为阳性对照。
·、·OH和ABTS
+·),测定胡柚果实不同部位醇提物的自由基清除能力,用半数抑制浓度(IC
50值)进行比较,以VC为阳性对照。
1.3.4.1 清除DPPH自由基能力测定
称取20 mg DPPH标准品,用甲醇定容至500 mL,置于棕色瓶中备用。将适当质量浓度的常山胡柚醇提物溶液0.2 mL和3.8 mL DPPH溶液混合,室温条件下放置1 h,在517 nm波长处测定吸光度(A s);同时测定DPPH溶液与0.2 mL蒸馏水的吸光度(A 0),以及0.2 mL醇提物溶液与3.8 mL甲醇的吸光度(A r)。按式(4)计算样品的DPPH自由基抑制能力 [18]。
1.3.4.2 清除ABTS +· 能力的测定
取440 μL过硫酸钾溶液(140 mmol/L)加入到25 mL ABTS溶液中混合,室温、避光,静置反应12 h,得到ABTS储备液。用无水乙醇将ABTS储备液调节至吸光度为0.700±0.02(734 nm波长处),制得ABTS使用液。取0.1 mL醇提物溶液和3.9 mL ABTS使用液混合,静置6 min,在734 nm 波长处测定吸光度(A s)。同时测定0.1 mL蒸馏水和3.9 mL ABTS溶液的吸光度(A 0),以及0.1 mL醇提物溶液和3.9 mL无水乙醇的吸光度(A r) [19]。
1.3.4.3 清除·OH能力的测定
将1.0 mL邻二氮菲溶液(0.5 mmol/L)、0.5 mL FeSO 4溶液(0.75 mmol/L)、1 mL磷酸盐缓冲液(pH 7.4,200 mmol/L)混合,加入醇提物溶液,最后加0.5 mL H 2O 2(体积分数0.1%)溶液,用去离子水补至10 mL,静置1 h。在500 nm波长处测定吸光度(A s);同时用等量的蒸馏水代替醇提物溶液及H 2O 2溶液,测量吸光度(A 0);用等量蒸馏水替代样品溶液,测量吸光度(A r)。计算·OH清除能力 [20]。
1.3.4.4 清除
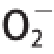 ·能力的测定
·能力的测定
取2.25 mL Tris-HCl缓冲液(pH 8.2)与2.1 mL蒸馏水混和,25 ℃水浴预热,加入0.5 mL适当质量浓度的常山胡柚醇提物溶液,最后加入0.15 mL已预热的30 mmol/L邻苯三酚溶液,摇匀后立即倒入比色皿中在320 nm波长处测量吸光度,每30 s记录一次数据,3 min后结束。空白对照以 0.01 mol/L HCl溶液代替邻苯三酚溶液,自氧化对照以蒸馏水代替样品溶液。按式(6)计算
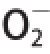 ·清除能力
[21]。
·清除能力
[21]。
式中:v 1为对照组邻苯三酚自氧化速率;v 2为加入多糖溶液的邻苯三酚氧化速率。
1.4 统计分析
数据以“
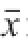 ±s”表示,采用SPSS(17.0)统计软件对数据进行单因素方差分析。
±s”表示,采用SPSS(17.0)统计软件对数据进行单因素方差分析。
2.1 常山胡柚果实不同部位占比及醇提得率
将10 只平均质量为(304.28±22.30)g的常山胡柚鲜果按不同部位进行取样、称质量,得到的数据如表1所示。油胞层、白皮层、籽、果渣和果汁在总质量中的平均占比分别为14.55%、16.20%、0.19%、31.73%和37.33%,胡柚汁加工副产物(油胞层、白皮层、籽、果渣)合计约占全果质量的三分之二,对其综合利用可推动环保和工业附加值,提高胡柚产业的良性发展。
表1 常山胡柚鲜果不同部位的质量(n=10)
Table1 Weight of different fruit parts of fresh Changshan Huyou (n=10)
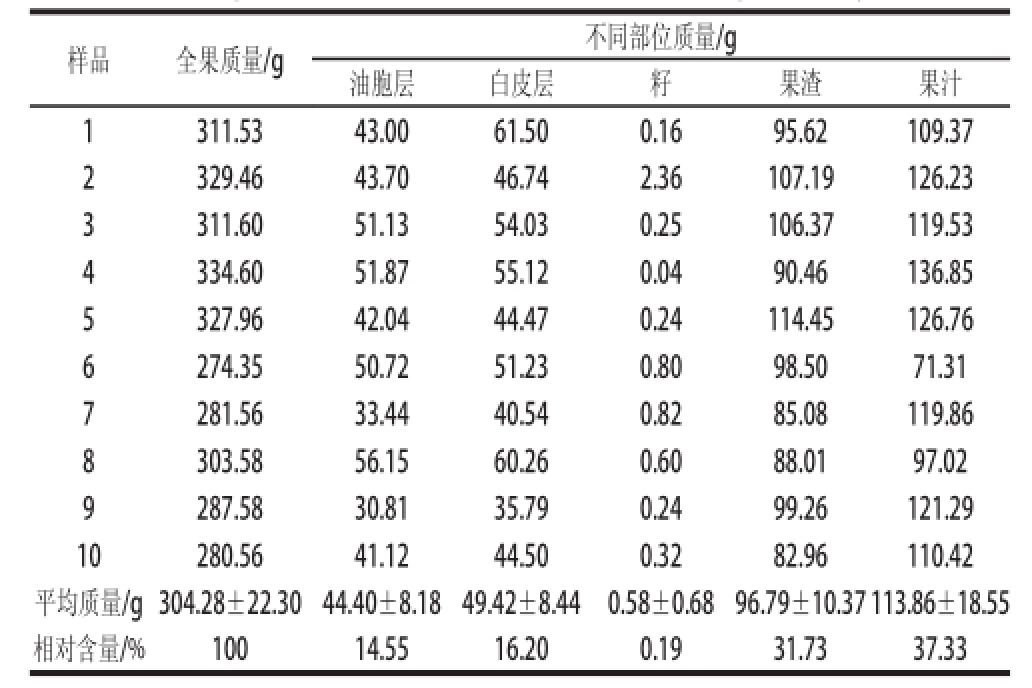
样品全果质量/g不同部位质量/g油胞层白皮层籽果渣果汁1311.5343.0061.500.1695.6 2109.37 2329.4643.7046.742.36107.19126.23 3311.6051.1354.030.25106.37119.53 4334.6051.8755.120.0490.46136.85 5327.9642.0444.470.24114.45126.76 6274.3550.7251.230.8098.50 71.31 7281.5633.4440.540.8285.08119.86 8303.5856.1560.260.6088.0197.02 9287.5830.8135.790.2499.26121.29 10280.5641.1244.500.3282.96110.42平均质量/g 304.28±22.3044.40±8.1849.42±8.440.58±0.6896.79±10.37113.86±18.55相对含量/%10014.5516.200.1931.7337.33
将油胞层、白皮层、果渣和籽于(60±1) ℃的烘箱内干燥48 h获得干品,脱水率分别为79.13%、75.34%、87.26%和64.15%,将其粉碎成40 目后,作为试样备用;各取2 g试样粉末于(110±1) ℃的烘箱内干燥至质量恒定,测定干粉的水分含量,以便在数据分析时统一折算成干基进行比较。综合表2的两组数据,可推算出鲜果不同部位的含水率分别为:油胞层80.43%、白皮层76.77%、果渣88.43%、籽66.42%。
表2 常山胡柚不同部位含水率
Table2 Water contents of different fruit parts of Changshan Huyou
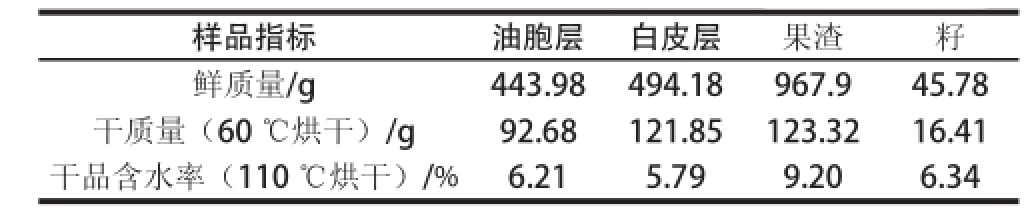
样品指标油胞层白皮层果渣籽鲜质量/g443.98494.18967.945.78干质量(60 ℃烘干)/g92.68121.85123.3216.41干品含水率(110 ℃烘干)/%6.215.799.206.34
表3 常山胡柚不同部位的醇提得率
Table3 Alcohol extract yields of different fruit parts of Changshan Huyou
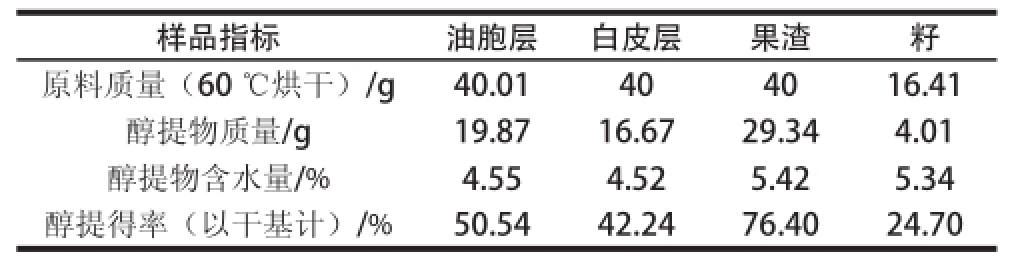
样品指标油胞层白皮层果渣籽原料质量(60 ℃烘干)/g40.01404016.41醇提物质量/g19.8716.6729.344.01醇提物含水量/%4.554.525.425.34醇提得率(以干基计)/%50.5442.2476.4024.70
按照1.3.1节方法得到醇提物,表3显示油胞层、白皮层、果渣和籽以干基计的醇提得率分别为50.54%、42.24%、76.40%和24.70%。
2.2 醇提物的总黄酮和总酚含量
表4 常山胡柚果汁及不同部位醇提物的总黄酮和总酚含量(以醇提物干基计)
Table4 Contents of total flavonoids and phenols in fresh Huyou juice and different parts of alcohol extracts (on dry basis)
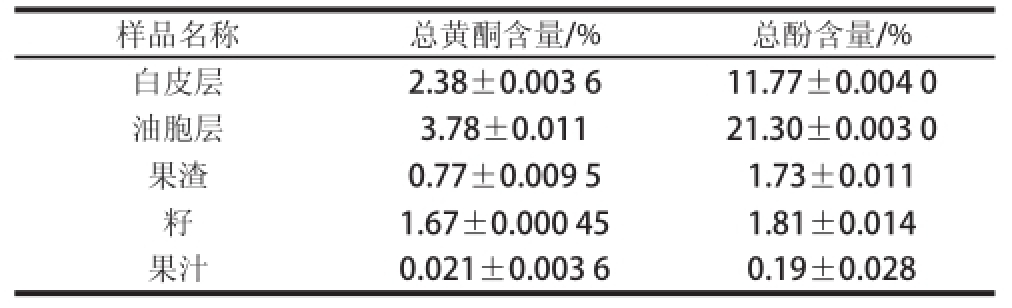
样品名称总黄酮含量/%总酚含量/%白皮层2.38±0.003 611.77±0.004 0油胞层3.78±0.01121.30±0.003 0果渣0.77±0.009 51.73±0.011籽1.67±0.000 451.81±0.014果汁0.021±0.003 60.19±0.028
表4显示,醇提物中油胞层的总酚含量最高(21.30%),其次是白皮层(11.77%),果渣(1.73%)和籽(1.81%)含量很低;总黄酮含量最高的部位也是油胞层(3.78%),其次是白皮层(2.38%),果渣(0.77%)和籽(1.67%)含量很低。同时,测得胡柚果汁的总黄酮和总酚含量分别为0.021%和0.19%。
2.3 常山胡柚不同部位醇提物的抗氧化能力
2.3.1 清除DPPH自由基的作用
从图1可见,当试样质量浓度低于0.8 mg/mL时,白皮层和油胞层清除DPPH自由基的活性呈显著的质量浓度依赖关系,当试样质量浓度继续加大到1 mg/mL及以上水平时,则呈现完全抑制,即其质量浓度在0.8 mg/mL以上水平时达到了与VC相同的清除活性。果渣和籽的醇提物具有相同的抑制趋势,但其作用仅相当于皮层醇提物的1/2~1/3。
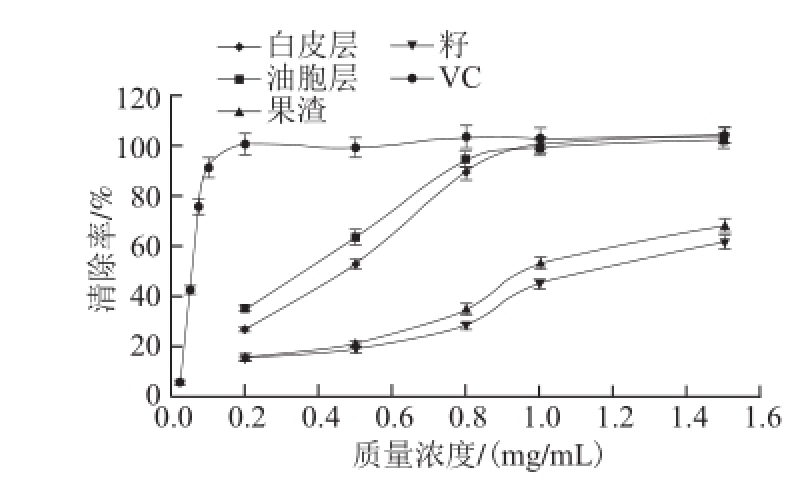
图1 胡柚不同部位醇提物清除DPH自由基的能力
Fig.1 DPH radical scavenging ability
2.3.2 清除ABTS +· 的作用
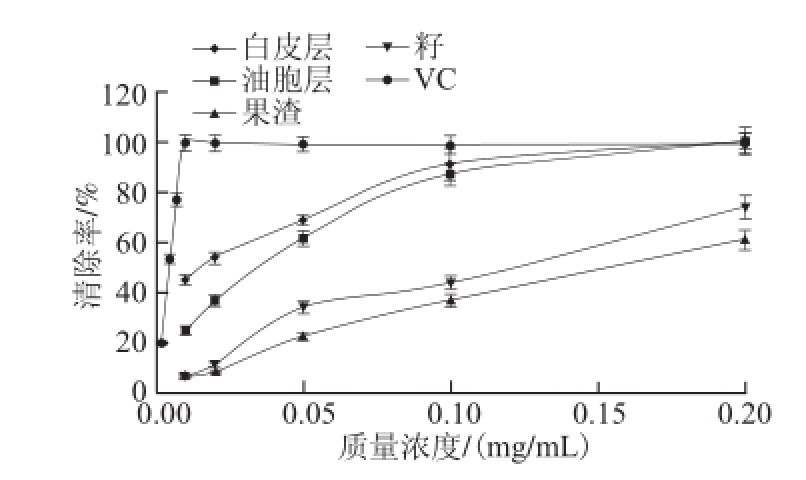
图2 胡柚不同部位醇提物对ABTS
+
·的清除能力
Fig.2 ABTS
+
· scavenging ability
从图2可见,当试样质量浓度小于0.1 mg/mL时,白皮层和油胞层醇提物对ABTS +· 的抑制作用随质量浓度升高而上升,在该质量浓度时清除率分别达到91.71%、87.65%,质量浓度继续加大,清除作用接近阳性对照,达到完全抑制;果渣和籽醇提物的抑制作用明显弱于皮层,至0.2 mg/mL质量浓度时,清除率分别为61.92%和74.71%。阳性对照VC在0.01 mg/mL时即可完全抑制ABTS +·。
2.3.3 清除·OH的作用
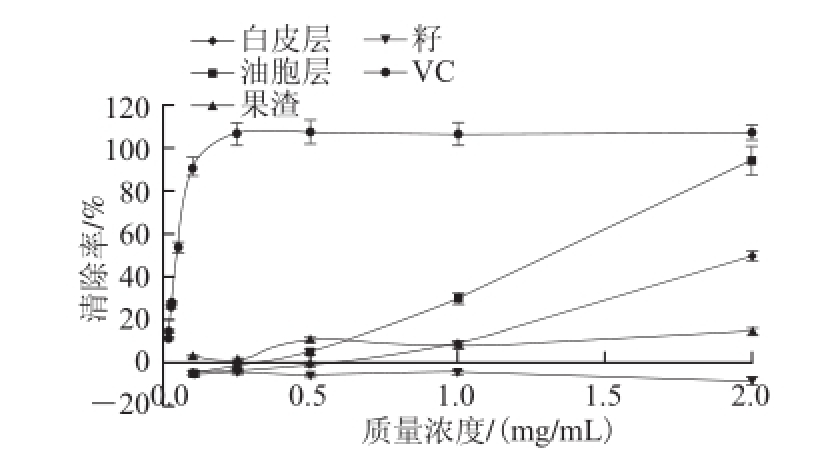
图3 胡柚不同部位醇提物对·OH的清除能力
Fig.3 ·OH scavenging ability
如图3所示,油胞层醇提物对·OH的抑制作用在所试质量浓度范围内(0.1~2 mg/mL)随质量浓度升高而增加,2 mg/mL时清除率为93.7%;白 皮层醇提物清除自由基效果弱于油胞层,2 mg/mL时清除率为49.36%;果渣醇提物在质量浓度范围内表现出低的抑制作用(>15%);而籽醇提物的清除率则表现为负数。
2.3.4 清除
 ·的作用
·的作用
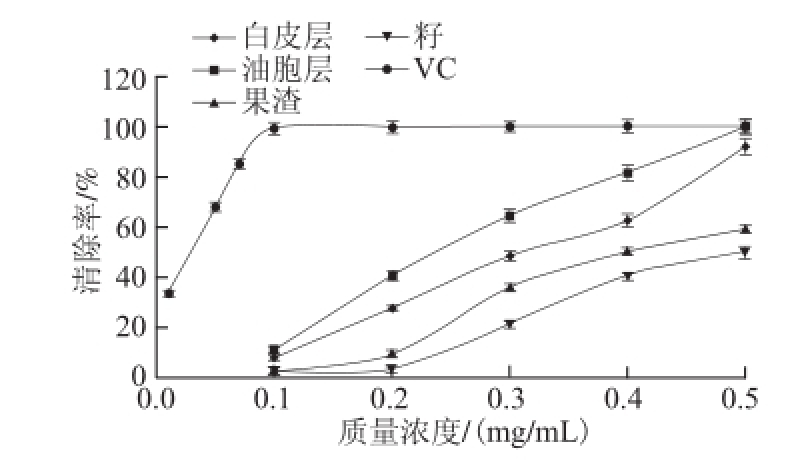
图4 胡柚不同部位醇提物对
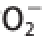 ·的清除能力
·的清除能力
Fig.4
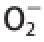 · scavenging ability
· scavenging ability
如图4所示,在所试质量浓度范围(0.1~0.5 mg/mL)内,白皮层、油胞层、果渣、籽醇提物对O 2 -·的抑制作用均呈显著的质量浓度依赖关系,质量浓度0.5 mg/mL时,清除率分别为:白皮层92.01%、油胞层99.68%、果渣59.03%、籽50.18%。
2.3.5 胡柚果汁的抗氧化活性
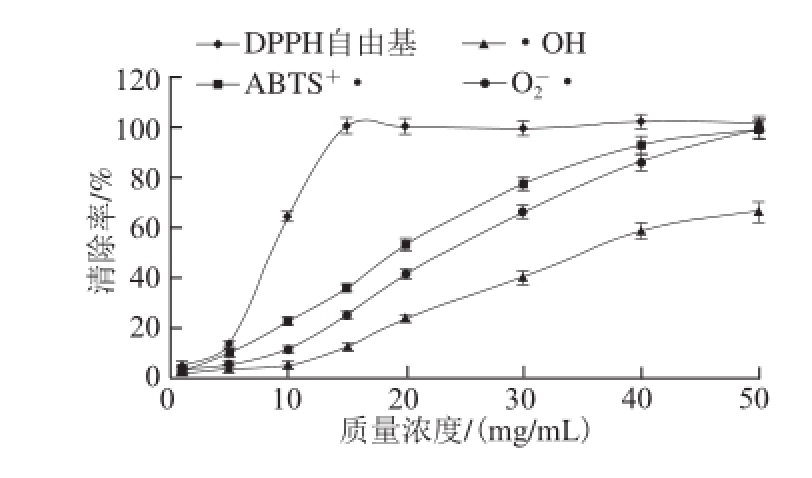
图5 常山胡柚果汁的抗氧化能力
Fig.5 Antioxidant activity of fresh Changshan Huyou juice
从图5可见,在所试质量浓度范围(1~50 mg/mL)内,胡柚果汁对ABTS +·、·OH、O 2 -·的抑制作用都随质量浓度升高而线性增加,当试样质量浓度为50 mg/mL时,其清除率分别为99.28%、66.84%和99.34%。唯独对DPPH自由基在15 mg/mL时即可完全抑制。
2.3.6 常山胡柚不同部位抗氧化活性综合分析
表5 常山胡柚不同部位醇提物清除活性氧自由基的能力比较(IC
50
值)
Table5 Comparison of active oxygen radical scavenging ability of extracts from different fruit parts of Changshan Huyou (IC50)
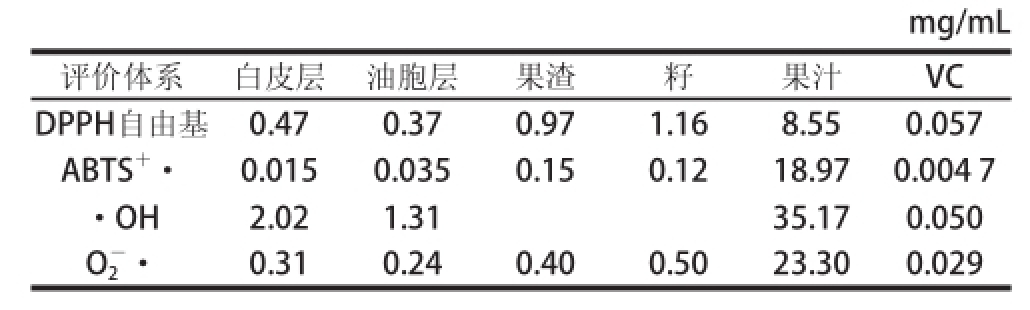
mg/mL评价体系白皮层油胞层果渣籽果汁VC DPPH自由基0.470.370.971.168.550.057 ABTS +·0.0150.0350.150.1218.970.004 7 ·OH2.021.3135.170.050 O 2 -·0.310.240.400.5023.300.029
胡柚果实不同部位醇提物、果汁及阳性对照VC对4 种活性氧自由基的半数抑制浓度(IC 50值)见表5。在4 个不同部位醇提物中,清除O 2 -·和·OH能力大小依次是油胞层>白皮层>果渣>籽,其中油胞层和白皮层醇提物清除O 2 -·的活性约为纯品VC的1/10、果汁的100 倍左右,果渣和籽醇提物在所试质量浓度范围内没有表现出清除·OH活性;清除DPPH自由基的顺序是油胞层>白皮层>果渣>籽,果皮强于果渣和籽;清除ABTS +·能力最强的是白皮层醇提物,其活性约为纯品VC的1/3;油胞层的清除·OH活性约为VC的1/25,白皮层约为VC的1/40。
总体上看,胡柚皮层含有丰富的抗氧化成分,具有相当强的抗自由基、抗氧化活性,且其醇提物具有柑橘类果实的特殊芬芳,是开发生物抗氧化剂的难得资源。
常山胡柚果实美观,呈梨形、圆球形或扁球形,色泽金黄,内质饱满,脆嫩多汁,酸甜适度,甘中微苦,鲜爽可口。单果质量300 g左右,皮厚约0.6 cm,鲜食的可食率约70%。鉴于常山胡柚突出的营养和保健价值及其不可多得的耐贮性,它是一种非常适用于工业化生产的、具有广阔开发前景的功能饮料主剂来源。然而,常山胡柚非可食部位(白皮层和油胞层)约占全果质量的1/3,榨汁后又会产生1/3左右的加工副产物(果渣和籽)。本研究显示,常山胡柚果皮部分(油胞层和白皮层)酚类物质含量较高,具有抗氧化活性,是一种良好的天然抗氧化物质的来源。对其进行综合开发是常山胡柚工业化、规模化和高值化利用过程中不可或缺的环节。
常山胡柚是葡萄柚的鼻祖,与其同宗同源的葡萄柚享誉全球,是人们熟悉并喜爱的日常水果,获得了广泛的关注,被研究的部位包括皮、肉、籽、果汁、各类醇提物以及副产物,研究内容涵盖了抗氧化性 [22]、神经活性 [23]、基因毒性 [24]等诸多方面。与之相比,对常山胡柚的研究则显得十分薄弱,因此也更为迫切,建议重点关注其对血糖的调节功效和对糖尿病并发症的预防作用。
参考文献:
[1] 陈力耕, 胡西琴, 赵四清. 关于胡柚起源的分子研究[J]. 园艺学报, 2002, 29(3): 276-277.
[2] 蔡剑华. 金柚[M]. 北京: 中国林业出版社, 1991: 1-4.
[3] 徐小忠, 赵四清, 汪丽霞, 等. 常山胡柚果皮中所含功能性成分与作用[J]. 浙江柑橘, 2014, 31(1): 10-12.
[4] ZHANG Jiukai, SUN Chongde, YAN Youyou, et al. Purification of naringin and neohesperidin from Huyou (Citrus changshanensis) fruit and their effects on glucose consumption in human HepG2 cells[J]. Food Chemistry, 2012, 135(3): 1471-1478.
[5] 施堂红, 刘晓政, 严晓丽, 等. 常山胡柚果品品质及贮藏过程中变化规律的研究[J]. 食品工程, 2013(4): 34-38.
[6] 姜翔鹤, 毕旭灿. 不同采摘期对常山胡柚贮藏期果实枯水的影响[J].浙江柑橘, 2011, 28(1): 38-39.
[7] 杨连珍. 葡萄柚概述[J]. 热带作物研究, 1996(1): 67-71.
[8] 赵雪梅, 叶兴乾, 席屿芳. 胡柚皮中黄酮类化合物提取及抗氧化性研究[J]. 果树学报, 2003, 20(4): 261-265.
[9] 赵雪梅, 朱大元. 胡柚皮中的黄酮类化合物[J]. 中草药, 2003, 34(1): 11-13.
[10] 时海香, 仲山民, 吴峰华. 超临界二氧化碳萃取常山胡柚外果皮中天然色素的工艺研[J]. 浙江林学院学报, 2008, 25(5): 639-643.
[11] 时海香, 仲山民. 常用食品添加剂对常山胡柚色素稳定性的影响[J].食品与机械, 2008(5): 32-35.
[12] 时海香, 仲山民. 常山胡柚天然色素的初步鉴定及其稳定性研究[J].林业科学研究, 2009, 21(6): 852-856.
[13] 吴倩, 朴香兰, 杨静. 胡柚中3 种主要黄酮类物质的含量测定[J]. 食品科学, 2011, 32(18): 168-170.
[14] 韩晓祥, 周凌霄, 励建荣, 等. 超声波辅助提取胡柚皮黄酮及抗氧化作用研究[J]. 中国食品学报, 2011, 11(4): 55-61.
[15] 邢建荣, 夏其乐, 程绍南, 等. 胡柚汁脱苦工艺的研究[J]. 中国食品学报, 2009, 9(4): 130-136.
[16] ESCOBEDO-AVELLANEDA Z, GUTI☒RREZ-URIBE J, VALDEZFRAGOSO A, et al. Phytochemicals and antioxidant activity of juice, flavedo, albedo and comminuted orange[J]. Journal of Functional Foods, 2014, 6: 470-481.
[17] 严娟, 蔡志翔, 张斌斌, 等. 桃果渣总酚提取和测定方法的研究[J].江苏农业学报, 2013, 29(3): 642-647.
[18] FIDRIANNY I, HARNOVI M, INSANU M. Evaluation of antioxidant activities from various extracts of sweet orange peels using DPPH, FRAP assays and correlation with phenolic, flavonoid, carotenoid content[J]. Asian Journal of Pharmaceutical and Clinical Research, 2014, 7(4): 186-190.
[19] FIDRIANNY I, WINDYASWARI A, WIRASUTISNA K. Antioxidant capacities of various leaves extract from five colors varieties of sweet potatoes tubers using ABTS, DPPH assays and correlation with total flavonoid, phenolic, carotenoid content[J]. Research Journal of Medicinal Plant, 2013, 7(3): 130-140.
[20] OBOH H A, OSAGIE A, ESEWE R. Evaluation of antioxidant and free radical scavenging abilities of some nigerian packaged fruit juices[J]. Nigerian Journal of Nutritional Sciences, 2013, 33(1): 31-36.
[21] ROY S, HAZRA B, MANDAL N, et al. Assessment of the antioxidant and free radical scavenging activities of methanolic extract of diplazium esculentum[J]. International Journal of Food Properties, 2013, 16(6): 1351-1370.
[22] CAVIA-SAIZ M, MUNIZ P, ORTEGA N, et al. Effect of enzymatic debittering on antioxidant capacity and protective role against oxidative stress of grapefruit juice in comparison with adsorption on exchange resin[J]. Food Chemistry, 2011, 125(1): 158-163.
[23] NAGAI K, NIIJIMA A, HORII Y, et al. Olfactory stimulatory with grapefruit and lavender oils change autonomic nerve activity and physiological function[J]. Autonomic Neuroscience, 2014, 185: 29-35.
[24] RAZO-AGUILERA G, BAEZ-REYES R, ☒LVAREZ-GONZ☒LEZ I, et al. Inhibitory effect of grapefruit juice on the genotoxicity induced by hydrogen peroxide in human lymphocytes[J]. Food and Chemical Toxicology, 2011, 49(11): 2947-2953.
Active Components and Antioxidant Activities of Different Parts of Citrus paradise Fruit
FANG Bowen, QI Ruiting, ZHANG Ying
*
(Zhejiang R&D Center for Food Technology and Equipment, Zhejiang Key Laboratory for Agro-Food Processing, College of Biosystems Engineering and Food Science, Zhejiang University, Hangzhou 310058, China)
Abstract:The fruit of Citrus paradisi was separated into albedo layer, oil gland layer, seed, pomace and juice. Active substances were extracted from albedo layer, oil gland layer, seed and pomace with 70% aqueous ethanol by hot refluxing. The contents of total flavonoids and phenolic substances in the resulting extracts were evaluated. Antioxidant activity was tested in four systems. The results showed that the content of total flavonoids in different fruit extracts of C. paradisi was in the following order: oil gland layer (3.78%) > albedo layer (2.38%) > seed (1.67%) > pomace (0.77%). Similarly, the content of total phenols was the highest in oil gland layer (21.30%) and the lowest in pomace (1.73%). The ethanol extract of oil gland layer showed the highest antioxidant activity to scavenge 1,1-diphenyl-2-picrylhydrazyl (DPPH), superoxide anion and hydroxyl radicals with IC 50of 0.37, 0.24 and 1.31 mg/mL, respectively. The ethanol extract of albedo layer showed the highest ABTS +· scavenging activity with IC 50of 0.015 mg/mL. The contents of total flavonoids and total phenols in the fresh juice were 0.021% and 0.19%, respectively. The IC 50values for DPPH free radical, ABTS +·, O 2 -·, ·OH were 8.55, 18.97, 35.17 and 23.30 mg/mL, respectively. These results showed that oil gland layer and albedo layer had quite good antioxidant activities, which were positively correlated with the contents of total flavonoids and phenols. The pericarp consisting of the two layers made up about one third of the total fruit weight, and was rich in potent antioxidant compounds. To conclude, further study and development of C. paradisi fruit will have great practical significance.
Key words:Citrus paradisi; different parts of whole fruit; alcohol extract; fresh juice; effective constituent; antioxidant activity
中图分类号:TS209
文献标志码:A
文章编号:
doi:10.7506/spkx1002-6630-201510032
收稿日期:2014-10-09
基金项目:浙江大学馥莉食品研究院基金资助项目(KY201303)
作者简介:方博文(1993—),男,本科生,研究方向为天然产物与功能性食品。E-mail:bwfang@zju.edu.cn
*通信作者:张英(1961—),女,教授,博士,研究方向为天然产物与功能性食品。E-mail:yzhang@zju.edu.cn