实时荧光HDA法快速检测单核细胞增生李斯特菌
张明如
1,饶 丽
1,王建光
1,结 莉
2,丁洪流
2,沈晓芳
1,*
(1.江南大学食品学院,江苏 无锡 214122;2.苏州市产品质量监督检验所,江苏 苏州 215104)
摘 要:目的:建立一种用于单核细胞增生李斯特菌的实时荧光赖解旋酶恒温核酸扩增(helicase-dependent isothermal DNA amplification,HDA)快速检测方法。方法:针对单核细胞增生李斯特菌hly基因序列设计引物对,基于荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪的平台,提取单核细胞增生李斯特菌基因组DNA,以此作为模板,优化反应温度、反应时间及引物浓度。利用单核细胞增生李斯特菌及10 株对照菌株,并与实时荧光PCR对比,来验证实时荧光HDA方法的特异性和灵敏度,并初步用于样品检测。结果:实时荧光HDA体系的最适引物浓度为0.075 μmol/L,反应温度及反应时间为65 ℃、80 min(40 个循环),具有良好的特异性和灵敏度。结论:建立了一种特异性强、灵敏度高的实时荧光HDA检测单核细胞增生李斯特菌的方法。
关键词:单核细胞增生李斯菌;hly基因;赖解旋酶恒温扩增;实时荧光HDA;快速检测
单核细胞增生李斯特氏菌(Listeria monocytogenes)简称单增李斯特菌,是一种革兰氏阳性短小无芽胞杆菌
[1-2]。李斯特菌属有2 个群共7 个种
[3],其中单核细胞增生李斯特菌是能引起人类疾病的一种重要的食源性致病菌。单增李斯特菌在自然界分布广泛,蔬菜、乳制品、海产品、肉类和禽类等食品都已被证实是其传播的载体
[4],该菌的易感人群主要是孕妇、新生儿、老年人和免疫缺陷者,感染后主要会引起李斯特菌病、败血症、脑膜炎和流产等,致死率高达20%~50%
[5-7]。2000年,世界卫生组织(World Health Organization,WHO)已将单增李斯特菌列为重点检控的食源性致病菌之一
[8-9]。
赖解旋酶DNA等温扩增技术(helicase-dependent isothermal DNA amplification,HDA)是由美国NEB公司研究人员Vincent等于2004年发明的一种新型核酸等温扩增技术
[10-11],该技术模拟体内DNA在恒温条件下进行复制的自然过程,在恒温条件下利用生物复制系统的关键组分实现DNA的体外扩增。HDA主要是利用解旋酶在恒温条件下解开DNA双链,同时DNA单链结合蛋白稳定解开的单链为引物提供结合模板,然后由DNA聚合酶催化合成互补链。新合成的双链在解旋酶的作用下又解成单链,并作为下一轮合成的模板进入循环扩增反应,最终实现靶序列的指数式增长
[12-17]。HDA技术与传统PCR的区别主要在于HDA通过添加解旋酶及单链结合蛋白在等温条件下实现单链模板的循环生产,克服了传统PCR需要依靠仪器反复升降温来获取单链模板的缺点。目前这种方法已应用于一些病原菌的检测
[18-21]。单增菌的致病性与多种毒力因子有关,其中溶血素O在单增菌侵染过程中扮演着重要角色,是单增菌的主要毒力因子,它存在于所有的致病性单增菌中,是能够结合胆固醇,并且可被巯基活化的细胞溶解素
[22-25]。溶血素O是由hly基因编码而来的,本研究尝试选取hly基因作为检测靶基因,自行设计特异性引物,建立实时荧光HDA快速检测单增李斯特菌的新方法。
1 材料与方法
1.1 材料与试剂
本研究所用的单核细胞增生李斯特菌株和实验菌株如表1所示。标准菌株分别购自美国典型菌种保藏中心(American Type Culture Collection,ATCC)和中国医学细菌保藏管理中心(National Center for Medical Culture Collections,CMCC)。
表1 参试菌株
Table1 Bacterial strains tested in this study

菌株名称拉丁名来源单核细胞增生李斯特氏菌Listeria monocytogenesATCC19115格氏李斯特氏菌Listeria grayiATCC700545英诺克李斯特氏菌Listeria innocuaATCC33090产气肠杆菌Enterobacter aerogenesATCC13048福氏志贺氏菌Shigella fl exneriCMCC51572大肠埃希氏菌Escherichia coliATCC8739鼠伤寒沙门氏菌Salmonella typhimuriumATCC14028金黄色葡萄球菌Staphylococcus aureusCMCC26003蜡样芽孢杆菌Bacillus cereusCMCC63303阪崎肠杆菌Enterobacter sakazakiiATCC29544
HDA等温扩增试剂盒(IsoAmpⅡ tHDA kit) 美国New England Biolabs(NEB)公司;7500荧光定量PCR仪美国ABI公司;Maxima SYBR Green qPCR预混液 美国Thermo Fisher Scientific公司;细菌基因组DNA提取试剂盒 天根生化科技(北京)有限公司;培养基广东环凯微生物科技有限公司。
1.2 方法
1.2.1 引物设计
根据单增李斯特菌ATCC19115在GenBank中hly基因的登录号JN703919.1,应用BatchPrimer3设计多对引物,分别筛选出适合实时荧光HDA和实时荧光PCR的引物对见表2,引物由生工生物工程(上海)股份有限公司合成。
表2 引物及序列
Table2 Primer sequences used in this study

方法引物序列(5’→3’)实时荧光HDA上游TCAGTGAGGGGAAAATGCAAGAAG下游CAGCTTTGCCGAAAAATCTGGAAGG实时荧光PCR上游AAAACGTGATTCATTAACACT下游CACTAATGTATTTACTGCGTTG
1.2.2 细菌基因组DNA的提取
分别通过试剂盒法和热裂解法提取各菌株基因组DNA,并用Epoch微孔板分光光度计进行DNA检测,结果表明2 种方法提取到的DNA差异不大,因此选择热裂解法提取各菌株的DNA。试剂盒法提取步骤详见试剂盒说明书,热裂解法提取步骤:取1 mL菌悬液于EP管中,12 000 r/min离心1 min,弃上清液;取500 μL灭菌水吹打沉淀,12 000 r/min离心1 min,弃上清液;重复上一步骤;取100 μL灭菌水吹打沉淀,沸水浴10 min,12 000 r/min离心1 min;取上清液至另一EP管,-20 ℃保存。
1.2.3 实时荧光HDA方法的建立
热裂解法提取菌株DNA,按HDA等温扩增试剂盒建立反应体系,并对引物终浓度、反应温度及反应时间进行优化。按照优化后的方法对各菌株提取的DNA进行实时荧光HDA扩增,验证方法的可行性。实时荧光PCR扩增方法参照反应试剂盒说明书,在7500荧光定量PCR仪上进行。
1.2.4 引物特异性实验
以单增李斯特菌株及对照菌株提取的DNA为模板,分别采用实时荧光HDA和实时荧光PCR方法进行实验,验证各自引物的特异性。
1.2.5 单增李斯特菌纯培养灵敏度实验
将单增李斯特标准菌株ATCC19115活化,接种至适宜的培养基中进行增菌培养,并用浊度仪检测其菌悬液浓度(1.2×10
8CFU/mL),将菌悬液进行10 倍梯度稀释,用热裂解法提取各梯度单增李斯特菌基因组DNA,以此为模板进行实时荧光HDA和PCR实验,验证其检测灵敏度。
1.2.6 人工污染鲜肉中单增李斯特菌最低检测限实验
对实验中用到的新鲜牛肉用国标的方法进行检测,证明不含单增李斯特菌。将增菌培养的单增李斯特菌菌悬液进行10 倍梯度稀释,对应的人工污染到牛肉中,具体操作:将市售牛肉进行搅拌,加少些生理盐水进行均质,称取30 g样品加入到270 mL生理盐水中,混合均匀并分成10份,每等份29 mL,进行灭菌。把稀释好的单增李斯特菌对应的污染到肉匀浆液中。用热裂解法提取各梯度污染的肉匀浆DNA,以此作为模板进行实时荧光HDA和PCR实验,验证其最低检测限。
2 结果与分析
2.1 建立及优化反应体系及反应条件
实时荧光HDA反应体系(25 μL):dd H
2O 12.5 μL,10×Annealing buffer 2.5 μL,MgSO
4(100 mmol/L)1 μL,NaCl(500 mmol/L) 2 μL,IsoAmp dNTP Solution 1.75 μL,Forward Primer(5 μmol/L) 0.375 μL,Reverse Primer(5 μmol/L) 0.375 μL,DNA 2 μL,IsoAmp Enzyme Mix 1.75 μL,EvaGreen(20×,Biotium)0.25 μL,ROX Reference Dye(50×,Invitrogen)0.5 μL。体系的最适引物浓度为0.075 μmol/L。
实时荧光PCR反应体系(25 μL):dd H
2O 7.45 μL,qPCR Mix 12.5 μL,Forward Primer(5 μmol)1.5 μL,Reverse Primer(5 μmol) 1.5 μL,DNA 2 μL,ROX 0.05 μL(使用前按说明书稀释)。
反应程序见表3。
表3 反应程序
Table3 Reaction procedures for HDA and PCR
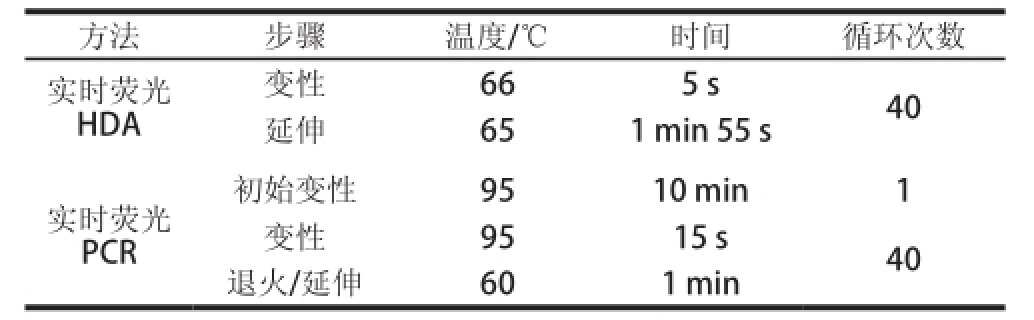
注:熔解曲线阶段根据遵循仪器设置。
方法步骤温度/℃时间循环次数实时荧光HDA变性665 s40延伸651 min 55 s初始变性9510 min1变性9515 s40退火/延伸601 min实时荧光PCR
2.2 引物特异性实验结果
由于引物设计参数的不同,HDA反应和PCR的最适引物有所不同。所以本实验分别针对HDA和PCR方法设计各自最适引物(表2),各自的扩增结果如图1所示。结果表明实时荧光HDA和PCR对单增李斯特菌都有较好的特异性,但从曲线可以看出,HDA方法可在较短时间内快速达到稳定期,扩增效率较高。
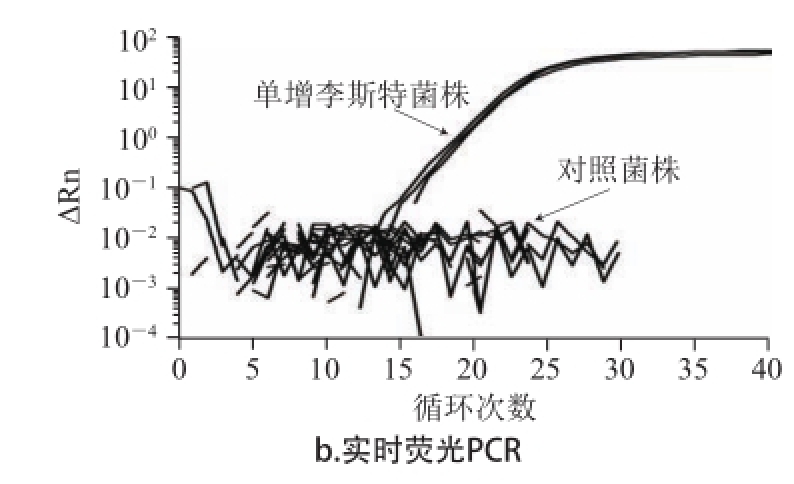
图1 单核细胞增生李斯特菌引物特异性扩增
Fig.1 Primer specificity of real-time HDA and real-time PCR for Listeria monocytogenes
2.3 单增李斯特菌纯培养灵敏度检测实验结果
将菌悬液浓度1.2×10
8CFU/mL的单增李斯特菌进行10 倍梯度稀释,提取每个稀释度的菌悬液DNA,分别用HDA及PCR方法进行扩增,比较两种方法的检测灵敏度,由图2可以看出,单增李斯特菌纯培养HDA方法的最低检测限是1.2×10
2CFU/mL,PCR方法的最低检测限是1.2×10
3CFU/mL,所以实时荧光HDA的检测灵敏度要微高于实时荧光PCR,且更易达到稳定期。
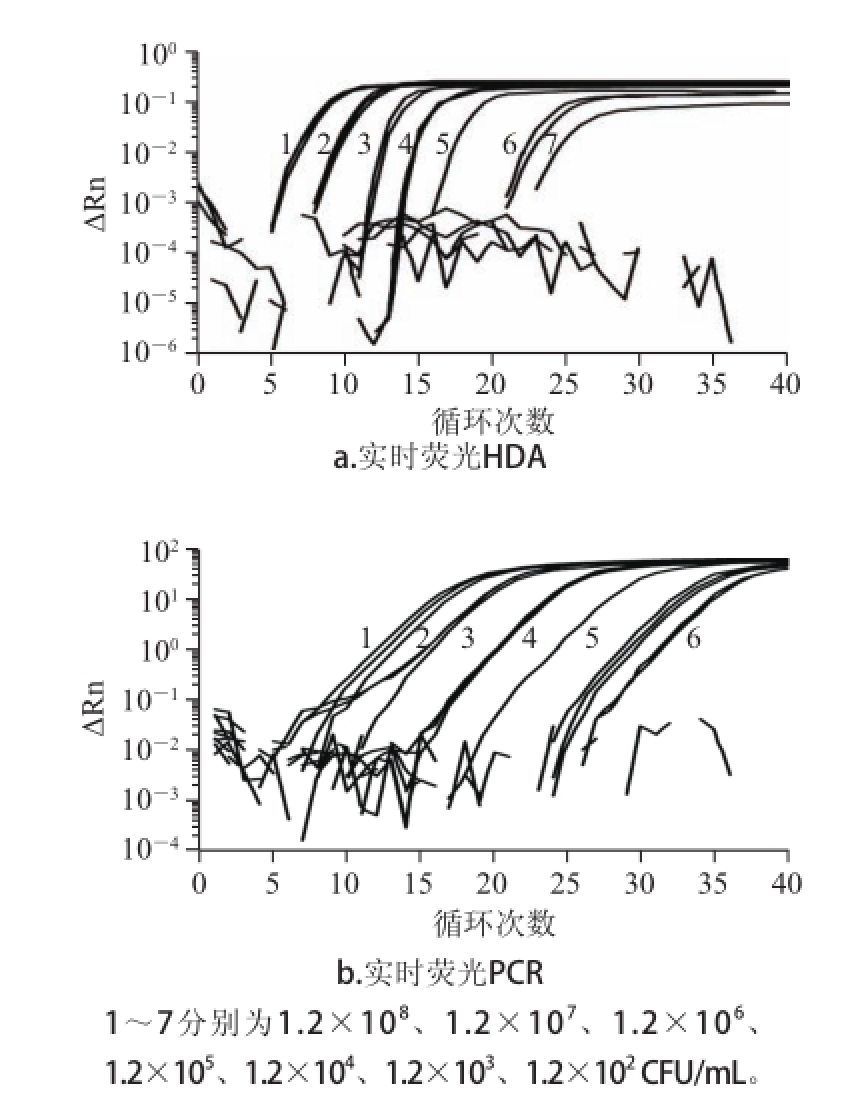
图2 单增李斯特菌纯培养灵敏度确定
Fig.2 Sensitivity of real-time HDA and real-time PCR for Listeria monocytogenes
2.4 人工污染鲜肉中单增李斯特菌最低检测限实验结果
将经过增菌纯培养的单增李斯特菌悬液10 倍梯度稀释后对应的人工污染到灭菌后的牛肉匀浆液中,经计算可知人工污染样品的菌悬液浓度是1.2×10
7~1.2×10
-2CFU/mL,热裂解法分别提取污染样品的DNA,以此作为模板进行HDA和PCR扩增,验证两种方法的最低检测限,由图3的扩增曲线可知,HDA和PCR可以检测到的最低单增李斯特菌浓度是一样的,都是1.2×10
4CFU/mL。说明实时荧光HDA和实时荧光PCR的样品最低检测限相当。

图3 人工污染鲜肉中单增李斯特菌最低检测限确定
Fig.3 Limits of detection of Listeria monocytogenes in artificially contaminated meat
2.5 样品检测验证实验结果
用实时荧光HDA方法对90 份送检食品、市售食品和人工污染食品进行检测,结果如表4所示。其中有3 份单核细胞增生李斯特菌阳性样品,经实时荧光PCR和国标法GB 4789.30—2010 《食品微生物学检验:单核细胞增生李斯特菌检验》复检,检测结果一致,由此可知,实时荧光HDA检测方法具有良好的特异性和灵敏度。
表4 实时荧光HDA方法样品检测
Table4 Results obtained from the detection of Listeria monocytogenes in real samples by real-time fluorescence HDA in comparison to real-time fluorescence PCR and the Chinese national standard

样品名称数量实时荧光HDA实时荧光PCR国标法阳性阴性阳性阴性阳性阴性鲜牛奶27027027027冷冻牛舌18018018018鲜鸡肉26125125125儿童奶粉9090909猪肉制品8080808人工污染样品2202020总计90387387387
3 讨 论
单核细胞增生李斯特菌是全球重点监控的食源性病原菌,快速、低成本检测是发展方向,传统的单增李斯特菌的检测方法主要有国标法、酶联免疫和PCR方法,国标法虽然成本低,但培养时间较长,且容易漏检;酶联免疫法是蛋白质水平的检测方法,灵敏度高于国标法,但有较多的影响因素,如加样方式、温育温度、洗涤方法等,实验的过程性分析较为复杂;普通PCR法扩增后,通过电泳条带判断目标产物大小,但是不能排除非特异性扩增,且很多电泳染料不利于人体健康;实时荧光PCR具有较高的灵敏度和特异性,但是需要昂贵的仪器设备,不易在基层应用,且仪器设备通常体积较大,不易进行户外或现场检测;近年来广泛被研究的环介导恒温扩增检测法虽然反应过程简单,无需使用PCR仪,但设计复杂,对靶序列要求较高,且耗时较长。基于靶基因检测的各种基因体外放大技术,都没法实现现场检测, HDA方法的最大优点是可以真正意义上达到恒温扩增,作为一种新的恒温扩增方法,HDA模拟生物体内DNA的合成方法,由解旋酶解开DNA双链替代PCR中的高温,扩增原理简单,耗时较短。普通的HDA扩增只需要一个恒温的环境即可进行,对设备要求较低。由以上实验可知实时荧光HDA具有较高的灵敏度和特异性,因为是新型的方法,所以目前的实时荧光HDA实验是基于荧光定量PCR仪进行的。本课题组基于HDA扩增原理,在研究对应的实时荧光HDA仪器,相信在不久的将来,低成本、易操作的实时荧光HDA仪有望应用于基层实验室和现场检测。
综上所述,本实验建立的实时荧光HDA检测方法可实现恒温扩增无需大型设备,且检测灵敏度和特异性等同于实时荧光定量PCR,未来在配备相关设备后,将具有良好的应用和发展前景。
参考文献:
[1] KATHARIOU S. Listeria monocytogenes virulence and pathogenicity, a food safety perspective[J]. Food Protection, 2002, 65(11): 1811-1829.
[2] VAZQUEZ-BOLAND J A, KUHN M, BERCHE P, et al. Listeria pathogenesis and molecular virulence determinants[J]. Clinical Microbiol Reviews, 2001, 14(3): 584-640.
[3] JAY J M, LOESSNER M J, GOLDEN D A. 现代食品微生物学[M].何国庆, 丁立孝, 宫春波, 等, 译. 北京: 中国农业大学出版社, 2008.
[4] LIU Dongyou, AINSEORTH A J, AUSTIN F W, et al. Use of PCR Primers derived from a putative transcriptional regulator gene for species-specific determination of Listeria monocytogenes[J]. International Journal of Food Microbiology, 2004, 91(3): 297-304.
[5] 徐义刚, 崔丽春, 李丹丹, 等. 食品中单核细胞增生李斯特菌DNA环介导恒温扩增快速检测方法的建立[J]. 食品科学, 2012, 33(16): 137-141.
[6] 江汉湖. 食品微生物学[M]. 北京: 中国农业出版社, 2005.
[7] 何冬梅, 邓峰, 赖蔚苳, 等. 单核细胞增生李斯特菌生物学研究进展[J].华南预防医学, 2006, 32(6): 26-29.
[8] 梅玲玲, 王晶, 孟真, 等. Taq Man-MGB探针Real-time PCR快速检测单增李斯特菌的研究[J]. 中国卫生检验杂志, 2007, 17(2): 211-213.
[9] 国家标准化管理委员会. GB/T 4789.30—2008 单核细胞增生李斯特菌检验[S]. 北京: 中国标准出版社, 2008.
[10] VINCENT M, XU Yan, KONG Huimin. Helicase-dependent isothermal DNA amplification[J]. EMBO Reports, 2004, 5(8): 795-800.
[11] 陈璐, 沈建箴. 赖解旋酶恒温基因扩增技术的研究进展[J]. 医学综述, 2010, 16(13): 1932-1934.
[12] JEONG Y J, PARK K, KIM D E. Isothermal DNA amplification in vitro: helicase-dependent amplification system[J]. Cellular and Molecular Life Sciences, 2009, 66(20): 3325-3336.
[13] CHAVOLLA E T, ALOCILJA E C. Nanoparticle based DNA biosensor for tuberculosis detection using thermophilic helicasedependent isothermal amplification[J]. Biosensors and Bioelectronics, 2011, 26(11): 4614-4618.
[14] TIAN Leilei, WEIZMANN Y. Real-time detection of telomerase activity using the exponential isothermal amplification of telomere repeat assay[J]. Journal of the American Chemical Society, 2013, 135(5): 1661-1664.
[15] CAO Anping, ZHANG Chunyang. Real-time detection of transcription factors using target-converted helicase-dependent amplification assay with zero-background signal[J]. Analytical Chemistry, 2013, 85(4): 2543-2547.
[16] RAMALINGAM N, SAN T C, KAI T J, et al. Microfluidic Devices harboring unsealed reactors for real-time isothermal helicase-dependent amplification[J]. Microfluid Nanofluid, 2009, 7(3): 325-336.
[17] MAHALANABIS M, DO J, ALMUAYAD H, et al. An integrated disposable device for dna extraction and helicase dependent amplification[J]. Biomed Microdevices, 2010, 12(2): 353-359.
[18] 王建广, 雷质文, 刘云国, 等. 志贺菌依赖解旋酶DNA恒温扩增技术建立[J]. 中国公共卫生, 2012, 28(4): 550-552.
[19] 梁炜, 张京宣, 张云霞, 等. 基于HDA的超级细菌耐药基因NDM-1检测方法的建立[J]. 食品安全质量检测学报, 2011, 2(3): 152-158.
[20] GILL P, AMINI M, GHAEMI A, et al. Detection of Helicobacter pylori by enzyme-linked immunosorbent assay of thermophilic helicase-dependent isothermal dna amplification[J]. Diagnostic Microbiology and Infectious Disease, 2007, 59(3): 243-249.
[21] O’NEIL D, DOSEEVA V, ROTHMANN T, et al. Evaluation of Chlamydia trachomatis and Neisseria gonorrhoeae detection in urine, endocervical, and vaginal specimens by a multiplexed isothermal thermophilic helicase-dependent amplification (tHDA) assay[J]. Journal of Clinical Microbiology, 2011, 49(12): 4121-4125.
[22] 孔德壮. 单增李斯特菌溶血素O单克隆抗体的制备及其间接夹心ELISA检测方法的初步建立[D]. 杨凌: 西北农林科技大学, 2010.
[23] 刘海瑞. 单核细胞增多性李斯特菌hly基因的克隆表达与间接ELISA检测方法的建立[D]. 大庆: 黑龙江八一农垦大学, 2009.
[24] MOUSHUMI P, GIAN M B, SABRIAN A, et al. Direct, quantitative detection of Listeria monocytogenes in fresh raw whole milk by qPCR[J]. Internation Dairy Journal, 2015, 41: 46-49.
[25] WANG Guangyu, QIAN Wenjuan, ZHANG Xinxiao, et al. Prevalence, genetic diversity and antimicrobial resistance of Listeria monocytogenes isolated from ready-to-eat meat products in Nanjing, China[J]. Food Control, 2015, 50: 202-208.
Real-Time Fluorescence Helicase-Dependent Isothermal DNA Amplification Method for Rapid Detection of Listeria monocytogenes in Foods
ZHANG Mingru
1, RAO Li
1, WANG Jianguang
1, JIE Li
2, DING Hongliu
2, SHEN Xiaofang
1,*
(1. School of Food Science and Technology, Jiangnan University, Wuxi 214122, China; 2. Suzhou Product Quality Supervision and Inspection Institute, Suzhou 215104, China)
Abstract:The purpose of this study was to develop a real-time helicase-dependent isothermal DNA amplification (HDA) method for the rapid detection of Listeria monocytogenes. Based on the platform of real-time PCR, pairs of primers targeting the hemolysin gene (hly) of Listeria monocytogenes were designed, and genomic DNA was extracted from a standard strain of L. monocytogenes for use as the template. The reaction temperature, primers and template DNA concentration were optimized. Compared with real-time PCR method, the specificity and sensitivity of the real-time HDA method were evaluated with L. monocytogenes and 10 bacteria control strains, and then this developed method was used to detect L. monocytogenes in real samples. The results showed that the optimal primer concentration, reaction temperature and time for real-time HDA system were 0.075 mol/L, 65 ℃ and 80 min (40 cycles), respectively. This system showed a high specificity and sensitivity. Thus a real-time HDA method for rapid and specific detection of L. monocytogenes has been successfully established.
Key words:Listeria monocytogenes; hemolysin gene; helicase-dependent isothermal amplification; real-time fluorescence HDA; rapid detection
中图分类号:R155.5
文献标志码:A
文章编号:
doi:10.7506/spkx1002-6630-201510041
收稿日期:2014-08-18
基金项目:苏州科技局科技支撑计划项目(SS201338)
作者简介:张明如(1988—),女,硕士,研究方向为食品安全与质量控制。E-mail:yyzmrhxn@163.com
*通信作者:沈晓芳(1976—),男,副教授,博士,研究方向为食品安全与质量控制。E-mail:xfshen@jiangnan.edu.cn







