应用LNA-TaqMan探针实时荧光PCR检测大米制品中转基因成分
潘 广
1,章桂明
1,陈枝楠
2,程颖慧
1,向才玉
1,包先雨
2,凌杏园
1,*
(1.深圳出入境检验检疫局动植物检验检疫技术中心,广东 深圳 518045;2.深圳市检验检疫科 学研究院,广东 深圳 518010)
摘 要:大米制品中痕量转基因成分的检测需要特异和超灵敏的检测方法。本研究以行业标准中转基因大米筛查位点CaMV35S启动子、NOS终止子和Cry1A基因为目标,利用在常规TaqMan探针中掺入锁核苷酸提高探针退火温度和杂交特异性等特点,经比较以上位点不同LNA-T aqMan探针实时荧光聚合酶链式反应(polymerase chain reaction,PCR)检测效果,建立了针对上述筛查位点的基于LNA-TaqMan探针的新型实时荧光PCR检测方法。该方法特异性强,检测灵敏度超高;与普通TaqMan实时荧光PCR方法相比,其反应Ct值可提前1~3个循环(Cry1A位点除外),检测低限可达3 pg。该检测方法可以用以检测大米制品中常规实时荧光PCR难以检测到的痕量转基因大米成分。
关键词:大米制品;锁核酸;锁核酸探针;实时荧光PCR
大米是我国最主要的主粮之一,其安全性特别是转基因情况倍受百姓关注。目前,国际上有5 个已批准商业化生产的转基因水稻品种,它们是拜耳公司研发的LLRICE06、LLRIC E601和LLRICE62,日本研发的7Crp#10和伊朗研发的Tarom molaii+cry1Ab。我国是最早开展转基因水稻研究的主要国家之一,截至2009年,我国有记录的田间试验达4 000多次,其中水稻有480余次
[1];仅国内外文献已披露的我国转基因水稻品系就有Bt汕优63、华 恢1号、科丰6号、科丰8号、科螟稻等
[2-4],其中品系Bt汕优63和华恢1号于2010年获农业部颁发的生物安全证书。我国迄今未批准任何转基因大米的进口,也未批准任何国内的转基因水稻商业化种植;因此,国内市场以及在出口的大米和米制品中不应含有任何的转基因成分。然而,仅在2012年,我国出口到欧盟的大米制品如米粉、米线、米条等被通报检出非法转基因成分的就达到32 次之多
[5]。这不仅给出口企业造成了直接的经济损失,更重要的是影响了我国出口产品的声誉。
出现上述情况,一是因为转基因品种或品系资源在环境释放等环节存在监管上的漏洞;其二是我国转基因水稻未商业化种植,出现在普通大米中的转基因大米往往是污染造成的,本身含量就很低,加上米制品在加工生产过程中,其基因组DNA高度降解,以目前常规聚合酶链式反应(polymerase chain reaction,PCR)和实时荧光PCR为主的转基因检测方法往往难以检出这些痕量的转基因成分。因此,有必要研发专门针对米制品等加工食品的痕量转基因成分的检测技术,以确保对这些大米制品中的转基因成分“检得出”和“检的准”。
L AN-TaqTan探针是一种应用于实时荧光PCR的新型的探针。由于其在常规TaqMan探针中参入了锁核苷酸(locked nucleotide acid,LAN),大大提高探针与目标序列的亲和力,提高了探针的T
m值,从而可使探针设计的更短,进而适应于超短DNA片段的检测,因此检测灵敏度更高
[6]。本研究以米制品为材料,以行业标准中筛查转基因大米成分的CaMV35S启动子、NOS终止子和Cry1A基因为目标
[7],设计和制备了掺入不等锁核苷酸的超短的LNA-TaqMan探针。通过对不同的LNA-TaqMan探针实时荧光PCR扩增效果比较,筛选得到了检测上述3 个外源基因的LNA-TaqMan短探针,进而建立了针对上述筛查基因的LNA-TaqMan探针实时荧光PCR检测方法。该方法特异性强、灵敏度高,特别适于大米制品等加工食品中含上述外源基因的转基因成分的检测。
1 材料与方法
1.1 材料与试剂
爆米花、旺旺大米饼、旺旺黑米雪饼、旺旺大米海苔、贝壳米粉、东莞米粉、河源米粉、桂林米粉、江西米粉和云南米线均采自超市。
转基因玉米标准品Bt11 欧盟标准局;转基因大米标准品LLRice62、LLRice601 美国美国油脂化学家协会;转基因水稻(大米)科丰8号、科丰6号和Bt汕优63参照样品由中国检验检疫科学研究院;大米制品米粉1、2和3号、东北五常大米、泰国香米及非转基因大豆、非转基因油菜、非转基因玉米、非转基因棉花和非转基因小麦均由本实验室收集。
实时荧光PCR反应用试剂盒TaqMan Enviromental Master Mix 2.0 美国Applied Biosystems公司。CTAB核酸提取液和沉淀液等均由实验室自行配制。
1.2 仪器与设备
离心机 美国贝克曼库尔特公司;涡旋震荡仪 德国IKA公司;恒温水浴锅 北京六一公司;NanoDrop2000c分光光度计 美国赛默飞世尔科技公司;7900实时荧光PCR仪 美国Applied Biosystem公司;纯水器 美国Millipore纯水器。
1.3 方法
1.3.1 DNA提取与制备
DNA提取方法采用GB/T 19495.3—2004《转基因产品检测:核酸提取纯化方法》中的CTAB-2方法
[8],用NanoDrop2000c测定其浓度和质量。DNA质量浓度按照下式计算:
C=A×N×50
式中:C为DNA质量浓度/(ng/μL);A为260 nm波长处的吸光度;N为核酸稀释倍数。当A
260
nm/A
280
nm比值在1.7~1.9之间时,适宜于PCR扩增。
1.3.2 LNA-TaqMan探针和引物
引物序列、LNA-TaqMan探针序列以及锁核苷酸掺入位置见表1,以上探针和引物均由江苏硕世生物科技有限公司合成。
表1 引物和探针序列信息
Table1 Sequence information for the primers and probes used in this study

注:探针序列中大写字母为引入锁核苷酸位置。
检测位点引物序列(5’→3’)探针序列(5’→3’)本研究扩增片段/bp行标实时荧光PCR扩增片段/bp CaMV35S正:5’-cgacagtggtcccaaagat-3’5'-FAM-gacccccAccCacGagg-BHQ1-3'5874反:5’-gtcttctttttccacgatgc-3’NOS正:5’-gcttaacgtaattcaacagaaat-3’5'-FAM-cgcaaGaccggcAacagg-BHQ1-3'91165反:5’-tcaaacatttggcaataaagtt-3’Cry1A正:5’-gcgtattcaattcaacgacat-3’5'-FAM-cagCgccttgacCacagct-BHQ1-3'73133反:5’-ttggtagttctggactgcga-3’
1.3.3 实时荧光PCR反应体系和反应条件
实时荧光PCR扩增反应体系20 μL,其中2× TaqMan Enviromental Mix 2.0 10 μL,DNA模板(50 ng/μL)3 μL,正反向引物(10 μmol/L)各2 μL,探针(10 μmol/L)1 μL,用双蒸水补足体积至20 μL,每个试样重复3 次PCR反应,同时设空白对照、阳性对照和阴性对照。
扩增反应在ABI7900型实时荧光PCR仪上进行。扩增反应采用两步法:95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火1 min,40 个循环。
1.3.4 实时荧光PCR反应特异性测定
用2% Bt11、10%科丰6号、100%科丰8号、100%克螟稻、5%Bt汕优63、LLRice62、LLRice601、东北大米、泰国香米以及非转基因大豆、非转基因油菜、非转基因玉米、非转基因棉花和非转基因小麦共总计14 个不同转基因或非转基因样品测试方法的特异性。
1.3.5 检测低限的测定
将100%科丰8号转基因大米基因组DNA,用10 倍梯度系列稀释成10 ng/μL~0.1 pg/μL共6 个质量浓度梯度,每PCR反应加3 μL,每个质量浓度重复3 次PCR反应。发生扩增反应的最低样品质量浓度或基因组DNA量即该方法的检测低限。
1.3.6 实时荧光PCR反应效率测定
按检测低限测定方法配制标准梯度样品,以样品扩增的Ct值为Y轴,标准梯度样品DNA拷贝数(或浓度)的对数为X轴,根据标准梯度样品的Ct值和基因组DNA拷贝数(或浓度)的对数绘制标准曲线(Ct=k×lg(DNA拷贝数)+b),计算标准曲线的线性斜率k值。根据公式E=10
-1/k-1计算定量PCR的扩增效率。
1.3.7 实际样品检测实验
用所建立的LNA-TaqMan探针实时荧光PCR方法和普通TaqMan探针实时荧光PCR方法同时对13 份米制品进行检测,每检测位点重复3 次检测。两者除了探针引物不同之外,其他其他反应体系、DNA用量和反应条件完成一致。
2 结果与分析
2.1 方法的建立
表2 LNA-TaqMan探针和常规TaqMan探针实时荧光PCR反应Ct值比较
Table2 Comparative Ct values of real-time PCR with LNA-TaqMan probe and TaqMan probe
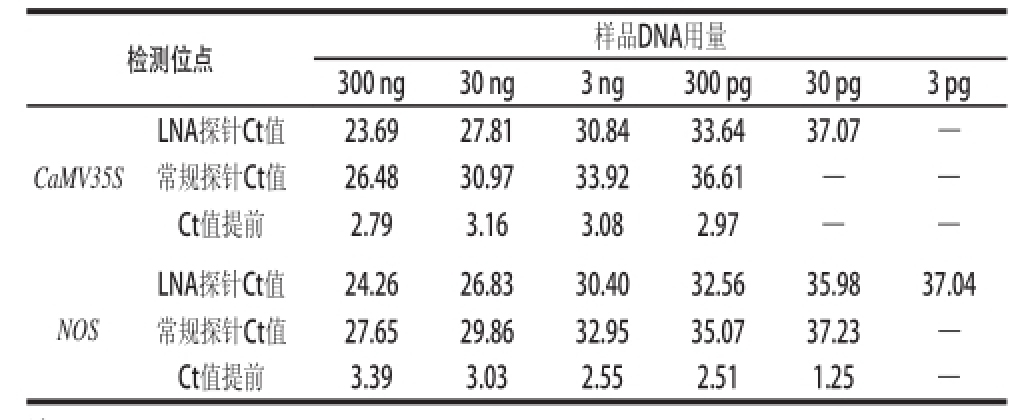
注:—.没有扩增。下同。
检测位点样品DNA用量300 ng30 ng3 ng300 pg30 pg3 pg CaMV35S LNA探针Ct值23.6927.8130.8433.6437.07—常规探针Ct值26.4830.9733.9236.61——Ct值提前2.793.163.082.97——NOS LNA探针Ct值24.2626.8330.4032.5635.9837.04常规探针Ct值27.6529.8632.9535.0737.23—Ct值提前3.393.032.552.511.25—
行业标准SN/T 2584—2010《水稻及其产品中转基因成分实时荧光PCR检测方法》
[8]规定了筛查转基因水稻成分外源基因CaMV35S、NOS和Cry1A的实时荧光PCR检测方法。本研究以上述3 种基因标准方法检测目标区序列为基础,设计掺入锁核苷酸的LNA-TaqMan的短探针和引物。由于掺入锁核苷酸的数目和位置直接影响探针的长短和实时荧光PCR反应的效果,本研究以100%科丰8号样品DNA为材料,将这些设计制备的锁核酸探针(包括相配套的引物)的实时荧光PCR反应在同等条件下与标准SN/T 2584—2010规定的实时荧光反应进行比较,根据实时荧光PCR反应Ct值提前最多(或大)同时锁核酸探针最短的原则,最终确定了检测CaMV35S、NOS和Cry1A位点的锁核酸探针和引物序列(表1)。上述三位点中CaMV35S和NOS的基于锁核酸探针的实时荧光PCR反应在不同DNA浓度时Ct值比相应普通探针实时荧光PCR方法均提前1~3个循环(表2);位点Cry1A不同浓度检测Ct值提高没有规律,但设计的探针比普通TaqMan探针大大缩短。以上结果表明这种基于LNA-TaqMan探针检测方法的灵敏度有了很大地提高。
2.2 特异性实验结果
Table3 Specificity evaluation of LNA-TaqMan probe- real-time PCR
Table3 Specificity evaluation of LNA-TaqMan probe- real-time PCR
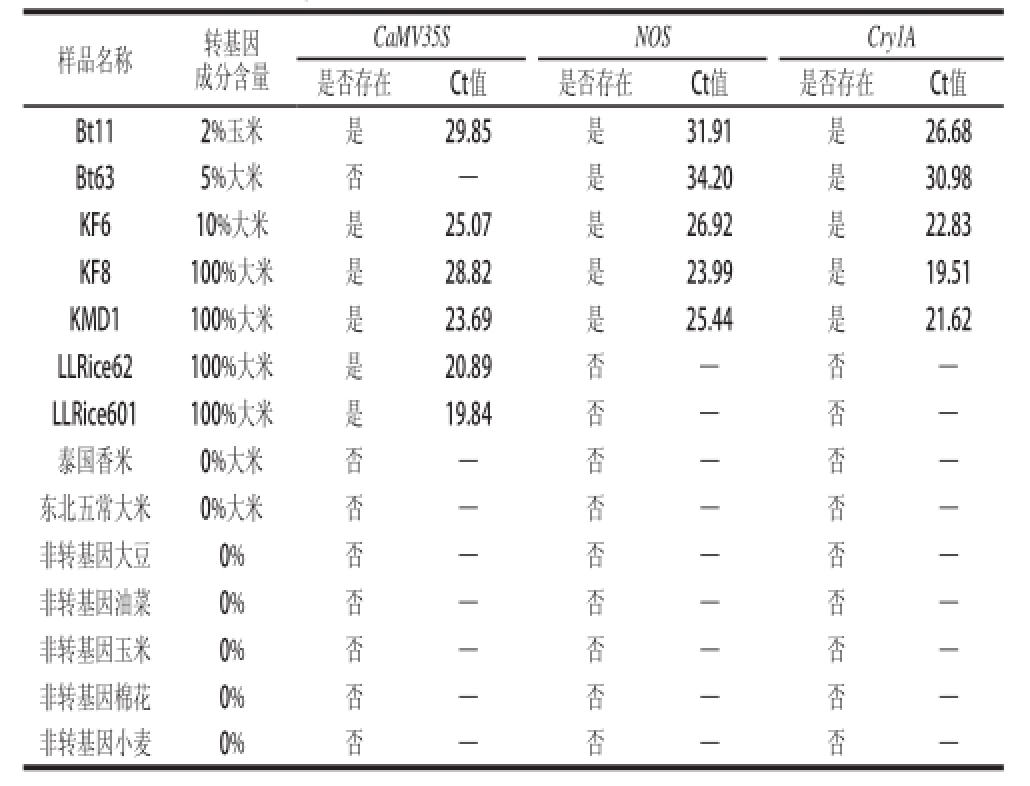
CaMV35SNOSCry1A是否存在Ct值是否存在Ct值是否存在Ct值Bt112%玉米是29.85是31.91是26.68 Bt635%大米否—是34.20是30.98 KF610%大米是25.07是26.92是22.83 KF8100%大米是28.82是23.99是19.51 KMD1100%大米是23.69是25.44是21.62 LLRice62100%大米是20.89否—否—LLRice601100%大米是19.84否—否—泰国香米0%大米否—否—否—东北五常大米0%大米否—否—否—非转基因大豆0%否—否—否—非转基因油菜0%否—否—否—非转基因玉米0%否—否—否—非转基因棉花0%否—否—否—非转基因小麦0%否—否—否—样品名称转基因成分含量
如表3所示,CaMV35S基因在KF6、Bt11、KF8、KMD1、LLRice6和LLRice601等转基因样品中实际存在
[4,
9-13],而本实验的特异性检测结果与其一致;NOS基因和Cry1A基因也得到了相同的结果;同时上述3 个基因均没有在泰国香米、东北大米和其他非转基因植物中检出。以上结果表明本研究建立的检测方法特异性强。
2.3 检测低限测定结果
以100%科丰8号样品DNA通过梯度稀释获得的30、3 ng,300、30、3 pg和0.3 pg的总DNA模板量进行实时荧光PCR扩增,每个DNA样品重复3 次。表4显示,对于300 pg的转基因含量100%的DNA样品来说,3 个筛查基因均得到有效扩增,且其Ct值均小于35,且不同重复间曲线重合性较好(图1~3)。对于30 pg的转基因含量100%的DNA样品来说,CaMV35S基因只有一个出现扩增,且Ct值已超过37(图1未给出扩增曲线),表明其检测低限低于300 pg;但NOS基因和Cry1A基因两者均可以检出,且Ct值在30左右,且重复性较好(图2和图3),可见该两基因的检测方法的灵敏度优于CaMV35S。对于3 pg和0.3 pg的转基因含量100%的DNA样品来说,NOS基因和Cry1A基因两者均有扩增,NOS基因扩增重复性较好(图2),Ct值在37左右;Cry1A基因在3 次重复中只扩增出1 次,Ct值已在37左右,可见0.3 pg基因组DNA(100%转基因含量)是两基因的检测低限。另外,计算扩增效率显示,CaMV35S、NOS和Cry1A基因的扩增效率分别为120%、105%和105%。
Table4 Limit of detection of LNA-TaqMan probe real-time PCR
Table4 Limit of detection of LNA-TaqMan probe real-time PCR

样品总DNA用量CaMV35SNOSCry1A重复1重复2重复3重复1重复2重复3重复1重复2重复3科丰8号(100%)30 ng28.6828.0827.6323.0221.8521.8121.1120.9920.96 3 ng30.8530.9531.4324.4224.6424.9824.2724.2824.48 300 pg33.6634.1933.9929.0128.7627.6427.7827.7727.69 30 pg37.07——29.8930.6932.8531.5831.5230.61 3 pg——35.6735.2034.2235.0034.5334.83 0.3 pg——36.6137.0736.0137.00——扩增效率120%105%105%
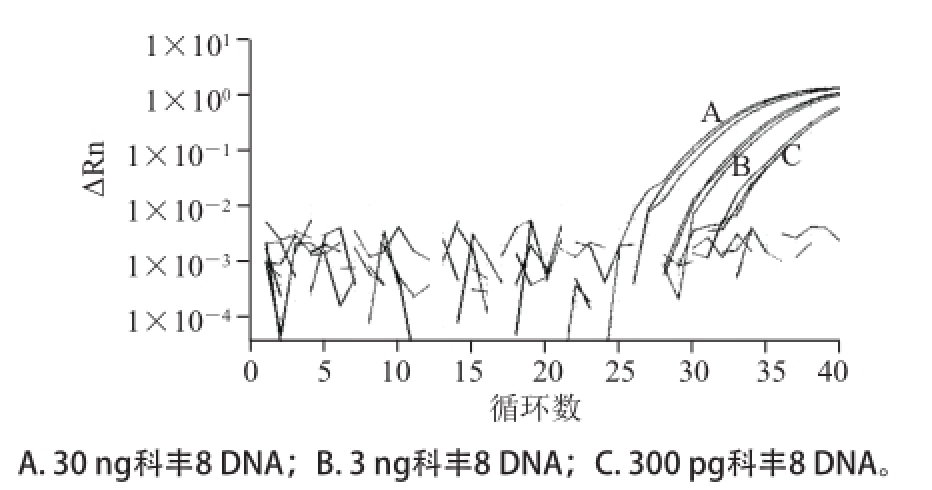
图1 1CaMV35S基因LNA-TaqMan探针实时荧光PCR检测低限测定图谱
Fig.1 Limit of detection of CaMV35S gene with LNA-TaqMan probe real-time PCR
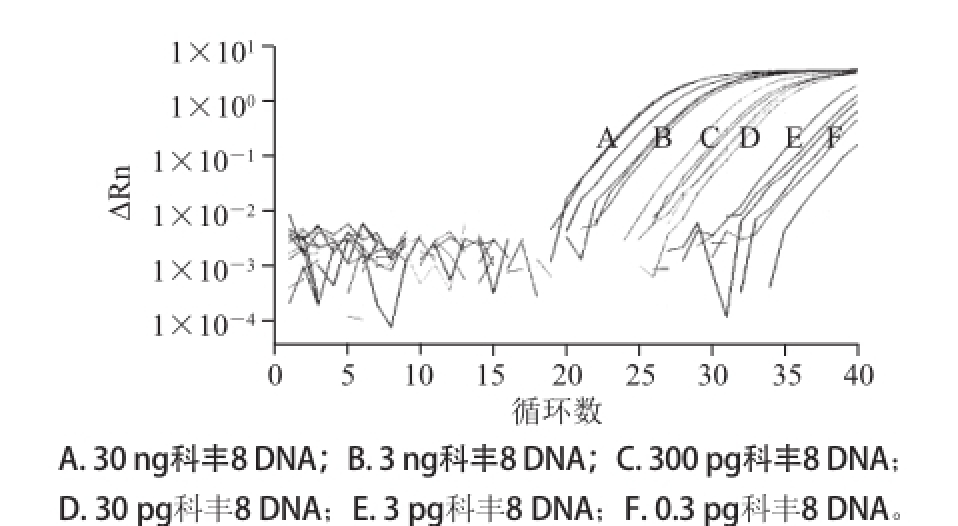
图2 2NOS基因LNA-TaqMan探针实时荧光PCR检测低限测定图谱
Fig.2 Limit of detection of NOS gene with LNA-TaqMan probe real-time PCR
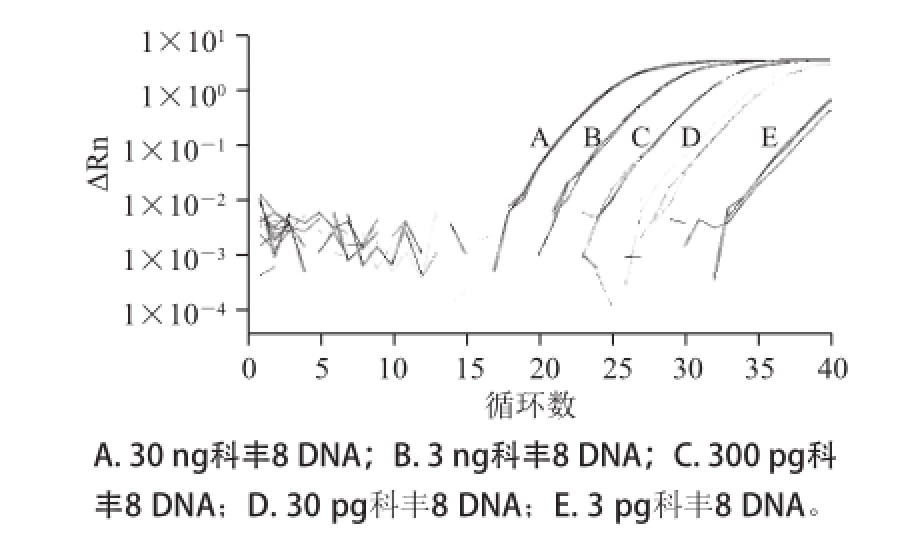
图3 3Cry1A基因LNA-TaqMan探针实时荧光PCR检测低限测定图谱
Fig.3 Limit of detection of Cry1A gene with LNA-TaqMan probe realtime PCR
2.4 实际样品的检测结果
用建立的LNA-TaqMan探针实时荧光PCR方法和普通TaqMan探针实时荧光PCR方法同时对13份米制品进行检测,每位点重复3 次检测,Ct值取其平均值,检测结果见表5。从表5可以看出,13 个米制品中提取的基因组DNA质量很好,没有抑制PCR扩增的物质存在,因为内源基因Gos9扩增效果好;3 种旺旺米制品和爆米花内源基因Gos9扩增Ct值高,表明大米制品DNA的降解比另外9 种米粉和米线产品程度大。从2 种方法外源基因的扩增Ct值可以看出,2号、3号、东莞、河源、桂林和江西米粉6个样品2 种实时荧光PCR均有扩增信号,其Ct值在33.12~38.89之间,表明它们含转基因成分,但含量低,是典型的弱阳性样品。旺旺大米饼2 种探针检测均无扩增信号,表明该大米制品不含转基因大米成分。而对于其他6 种大米制品两种方法检测的结论不同,普通TaqMan探针实时荧光PCR检测结果为阴性,而本研究建立的方法检测结果为阳性,因为CaMV35S基因检测呈阳性。从表5还可以看出,位点CaMV35S和NOS位点锁核酸探针实时荧光PCR检测Ct值比普通实时荧光PCR方法均提前1~3各循环;对于位点Cry1A,含LNA探针实时荧光PCR反应Ct值也均有提前,但对样品桂林米粉和江西米粉Ct值提前不到1 个循环(表5中带“*”的Ct值)。可见本新方法的检测灵敏度优于行业标准使用的普通探针实时荧光检测方法。这是因为锁核酸探针与靶序列DNA结合稳定性高、荧光信号强、嘈音低,荧光信号更易为PCR仪检出;另外,由于锁核酸探针比普通探针短很多(表1),对于DNA高度降解的加工食品,其有效模板数相对增加了。
表5 大米制品LNA-TaqMan探针和常规TaqMan探针Ct值检测结果
Table5 Ct values of rice-derived products detected with LNA-TaqMan probe and conventional TaqMan probe real-time PCR
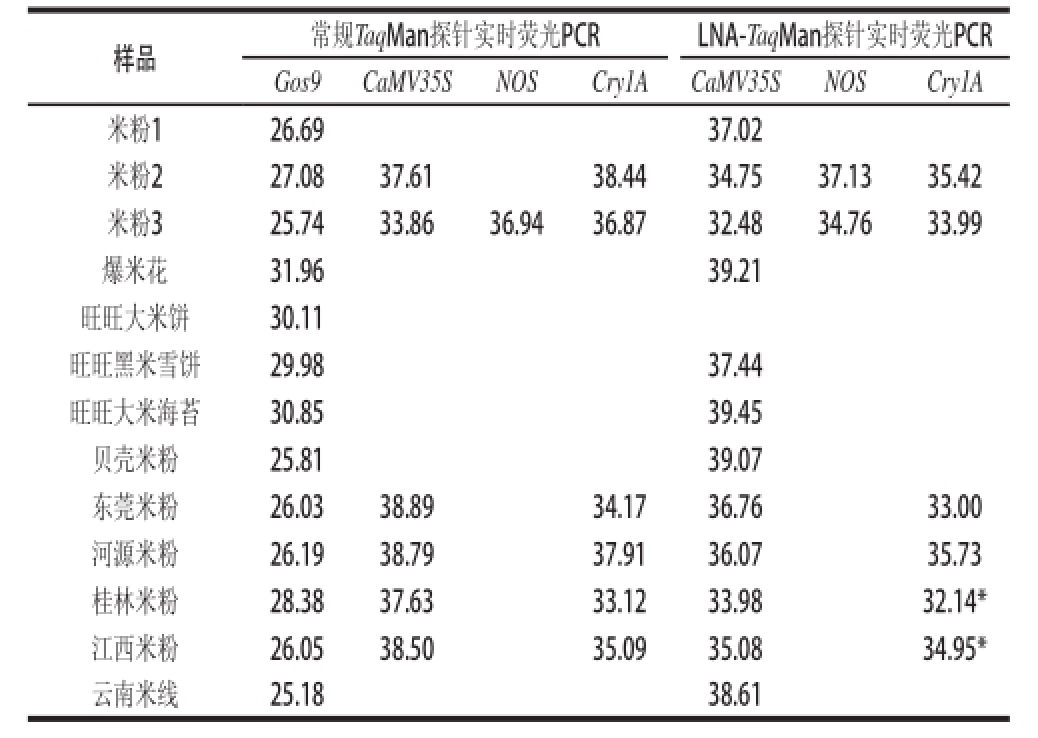
样品常规TaqMan探针实时荧光PCRLNA-TaqMan探针实时荧光PCR Gos9 CaMV35SNOSCry1ACaMV35SNOS Cry1A米粉126.69 37.02米粉227.0837.61 38.4434.7537.1335.42米粉325.7433.8636.9436.8732.4834.7633.99爆米花31.96 39.21旺旺大米饼30.11旺旺黑米雪饼29.98 37.44旺旺大米海苔30.85 39.45贝壳米粉25.81 39.07东莞米粉26.0338.89 34.1736.76 33.00河源米粉26.1938.79 37.9136.07 35.73桂林米粉28.3837.63 33.1233.98 32.14*江西米粉26.0538.50 35.0935.08 34.95*云南米线25.18 38.61
3 讨 论
目前,针对大米制品等加工食品低痕量转基因成分的检测方法,主要有TaqMan或SYBR Green实时荧光PCR和巢式PCR等分子检测方法
[9,14-16],其检测灵敏度可达0.01%(质量百分比)。但这些PCR方法的检测目标DNA一般在100 bp以上,由于加工食品中DNA遭到高度降解,许多DNA片段小于以上长度,因而进一步降低加工食品中PCR反应有效的起始模板数,致使这些方法的实际检测灵敏度大大降低。而巢式PCR还存在易污染、假阴性等现象。因此,对加工食品高度降解后短片断DNA的检测,是提高检测灵敏度高的关键。
LNAs是核酸的类似物,其与普通寡核苷酸类似物相比在其碳环的2’氧原子和4’碳原子位置引入亚甲基桥形成锁状结构,由于LNA与DNA/RNA在结构上具有相同的磷酸盐骨架,其不但可以与DNA、RNA结合成双链,且其双链的热稳定性更高。据研究在普通探针中引入一个LNA碱基可增强探针和底物结合的稳定性,提高探针T
m(退火温度)3~8 ℃并使TaqMan探针信号增强、信噪比增大
[17-18]。因此,相同长度的含LNA的杂交探针比普通杂交探针与目标序列的杂交特异性更高,目前含LNA杂交探针的这一特点已应用于如芯片、原位杂交等分子生物学领域
[19]。同理,在相同解链温度条件下,LNATaqMan探针比普通TaqMan探针短。LNA-TaqMan探针可以设计较得更短的这一特点已应用于检测复杂目标序列,如AT或GC富含区。Tranh等
[20]应用LNA-TaqMan探针RT-PCR检测H
5N
1流感病毒,并指出LNA探针因其检测的高效率性而与实时荧光定量PCR结合用于临床疾病检测。韦信贤等
[21]应用LNA-TaqMan探针荧光定量PCR快速检测对虾传染性皮下及造血组织坏死病毒,证明该方法检测IHHNV的灵敏度高,可以检测到约10 个病毒粒子/反应,且特异性、重复性和重现性较好。
LNA-TaqMan探针比常规TaqMan探针可设计得更短,可以适于加工食品中降解DNA的检测,然而这一特点迄今未用于转基因检测。本实验通过比较分析转基因大米常见品系的分子特征,选择覆盖面广的CaMV35S、NOS和Cry1A基因作为筛查基因,并针对这3 个位点设计了锁核酸检测引物和探针,使检测的目标序列比普通实时荧光检测目标区大大缩短。这些位点的基于LNATaqMan探针的检测方法特异性强,检测灵敏度非常高,检测低限可以达到0.3 pg,根据理论推算,一个单倍体水稻基因组的大小为0.47 pg
[4],该方法等同于能检测到1 个拷贝左右的目的基因。重复性实验表明所建立的方法具有较好的稳定性,在不同重复间曲线拟合性较好。在对实际转基因米粉样品进行检测时,可以快速、准确地检测出米制品中的痕量转基因成分。该方法与普通TaqMan探针法相比不仅检测灵敏度较高、重现性好,而且Ct值明显提高。根据标准要求,如实时荧光PCR检测Ct值大于36,须重新对样品进行检测。LNA-TaqMan探针实时荧光PCR检测Ct值提前这一特点,利于弱阳性样品检测Ct值降到36以下,从而利于结果的判断,避免重新检测样品,节约了检测成本。
本研究应用LNA-TaqMan探针解决了米制品等食品中含位点CaMV35S、NOS和Cry1A痕量转基因成分的检测难题。其他转基因筛查位点的检测同样可以采用LNATaqMan探针,来建立超灵敏和高特异性检测方法。转基因品系检测比转基因筛查更能区分产品中批准和未批准的转基因成分,今后采用本研究方法研究建立以转基因品系边界序列为目标的基于LNA-TaqMan探针的实时荧光PCR检测方法意义更为重要。
参考文献:
[1] 李晓飞, 谭小力, 李俊, 等. 转基因水稻检测用阳性质粒分子的构建及应用[J]. 生物技术通报, 2013(7): 71-77.
[2] KLUGA L, FOLLONI S, KAGKLI D M, et al. Combinatory SYBR
☒green real-time pcr screening approach for tracing materials derived from genetically modified rice[J]. Food Analytical Methods, 2013, 6(2): 361-369.
[3] 姚友良. 转基因抗虫水稻对主要非靶标害虫及天敌的影响[D]. 福州: 福建农林大学, 2012.
[4] 黄新, 张琰, 侯立华, 等. 转基因水稻“科丰6号”实时荧光PCR定性定量检测方法研究[J]. 生物技术通报, 2010(2): 90-93.
[5] 欧盟食品和饲料类快速预警系统[EB/OL]. http://webgate. ec.europa.eu/rasff-window/portal/?event=SearchForm&cleanSear ch=1,2013/10/4.
[6] GAŠPARIČ M B, TENGS T, la PAZ J L, et al. Comparison of nine different real-time PCR chemistries for qualitative and quantitative applications in GMO detection[J]. Analytical and Bioanalytical Chemistry, 2010, 396(6): 2023-2029.
[7] 国家质量监督检验检疫总局. SN/T 2584—2010 水稻及其产品中转基因成分实时荧光PCR检测方法[S]. 北京: 中国标准出版社, 2010.
[8] 国家质量监督检验检疫总局. GB/T 19495.3—2004 转基因产品检测: 核酸提取纯化方法[S]. 北京: 中国标准出版社, 2004.
[9] 覃文, 曹际娟, 朱水芳. 加工产品中转基因玉米Bt11成分实时荧光PCR定量(性)检测[J]. 生物技术通报, 2003(6): 46-50.
[10] WANG Weixia, ZHU Tingheng, LAI Fengxiang, et al. Event-specific qualitative and quantitative detection of transgenic rice Kefeng-8 by characterization of the transgene flanking sequence[J]. European Food Research and Technologyl, 2012, 234(3): 477-484.
[11] 谢家建, 王锡锋, 彭于发. 转基因水稻品系克螟稻1的外源插入片段的旁侧序列: 中国, 200710063778[P]. 2014-09-10.
[12] Health Canada. novel food information: glufosinate tolerant rice event LLRICE62[R]. Ottawa: Health Canada, 2013.
[13] QUIRASCO M, SCHOEL B, CHHALLIYIL P, et al. Real-time and conventional PCR detection of Liberty Link rice varieties and transgenic soy in rice sampled in the Mexican and American retail markets.[J]. Analytical and Bioanalytical Chemistry, 2008, 392(3): 395-404.
[14] WOLF C, SCHERZINGER M, WURZ A, et al. Detection of cauliflower mosaic virus by the polymerase chain reaction: testing of food components for false-positive 35S-promoter screening results[J]. European Food Research and Technology, 2000, 210(5): 367-372.
[15] 敖金霞, 高学军, 于艳波, 等. 转基因大豆、玉米、水稻深加工产品的五重巢式PCR技术检测[J]. 中国农业大学学报, 2010, 15(2): 93-99.
[16] 闻伟刚, 盛蕾, 张吉红, 等. 痕量及微量转基因大米成分半巢式PCR检测方法的建立[J]. 食品科学, 2008, 29(12): 622-626.
[17] COSTA J M, ERNAMLT P, OLIVI M, et al. Chimeric LNA/ DNA probes as a detection system for real-time PCR[J]. Clinical Biochemistry, 2004, 37(10): 930-932.
[18] SINGH S K, KOSHKIN A A, WENGEL J, et al. LNA (locked nucleic acids): synthesis and high-affinity nucleic acid recognition[J]. Chemical Communications, 1998, 4: 455-456.
[19] VEEDU R N, VESTER B, WENGEL J. Novel applications of locked nucleic acids[C]//Nucleic acids symposium series. Oxford University Press, 2007, 51(1): 29-30.
[20] THANH T T, PAWESTRI H A, NGOC N M, et al. A real-time RTPCR for detection of clade 1 and 2 H5N1 influenza A virus using locked nucleic acid (LNA) TaqMan probes [J]. Virology Journal, 2010, 7: 46-48.
[21] 韦信贤, 童桂香, 谢宗升, 等. TaqMan-LNA探针荧光定量PCR快速检测对虾传染性皮下及造血组织坏死病毒[J]. 南方农业学报, 2011, 42(12): 1545-1549.
Ultra-Sensitive Detection of Genetically Modified Ingredients in Rice-Derived Products Using Real-Time PCR with Locked Nucleic Acid TaqMan Probe
PAN Guang
1, ZHANG Guiming
1, CHEN Zhinan
2, CHENG Yinghui
1, XIANG Caiyu
1, BAO Xianyu
2, LING Xingyuan
1,*
(1. Animal and Plant Inspection and Quarantine Technology Center, Shenzhen Entry-Exit Inspection and Quarantine Bureau, Shenzhen 518045, China; 2. Shenzhen Academy of Inspection and Quarantine, Shenzhen 518010, China)
Abstract:This study aimed to establish a specific and ultra-sensitive detection method for trace genetically modified (GMO) ingredients in rice-derived products. In this study, the CaMV35S promoter, NOS terminator and Cry1A gene included in the industrial standard for screening the GM components of rice were selected as the targets. By substituting a few nucleotides of the TaqMan probe with locked nucleic acid (LNA) nucleotide and comparing the performances of these LNA-TaqMan probes in real-time PCR (RT-qPCR), a novel real-time PCR method based on LNA-TaqMan probe for the above genes and gene elements was established with high specificity. Compared to the conventional RT-PCR with TaqMan probe, this RTPCR with LAN-Taqman probe was much more sensitive, ha d lower limit of detection (LOD) (0.001% by mass) and 1-3 less Ct value cycles except for Cry1A. This reported new PCR method can be applied for the detection of trace GM components in rice-derived products that could not be detected with the conventional RT-PCR probe.
Key words:rice-de rived products; locked nucleic acid (LNA); LNA-TaqMan probe; real-time PCR
中图分类号:S511
文献标志码:A
文章编号:
doi:10.7506/spkx1002-6630-201510042
收稿日期:2014-07-24
基金项目:深圳市科技研发资金基础研究计划重点项目(JC201105190969A);国家转基因重大专项 (2014ZX08012-001)
作者简介:潘广(1985—),男,农艺师,硕士,研究方向为转基因产品检测技术。E-mail:pg0101@126.com
*
通信作者:凌杏园(1964—),男,高级农艺师,博士,研究方向为植物基因工程和分子生物学。E-mail:lxy6421@qq.com







