外源亚精胺对黄果柑果实抗氧化酶活性的影响
熊 博,汪志辉
*,高婧斐,张婷婷,石冬冬,古咸杰,曾海琼,廖 玲
(四川农业大学园艺学院,四川 成都 611130)
摘 要:为探索亚精胺(spermidine,Spd)与3 种抗氧化酶过氧化氢酶(CAT)、过氧化物酶(POD)和超氧化物歧化酶(SOD)活性变化的关系,以及黄果柑果实成熟过程中抗氧化酶活性的变化趋势。以5 a生黄果柑果树为实验材料,设置3 个不同质量浓度的亚精胺处理,通过叶面、果面喷施亚精胺,研究外源亚精胺对黄果柑果实发育后期抗氧化酶活性的影响。结果表明:外源Spd能显著提高黄果柑果实中Spd和精胺含量,极显著降低腐胺含量;显著提高黄果柑果实转色初期CAT、POD和SOD活性;显著降低成熟后果实丙二醛(malondialdehyde,MDA)含量,推迟MDA含量快速累积的时间。结果显示,外源Spd具有改善黄果柑果实抗氧化保护系统的功能,通过调控黄果柑果实抗氧化酶活性,提高自由基防御系统的防御能力。
关键词:亚精胺;黄果柑;抗氧化酶;丙二醛
多胺是一类具有较高生物活性的低分子脂肪族含氮碱胺
[1],是广泛存在于植物、动物和微生物体内的多聚阳离子,易与细胞中带有负电荷的物质结合,保持膜结构的稳定,直接或间接清除体内活性氧自由基
[2-3],防止细胞膜脂过氧化,延迟衰老,甚至与植物的生存密切相关
[4-5]。在植物细胞中,精胺(spermine,Spm)、亚精胺(spermidine,Spd)以及其合成前体腐胺(putrescine,Put)是3 种最常见的多胺
[6-7]。
大量研究表明,外源多胺能提高植物的抗逆能力
[4,8-9],外源Spd和Spm对环境胁迫下的植物具有保护作用
[10-11],Spd与植物逆境胁迫抗性的关系最为密切
[8]。外源Spd能降低NaCl胁迫下黄瓜幼苗的活性氧水平、丙二醛(malondialdehyde,MDA)和H
2O
2含量
[12],增强超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)和过氧化氢酶(catalase,CAT)的活性,从而缓解NaCl对植株的伤害
[13-15];外源Spd有助于提高植物对多种胁迫的耐受力
[16],在非生物胁迫条件下,Spd可能是通过向非原生质体中运输,并在多胺氧化酶催化下氧化降解形成H
2O
2,继而H
2O
2发挥的信号特征决定植物的逆境耐性
[17]。目前,关于多胺与植物抗逆性关系的研究主要集中在草本和藤本植物上
[18-20]。同时,外源Spd对果实成熟过程中抗氧化酶活性调控作用的报道较少。
黄果柑是芸香科(Rutaceae)柑橘属(Citrus L.)杂柑品种,为橘和橙的天然杂交种
[21],原产于四川省雅安市石棉县,是地方特色水果
[22]。研究外源Spd对黄果柑成熟后期的抗氧化酶活性的调控机理,对黄果柑产业的健康发展都具有重要意义。本实验通过研究不同质量浓度Spd对黄果柑果实发育中后期果实抗氧化酶活性的影响,探究黄果柑果实多胺含量和3 种抗氧化保护酶活性变化规律,为提高黄果柑的高效栽培管理和延长黄果柑的留树时间提供理论参考。
1 材料与方法
1.1 材料、试剂与仪器
田间实验于2013年5月—2014年4月在四川省雅安市石棉县小水敬老院黄果柑果园内进行。选择树势基本一致、健壮的黄果柑果树(树高、冠径、坐果率基本一致,5 a生、生长状况良好、无病虫害、株行距3 m×4 m)36 株作为实验树,果园采用常规管理。
Spd 美国Sigma公司;其他试剂均为分析纯。
1260型高压液相色谱仪 美国Agilent公司。
1.2 方法
1.2.1 外源Spd喷洒与采果方法
于2013年8月17日(果实快速膨大期)17时用小型喷雾器对黄果柑叶面、果面喷洒质量浓度分别为0.4、0.5、0.6 g/L的Spd,至果面和叶面自然滴液为止,以清水处理为对照,15 d后重复处理1 次。以3 株黄果柑果树为1 个处理,3 次重复,共设3 个处理和1 个对照。
从果实开始转色(11月下旬)到果实成熟(3月下旬)前,每隔30 d左右采果1 次,采果时间分别是:2013年11月22日、2013年12月23日、2014年1月21日、2014年2月26日和2014年3月23日,果实成熟后每10 d进行1 次采果,采果时间分别是:2014年4月4日和2014年4月14日。每次采果时间为上午9时,随机选择大小适中、均匀一致、无病虫、无损伤的果实,每个处理采果15 个。采果后将果实置于冰盒中,立即带回实验室于液氮中速冻固定,放入冰箱(-20 ℃)待用。
1.2.2 分析方法
MDA含量、POD和SOD活力的测定参照李合生等
[23]的方法,CAT活性的测定参照邹琦等
[24]的方法。
多胺含量的测定:在马宝龙等
[25]测定方法的基础上加以改进,用1260型高压液相色谱仪检测,流动相为64%的甲醇(色谱纯)和36%的水,反相C
18柱(3.9 mm×150 mm),检测波长256 nm,进样量10 μL,流速1.0 mL/min,柱温30 ℃。
1.3 数据分析
采用Excel 2010和SPSS 20对数据进行Duncan’s新复极差法多重比较(P<0.05)。
2 结果与分析
2.1 外源Spd对黄果柑果实中多胺含量的影响
表1 转色期和成熟期黄果柑果实中多胺含量
Table1 PA contents during the early color-turning period and maturation period of Huangguogan fruits
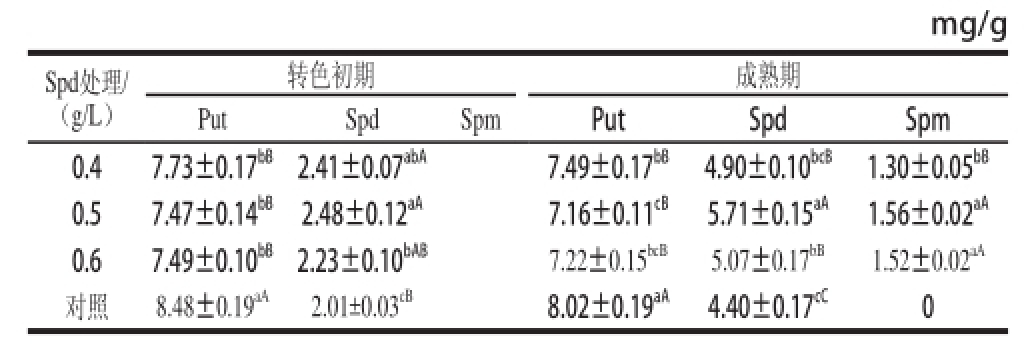
注:同列不同小写字母表示在P=0.05水平上差异显著,同列不同大写字母表示在P=0.01水平上差异显著。下同。
mg/g Spd处理/(g/L)转色初期成熟期PutSpdSpmPutSpdSpm 0.47.73±0.17
bB2.41±0.07
abA7.49±0.17
bB4.90±0.10
bcB1.30±0.05
bB0.57.47±0.14
bB2.48±0.12
aA7.16±0.11
cB5.71±0.15
aA1.56±0.02
aA0.67.49±0.10
bB2.23±0.10
bAB7.22±0.15
bcB5.07±0.17
bB1.52±0.02
aA对照8.48±0.19
aA2.01±0.03
cB8.02±0.19
aA4.40±0.17
cC0
通过检测黄果柑转色初期和果实成熟期果实多胺含量,如表1所示,外源Spd处理极显著增加了转色初期、成熟期黄果柑果实中Spd的含量,极显著降低了Put的含量;在黄果柑果实转色初期,未能检测出Spm含量,果实成熟期Spd处理组样品中Spm含量分别为1.30、1.56、1.52 mg/g,而对照组果实Spm含量为0;果实成熟期与转色初期相比,Put含量有所降低,而Spd和Spm含量有较大幅度的增加;转色初期4组样品中Spd、Spm含量之和与Put含量的比值,即(Spd+Spm)/Put分别为0.31、0.33、0.30和0.24,而果实成熟后4 组样品中(Spd+ Spm)/Put分别为0.83、1.02、0.91和0.60,均以0.5 g/L处理组的值最大;果实成熟后Spd含量分别是转色初期含量的2.03、2.30、2.27、2.39 倍。
2.2 外源Spd对黄果柑果实MDA含量的影响
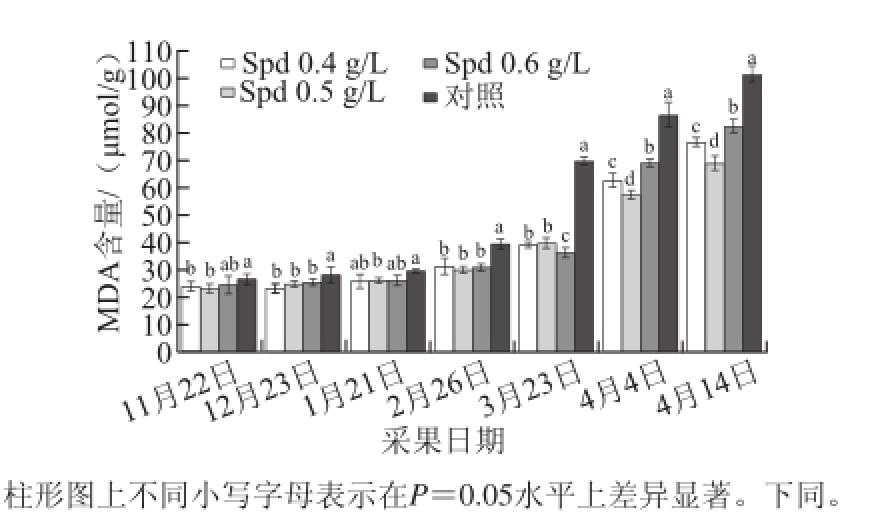
图1 外源Spd对黄果柑果实MDA含量的影响
Fig.1 Effects of exogenous Spd on MDA content of ‘Huangguogan’ fruits
MDA含量的变化是质膜损伤程度的重要标志之一,其含量的多少可代表膜损伤的严重程度。由图1可知,黄果柑果实内MDA含量呈现缓慢增长到快速增长的变化规律,外源Spd能显著降低黄果柑成熟后期果实MDA含量。当果实成熟时,外源Spd处理的黄果柑果实MDA含量比对照组平均降低了44.47%。果实成熟后,对照组黄果柑果实MDA含量出现快速增长的现象,且增长速度大于同时期外源Spd处理组,而外源Spd处理组的黄果柑果实MDA含量直到果实成熟后10 d(2014年4月4日)才出现快速增长现象,较对照组延后了10 d左右,说明外源Spd处理推迟了黄果柑果实MDA快速增长的时期。
2.3 外源Spd对黄果柑果实CAT活性的影响
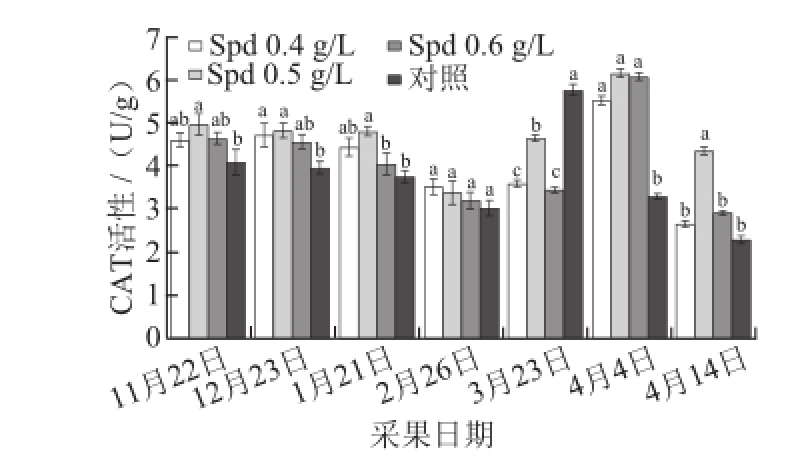
图2 外源Spd对黄果柑果实CAT活性的影响
Fig.2 Effects of exogenous Spd on CAT activity of ‘Huangguogan’ fruits
果实成熟后期,由于体内活性氧代谢加强而使H
2O
2产生积累。CAT可将H
2O
2分解为H
2O和O
2,使生物机体免受过氧化氢的毒害,是植物体内重要的抗氧化酶之一。由图2可知,从转色初期到果实成熟的过程中,黄果柑果实CAT活性呈现“降-升-降”的变化规律;黄果柑果实转色初期,CAT活性缓慢降低;果实成熟后,CAT活力出现一个峰值,之后迅速降低;果实成熟后10 d(2014年4月4日)所有处理组CAT活力的峰值均显著高于对照组,0.5 g/L Spd处理组的黄果柑果实CAT活力的峰值最高,为6.12 U/g;与对照组相比,外源Spd处理的黄果柑果实CAT活性出现峰值的时间推迟了10 d。
2.4 外源Spd对黄果柑果实SOD活性的影响
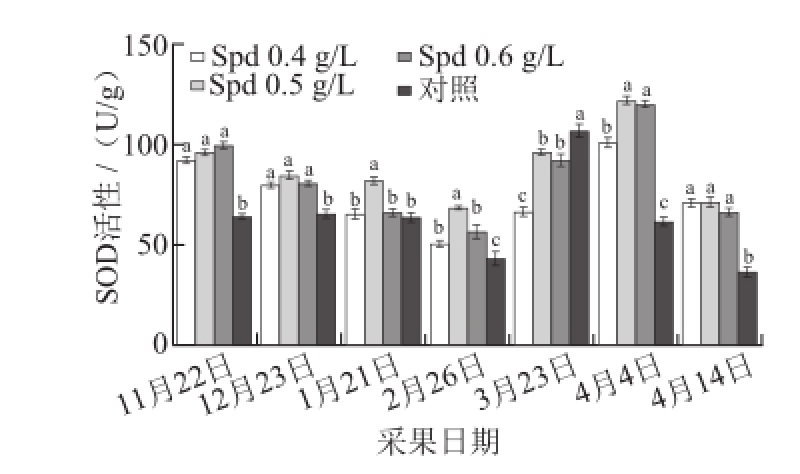
图3 外源Spd对黄果柑果实SOD活性的影响
Fig.3 Effects of exogenous spermidine on SOD activity of ‘Huangguogan’ fruits
SOD与CAT、POD等协同作用防御活性氧或其他过氧化物自由基对细胞膜的伤害,其酶活力与抗逆性及衰老有密切关系,是活性氧清除体系中的关键酶。由图3可知,转色初期处理组果实SOD活性较高,活性大小变化较为明显,这可能与叶面、果面喷施外源Spd溶液有关;从转色初期到果实成熟的过程中,处理组和对照组黄果柑果实SOD活力总体都呈现“降-升-降”的变化趋势,但对照组果实SOD活力在成熟期之前变化较小,果实成熟后到达最大值,为106.16 U/g;处理组黄果柑果实SOD活力于果实成熟后10 d才出现峰值,0.5 g/L Spd处理组黄果柑果实SOD活力值最大,为121.46 U/g,显著高于对照组。
2.5 外源Spd对黄果柑果实POD活性的影响
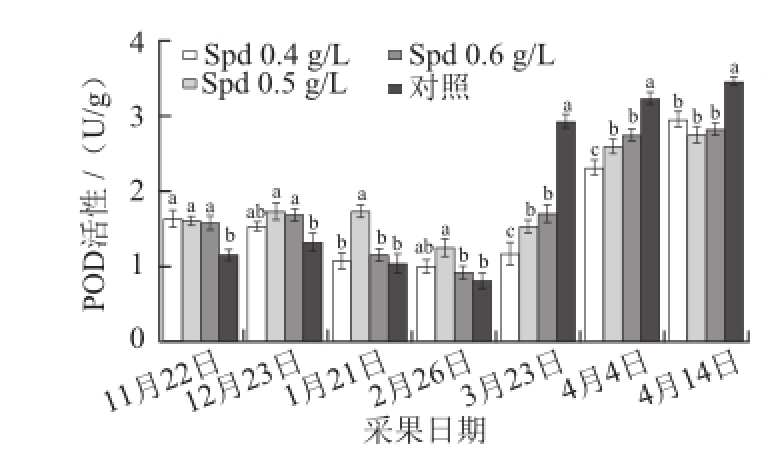
图4 外源Spd对黄果柑果实POD活性的影响
Fig.4 Effects of exogenous spermidine on POD activity of ‘Huangguogan’ fruits
POD是植物体内一种消除自由基伤害防护酶,在活性氧代谢过程中发挥了重要的作用。由图4可知,黄果柑果实POD活性呈现类似“V”字型变化趋势,缓慢降低后再迅速增大。在果实成熟前,处理组和对照组黄果柑果实POD活力相对较低,果实成熟后对照组POD活力急剧升高,且显著高于Spd处理组;黄果柑果实成熟前,0.5 g/L Spd处理组果实POD活性显著高于对照,而成熟后则显著低于对照;果实成熟时(2014年3月23日),对照组黄果柑果实POD活力为2.94 U/g,显著高于同期处理组,0.4 g/L Spd处理组的酶活力最低。说明外源Spd处理能有效调控黄果柑果实POD活力,使之在整个黄果柑果实发育后期维持在较为稳定的酶活力水平。
3 讨 论
外源Spd处理可不同程度提高植物体活性氧清除能力,降低活性氧对植物体的氧化伤害
[20,26-27]。本实验结果表明:外源Spd具有改善黄果柑果实抗氧化保护系统的功能,通过调控黄果柑果实SOD、POD和CAT 3 种抗氧化保护酶活性,增强活性氧的有效清除能力,进而减少活性氧产生,提高了清除自由基防御系统的防御能力,缓解了果实O
2
-·、H
2O
2的积累,降低了黄果柑果实的MDA含量。
在植物抗逆性中,Spd既是胁迫保护物质,也是胁迫信号转导过程中的信号分子,有利于胁迫抗性机制的构建
[28-29]。本结果表明,外源Spd处理后,黄果柑果实Spd和Spm含量显著上升,而Put含量极显著降低。Put作为Spd和Spm合成的前体物质,果实成熟后逐渐合成Spd和Spm,导致果实Put含量进一步降低,而Spd和Spm含量增长幅度较大。同时,抗氧化酶活性也相应提高,表明黄果柑果实多胺含量与抗氧化酶活性可能存在着某种联系。结果表明,在外源Spd处理之下,黄果柑果实中(Spd+Spm)/Put的比值与SOD和CAT活力间相关系数R值分别为0.932 2和0.906 1,该比值与SOD和CAT活力呈正相关性。说明外源Spd与黄果柑果实活性氧代谢密切相关,Spd处理增强了抗氧化酶活性,降低果实MDA对黄果柑的伤害,这与江行玉
[30]、萨日娜
[31]、刘俊
[32]等的研究结果一致。外源Spd处理对黄果柑果实3 种抗氧化酶活力有一定的调控作用,增大了3 种抗氧化酶活性的变化幅度,但其变化规律与对照基本一致。果实成熟前3 种抗氧化酶活性均出现减弱的现象,这种变化规律的形成原因还有待进一步的研究。
Spd还是H
+的载体,它可以部分代替SOD的作用,通过歧化反应来有效清除活性氧
[33],Spd在黄果柑果实成熟后期活性氧清除的过程中,主要是直接清除活性氧,还是作为酶保护剂间接清除,需要进一步的研究验证。
CAT和SOD是抗氧化过程中的直接作用酶,活力越强抗氧化能力越强,而POD是被动清除酶,果实成熟后POD活力、MDA含量均低于对照,反映出Spd处理组黄果柑果实完整性较好,间接说明Spd处理增强了果实的抗氧化能力。
POD活力大小是果实成熟衰老的主要标志,可作为组织老化的一种生理指标
[34]。李梦钗等
[35]研究也表明,在植物生长发育过程中,POD的活性不断发生变化,一般在老化、衰老组织中其活性较高,在幼嫩组织中活性较弱。本研究结果表明,随着黄果柑果实的成熟,MDA含量和POD活性都有一定程度的增大,说明在此过程中果实可能出现了衰老现象。
适量的外源Spd能有效增强黄果柑果实成熟前CAT、POD和SOD抗氧化酶的活性。同时,外源Spd降低果实成熟过程中MDA含量,表明Spd处理增强了果实的抗氧化能力,以0.5 g/L Spd质量浓度的综合作用效果最好。
参考文献:
[1] MARTIN T J. Metabolism and function of polyamines in plants: recent development (new) approaches[J]. Plant Growth Regulation, 2001, 34(1): 135-148.
[2] 尹璐璐, 杨秀华, 李坤, 等. 亚精胺预处理对黄瓜幼苗抗冷性的影响[J].园艺学报, 2007, 34(5): 1309-1312.
[3] DROLET G, DUMBROFF E B, LEGGE R L, et al. Radical scavenging properties of polyamine[J]. Phyto Chemistry, 1986, 25(2): 367-371.
[4] 李璟, 胡晓辉, 郭世荣, 等. 外源亚精胺对根际低氧胁迫下黄瓜幼苗根系多胺含量和抗氧化酶活性的影响[J]. 植物生态学报, 2006, 30(1): 118-123.
[5] 江行玉, 赵可夫, 窦君霞. NaCl胁迫对玉米和滨蔾叶片中内源多胺含量与幼苗生长的影响[J]. 植物生理学通讯, 2001, 35(3): 188-190.
[6] 刘强, 王庆成, 徐静, 等. 外源亚精胺和精胺对NaHCO
3胁迫下南蛇藤抗氧化系统的影响[J]. 应用生态学报, 2009, 20(3): 549-554.
[7] 苏国兴, 刘友良. 高等植物体内的多胺分解代谢及其主要产物的生理作用[J]. 植物学通报, 2005, 22(4): 408-418.
[8] 李璟, 胡晓辉, 郭世荣, 等. D-精氨酸对低氧胁迫下黄瓜幼苗根系多胺含量和无氧呼吸代谢的影响[J]. 应用生态学报, 2007, 18(2): 376-382.
[9] NDAYIRAGIJE A, LUTTS S. Do exogenous polyamines have an impact on the response of a salt-sensitive rice cultivar to NaCl[J]. Journal of Plant Physiology, 2006, 163(5): 506-516.
[10] YAMAGUCHI K, TAKAHASHI Y, BERBERICH T, et al. A protective role for the polyamine spermine against drought stress in Arabidopsis[J]. Biochemical and Biophysical Research Communications, 2007, 352(2): 486-490.
[11] 周国贤, 郭世荣, 王素平. 外源多胺对低氧胁迫下黄瓜幼苗光合特性和膜脂过氧化的影响[J]. 植物学通报, 2006, 23(4): 341- 347.
[12] 陈丽芳, 陆巍, 孙锦, 等. 外源亚精胺对盐胁迫下黄瓜幼苗光合作用和根叶碳水化合物积累的影响[J]. 南京农业大学学报, 2011, 34(3): 31-36.
[13] 胡晓辉, 杜灵娟, 邹志荣. Spd浸种对盐胁迫下番茄(Solanum lycopersicum)幼苗的保护效应[J]. 生态学报, 2009, 29(9): 5152-5157.
[14] 金春燕, 孙锦, 郭世荣. 外源亚精胺对Ca(NO
3)
2胁迫下黄瓜幼苗生长和活性氧代谢的影响[J]. 西北植物学报, 2010, 30(8): 1627-1633.
[15] 吴成龙, 周春霖, 尹金来, 等. NaCl胁迫对菊芋幼苗生长及其离子吸收运输的影响[J]. 西北植物学报, 2006, 26(11): 2289-2296.
[16] GROPPA M D, BENAVIDES M P. Polyamines and abiotic stress: recent advances[J]. Amino Acids, 2008, 34(1): 35-45.
[17] MOSCHOU P N, PASCHALIDIS K A, DELIS I D, et al. Spermidine exodus and oxidation in the apoplast induced by abiotic stress is responsible for H
2O
2signatures that direct tolerance responses in tobacco[J]. Plant Cell, 2008, 20(6): 1708-1724.
[18] 段九菊, 郭世荣, 康云艳. 外源亚精胺对盐胁迫下黄瓜幼苗活性氧水平和抗氧化酶活性的影响[J]. 园艺学报, 2006, 33(3): 639-641.
[19] 张润花, 郭世荣, 樊怀福, 等. 外源亚精胺对盐胁迫下黄瓜幼苗体内抗氧化酶活性的影响[J]. 生态学杂志, 2006, 25(11): 1333-1337.
[20] TANG W, NEWTON R J. Polyamines reduce salt- induced oxidative damage by increasing the activities of antioxidant enzymes and decreasing lipid peroxidation in Virginia pine[J]. Plant Growth Regulation, 2005, 46(1): 31-43.
[21] 张泽芩, 王大华. 用同工酶分析黄果柑亲缘关系的研究[J]. 四川农业大学学报, 1994, 12(1): 81-83.
[22] 汪志辉, 刘世福, 严巧巧, 等. 石棉县黄果柑生物学特性调查与差异株系比较[J]. 北方园艺, 2011(14): 20-24.
[23] 李合生, 赵世杰. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
[24] 邹琦, 赵世杰. 植物生理学实验指导[M]. 北京: 中国农业出版社, 2000.
[25] 马宝龙, 屈旭斌. 高效液相色谱法测定枸杞叶中精胺和亚精胺[J].宁夏工程技术, 2011, 10(1): 48-50.
[26] 王红霞, 胡金朝, 施国新, 等. 外源多胺对铜胁迫下水鳖叶片多胺代谢、抗氧化系统和矿质营养元素的影响[J]. 生态学报, 2010, 30(10): 2784-2792.
[27] 王秀红, 王秀峰, 杨凤娟, 等. 外源精胺对NO
3
-胁迫下黄瓜幼苗抗氧化酶活性及光合作用的影响[J]. 植物营养与肥料学报, 2010, 16(4): 1020-1026.
[28] GALSTON A W, SAWHNEY R K. Polyamines in plant physiology[J]. Plant Physiology, 1990, 94(2): 406-410.
[29] BELLE N A, DALMOLIN G D, FONINI G, et.al. Polyamines reduces lipid peroxidation induced by different proxidant agents[J]. Brain Research, 2004, 1008(2): 245-251.
[30] 江行玉, 宋杰, 范海, 等. 外源钙和亚精胺对NaCl胁迫条件下玉米幼苗体内离子平衡和多胺水平的调节[J]. 植物生理学报, 2000, 26(6): 539-544.
[31] 萨日娜, 陈贵林. 外源亚精胺对盐胁迫下白刺幼苗叶片抗氧化酶系统的影响[J]. 西北植物学报, 2013, 33(2): 352-356.
[32] 刘俊, 周一峰, 章文华, 等. 外源多胺对盐胁迫下玉米叶绿体结合态多胺水平和光合作用的影响[J]. 西北植物学报, 2006, 26(2): 254-258.
[34] 于娟娟, 李玲, 金青, 等. 砀山酥梨石细胞发育过程中木质素代谢关键酶POD类型的分析[J]. 园艺学报, 2011, 38(6): 1037-1044.
[35] 李梦钗, 冯薇, 葛艳蕊. 臭氧处理对草莓果实PPO和POD活性的影响[J].经济林研究, 2012, 30(3): 84-86.
Effects of Exogenous Spermidine on Activities of Antioxidant Enzymes in ‘Huangguogan’ Orange Fruits
XIONG Bo, WANG Zhihui
*, GAO Jingfei, ZHANG Tingting, SHI Dongdong, GU Xianjie, ZENG Haiqiong, LIAO Ling
(College of Horticulture, Sichuan Agricultural University, Chengdu 611130, China)
Abstract:This study was conceived to explore the relationship between exogenous spermidine (Spd) and the activities of antioxidant enzymes, namely catalase (CAT), peroxidases (POD) and superoxide dismutase (SOD) and investigate the changes in these antioxidant enzyme activities during the ripening process of oranges. The leaves and fruits of fi ve-yearold ‘Huangguogan’ orange trees were sprayed with spermidine at three concentrations to examine the effect of exogenous Spd on the antioxidant enzyme activities during the later developmental stage. The results showed that exogenous Spd could signifi cantly improve the contents of Spd and spermine (Spm) and signifi cantly decrease the content of Put. During the early color-turning period, exogenous Spd treatment caused signifi cant increases in the activities of CAT, POD and SOD and a significant decrease in malondialdehyde (MDA) content in the ripe fruits, and retarded the rapid accumulation of MDA. These fi ndings suggest that exogenous Spd can improve the antioxidant defense system in ‘Huangguogan’ fruits by enhancing the activities of CAT, POD and SOD.
Key words:Spd; ‘Huangguogan’ orange; antioxidant enzymes; malondialdehyde
中图分类号:S666.9
文献标志码:A
文章编号:
doi:10.7506/spkx1002-6630-201510048
收稿日期:2014-07-01
基金项目:四川省科技支撑计划项目(2011NZ0034);四川省科技厅基金项目(10ZC1454);四川农业大学研究生社会实践与科技服务团项目(ACT201304)
作者简介:熊博(1988—),男,博士研究生,研究方向为果树栽培理论与技术。E-mail:xiongbo200977@163.com
*通信作者:汪志辉(1968—),男,教授,博士,研究方向为果树栽培理论与技术。E-mail:wangzhihui318@126.com




