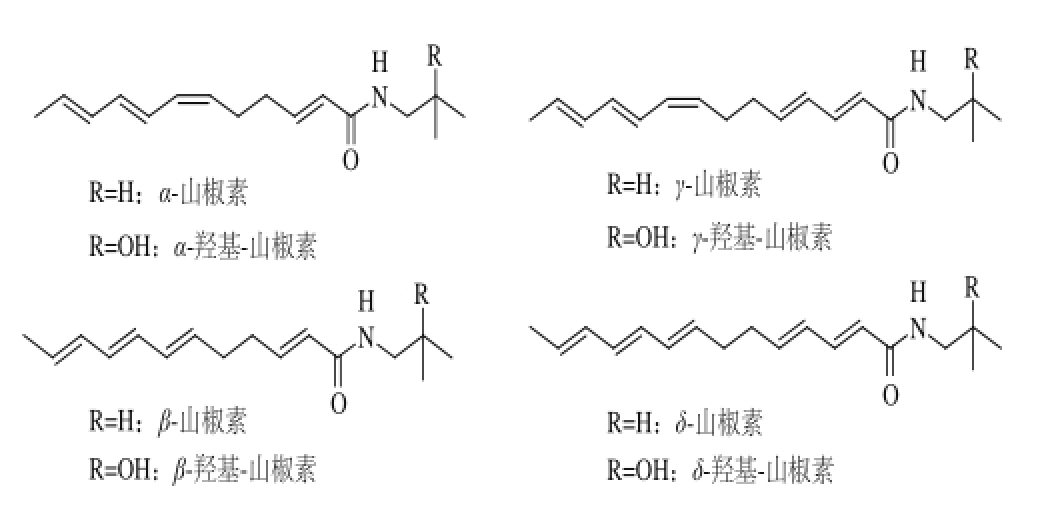
图1 花椒中的主要麻味成分
Fig.1 Main sanshools found in Sichuan peppers
游玉明 1,2,周 敏 1,王倩倩 1,任 亭 1,刘 雄 1,*
(1.西南大学食品科学学院,重庆 400715;2.重庆文理学院林学与生命科学学院,重庆 402160)
摘 要:为研究花椒麻素的抗氧化活性,采用体外抗氧化实验,评价不同剂量花椒麻素的总抗氧化能力、还原力以及对羟自由基(·OH)和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的清除作用,并以人肝癌细胞HepG2为模型,探讨其在细胞水平的抗氧化能力。结果表明:花椒麻素具有一定的还原力和总抗氧化能力,且呈现良好的剂量-效应关系;但对DPPH自由基、·OH的清除作用较弱。花椒麻素在较低质量浓度(0~50 μg/mL)条件下可使HepG2细胞内超氧化物歧化酶(superoxide dismutase,SOD)活性降低,丙二醛(malondialdehyde,MDA)含量增加,但当花椒麻素质量浓度达到100 μg/mL时,细胞SOD活性显著增加,MDA含量则显著降低(P<0.05)。因此,花椒麻素是一类潜在的抗氧化物质,可用于此类功能食品的开发。
关键词:花椒麻素;抗氧化活性;HepG2细胞
花椒作为我国卫生部确认的药食两用植物材料,其以独特的辛麻味,广泛应用于川菜及火锅等的烹调中,被誉为“十三香”之首、“八大味”之一 [1-3]。花椒麻素是一类链状不饱和脂肪酸酰胺类物质,具有强烈的刺激性,是花椒产生麻味的物质基础 [4-5]。目前,从花椒叶、茎和果皮等部位中至少分离鉴定出25 种花椒麻味物质,主要包括α-山椒素、β-山椒素、γ-山椒素、δ-山椒素以及它们在氨基部分含有一个羟基的同系物(图1) [6-8]。近几年的研究发现,花椒麻素具有麻醉 [9]、抗炎镇痛 [10]、除皱 [11]以及抗癌 [12]等多种生理功能,因而引起了广泛的关注。
自由基是机体正常代谢的中间产物,当机体内自由基过剩时,其强氧化能力可损伤机体的组织及细胞,从而引发一系列相关疾病,如衰老、癌症、炎症、动脉粥样硬化和肿瘤等 [13-14]。大量研究证明,抗氧化物质可通过捕获或中和自由基以及干预自由基作用的通路而抑制自由基对机体的损伤 [15-17]。已有研究表明,花椒提取物具有较强的抗氧化功效 [18-20],是一种潜在的抗氧化剂,其中花椒麻素是花椒中结构独特且具有明显生物学活性的重要成分。但有关花椒麻素抗氧化活性的研究还未见报道。本实验采用体外化学分析法和细胞实验对花椒麻素的抗氧化活性进行评价,以期为其生理功效的探讨及高值化利用提供参考。

图1 花椒中的主要麻味成分
Fig.1 Main sanshools found in Sichuan peppers
1.1 材料与试剂
花椒麻素 实验室自制;人肝癌细胞株HepG2军事医学科学院生物工程研究所发育与疾病遗传学研究室杨晓教授惠赠。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH,分析纯)、1%青链霉素混合液 北京索莱宝公司;DMEM培养基、胰蛋白酶(生化试剂) 美国Thermo Scientific公司;胎牛血清(fetal calf serum,FBS) 美国Gibco公司;超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒、丙二醛(malondialdehyde,MDA)测定试剂盒、微量蛋白测定试剂盒 南京建成生物工程研究所;2,4,6-三吡啶基三嗪(2,4,6-tris(2-pyridyl)-s-triazine,TPTZ)、甲醇、无水乙醇、三氯乙酸、氯化铁等均为分析纯试剂。
1.2 仪器与设备
HGC-12Ax型氮吹仪 天津市恒奥科技发展有限公司;HERAcell150I型CO 2培养箱、Multiskan FC型酶标仪、ST16型离心机 美国Thermo Scientific公司;BDS200-PH型倒置生物显微镜 日本Olympus公司;SW-CJ-1FD型超净工作台 苏州净化设备有限公司。
1.3 方法
1.3.1 花椒麻素溶液配制
准确称取经氮气吹干后的花椒麻素10 mg,充分溶解于200 μL甲醇中,配制成终质量浓度为50 mg/mL的花椒麻素溶液,依次进行梯度稀释,使样品溶液终质量浓度为25、50、100、200、400、800 μg/mL。
1.3.2 花椒麻素总抗氧化能力的测定
按照Brand-Williams等 [21]的方法,将pH 3.6的醋酸盐缓冲液、20 mmol/L FeCl 3溶液、10 mmol/L TPTZ溶液按10∶1∶1(V/V)比例配制亚铁还原能力(ferric reducing antioxidant power,FRAP)工作液以及浓度为0.2~1.6 mmol/L FeSO 4标准溶液。分别取20 μL不同质量浓度的样品及阳性对照溶液于96 孔板中,加入150 μL经37 ℃预热的蒸馏水和150 μL经37 ℃预热的TPTZ工作液,轻轻振动混匀,静置4 min后,于593 nm波长处测定光密度(OD 593 nm)值。以0.2~1.6 mmol/L的FeSO 4标准溶液代替样品,按照上述方法绘制标准曲线(回归方程为y=0.171 9x+0.002 4,R 2= 0.993 0)。根据样品所测得OD 593 nm,在标准曲线上求得FeSO 4的浓度(mmol/L),以FeSO 4当量浓度(mmol/L)表示花椒麻素总抗氧化能力(U),定义为FRAP值。
1.3.3 花椒麻素总还原 力测定
参照Oyaizu [22]的方法:分别吸取50 μL不同质量浓度的样品及阳性对照溶液,加入75 μL质量分数1%的铁氰化钾溶液,混合均匀,立即 置于50 ℃水浴中保温20 min,冷却后加入75 μL体积分数10%的三氯乙酸溶液混匀,3 000 r/min离心10 min,吸取100 μL上清液于新孔中,加入75 μL蒸馏水、25 μL质量分数0.1%的FeCl 3,室温静置10 min后在700 nm波长处测定其光密度(OD 700 nm)值。
1.3.4 花椒麻素DPPH自由基清除能力测定
参照杨虎等 [23]的方法:分别取100 μL不同质量浓度的样品及阳性对照溶液加入0.08 mg/mL的DPPH甲醇溶液100 μL,摇匀后于室温条件下避光静置30 min,517 nm波长处测定光密度(OD 517 nm)值。以DPPH溶液和甲醇溶液为空白,按照式(1)计算样品对DPPH自由基的清除能力。
1.3.5 花椒麻素羟自由基(·OH)清除能力测定
采用Fenton反应体系建立样品对·OH的清除模型 [24]。分别取不同质量浓度的样品或阳性对照溶液40 μL,再加入9 mmol/L的水杨酸-乙醇溶液40 μL、9 mmol/L FeSO 4溶液40 μL、8.8 mmol/L H 2O 2溶液40 μL,并用蒸馏水补齐至每孔200 μL,混匀后在37 ℃保温30 min,于510 nm波长处测定光密度(OD 510 nm)值,以蒸馏水代替样品或阳性对照溶液作为空白,并按照式(2)计算样品对·OH的清除能力。
1.3.6 细胞抗氧化实验
取对数期生长状态良好的人肝癌细胞HepG2接种于96 孔板中,使每孔细胞数约为5×10 3个,在37 ℃、5% CO 2的恒温培养箱中培养24 h,加入花椒麻素溶液,使其终质量浓度分别为25、50、100、200 μg/mL,空白对照组加入等量溶剂代替。培养24 h后,3 000 r/min离心5 min,小心吸弃上清液,加入100 μL经4 ℃预冷的细胞裂解液,4 ℃条件下裂解20 min。取上述细胞裂解液,以二辛可宁酸(bicinchonininc acid,BCA)法测定蛋白质含量,同时按试剂盒说明书方法测定细胞中SOD活力及MDA含量。
1.4 数据处理
实验重复3 次,实验结果以
 表示,数据采用SPSS 17.0软件进行处理,Duncan's法进行显著性分析,P<0.05或P<0.01为具有统计学意义上的差异。
表示,数据采用SPSS 17.0软件进行处理,Duncan's法进行显著性分析,P<0.05或P<0.01为具有统计学意义上的差异。
2.1 花椒麻素的总抗氧化能力
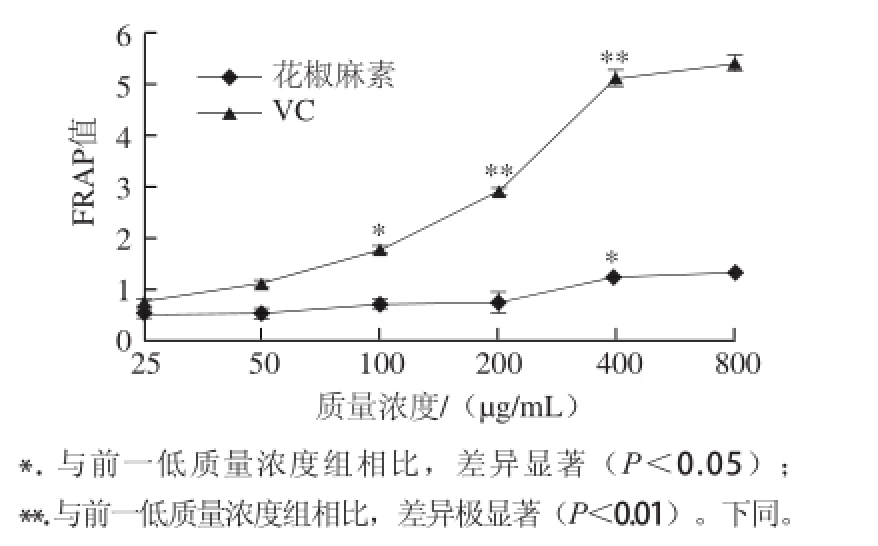
图2 不同质量浓度花椒麻素的总抗氧化能力
Fig.2 Ferric reducing power of sanshool with various concentrations
FRAP值越高,代表总抗氧化能力越强。由图2可知,花椒麻素具有一定的抗氧化能力,并且随着质量浓度的增加,总抗氧化能力呈缓慢增长趋势,这与阳性对照VC的趋势一致。当花椒麻素质量浓度为400 μg/mL时,其总抗氧化能力显著增加(P<0.05),但与VC相比还有较大的差距,其总抗氧化能力仅为相同质量浓度下VC的22.2%。
2.2 花椒麻素的总还原力

图3 不同质量浓度花椒麻素的总还原力
Fig.3 Reducing power of sanshool with various concentrations
物质的还原力是评价其潜在抗氧化活性的重要指标,还原力强弱与抗氧化能力大小呈正比。由图3可知,花椒麻素具有良好的总还原力,当质量浓度在50~400 μg/mL范围内,其总还原力显著增加(P<0.05),且在该质量浓度范围内花椒麻素的总还原力与其质量浓度呈良好的线性关系(R 2=0.997),但当其质量浓度超过400 μg/mL时,其总还原力基本保持不变,表明过高质量浓度的花椒麻素并不能增加其总还原力。与阳性对照VC相比,在实验质量浓度范围内,两者的总还原力比较接近。
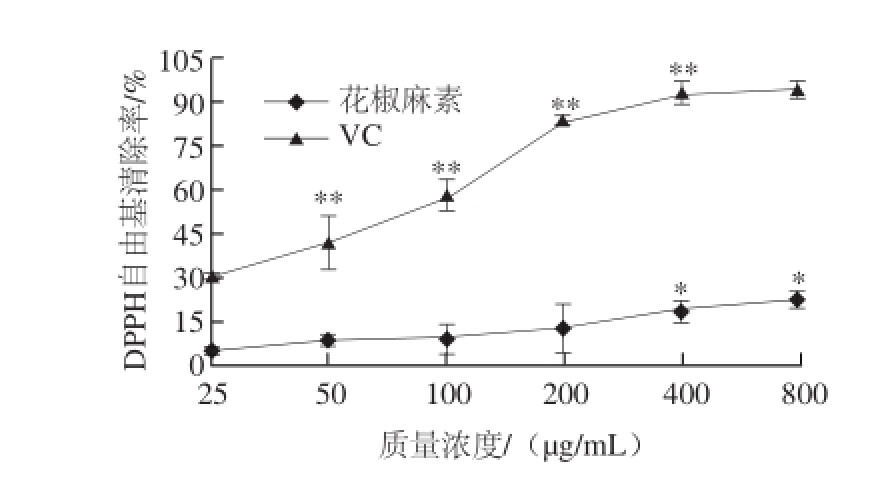
图4 不同质量浓度花椒麻素对DPPH自由基的清除作用
Fig.4 DPPH radical scavenging activity of sanshool with various concentrations
2.3 花椒麻素的DPPH自由基清除能力DPPH自由基是一种以氮为中心的稳定的有机自由基,紫色溶液,在517 nm波长处有强吸收,通过测定样品对DPPH自由基的清除能力可以表示其抗氧化性的强弱。由图4可知,花椒麻素对DPPH自由基具有一定的清除作用,且随着质量浓度的增加,清除作用有缓慢增加,当其质量浓度达到400 μg/mL时,其对DPPH自由基的清除效果显著增加(P<0.05),但与阳性对照VC相比,其对DPPH自由基的清除能力仅为相同质量浓度下VC的20.8%。
2.4 花椒麻素的·OH清除能力
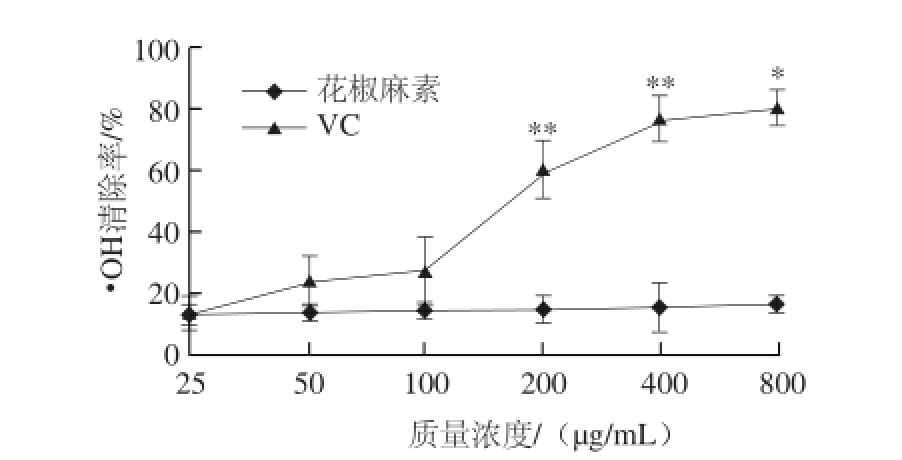
图5 不同质量浓度花椒麻素的·OH清除能力
Fig.5 Hydroxyl radical scavenging activities of sanshool with various concentrations
·OH是一种氧化能力极强的自由基,它可使细胞内的糖、蛋白质、核酸及脂类等物质发生氧化反应,进而造成组织过氧化及细胞膜的损伤。由图5可知,在实验质量浓度范围内,花椒麻素对·OH的清除率基本保持不变,当花椒麻素质量浓度为25 μg/mL时,对·OH的清除率为13.4%,而随着花椒麻素的质量浓度增加至800 μg/mL时,其对·OH的清除率仅增加至16.4%(P>0.05)。与同等质量浓度下的阳性对照VC相比,花椒麻素对·OH的清除率能力远不如VC。
2.5 花椒麻素的细胞内抗氧化能力
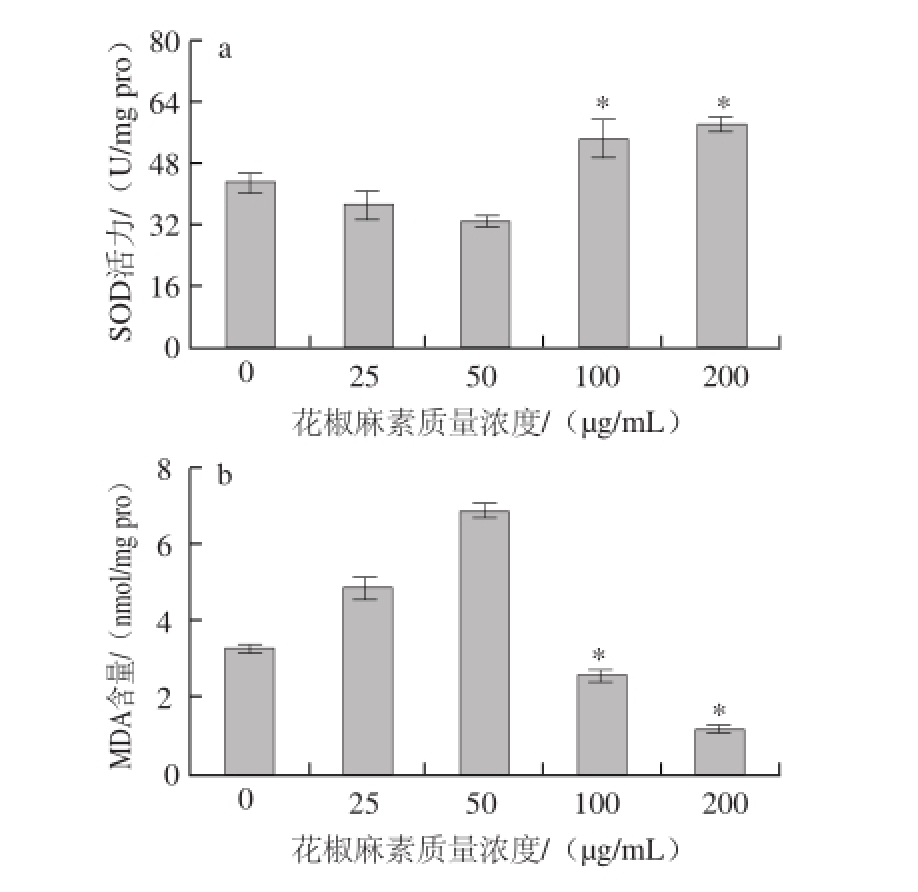
图6 花椒麻素对HepG2细胞SOD活力(a)及MDA含量(b)的影响
Fig.6 Effect of sanshool on SOD activity (a) and MDA content (b) in HepG2 cells
由图6可知,HepG2细胞经花椒麻素作用24 h后,与空白对照组(0 μg/mL)相比,随着花椒麻素质量浓度的增加,HepG2细胞内SOD活力呈现出先下降随后上升的趋势,当花椒麻素质量浓度达到100 μg/mL时,SOD活力显著增加(P<0.05),而细胞内MDA含量则与SOD活力呈现出相反的变化趋势,当花椒麻素质量浓度达到100 μg/mL时,其MDA含量显著降低(P<0.05)。
自由基是游离存在的,含有不配对电子的基团,正常情况下,机体的氧化与抗氧化存在动态平衡,当在患病或衰老等状态下,则出现自由基水平升高,造成细胞蛋白质氧化、核酸断裂及脂质过氧化等产生,进而影响细胞的正常功能 [25-26]。本实验采用体外化学分析法研究了花椒麻素的总抗氧化能力、总还原力以及对DPPH自由基和·OH的清除能力。实验结果显示,花椒麻素对DPPH自由基、·OH的清除能力较弱,具有一定的总抗氧化能力,但其对铁的还原力较强,并随着剂量增加而增大,呈现良好的剂量-效应关系,与阳性对照VC相比无显著差异(P>0.05)。
为了更全面评价花椒麻素的抗氧化能力,本实验以人肝癌细胞HepG2为模型,探讨了其在细胞水平上的抗氧化能力。SOD是一种通过清除超氧阴离子自由基从而起到保护机体抵抗自由基损伤的重要抗氧化酶,是生物体内清除自由基的第一道防线;MDA是自由基作用于脂质发生过氧化反应的氧化终产物,可引起细胞毒性,破坏细胞膜结构,其含量间接反映出细胞受损伤的程度,常将两者联合应用于评价细胞的氧化应激水平 [27-28]。本研究的结果显示,随着花椒麻素质量浓度增加,SOD活力呈现先下降随后上升的趋势,且差异显著(P<0.05);而MDA含量随着花椒麻素质量浓度的增加呈现出先增加后降低的趋势。有研究表明,花椒麻素存在潜在的细胞毒性,且可减缓胃癌细胞循环周期,有效阻止癌细胞周期调节的失控 [29-30],这可能使得较低质量浓度的花椒麻素不能有效抑制肝癌细胞增殖,癌细胞内过剩的自由基不能得到有效清除,导致SOD活力降低,MDA含量增加;随着花椒麻素质量浓度的增加,HepG2细胞活性被抑制,细胞内自由基减少,MDA含量降低,SOD活力增加,这可能也是花椒麻素抑制肿瘤的作用机制之一。
综上所述,花椒麻素具有一定的抗氧化能力,且在一定质量浓度范围内,能有效降低HepG2细胞内的MDA含量,增加SOD活力。
参考文献:
[1] ZHAO Zhifeng, ZHU Ruixue, ZHONG Kai, et al. Characterization and comparison of the pungent components in commercial Zanthoxylum bungeanum oil and Zanthoxylum schinifolium oil[J]. Journal of Food Science, 2013, 78(10): C1516-C1522.
[2] CHEN Kewei, ZHANG Fusheng, KAN Jianquan. Characterization of chlorophyll breakdown in green prickleyashes (Zanthoxylum schinifolium Zucc.) during slow drying[J]. European Food Research and Technology, 2012, 234(6): 1023-1031.
[3] DIAO Wenrui, HU Qingping, FENG Saisai, et al. Chemical composition and antibacterial activity of the essential oil from green huajiao (Zanthoxylum schinifolium) against selected foodborne pathogens[J]. Journal of Agricultural and Food Chemistry, 2013,61(25): 6044-6049.
[4] 罗凯, 胡江, 黄秀芳, 等. 花椒麻味物质的提取分离及其组分分析[J]. 食品科学, 2013, 34(24): 88-91. doi: 10.7506/spkx1002-6630-201324018.
[5] ALIN K C, SIMONS C T. Psychophysical evaluation of a sanshool derivative (alkylamide) and the elucidation of mechanisms subserving tingle[J]. PLoS ONE, 2010, 5(3): e9520. doi: 10.1371/journal. pone.0009520.
[6] 王素霞, 赵镭, 史波林, 等. 花椒麻味化学基础的研究进展[J]. 中草药, 2013, 44(23): 3406-3412.
[7] SUGAI E, MORIMITSU Y, KUBOTA K. Quantitative analysis of sanshool compounds in Japanese pepper (Xanthoxylum piperitum DC.)and their pungent characteristics[J]. Bioscience, Biotechnology, and Biochemistry, 2005, 69(10): 1958-1962.
[8] BADER M, STARK T D, DAWID C, et al. All-trans-configuration in Zanthoxylum alkylamides swaps the tingling with a numbing sensation and diminishes salivation[J]. Journal of Agricultural and Food Chemistry, 2014, 62(12): 2479-2488.
[9] SUGAI E, MORIMITSU Y, IWASAKI Y, et al. Pungent qualities of sanshool-related compounds evaluated by a sensory test and activation of rat TRPV1[J]. Bioscience, Biotechnology, and Biochemistry, 2005,69(10): 1951-1957.
[10] TSUNOZAKI M, LENNERTZ R C, VILCEANU D, et al. A‘toothache tree' alkylamide inhibits Aδ mechanonociceptors to alleviate mechanical pain[J]. The Journal of Physiology, 2013,591(13): 3325-3340.
[11] ARTARIA C, MARAMALDI G, BONFIGLI A, et al. Lifting properties of the alkamide fraction from the fruit husks of Zanthoxylum bungeanum[J]. International Journal of Cosmetic Science, 2011, 33(4):328-333.
[12] D E V K O T A K P, W I L S O N J, H E N R I C H C J, e t a l. Isobutylhydroxyamides from the pericarp of Nepalese Zanthoxylum armatum inhibit NF1-defective tumor cell line growth[J]. Journal of Natural Products, 2013, 76(1): 59-63.
[13] NAGUMO K, TANAKA M, CHUANG V T G, et al. Cys34-Cysteinylated human serum albumin is a sensitive plasma marker in oxidative stress-related chronic diseases[J]. PLoS ONE, 2014, 9(1):e85216. doi: 10.1371/journal.pone.0085216.
[14] POPOLO A, AUTORE G, PINTO A, et al. Oxidative stress in patients with cardiovascular disease and chronic renal failure[J]. Free Radical Research, 2013, 47(5): 346-356.
[15] SMALL D M, COOMBES J S, BENNETT N, et al. Oxidative stress,anti-oxidant therapies and chronic kidney disease[J]. Nephrology,2012, 17(4): 311-321.
[16] GUO Chao, LI Rong, ZHENG Ni, et al. Anti-diabetic effect of ramulus mori polysaccharides, isolated from Morus alba L., on STZ-diabetic mice through blocking inflammatory response and attenuating oxidative stress[J]. International Immunopharmacology, 2013, 16(1):93-99.
[17] SHIOTA M, YOKOMIZO A, NAITO S. Pro-survival and antiapoptotic properties of androgen receptor signaling by oxidative stress promote treatment resistance in prostate cancer[J]. Endocrine-Related Cancer, 2012, 19(6): R243-R253.
[18] 豆海港, 陈文学, 仇厚援. 花椒提取物抗氧化作用研究[J]. 食品研究与开发, 2006, 27(7): 14-16.
[19] YAMAZAK E, INAGAKI M, KURITAI O, et al. Antioxidant activity of Japanese pepper (Zanthoxylum piperitum DC.) fruit[J]. Food Chemistry, 2013, 100(1): 171-177.
[20] XIA Lian, YOU Jinmao, LI Guoliang, et al. Compositional and antioxidant activity analysis of Zanthoxylum bungeanum seed oil obtained by supercritical CO 2fluid extraction[J]. Journal of the American Oil Chemists' Society, 2011, 88(1): 23-32.
[21] BRAND-WILLIAMS W, CUVELIER M E, BERSET C. Use of a free radical method to evaluate antioxidant activity[J]. LWT-Food Science and Technology, 1995, 28(1): 25-30.
[22] OYAIZU M. Antioxidative activities of browning products of glucosamine fractionated by organic solvent and thin-layer chromatography[J]. Journal of the Japanese Society for Food Science & Technology Nippon Shokuhin Kagaku Kogaku Kaishi, 1988, 35(11):771-775.
[23] 杨虎, 张生堂, 高国强. 玫瑰黄酮的提取及其清除DPPH自由基活性研究[J]. 食品科学, 2012, 33(24): 152-155.
[24] 杨明惠, 何丽仙, 李珍贵. 分光光度法测定Fenton体系中产生的羟自由基[J]. 大理学院学报, 2007, 6(4): 38-40.
[25] 李勇, 孔令青, 高洪, 等. 自由基与疾病研究进展[J]. 动物医学进展,2008, 29(4): 85-88.
[26] DATTA K, SINHA S, CHATTOPADHYAY P. Reactive oxygen species in health and disease[J]. National Medical Journal of India,2000, 13(6): 304-310.
[27] SUN Fang, HAMAGAWA E, TSUTSUI C, et al. Evaluation of oxidative stress during apoptosis and necrosis caused by carbon tetrachloride in rat liver[J]. Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease, 2001, 1535(2): 186-191.
[28] 高慧亭, 徐丽姝, 李东风, 等. GLP-1对非酒精性脂肪肝大鼠肝氧化应激及TNF-α、TGF-β1的影响[J]. 南方医科大学学报, 2013,33(11): 1661-1664.
[29] NAVARRETE A, HONG E. Anthelmintic properties of α-sanshool from Zanthoxylum liebmannianum[J]. Planta Medica, 1996, 62(3):250-251.
[30] HASHIMOTO K, SATOH K, KASE Y, et al. Modulatory effect of aliphatic acid amides from Zanthoxylum piperitum on isolated gastrointestinal tract[J]. Planta Medica, 2001, 67(2): 179-181.
Antioxidant Activity in vitro of Sanshool from Sichuan Peppers (Zanthoxylum bungeanum)
YOU Yuming
1,2, ZHOU Min
1, WANG Qianqian
1, REN Ting
1, LIU Xiong
1,*
(1. College of Food Science, Southwest University, Chongqing 400715, China;2. College of Forestry and Life Science, Chongqing University of Arts and Sciences, Chongqing 402160, China)
Abstract:The an tioxidant activity in vitro of sanshool from Sichuan peppers (Zanthoxylum bungeanum) was assessed by total antioxidant capacity, reducing power and scavenging capacities against hydroxyl and 1,1-diphenyl-2-picrylhydrazyl(DPPH) free radicals as well as its cellular antioxidant activity on human liver HepG2 cells. The results indicated that sanshool had a certain reducing power and total antioxidant capacity in a dose-effect manner, but the scavenging activity on DPPH and hydroxyl radicals was a little weak. The cellular antioxidant activity on human liver HepG2 cells showed that at lower concentrations (0-50 μg/mL) of sanshool, superoxide dismutase (SOD) activity was decreased and malondialdehyde(MDA) content was increased. At a concentration up to 100 μg/mL, SOD activity was increased significantly and MDA content was reduced significantly (P < 0.05). Therefore, sanshool is can be considered as a potential antioxidant ingredient for functional foods.
Key words:sanshool; antioxidant activity; HepG2 cells
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2015)13-0027-05
doi:10.7506/spkx1002-6630-201513006
收稿日期:2014-08-27
基金项目:国家自然科学基金面上项目(NSFC31171679);重庆市科学技术基金项目(CSTC2010BB1350)
作者简介:游玉明(1983—),男,讲师,博士研究生,研究方向为食品化学与营养学。E-mail:xuxiaojiaoyou@126.com
*通信作者:刘雄(1970—),男,教授,博士,研究方向为碳水化合物功能与利用、食品化学与营养学。
E-mail:liuxiong848@hotmail.com