涂宗财 1,2,段邓乐 1,王 辉 1,陈智韡 1,黄小琴 2
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.江西师范大学生命科学学院,江西 南昌 330022)
摘 要:以大豆分离蛋白(soy protein isolate,SPI)和乳糖(lactose)为原料,利用微波无溶剂糖基化反应合成SPI-乳糖糖基化接枝物(SPI-L)和以金属氧化物Al 2O 3为载体的微波SPI-乳糖糖基化接枝物(SPI-L-Al 2O 3),并通过颜色变化、荧光光谱分析、氨基酸分析、溶解性以及褐变程度等方法对比,研究两种接枝产物的理化性质和结构变化。结果表明:SPI-L-Al 2O 3比SPI-L反应速率略慢,随着微波时间的延长,两者颜色均逐渐变深,颜色差异逐渐变大;溶解度均呈先增大后降低的趋势;赖氨酸和精氨酸相对含量均明显降低;SPI-L最大荧光波长先蓝移后红移,相对荧光强度先增大后减小,SPI-L-Al 2O 3最大荧光波长发生蓝移,相对荧光强度逐渐增强。
关键词:大豆分离蛋白;乳糖;微波;接枝物;理化性质
蛋白质和糖类是组成食品体系的重要成分,在食品体系中处于共存状态,二者之间的相互作用是影响食品体系流变学特性、稳定性和口感的主要因素 [1]。蛋白质和糖易发生接枝反应,且研究发现,蛋白质与还原糖发生糖基化反应可以提高蛋白质的功能特性 [2]。大豆分离蛋白(soy protein isolate,SPI)是一种重要的植物蛋白产品,已经广泛应用于食品及其他行业中,其蛋白质含量高达90%以上,应充分利用我国大豆资源,大力推广大豆分离蛋白制品在食品加工中的应用 [3]。另一方面,大豆分离蛋白的乳化性、凝胶性等性质与某些动物源蛋白质相比仍有较大差距,且它较差的溶解性也不利于其在食品工业中的广泛应用,因此需要对SPI进行改性处理来获得优良的功能特性 [4]。
微波可以使电磁能通过分子运动而转化为热能,由于其高效、节能、安全的热处理方法,微波加热(microwave heating,MH)已经被广泛地应用到食品工业中 [5],如微波加热应用于糖基化修饰 [6]。
已经有研究表明,在缓冲溶液存在的条件下,微波可以明显地加快大豆分离蛋白-糖美拉德反应 [7]。在SPI-糖湿法接枝改性研究的基础上,通过微波辐射强化可以极大地提高接枝反应 的速率,且接枝改性产品的功能性也有很大的改善 [8]。但是,微波加热的机制是目标分子电偶极子发生旋转和振动,因此,微波辐照常常被水分子吸收 [9]。在干燥介质中,反应物混合不完全,不均匀的微波电场使反应物产生局部过热,表面温度更高,使固相载体反应比溶液相反应速率更快,产率更高 [10],因此微波无溶剂条件下的有机合成反应由于未使用溶剂,发生有机反应时反应物彼此直接接触,物质本身的性质决定了反应速率和条件。氧化铝(Al 2O 3)作为一种常用的金属氧化物载体,可以反射微波,导致反应物的反应程度更均匀 [5]。为了减少水分子优先被加热而导致目标分子间接被加热的影响,本实验以大豆分离蛋白为研究对象,利用微波无溶剂糖基化反应合成以金属氧化物Al 2O 3为载体的微波SPI-乳糖糖基化接枝物(SPI-LAl 2O 3)和SPI-乳糖糖基化接枝物(SPI-L),并研究接枝产物的理化性质和功能性质,旨在获得新的、快速有效的蛋白质改性方法,为蛋白-糖接枝物的工业生产提供理论基础和方法指导。
1.1 材料与试剂
大豆蛋白 谷神生物科技集团有限公司;粗蛋白、乳糖(分子质量360.31 D) 阿拉丁试剂有限公司;酸性氧化铝(alumina,Al 2O 3)、NaOH、HCl 天津市大茂化学试剂厂。
1.2 仪器与设备
CR-10色差仪 日本Minolta公司;T6新世纪紫外-可见分光光度计 北京普析通用仪器有限公司;G80F20CN2L-B8(RO)型微波炉 广东格兰仕微波炉电器制造有限公司;L-8800氨基酸分析仪、F-7000荧光光谱仪 日本日立公司。
1.3 方法
1.3.1 SPI的制备
大豆蛋白与蒸馏水按质量比1∶10混合,室温下低速搅拌2 h,搅拌过程用1 mol/L NaOH保持pH 8.5。混合液经8 000×g离心30 min除去不溶物,上清液用2 mol/L HCl调节pH值至4.5,溶液经5 000×g离心15 min,去除上清液,收集蛋白质凝乳,凝乳经蒸馏水冲洗3 次后,加入一定量蒸馏水,用1 mol/L NaOH调节溶液pH值至7.0,搅拌,待沉淀充分溶解后,溶液经8 000×g离心30 min除去不溶物,上清液冷冻干燥 [11]。
1.3.2 SPI-L-Al 2O 3的制备
称取SPI、乳糖、Al 2O 3( 5∶5∶1,m/m)若干置于研钵中研磨,混合均匀后过150 目筛,收集筛出物。SPI-乳糖- Al 2O 3混合物(水分含量为5.2%,水分含量测定采用GB 5009.3—2010《食品中水分的测定》中的方法)在800 W微波功率下加热不同时间(30、60、90、120、150、180 s),冰水浴30 s结束反应。不同样品配成50 mL溶液,4 ℃透析2 d,再将溶液稀释至100 mL,3 000×g离心除去不溶物,样品冻干制成干粉。
1.3.3 SPI-L的制备
称取等质量的SPI与乳糖置于研钵中研磨,混合均匀后过150 目筛,收集筛出物。SPI-乳糖混合物(水分含量为7.2%)在800 W微波功率下加热不同时间(30、60、90、120、150、180 s),冰水浴结束反应。不同样品配成50 mL溶液,4 ℃透析2 d,再将溶液稀释至100 mL,3 000×g离心除去不溶物,取10 mL混合物样品置于冰箱中保存备用,其余样品冻干制成干粉。
1.3.4 颜色变化测定
用色差计测定样品颜色的变化。样品置于透明自封袋中,放置在光滑黑色平板上,以此平板测量值为空白。用国际照明委员会(International Commission on Illumination,CIE)建立的色彩系统为技术标准,L表示标准白光,a、b为色度坐标。+a是向红色变化,-a是向绿色变化;+b为向黄色变化,-b为向蓝色变化。总色差(ΔΕ)通过同一样品5 个不同位置进行评价 [12-14],按照下式计算。
式中:L、a、b为样品测量值;L 0、a 0、b 0为空白测量值。
1.3.5 溶解度测定
将SPI及接枝物样品配制成质量浓度为0.1 g/mL的溶液,室温搅拌30 min,于10 000 r/min高速离心30 min,取上清液以Folin-酚法测定蛋白质含量,蛋白质总量使用凯氏定氮法测定 [15-16]。蛋白质氮溶指数(nitrogen solubility index,NSI)按下式计算。
1.3.6 褐变程度的测定
称取冻干后样品加入蒸馏水配制成5 mg/mL的溶液,用紫外分光光度计于420 nm波长处(稀释5 倍)及294 nm波长处(稀释10 倍)测定吸光度,用以表示褐变程度 [17]。
1.3.7 氨基酸组成及含量分析
分别称取0.1 g样品于安瓿管的底部,缓慢加入8 mL 6 mol/L HCl并轻轻转动安瓿管,保证样品全部在安瓿管底部并保证样品得到全部润湿,抽真空,维持10 min后,在酒精喷灯上封口。在110 ℃条件下水解24 h,冷却后双层滤纸过滤浓缩,定容至5 mL,过0.54 nm滤膜后保存备用。用Hitachi L-8800氨基酸分析仪测定氨基酸组成及各氨基酸含量 [18-19]。氨基酸相对含量按下式计算。

1.3.8 荧光光谱采集
样品用10 mmol/L的磷酸盐缓冲液(pH 7.0)稀释,使其蛋白质质量浓度约为2 mg/mL,使用F-7000荧光光谱仪分析样品的相对荧光强度。激发波长290 nm,狭缝5 nm,发射波长300~500 nm,狭缝5 nm,扫描速率1 200 nm/min [20]。
2.1 颜色变化
表1 不同MH时间SPI-L-Al
2O
3颜色变化
Table1 Changes in the color of SPI-L-alumina grafts under different
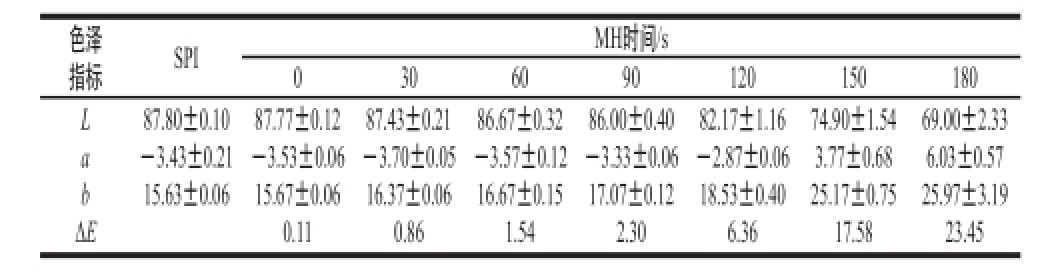
色泽指标SPIMH时间/s 0306090120150180 LabΔ E 87.80±0.10 -3.43±0.21 15.63±0.06 87.77±0.12 -3.53±0.06 15.67±0.06 0.11 87.43±0.21 -3.70±0.05 16.37±0.06 0.86 86.67±0.32 -3.57±0.12 16.67±0.15 1.54 86.00±0.40 -3.33±0.06 17.07±0.12 2.30 82.17±1.16 -2.87±0.06 18.53±0.40 6.36 74.90±1.54 3.77±0.68 25.17±0.75 17.58 69.00±2.33 6.03±0.57 25.97±3.19 23.45
表2 不同MH时间SPI-L颜色变化
Table2 Changes in the color of SPI-L grafts under different MH times
Table2 Changes in the color of SPI-L grafts under different MH times
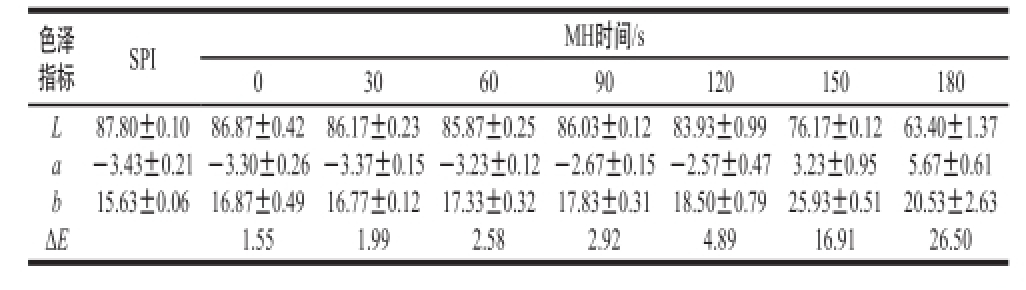
指标SPIMH时间/s 0306090120150180色泽LabΔ E 87.80±0.10 -3.43±0.21 15.63±0.06 86.87±0.4 2 -3.30±0.26 16.87±0.49 1.55 86.17±0.23 -3.37±0.15 16.77±0.12 1.99 85.87±0.25 -3.23±0.12 17.33±0.32 2.58 86.03±0.12 -2.67±0.15 17.83±0.31 2.92 83.93±0.99 -2.57±0.47 18.50±0.79 4.89 76.17±0.12 3.23±0.95 25.93±0.51 16.91 63.40±1.37 5.67±0.61 20.53±2.63 26.50
由表1和表2可知,经过微波糖基化处理后,SPI的颜色变化明显,SPI与还原糖反应产物随着微波时间延长,标准白光(L)值逐渐减小,色度坐标a值、b值逐渐增大,说明SPI经微波糖基化处理后,样品颜色逐渐变黑、变红、变黄。ΔE表示总色差的大小,ΔE逐渐增大,说明随着微波时间延长,样品的颜色差别变大。微波时间越长,温度越高,高温加速了样品分子间的相互作用,产生聚合物色素越多,造成色泽指标的变化 [21]。

图1 不同MH时间接枝物溶解度的变化
Fig.1 Changes in solubility of grafts under different MH times
2.2 溶解度变化蛋白质的溶解度是蛋白质肽链骨架上的极性基团与水分子发生水合作用的结果,能够间接反映蛋白质分子结构的变化,以及蛋白质分子电荷和疏水性的平衡 [22]。由图1可知,随着微波加热时间的延长,样品的溶解度先增大后减小。反应初期,微波加热促使蛋白与糖结合,随着糖链的引入,糖链的亲水性羟基与水分子相互作用,从而增加SPI的NSI。反应时间进一步延长时,更多的糖链引入,蛋白的亲水性变化不明显,但温度进一步升高,高温将导致SPI变性并发生聚集,从而使NSI减小。
2.3 褐变程度变化

图2 样品在294 nm波长处的吸光度
Fig.2 Absorbance of samples at 294 nm

图3 样品在420 nm波长处的吸光度
Fig.3 Absorbance of samples at 420 nm
样品在294 nm波长处的吸光度可用来表示糖基化过程中中间产物的生成量 [23]。由图2可知,在微波加热120 s内,样品糖基化产物在294 nm波长处的吸光度显著增加,随着时间延长到180 s变化不明显。这表明中间产物很大程度上 是在反应前120 s内生成的,随着微波加热时间延长,一些中间产物聚合形成黑色蛋白,导致只有很少的中间产物形成 [24]。
糖基化反应常伴随着褐变现象,可通过420 nm波长处吸光度来监测样品糖基化反应的高级阶段 [25]。由图3可知,随着微波时间的增长,样品褐变越明显,加热150 s后增强程度变缓,可能是微波加热会导致糖基化反应发生,其生成褐色物质的同时也会发生焦糖化反应。加热150 s后,褐变程度变缓,可能是由于糖基化反应使样品中氨基含量减少并产生酸,过酸条件会减缓褐变反应的发生 [23]。
2.4 氨基酸组成及含量
表3 SPI及其接枝物氨基酸相对含量
Table3 Relative content of amino acids in SPI and grafts

保留时间/min氨基酸种类氨基酸相对含量/% SPISPI-L-Al 2O 3MH 90 sSPI-L MH 90 s 4.99Asp7.217.967.89 5.58Thr5.945.384.33 6.19Ser5.045.217.07 7.03Glu22.6022.6324.21 9.84Gly6.356.466.42 10.68Ala3.593.673.73 12.46Cys0.520.510.49 13.00Val4.114.074.29 14.20Met0.870.890.74 16.36Ile4.054.084.20 17.39Leu6.356.396.62 18.07Tyr2.364.272.40 18.96Phe3.533.443.59 21.03Lys5.003.802.48 22.33NH 315.1014.5814.96 23.24His1.871.901.92 27.00Arg5.504.784.66总量100100100
由表3可知,与未处理SPI相比,其接枝物赖氨酸(Lys)与精氨酸(Arg)相对含量明显降低。SPI-糖的接枝反应主要是SPI中自由氨基与糖分子的还原性末端发生羰氨缩合反应。降低的自由氨基可能是赖氨酸残基的侧链和精氨酸的胍基基团与乳糖发生共价结合的结果。加热也会导致胱氨酸和赖氨酸减少,加热会使胱氨酸形成脱氢丙氨酰残基,它能与赖氨酸ε-氨基形成赖氨酸丙氨酸 [23]。
2.5 荧光光谱分析
天然蛋白质中只有色氨酸、酪氨酸和苯丙氨酸3 种氨基酸残基有荧光性,这3 种氨基酸残基由于侧链芳香族基团不同而有不同的荧光光谱,并且最大荧光波长分别为348、303、282 nm。与酪氨酸、苯丙氨酸残基相比,色氨酸残基荧光量子产率较高,因此荧光光谱主要反映了色氨酸残基的荧光性 [20,26]。
表4 SPI及其接枝的内源性荧光变化Table4 Changes in intrinsic florescence spectra of SPI and grafts
Table4 Changes in intrinsic florescence spectra of SPI and grafts

样品最大荧光波长/nm相对荧光强度SPI344.2306.5 SPI-L-Al 2O 390 s343.2325.7 SPI-L-Al 2O 3150 s343.0548.1 SPI-L 90 s340.0934.2 SPI-L 150 s346.6212.9
由表4可知,SPI-L经微波糖基化处理90 s后,最大荧光波长从344.2 nm蓝移到340 nm,相对荧光强度由306.5增大到极大值934.2。通常而言,最大荧光波长与蛋白分子中色氨酸残基的位置紧密相关 [26]。最大荧光波长向低波长移动表明由于糖分子的引入,SPI中部分色氨酸残基在低极性环境中发生了掩埋。相对荧光强度增强说明部分发色团暴露在分子表面,这可能是由于微波糖化处理后,SPI与糖共价结合、蛋白质-蛋白质聚集及多肽-多肽聚合,部分色氨酸残基结合在非极性部位,从而导致相对荧光强度增加。SPI-L经微波糖化处理150 s后,最大荧光波长从344.2 nm红移到346.6 nm,相对荧光强度由306.5减小至212.9。随着微波时间的延长,色氨酸残基暴露出来,导致最大荧光波长增大。另外,微波加热处理150 s后,SPI-L相对荧光强度降低,表明随微波时间的增长,糖分子含量的增多,SPI聚合物的“空间位阻”效应增强导致相对荧光强度降低。SPI-L-Al 2O 3随着微波时间的延长,最大荧光波长蓝移,相对荧光强度逐渐增强。可能是因为蛋白质与糖吸附在Al 2O 3载体上,由于微波透过Al 2O 3而不被其吸收,从而使蛋白与糖均匀吸收能量,反应程度也较均匀;微波具有局部加热的特性,先吸收微波能的大分子有机物先发生反应,所以SPI-L微波糖基化反应较加入载体更快 [5]。
微波对固相无溶剂糖基化接枝物SPI-L-Al 2O 3和SPI-L的理化性质和结构均有影响,SPI-L-Al 2O 3糖基化反应较SPI-L慢。随着微波时间的延长,两种糖基化产物在294 nm波长处的吸光度均增加,褐变程度也明显增强,颜色差别增大,溶解度均先增大后减小;赖氨酸与精氨酸相对含量均明显降低,最大荧光波长和相对荧光强度也有相应的变化。该研究为为蛋白质- 糖接枝物的工业化生产提供理论基础和方法指导。
参考文献:
[1] de KRUIF C G, TUINIER R. Polysaccharide protein interactions[J]. Food Hydrocolloids, 2001, 15(4/6): 555-563.
[2] 管军军. 微波合成大豆蛋白-糖接枝物机理, 结构及功能性[D]. 无锡: 江南大学, 2005: 1-4.
[3] 李玉珍, 肖怀秋, 兰立新. 大豆分离蛋白功能特性及其在食品工业中的应用[J]. 中国食品添加剂, 2008(1): 121-124.
[4] 王松, 夏秀芳, 黄莉, 等. 湿法糖基化改性对大豆分离蛋白功能性质的影响[J]. 食品科学, 2014, 35(9): 38-42. doi: 10.7506/spkx1002-6630-201409009.
[5] RANER K D, STRAUSS C R, TRAINOR R W, et al. A new microwave reactor for batchwise organic synthesis[J]. The Journal of Organic Chemistry, 1995, 60(8): 2456-2460.
[6] GUAN Junjun, QIU Aiyong, LIU Xiaoya, et al. Microwave improvement of soy protein isolate-saccharide graft reactions[J]. Food Chem istry, 2006, 97(4): 577-585.
[7] TU Zongcai, HU Yueming, WANG Hui, et al. Microwave heating enhances antioxidant and emulsifying activities of ovalbumin glycated with glucose in solid-state[J]. Journal of Food Science and Technology, 2015, 52(3): 1453-1461.
[8] 管军军, 裘爱泳, 刘晓亚, 等. 微波辐射合成大豆分离蛋白: 糖接枝物的功能性[J]. 食品科学, 2005, 26(11): 35-39.
[9] YASUHIRO T, SHUNJI F, SEIJI N, et al. Glycation of ovalbumin in solid-state by conductive and microwave heating[J]. Food Science and Technology Research, 2009, 15(4): 377-380.
[10] SINGH V, KUMAR P, SANGHI R. Use of microwave irradiation in the grafting modification of the polysaccharides: a review[J]. Progress in Polymer Science, 2012, 37(2): 340-364.
[11] JAMBRAK A R, LELAS V, MASON T J, et al. Physical properties of ultrasound treated soy proteins[J]. Journal of Food Engineering, 2009,93(4): 386-393.
[12] LEE M, LEE S, SONG K B. Effect of γ-irradiation on the physicochemical properties of soy protein isolate films[J]. Radiation Physics and Chemistry, 2005, 72(1): 35-40.
[13] XU W, LIU B, YANG H, et al. Effect of γ-irra diation on the physicochemical properties of mixed soy protein isolate/starch material[J]. African Journal of Biotechnology, 2012, 11(28): 7238-7246.
[14] LIU K. Particle size distribution of distillers dried grains with solubles(DDGS) and relationships to compositional and color properties[J]. Bioresource Technology, 2008, 99(17): 8421-8428.
[15] WANG Xiansheng, TANG Chuanhe, LI Biansheng, et al. Effects of high-pressure treatment on some physicochemical and functional properties of soy protein isolates[J]. Food Hydrocolloids, 2008, 22(4):560-567.
[16] PET RUCCELLI S, ANON M C. Relationship between the method of obtention and the structural and functional properties of soy proteins isolates. 1. Structural and hydration pro perties[J]. Journal of Agricultural and Food Chemistry, 1994, 42(10): 2161-2169.
[17] GUAN Yongguang, LIN Hua, HAN Zhong, et al. Effects of pulsed electric field treatment on a bovine serum albumin: d extran model system, a means of promoting the Maillard reaction[J]. Food Chemistry, 2010, 123(2): 275-280.
[18] HOU D H J, CHANG S K C. Structural characteristics of purified glycinin from soybean s stored under various conditions[J]. Journal of Agricultural and Food Chemistry, 2004, 52(12): 3792-3800.
[19] WANG M, HETTIARACHCHY N S, QI M, et al. Preparation and functional properties of rice bran protein isolate[J]. Journal of Agricultural and Food Chemistry, 1999, 47(2): 411-416.
[20] TANG Chuanhe, YANG Xiaoquan, CHEN Zhong, et al. Physicochemical and structural characteristics of sodium caseinate biopolymers induced by microbial transglutaminase[J]. Journa l of Food Biochemistry, 2005, 29(4): 402-421.
[21] 项惠丹, 许时婴, 王璋. 蛋白质与还原糖美拉德反应产物的抗氧化活性[J]. 食品科学, 2008, 29(7): 52-57.
[22] 穆利霞. 大豆蛋白-糖接枝改性及其结构与功能特性研究[D]. 广州:华南理工大学, 2010, 40-41.
[23] GU Fenglin, KIM J M, HAYAT K, et al. Characteristics a nd antioxidant activity of ultrafiltrated Maillard reaction products from a casein-glucose model system[J]. Food Chemistry, 2009, 117(1): 48-54.
[24] LERTITTIKUL W, BENJAKUL S, TANAKA M. Character istics and antioxidative activity of Maillard reaction products from a porcine plasma protein-glucose model system as influenced by pH[J]. Food Chemistry, 2007, 100(2): 669-677.
[25] JIANG Z, WANG L, WU W, et al. Biological activities and physicochemical properties of Maillard reaction products in sugarbovine casein peptide model systems[J]. Food Chemistry, 2013,141(4): 3837-3845.
[26] KIM S H, KINSELLA J E. Effects of reduction with dithiothreitol on some molecular properties of soy glycinin[J]. Journal of Agricultural and Food Chemistry, 1986, 34(4): 623-627.
Effect of Microwave Treatment on Solid-Phase Synthesis of Soy Protein Isolate-Lactose Graft
TU Zongcai
1,2, DUAN Dengle
1, WANG Hui
1, CHEN Zhiwei
1, HUANG Xiaoqin
2
(1. State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China;2. College of Life Science, Jiangxi Normal University, Nanchang 330022, China)
Abstract:Soybean protein isolate (SPI) and lactose were used as raw materials to synthesize SPI-lactose graft by solventfree glycosylation with microwave heating and SPI-lactose-Al 2O 3graft using Al 2O 3as the carrier. The chemical and structural properties of the two graft copolymers including color, fluorescence spectral characteristics, amino acid composition,solubility and degree of browning were compared. Results showed that the react ion rate of SPI-L-alumina was lower than that of SPI-L. With the extension of microwave heating time, the color of both samples were deeper, and color difference gradually increased, the solubility rose fi rst and then dropped, and the contents of lysine and arginine were signifi cantly reduced. The maximum fluorescence wavelength of SPI-L revealed a blue shift followed by a red shift with an initial increase and then a decrease in relative fl uorescence intensity, whereas the maximum fl uorescence wavelength of SPI-L-alumina displayed a blue shift with a gradual increase in relative fl uorescence intensity.
Key words:soybean protein isolate (SPI); lactose; microwave; graft; physicochemical properties
中图分类号:TQ93
文献标志码:A
文章编号:1002-6630(2015)13-0032-05
doi:10.7506/spkx1002-6630-201513007
收稿日期:2014-06-30
基金项目:国家重点基础研究发展计划(973计划)项目(2012CB126314);江西省重大科技创新项目(20124ACB00600)
作者简介:涂 宗财(1965—),男,教授,博士,研究方向为食物资源开发与高效利用。E-mail:tuzc_mail@aliyun.com