
图1 胞外多糖S2(50 ☒g/mL)的原子力显微镜图像
Fig.1 AFM topographic image of EPS S2 deposited on mica at a concentration of 50 ☒g/mL
a. 平面图像;b. 立体图像;扫描范围:5.0 ☒m×5.0 ☒m。图2同。
邵 丽 1,2,吴正钧 1,张 灏 2,陈 卫 2,郭本恒 1,2,*
(1.光明乳业股份有限公司乳业技术中心,乳业生物技术国家重点实验室,上海 200436;2.江南大学食品学院,江苏 无锡 214122)
摘 要:胞外多糖S2是从鼠李糖乳杆菌(Lactobacillus rhamnosus)KF5的发酵乳中分离纯化得到的高分子质量组分。采用原子力显微镜(atomic force microscopy,AFM)对胞外多糖S2在水溶液中的表观形貌进行观察。结果表明:不同质量浓度的胞外多糖S2经AFM成像,得到了不同形貌多糖分子聚集行为的图像。随着胞外多糖S2质量浓度的降低,多糖分子之间的作用力减弱,外貌发生从膜状、岛屿状、网格状到单链/双链结构的变化。当胞外多糖S2质量浓度为50 ng/mL时,多糖分子间形成网状结构,说明胞外多糖S2具有多分支的化学结构。当胞外多糖S2质量浓度为10 ng/mL时,多糖分子在水溶液中呈柔性链,形成无规卷曲的构象,进一步验证了由高分子稀溶液理论推断的无规卷曲构象的结论。
关键词:鼠李糖乳杆菌;胞外多糖;原子力显微镜;分子外貌
乳酸菌(lactic acid bacteria,LAB)胞外多糖是乳酸菌在生长代谢过程中分泌到细胞外的黏液或荚膜多糖。LAB被公认为是安全(generally regarded as safe,GRAS)的,因此,产胞外多糖的乳酸菌菌株可以直接应用到发酵生产中,以提高产品的稳定性、改善发酵乳的风味,使产品质地细腻均匀,口感润滑 [1-4]。同时,LAB胞外多糖还具有重要的生物活性,如抗肿瘤、抗氧化、免疫调节、降胆固醇、降血压、增强黏膜吸附作用等 [5-8]。
多糖的生物活性不仅取决于多糖链的化学结构,还与多糖本身的分子质量大小、溶解性以及构象等物理性质有着密切关系 [9-11]。因此,了解多糖的构象可以更好地阐明其结构与功能的关系。多糖链构象主要由其在溶液中的分子参数确定,同时也可用显微技术直接观察。原子力显微镜(atomic force microscopy,AFM)是近十几年发展起来的研究生物大分子形态和构象的有力工具。生物大分子在其生理环境下直接成像,可以很直观地观察分子的构象变化及分子间的实时动态反应 [12-14]。
鼠李糖乳杆菌(Lactobacillus rhamnosus)KF5是一株筛选自健康志愿者粪便的乳酸菌菌株。前期研究表明,菌株KF5在脱脂乳中产胞外多糖,经提取和分离纯化得到低分子质量组分S1和高分子质量组分S2,两组分均能显著地促进T淋巴细胞增殖,具有潜在的免疫调节功能 [15]。同时,应用高分子稀溶液理论,通过黏度法、尺寸排除色谱和多角度激光光散射联用(size-exclusion chromatography with multi-angle laser light scattering,SEC-MALLS)和动态光散射法(dynamic light scattering,DLS)等对胞外多糖S2的分子特性进行测定,结果表明胞外多糖S2在0.1 mol/L NaNO 3溶液中呈现无规卷曲的构象 [16]。本实验进一步采用AFM对不同质量浓度的胞外多糖S2在水溶液中的微观形貌进行观察,以期获得更多该多糖的分子结构特征信息。
1.1 菌株与培养基
鼠李糖乳杆菌(L. rhamnosus)KF5(CGMCC No. 6430),由光明乳业技术中心筛选得到。
脱脂乳培养基(1 L):脱脂乳粉120 g、葡萄糖10 g、水880 g,118 ℃灭菌15 min。
1.2 试剂与仪器
DEAE-Sepharose Fast Flow离子胶、Sepharose CL-6B凝胶 美国GE公司;其他试剂均为分析纯。
Nano Scope Ⅲa型原子力显微镜 美国Digital Instruments公司;超纯水仪 美国Millipore公司。
1.3 方法
1.3.1 胞外多糖S2的制备
将活化的L. rhamnosus KF5接种到脱脂乳培养基中,30 ℃培养32 h制得发酵乳。发酵乳经煮沸、离心、乙醇沉淀、除蛋白、透析、冷冻干燥得到粗多糖。粗多糖再经DEAE-Sepharose Fast Flow离子交换层析和Sepharose CL-6B凝胶层析制得纯多糖,经高效液相色谱鉴定为单一对称峰,确定为均一组分(S2) [15]。
1.3.2 多糖溶液的制备
准确称取1 mg胞外多糖S2,溶解在20 mL超纯水中,配制成50 μg/mL的多糖溶液。在磁力搅拌器上搅拌6 h,使其充分溶解,然后用超纯水系列稀释得到10、0.1 μg/mL以及50、10 ng/mL的多糖溶液。
1.3.3 AFM样本的制备
AFM样本的制备采用两种如下方法:1)直接将5 μL多糖溶液滴在新剥开的云母片表面,空气中自然干燥。2)取5 μL 20 mmol/L MgCl 2溶液滴在新剥开的云母片上,孵育2 min,然后用大量的超纯水冲洗,干燥后在其表面滴加5 μL多糖溶液,在空气中自然干燥(本实验中仅10 ng/mL多糖溶液采用此方法) [17]。
1.3.4 AFM观察条件
在室温、大气环境(相对湿度不高于60%)中,将制备好的多糖云母片样本在Nano Scope Ⅲa型原子力显微镜下进行扫描。扫描采用轻敲模式,作用力控制在3~4 nN量级以内,扫描频率2 Hz。所用探针为Si 3N 4,微悬臂长:225 μm,弹性系数:0.6~3.7 N/m。图像处理分析采用AFM附带的软件Nanoscope 5.30r3sr3进行。
2.1 50 μg/mL胞外多糖S2的AFM图像
图像所显示的多糖分子的密度取决于其初始质量浓度及其沉积到云母表面的量 [18]。将不同质量浓度的胞外多糖S2样品分别用AFM成像观察,得到了不同形貌多糖分子聚集行为的图像。

图1 胞外多糖S2(50 ☒g/mL)的原子力显微镜图像
Fig.1 AFM topographic image of EPS S2 deposited on mica at a concentration of 50 ☒g/mL
a. 平面图像;b. 立体图像;扫描范围:5.0 ☒m×5.0 ☒m。图2同。
如图1所示,当质量浓度为50 μg/mL时,胞外多糖S2在云母片表面铺展开,形成连续的膜(图1a),膜的厚度为2.5~3.8 nm。在立体图(图1b)上清楚地看到一张完整的膜,具有浅的凹坑的表面结构。由于多糖质量浓度大,羟基数目多,分子间的氢键缔合作用增强,多糖聚合较紧密,形成膜状结构。Ding Xiang等 [19]从灰松乳菇子实体中分离到多糖LDG-A(25 μg/mL),在云母片上也观察到成膜的表面结构,直径和高度在20~80 nm之间。
2.2 10 μg/mL胞外多糖S2的AFM图像
随着质量浓度的降低,胞外多糖S2的形貌发生了变化。当多糖质量浓度为10 μg/mL时,多糖分子聚集成片状黏连结构,如图2a所示。图2b显示了胞外多糖S2的3D地形图,形貌如岛屿状结构,这些大小不等的“孤岛”的相对连续表面的高度为1.8~3.0 nm,直径大小不等,如156、259、350、470 nm等。这种岛屿状的表观外貌在其他多糖中也曾观察到。Zeng Weicai等 [20]利用AFM观察木耳多糖(Auricularia auricular polysaccharides,AAP)在50 μg/mL时的微观外貌,结果发现多糖聚 集成高度为1.1~1.5 nm、直径为7~56 nm大小不等的球壳。陈海霞 [21]研究不同质量浓度茶多糖的分子外貌,发现茶多糖在1 μg/mL时形成厚度为1.4~2.6 nm、直径为320~460 nm的球状。多糖这种形貌的形成是大量多糖分子的分子间和分子内氢键作用以及范德华力造成的。
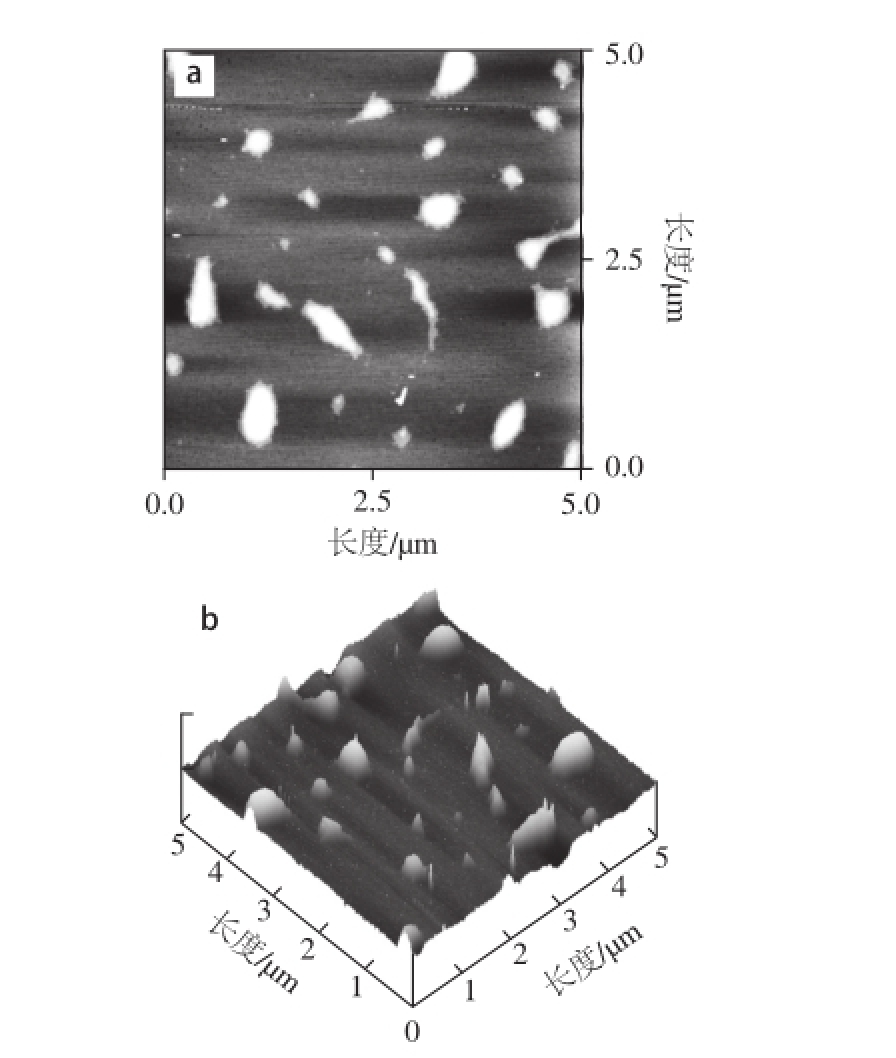
图2 胞外多糖S2(10 ☒g/mL)的原子力显微镜图像
Fig.2 AFM topographic image of EPS S2 deposited on mica at a concentration of 10 ☒g/mL
2.3 0.1 μg/mL胞外多糖S2的AFM图像

图3 胞外多糖S2(0.1 ☒g/mL)的原子力显微镜图像
Fig.3 AFM topographic image of EPS S2 deposited on mica at a concentration of 0.1 ☒g/mL
如图3所示,当胞外多糖S2质量浓度为0.1 μg/mL时,多糖链的形貌初现,从图中可以很明显地看到多糖链之间旋转缠绕,呈麻花状。测得链的高度为0.7~1.5 nm,而链的宽度为100~120 nm,远远高于多糖链的宽度,这是扫描探针的增宽效应所致 [18]。
2.4 50 ng/mL胞外多糖S2的AFM图像

图4 胞外多糖S2(50 ng/mL)的原子力显微镜图像
Fig.4 AFM topographic image of EPS S2 deposited on mica at a concentration of 50 ng/mL
如图4所示,当质量浓度为50 ng/mL时,胞外多糖S2在云母片表面形成网状结构,这是由于多糖链间通过糖单元间不同的连接方式衍生出许多大小不一的环状结构所致,小环的直径为126.95、146.48 nm大小不等,从而直接证明了胞外多糖S2具有多分支的结构。链的高度很一致,平均高度在0.45~0.75 nm之间。通常多糖分子链的高度在0.1~1 nm之间 [22-23],可以推测此处多糖链由单股或双股缠绕而成。从图中可以清楚地观察到多糖链呈卷曲旋转状,趋势很像螺旋。多糖分子链之间交联成网状结构的现象也曾被报道过:蔡林涛等 [24]对纯化的虫草多糖(0.01 mg/mL)在水溶液中的分子外貌进行观察,发现虫草多糖分子链呈分支结构,而且互相缠绕,链间形成大大小小的环。单链的厚度为1.8 nm,长度为几个微米,宽度为20~40 nm。绞股蓝多糖GPPⅢ-a(10 μg/mL)经45 ℃水浴加热后用AFM观察,聚合物链分子间互相缠绕,交联形成许多大小不一的不规则环状结构 [25]。
2.5 10 ng/mL胞外多糖S2在经修饰的云母片上的AFM图像
胞外多糖S2分子本身带有少量的负电荷,为了减少因多糖与云母片间的静电排斥作用而产生的聚集效应,可采用二价阳离子(如Ni 2+、Mg 2+)来修饰云母片 [17,24],本实验选用20 mmol/L MgCl 2来处理云母片表面,再将多糖溶液滴在云母片上。当胞外多糖S2的质量浓度为10 ng/mL时,捕捉到多糖S2在水溶液中的表观外貌(图5a),胞外多糖S2分子在水溶液中以柔性链存在,形成无规卷曲的构象,很明显地不同于黄原胶(单股螺旋构象) [26]或者香菇多糖(三股螺旋构象) [27]的硬链(rigid/stiff)或棒状(rod-like)链构象。如图5b所示,多糖链呈旋转弯曲状,测得链的平均高度在1.6~2.1 nm左右,链的宽度在40~55 nm范围内。说明本实验所观测的多糖链并非是单链多糖,而是由几股单链缠绕聚集而成。即使在如此低的多糖质量浓度下,多糖分子之间仍然发生了聚集。这是由于柔性多糖分子具有更复杂的结构,通常含有支链和非碳取代基团,它们之间通过糖链上的负离子与阳离子相互作用,或分子内和分子间的氢键或者范德华力相互作用产生聚集 [28-29]。因此,柔性多糖分子在水溶液中很容易发生链间聚集 [30]。

图5 胞外多糖S2(10 ng/mL)的原子力显微镜图像
Fig.5 AFM topographic image of EPS S2 deposited on modified mica at a concentration of 10 ng/mL
从胞外多糖S2的AFM图像(图1~5)可以看出,随着质量浓度的减小,胞外多糖S2的聚集性明显减小,表观外貌呈现出从膜状、岛屿状、网状到单链/双链结构的变化。根据现有的数据还没有办法确定胞外多糖S2单链的厚度、宽度和长度。多糖链的构象主要与链结构、分子内和分子间作用力以及溶剂有关,多糖分子作用力主要包括氢键、偶极相互作用、疏水力和静电力等非共价作用力 [31]。外界条件(如热处理、超声波、pH值的变化、金属离子、溶剂)的改变都会引起多糖在溶液中构象的变化 [32]。为了进一步了解胞外多糖S2分子链的信息,可以选择尿素、NaOH、表面活性剂十二烷基硫酸钠(sodium dodecyl sulfate,SDS)或二甲基亚砜(dimethyl sulfoxide,DMSO)来消除分子间或分子内的作用力 [10,31,33-34],分析胞外多糖S2的构象变化,获得更多的信息。
本实验观察了鼠李糖乳杆菌胞外多糖S2在不同质量浓度条件下所呈现的不同表观外貌。随着质量浓度的降低,胞外多糖S2分子之间的作用力减弱,外貌呈现出从膜状、岛屿状、网状到单链/双链结构的变化。当质量浓度为50 ng/mL时,多糖分子间形成网状结构,说明胞外多糖S2具有多分支的化学结构。当质量浓度达到10 ng/mL时,多糖分子在水溶液中呈柔性链,形成无规卷曲的构象,这与动静态激光光散射法和黏度法推测的多糖链构象结果一致。AFM是研究多糖高级结构的有力工具,可以与其他表征方法结合起来更好地解析多糖构象。但由于多糖结构复杂,采用AFM对多糖分子的研究还远不及对核酸(DNA)、蛋白质等生物大分子的研究。目前运用AFM成功地观察多糖分子的构象还主要集中在具有刚性链结构的多糖分子中,而对含有多支链的柔性链多糖分子的观察相对较少 [30]。随着AFM技术的改进和完善,AFM在多糖构象研究中会有更广泛的应用前景。
参考文献:
[1] de VUYST L, de VIN F, VANINGELGEM F, et al. Recent developments in the biosynthesis and applications of heteropolysaccharides from lactic acid bacteria[J]. International Dairy Journal, 2001, 11(9): 687-707.
[2] JOLLY L, VINCENT S F, DUBOC P, et al. Exploiting exopolysaccharides from lactic acid bacteria[J]. Antonie van Leeuwenhoek, 2002, 82(1/4): 367-374.
[3] HESS S J, ROBERTS R F, ZIEGLER G R. Rheological properties of nonfat yogurt stabilized using Lactobacillus delbrueckii ssp. bulgaricus producing exopolysaccharide or using commercial stabilizer systems[J]. Journal of Dairy Science, 1997, 80(2): 252-263.
[4] PUROHIT D H, HASSAN A N, BHATIA E, et al. Rheological,sensorial, and c hemopreventive properties of milk fermented with exopolysaccharide-producing lactic cultures[J]. Journal of Dairy Science, 2009, 92(3): 847-856.
[5] AI Lianzhong, ZHANG Hao, GUO Benheng, et al. Preparation,part ial characterization and bioactivity of exopolysaccharides from Lactobacillus casei LC2W[J]. Carbohydrate Polymers, 2008, 74(3):353-357.
[6] LI Wei, J I Juan, TANG Weizhi, et al. Characterization of an antiproliferative exopolysaccharide (LHEPS-2) from Lactobacillus helveticus MB2-1[J]. Carbohydrate Polymers, 2014, 105: 334-340.
[7] ZHANG Li, LIU Chunhong, LI Da, et al. Antioxidant activity of an exopolysa ccharide isolated from Lactobacillus plantarum C88[J]. International Journal of Biological Macromolecules, 2013, 54: 270-275.
[8] CISZEK-LENDA M, NOWAK B, ŚR☒TTEK M, et al. Immunoregulatory potential of exopolysaccharide from Lactobacillus rhamnosus KL37. Effects on the production of inflammatory mediators by mouse macrophages[J]. International Journal of Experimental Pathology, 2011, 92(6): 382-391.
[9] YANG Liqun, ZHAN G Liming. Chemical structural and chain conformational characterization of some bioactive polysaccharides isolated from natural sources[J]. Carbohydrate Polymers, 2009, 76(3):349-361.
[10] 王强, 刘红芝, 钟葵. 多糖分子链构象变化与生物活性关系研究进展[J]. 生物技术进展, 2011, 1(5): 318-326.
[11] KALKA-MOLL W M, TZIANABOS A O, WANG Y, et al. Effect of molecular size on the ability of zwitterionic polysaccharides to stimulate cell ular immunity[J]. The Journal of Immunology, 2000,164(2): 719-724.
[12] 鲍幸峰, 方积年. 原子力显微镜在生物大分子结构研究中的应用进展[J]. 分析化学, 2000, 28(10): 1300-1307.
[13] 李斌. 原子力显微镜在多糖研究中的应用进展[J]. 食品科学, 2005,26(4): 264-269.
[14] 李国有, 陈勇, 王云起, 等. 原子力显微镜在多糖分子结构研究中的应用[J]. 现代仪器, 2006(5): 14-17.
[15] SHAO Li, WU Zhengjun, ZHANG Hao, et al. Partial characterization and immunostimulatory activity of exopolysaccharides from Lactobacillus rhamnosus KF5[J]. Carbohydrate Polymers, 2014, 107:51-56.
[16] SHAO Li, WU Zhengjun, TIAN Fengwei, et al. Molecular characteristics of an exopolysaccharide from Lactobacillus rham nosus KF5 in solution[J]. International Journal of Biological Macromolecules, 2015, 72: 1429-1434.
[17] LIU Zhiguo, LI Zhuang, ZHOU Hualan, et al. Imaging DNA molecules on mica surface by atomic force microsc opy in air and in liquid[J]. Microscopy Research and Technique, 2005, 66(4): 179-185.
[18] KIRBY A R, GUN NING A P, MORRIS V J, et al. Observation of the helical structure of the bacterial polysaccharide acetan by atomic force microscopy[J]. Biophysical Journal, 1995, 68(1): 360-363.
[19] DING Xiang, HOU Yiling, HOU Wanru. Structure feature and antitumor activity of a novel polysaccharide isolated from Lactarius deliciosus Gray[J]. Carbohydrate Polymers, 2012, 89(2): 397-402.
[20] ZEN G Weicai, ZHANG Zeng, GAO Hong, et al. Characterization of antioxidant polysaccharides from Auricularia auricular using microwave-assisted extraction[J]. Carbohydrate Polymers, 2012,89(2): 694-700.
[21] 陈海霞. 高活性茶多糖的一级结构 表征、空间构象及生物活性的研究[D]. 武汉: 华中农业大学, 2002: 54-56.
[22] LI B, XIE B J. Single molecular chain geometry of konjac glucomannan as a high quality dietary fiber in East Asia[J]. Food Research International, 2006, 39(2): 127-132.
[23] 马秀俐, 白玉白, 孙允秀, 等. 西洋参多糖(PPQ-d)的原子力显微镜观察[J]. 吉林大学自然科学学报, 2000(1): 105-106.
[24] 蔡林涛, 李萍, 陆祖宏. 原子力显微镜观察虫草多糖分子的结构形貌[J]. 电子显微学报, 1999, 18(1): 109-111.
[25] 刘荣华, 杨小帆, 池爱平. 绞股 蓝多糖GPPⅢ-a的原子力显微镜观察[J].食品科学, 2009, 30(17): 76-78.
[26] ZHANG Lina, YANG Liqun. Properties of auricularia auricula-judae β-D-glucan in dilute solution[J]. Biopolymers, 1995, 36(6): 695-700.
[27] WA NG Xiaohua, XU Xiaojuan, ZHANG Lina. Thermally induced conformation transition of triple-helical lentinan in NaCl aqueous solution[J]. The Journal of Physical Chemistry B, 2008, 112(33):10343-10351.
[28] RI NAUDO M. Non-covalent interactions in polysaccharide systems[J]. Macromolecular Bioscience, 2006, 6(8): 590-610.
[29] LAMBO-FODJE A M, LEEMAN M, WAHLUND K G, et al. Molar mass and rheological characterisation of an exopolysaccharide from Pediococcus damnosus 2.6[J]. Carbohydra te Polymers, 2007, 68(3):577-586.
[30] ZHANG M, CUI S W, CHEUNG P C K, et al. Antitumor polysaccharides from mus hrooms: a review on their isolation process,structural characteristics and antitumor activity[J]. Trends in Food Science & Technology, 2007, 18(1): 4-19.
[31] LI Hongbin, ZHANG Wenke, XU Weiqing, et al. Hy drogen bonding governs the elastic properties of poly (vinyl alcohol) in water:single-molecule force spectroscopic studies of PVA by AFM[J]. Macromolecules, 2000, 33(2): 465-469.
[32] PENG Yanfei, ZHANG Lina, ZENG Fanbo, et al. Structure and antitumor activities of the water-soluble polysaccharides from Ganoderma tsugae mycelium[J]. Carbohydra te Polymers, 2005, 59(3):385-392.
[33] WANG Xiaohua, ZHANG Yangyang, ZHANG Lina, et al. Multiple conformation transitio ns of triple helical lentinan in DMSO/Water by microcalorimetry[J]. The Journal of Physical Chemistry B, 2009,113(29): 9915-9923.
[34] CHEN Lei, ZHANG Bobo, CHEN Jialun, et al. Cell wall structure o f mushroom sclerotium (Pleurotus tuber-regium): Part 2. Fine structure of a novel alkali-soluble hyper-branched cell wall polysaccharide[J]. Food Hydrocolloids, 2014, 38: 48-55.
Observation of Exopolysaccharide S2 from Lactobacillus rhamnosus KF5 Using Atomic Force Microscopy
SHAO Li
1,2, WU Zhengjun
1, ZHANG Hao
2, CHEN Wei
2, GUO Benheng
1,2,*
(1. State Key Laboratory of Dairy Biotechnology, Technology Center of Bright Dairy and Food Co. Ltd., Shanghai 200436, China;2. School of Food Science and Technology, Jiangnan University, Wuxi 214122, China)
Abstract:S2, a high molecular weight fraction of exopolysaccharides (EPS), was purified from skim milk fermented by Lactobacillus rhamnosus KF5. The surface topography of EPS S2 in aqueous solution was observed using atomic force microscopy (AFM). The different topographic images of EPS S2 were obtained in aqueous solutions at different concentrations of polysaccharide. With a decrease in the concentration of polysaccharide solution, the interactions between polysaccharide molecules were weakened. The surface topography of S2 was changed from the spherical lump, island-shape, entangled network to one/two strand chains. At a concentration of 50 ng/mL, the polysaccharide molecules formed network structures, indicated that S2 had branched structure. When the concentration of S2 polysaccharide was 10 ng/mL, the polysaccharides existed as flexible chains,formed disordered random coils in water. This further proved that the random coil conformation of this molecule obtained from light scattering and viscometry experiments, according to the theory of dilute polymer solutions.
Key words:Lactobacillus rhamnosus; exopolysaccharides; atomic force microscopy (AFM); molecular morphology
中图分类号:Q539;TS201
文献标志码:A
文章编号:1002-6630(2015)13-0043-05
doi:10.7506/spkx1002-6630-201513009
收稿日期:2014-08-14
基金项目:国家高技术研究发展计划(863计划)项目(2011AA100901);“十二五”国家科技支撑计划项目(2013BAD18B01)
作者简介:邵丽(1980—),女,博士研究生,研究方向为食品生物技术。E-mail:teamo-lily@163.com
*通信作者:郭本恒(1963—),男,教授,博士,研究方向为乳品科学与技术。E-mail:gbhbrightdairy@hotmail.com