王 娟,闫祥林,周光宏,徐幸莲,张万刚*
(南京农业大学食品科技学院,肉品加工与质量控制教育部重点实验室,食品安全与营养协同创新中心,江苏 南京 210095)
摘 要:目的:比较梅山猪与三元杂交猪(杜洛克猪×长白猪×大白猪)的剪切力、肌内脂肪含量、μ-钙蛋白酶及蛋白降解的差异,分析影响梅山猪肉嫩度的因素。方法:选取6 头纯种梅山猪和6 头三元杂交猪,取背最长肌为实验材料,采用变性聚丙烯酰胺凝胶电泳和蛋白免疫印迹技术测定μ-钙蛋白酶在宰后45 min的降解和整联蛋白、伴肌动蛋白在宰后成熟1、3、7 d的降解情况。结果:梅山猪肉在宰后成熟1、3、7 d的剪切力值均显著低于三元杂交猪(P<0.05),在宰后成熟1 d的肌内脂肪含量显著高于三元杂交猪(P<0.05)。在宰后45 min,梅山猪的μ-钙蛋白酶的80 kD百分含量显著高于三元杂交猪,78 kD和76 kD百分含量显著低于三元杂交猪(P<0.05),梅山猪的μ-钙蛋白酶的自我降解程度较低,这与梅山猪的蛋白降解情况相一致。梅山猪的整联蛋白在成熟3 d的相对光密度值显著高于三元杂交猪(P<0.05),宰后成熟3 d和7 d的降解率显著低于三元杂交猪(P<0.05),伴肌动蛋白在成熟1 d和3 d的相对光密度值显著高于三元杂交猪(P<0.05)。结论:梅山猪的整联蛋白和伴肌动蛋白降解较少,这与μ-钙蛋白酶的降解有关,而μ-钙蛋白酶和蛋白降解对梅山猪肉的嫩度影响不大,梅山猪肉相对较高的肌内脂肪含量解释了其较高的嫩度。
关键词:梅山猪;μ-钙蛋白酶;整联蛋白;伴肌动蛋白
嫩度是评价肉食用品质的一个重要指标,成熟是改善嫩度的有效途径之一。在宰后成熟过程中,胴体僵直解除、肌肉变软,肌肉的嫩度和系水力都得到很大改善 [1]。影响肌肉嫩度的因素主要有品种、年龄、脂肪含量、肌肉部位等,而这些影响嫩度的因素归根结底都是因为影响了肌肉的基本组织结构,即肌原纤维和结缔组织的结构和生化特性,从而导致肌肉的嫩度存在差异 [2]。目前普遍认为成熟过程中嫩度的改善是由于肌原纤维蛋白在Z线附近发生断裂从而破坏肌肉细胞结构的完整性,特别是一些细胞骨架蛋白的降解(如肌间线蛋白和整联蛋白),减少了肌细胞间的收缩同时增加了肌细胞间的膨胀,改善了肌肉的嫩度和持水力 [3]。整联蛋白是一种介导细胞及其外环境之间的跨膜蛋白,是一种由α、β两个亚基组成的异二聚体。整联蛋白的β 1亚基的降解增加了滴水通道的形成,对猪肉的持水力和嫩度具有一定的影响 [4]。伴肌动蛋白是存在于骨骼肌中的分子量较大的结构蛋白,其C端部分地和Z线中的α-肌动蛋白结合,N端延伸到细肌丝的末端,从而将细肌丝固定在Z线上。正是由于伴肌动蛋白在Z线上与细丝之间的连接作用,伴肌动蛋白的降解会改变肌细胞的结构 [5]。
钙蛋白酶是作用于这些细胞骨架蛋白的主要酶类,主要包括μ-钙蛋白酶和m-钙蛋白酶。μ-钙蛋白酶由80 kD的催化亚基和28 kD的调节亚基构成,它们在钙离子的存在下发生自溶 [6]。在猪肉成熟过程中,80 kD的催化亚基通过78 kD的中间状态降解为76 kD产物 [7],催化主要细胞骨架蛋白的降解,改善肌肉的嫩度和持水性。研究表明牦牛在宰后成熟过程中,肌肉的μ-钙蛋白酶的活力与剪切力呈正相关 [8],樱桃谷鸭在宰后成熟过程中的钙蛋白酶活力与肌肉的剪切力呈极显著正相关 [9],因此,钙蛋白酶的活力对肌肉的嫩度具有一定的影响。
近年来,我国地方猪种生产的梅山猪肉因其肉质细嫩味美、肥而不腻等优点逐渐受到消费者的青睐。Ellis等 [10]报道指出梅山猪肉的剪切力比三元杂交猪低。然而关于我国梅山猪肉嫩度以及可能影响嫩度的因素研究较少。本实验选取我国地方猪种梅山猪和国内主要养殖的三元杂交猪(杜洛克猪×长白猪×大白猪)为研究对象,采用变性聚丙烯酰胺凝胶电泳和免疫印迹技术比较两猪种在宰后成熟过程中μ-钙蛋白酶及整联蛋白和伴肌动蛋白降解的差异,分析可能影响梅山猪肉嫩度的因素。
1.1 材料与试剂
实验分别选取了6 头达到出栏日龄的公梅山猪和公三元杂交猪为研究对象。梅山猪由江苏常州金坛永康农牧科技有限公司提供,三元杂交猪由江苏淮安苏食屠宰场提供,两公司的饲养模式和屠宰方式一致。宰后45 min,取下胴体左侧背最长肌于包装袋内,平放于桌面,在4 ℃冷库中冷藏,自然成熟24 h。
二喹啉甲酸(bicinchoninic acid,BCA)蛋白检测试剂盒、酶放大化学发光免疫分析(electrochemi-luminescence,ECL)试剂盒 美国赛默飞世尔科技公司;鼠抗-μ钙蛋白酶单克隆抗体(MA3-940) 美国亲和生物试剂公司;鼠抗-整联蛋白单克隆抗体(ab30388)、HRP酶标记的羊抗鼠免疫球蛋白(ab6789) 英国Abcam公司;聚偏氟乙烯(polyvinylidene fluoride,PVDF)转移膜 美国Millipore公司;其他相关试剂均为分析纯级。
1.2 仪器与设备
C-LM3B型数显式肌肉嫩度仪 东北农业大学工程学院;Ultra Turrax T25 BASIS型高速匀浆机 德国IKA公司;XDDC-2006型旋蒸发生器 上海亚荣生化仪器厂;U410型超低温冰箱 日本日立公司;HANNA211型pH计 意大利Hanna公司;Avanti J-E型落地式高速冷冻离心机、Spectramax M2型酶标仪 美国Beckman Coulter公司;AUY120型电子分析天平 日本Shimadzu公司;Mini-Protean system型电泳和印记转运系统 美国Bio-Rad公司;ImageQuant LAS4000型凝胶成像系统美国GE公司。
1.3 方法
1.3.1 嫩度的测定
肌肉嫩度的测定参考王晓宇等 [11]方法并稍作修改。肌肉在宰后排酸24 h后,剔除肉样表面的肌膜和脂肪,并将肉样均匀的切成2 cm×3 cm×5 cm大小的肉块。每头猪的背最长肌切出3 块。将肉块放入蒸煮袋内,在72 ℃水浴锅中加热到肉样中心温度为70 ℃(用热电偶记录中心温度变化)并保持稳定,流水冷却至室温,然后用吸水纸将肉样表面的汁液吸干。修整肉样的边缘并找出肌纤维的自然走向,使用双面刀(间距1 cm)沿肌纤维的平行方向将肉块切成多个1 cm厚的小块,再次用该双面刀沿肌纤维走向将1 cm厚的小块切成1 cm宽的肉柱,每个肉块选取5 个切的较好的肉柱进行剪切力值的测定。
将切好的肉柱置于肌肉嫩度仪内,使肉柱的肌纤维走向与嫩度仪内的刀面方向垂直,测定肌肉的剪切力(剪切速率:5 mm/s),记录剪切力值,并计算平均值。
1.3.2 肌内脂肪含量的测定
肌内脂肪含量的测定参照Folch等 [12]方法并稍作修改。准确称取4 g肉样于微型绞肉机中绞碎,并将绞碎肉样置于80 mL离心管中,加入30 mL氯仿-甲醇(2∶1,V/V)溶液,在冰浴条件下进行匀浆,6 000 r/min匀浆2 次,每次20 s。然后加入30 mL相同体积比的氯仿-甲醇溶液,在通风橱内静置1 h。静置结束,使用中速滤纸过滤溶液,将滤液转移至离心管中,加入0.2 倍体积的生理盐水并充分振荡均匀。然后在4 ℃、3 000 r/min离心15 min,取下层有机相,于40 ℃左右条件下进行旋蒸。旋蒸前,称取旋蒸瓶的质量。当旋蒸瓶内出现油滴状物质且冷凝管内不再滴水结束旋蒸。旋蒸结束后,再次称取旋蒸瓶质量。旋蒸瓶内多出的液体为肌肉的肌内脂肪。
1.3.3 样品的制备与处理
参考Lonergan等 [13]方法并稍作修改。称取约0.5 g去除结缔组织的肉样,剪碎后,加入6 倍体积的裂解缓冲液(10 mmol/L磷酸钠,2 g/100 mL十二烷基硫酸钠(sodium dodecyl sulfate,SDS),pH 7.0),在低温条件下14 000×g匀浆30 s,每15 s间隔20 s。然后在4 ℃、16 000×g离心30 min。离心后,取上清,用BCA蛋白试剂盒测定蛋白浓度。然后将每头猪的蛋白样品分别与样品处理液(3 mmol/L乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA),3 g/100 mL SDS,30 g/100 mL甘氨酸,30 mmol/L Tris-HCl,0.001 g/100 mL溴酚蓝,pH 8.0)按体积比1∶1混合,使其最终质量浓度调为4 mg/mL。充分混匀后,在50 ℃水浴锅中加热20 min。分装后,放于-80 ℃冰箱备用。
1.3.4 变性聚丙烯酰胺凝胶电泳
根据蛋白质分子质量的大小采用不同质量浓度的凝胶电泳。大分子蛋白-伴肌动蛋白采用5 g/100 mL的连续变性电泳(丙烯酰胺、甲叉双丙烯酰胺质量比100∶1,200 mmol/L Tris-HCl,0.1 g/100 mL SDS,0.067% N,N,N',N'-四甲基二乙胺(N,N,N',N'-tetramethylethylenediamine,TEMED),0.1 g/100 mL过硫酸铵,pH 8.0)。整联蛋白和μ-钙蛋白酶采用10 g/100 mL的分离胶(丙烯酰胺、甲叉双丙烯酰胺质量比37.5∶1,0.5 mol/L Tris-HCl pH 8.8,0.05 g/100 mL TEMED,0.05 g/100 mL过硫酸铵,0.1 g/100 mL SDS)和4 g/100 mL的浓缩胶(丙烯酰胺、甲叉双丙烯酰胺质量比37.5∶1,125 mmol/L Tris-HCl pH 8.8,0.05 g/100 mL TEMED,0.05 g/100 mL过硫酸铵,0.1 g/100 mL SDS)。电泳缓冲液含有25 mmol/L Tris,192 mmol/L甘氨酸和0.1 g/100 mL SDS。上样量分别为:5 g/100 mL连续胶80 μg,μ-钙蛋白酶60 μg,整联蛋白80 μg。电泳开始前,选取某一固定样品作为标准样品,每块胶都加入标准样品,从而消除跑电泳时由于不同的胶带来的误差。电泳结束后,5 g/100 mL连续胶采用胶体考染法 [14]进行染色,然后进行脱色,拍照。μ-钙蛋白酶和伴肌动蛋白的胶进行转印。
1.3.5 免疫印迹
电泳结束后,采用湿法转印将胶上的蛋白转移到PVDF膜上,在恒压90 V低温条件下转印90 min。转印液含有20 mmol/L Tris-HCl,192 mmol/L甘氨酸和体积分数15%甲醇。转印结束后,将PVDF膜放入含有5 g/100 mL脱脂奶粉的三羟甲基氨基甲烷-吐温缓冲液(Trisbuffered saline and tween 20,TBST)(500 mmol/L NaCl,0.05 mL/100 mL吐温-20,30 mmol/L Tris-HCl,pH 7.5)中,在室温条件下封闭90 min。然后分别用鼠抗-μ钙蛋白酶单克隆抗体(1∶10 000,V/V)和鼠抗-整联蛋白单克隆抗体(1∶3 500,V/V)在4 ℃条件下反应过夜(14 h)。一抗结束后,用TBST溶液漂洗PVDF膜3 次,10 min/次,洗脱与蛋白非特异性结合的一抗。之后将PVDF膜放入含有HRP酶标记的羊抗鼠免疫球蛋白溶液中反应90 min,使一抗与二抗结合。在TBST溶液中漂洗3 次,10 min/次。最后,使用ECL发光试剂盒在凝胶成像仪上拍照,使用Quantity One分析软件对蛋白免疫印迹条带光密度值进行半定量分析并计算蛋白降解率(即相对宰后成熟1 d蛋白相对光密度值的变化百分比)。
1.4 统计分析
使用SPSS18.0统计软件进行独立性t检验和Pearson's相关系数进行相关性分析,显著水平为P<0.05。用Origin 8.0和Microsoft Office 2007进行图表的绘制和相关数据的处理,实验数据以
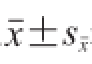 表示。
表示。
2.1 嫩度和肌内脂肪含量的比较
表1 梅山猪和三元杂交猪剪切力值和肌内脂肪含量的比较
Table1 Compar i son of shear force and intramuscular fat content between Meishan and crossbred pigs
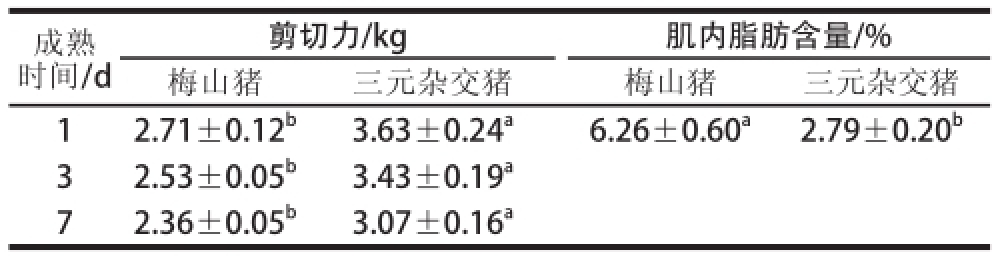
注:同一指标同行肩标不同字母表示差异显著(P<0.05)。下同。
剪切力/kg肌内脂肪含量/%梅山猪三元杂交猪梅山猪三元杂交猪12.71±0.12 b3.63±0.24 a6.26±0.60 a2.79±0.20 b32.53±0.05 b3.43±0.19 a72.36±0.05 b3.07±0.16 a成熟时间/d
梅山猪和三元杂交猪的剪切力值和肌内脂肪含量见表1。梅山猪在宰后成熟1、3、7 d的剪切力均显著低于三元杂交猪(P<0.05),宰后成熟1 d的肌内脂肪含量显著高于三元杂交猪(P<0.05)。在肌肉嫩度的研究中,国内外通用肌肉剪切力值的大小来直观反映肉的嫩度,因此相比于三元杂交猪,梅山猪肉更嫩。这与Ellis等 [10]研究结果一致,他们指出梅山猪的剪切力值低于大白猪。同时,刘顺德等 [15]也表明梅山猪的剪切力值低于杜洛克猪、长白猪和约克夏猪。梅山猪相对较低的剪切力值可能与肌肉的肌纤维类型以及粗细、长短有关 [16]。较高的肌内脂肪含量对肌肉的嫩度也有一定的改善作用 [17]。肌内脂肪通过三方面改善肌肉的嫩度:一是肌内脂肪切断了肌纤维束间的结构;二是肌内脂肪有利于咀嚼过程中肌纤维的断裂;三是肌内脂肪含量高,水分含量相对减少,失水率相对降低,表现为肌肉的多汁性,对肌肉的嫩度具有一定的改善作用 [15]。因此,梅山猪肉中相对较高的肌内脂肪含量在一定程度上可以解释肌肉较高的嫩度。
2.2 μ-钙蛋白酶的降解

图1 宰后45 min梅山猪和三元杂交猪μ-钙蛋白酶的免疫印迹图谱
Fig.1 Western blotting of μ-calpain at 45 min postmortem for Meishan and crossbred pigs
由图1可知,在宰后过程中,三元杂交猪的μ-钙蛋白酶有一定的降解,在80 kD条带的下面有78 kD和76 kD两条降解条带,而梅山猪的μ-钙蛋白酶降解较少。由表2可知,梅山猪的μ-钙蛋白酶的80 kD相对百分含量显著高于三元杂交猪(P<0.05),78 kD和76 kD的相对百分含量显著低于三元杂交猪(P<0.05)。μ-钙蛋白酶由80 kD降解为78 kD和76 kD的过程被认为是μ-钙蛋白酶具有活性的标志 [18]。梅山猪肉中相对较少的76 kD相对百分含量说明梅山猪的μ-钙蛋白酶降解较少,活性较低。在宰后成熟过程中,μ-钙蛋白酶对蛋白降解有一定的影响 [19-20]。因此,梅山猪肉中μ-钙蛋白酶的76 kD相对百分含量低于三元杂交猪,预示着梅山猪肉在成熟过程中将有较少的蛋白降解。
表2 梅山猪和三元杂交猪μ--钙蛋白酶在宰后45 min降解情况的比较
Table2 Comparison off μ-calpain degradation at 45 min postmortem between Meishan and crossbred pigs
%
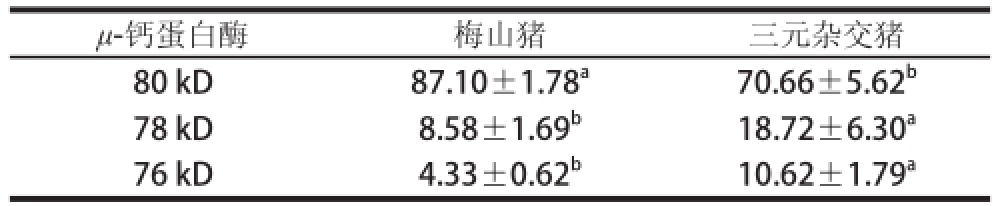
注:表中数据为条带的光密度值在总(80 kD+78 kD+76 kD)光密度值中所占的百分比。
μ-钙蛋白酶梅山猪三元杂交猪80 kD87.10±1.78 a70.66±5.62 b78 kD8.58±1.69 b18.72±6.30 a76 kD4.33±0.62 b10.62±1.79 a
2.3 整联蛋白和伴肌动蛋白的降解
通过免疫印迹技术比较梅山猪和三元杂交猪在宰后成熟1、3、7 d整联蛋白的降解情况。由图2可知,在宰后成熟过程中,三元杂交猪的整联蛋白有一定的降解,而梅山猪降解的较少。从表3可以看出,梅山猪在宰后成熟第3天的相对光密度值显著高于三元杂交猪,在宰后成熟第3天和第7天的降解率显著低于三元杂交猪(P<0.05),这表明三元杂交猪的整联蛋白的降解程度高于梅山猪。这与μ-钙蛋白酶的结果相一致,μ-钙蛋白酶活性的降低减少了整联蛋白的降解,从而影响滴水通道的形成 [21]。整联蛋白的降解改变了肌纤维内水分的流动 [22]。Zhang Wangang等 [7]等研究表明,宰后成熟1 d的整联蛋白与宰后1 d的滴水损失呈正相关,整联蛋白减少了胞内水分流向胞外,从而改善了肌肉的保水性和嫩度。
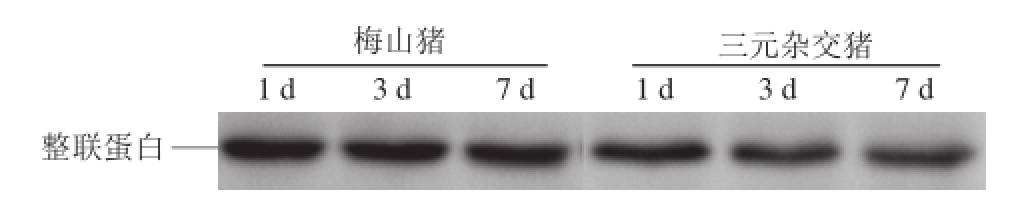
图2 梅山猪和三元杂交猪肉在成熟1、3、7 d整联蛋白的免疫印迹图谱
Fig.2 Western blotting analysis of integrin at 1, 3 and 7 d of postmortem aging of Meishan and crossbred pork
表3 整联蛋白和伴肌动蛋白的降解分析
Table 3 Analysis of integrin and nebulin degradation in Meishan and crossbred pork
注:表中蛋白的相对光密度值是相对标准蛋白质样品的光密度值的比值;ND.在检测水平以下。
蛋白成熟时间/d相对光密度值蛋白降解率/%梅山猪三元杂交猪梅山猪三元杂交猪整联蛋白11.10±0.031.04±0.01 31.05±0.35 a0.87±0.04 b4.76±1.40 b15.10±1.94 a70.94±0.030.79±0.0312.61±3.74 b22.23±4.45 a11.20±0.04 a0. 49±0.03 b30.43±0.02 a0.14±0.01 b0.64±0.010.71±0.01 7NDNDNDND伴肌动蛋白
由图3可知,在宰后成熟过程中,每个样品的伴肌动蛋白均有一定的降解,而且三元杂交猪在宰后成熟第3天,几乎看不到伴肌动蛋白。从表3可以看出,在宰后成熟第1天,梅山猪与三元杂交猪的伴肌动蛋白的相对光密度值差异显著(P<0.05),在宰后成熟第3天,梅山猪的伴肌动蛋白相对光密度值显著高于三元杂交猪(P<0.05)。在宰后成熟第7天,伴肌动蛋白的相对光密度值在检测水平以下。Huff-Lonergan等 [23]研究表明伴肌动蛋白在宰后成熟过程中逐渐发生降解,且在宰后成熟第3天检测不到伴肌动蛋白。在宰后的样品中加入μ-钙蛋白酶和氯化钙在4 ℃条件下进行孵育,伴肌动蛋白比未加μ-钙蛋白酶孵育条件下降解的多 [23]。这与本结果相一致,较快的钙蛋白酶降解促进伴肌动蛋白的降解。因此μ-钙蛋白酶对于伴肌动蛋白的降解起到重要作用。Wu等 [24]研究表明伴肌球蛋白、伴肌动蛋白等大细胞骨架蛋白的降解有助于改善肌肉的嫩度,伴肌动蛋白与剪切力值呈显著正相关。对于梅山猪和三元杂交猪这两个不同的猪种而言,梅山猪的剪切力值低于三元杂交猪,而伴肌动蛋白的降解少于三元杂交猪,这说明伴肌动蛋白的降解和μ-钙蛋白酶不是使梅山猪肉的嫩度高于三元杂交猪的主要原因。
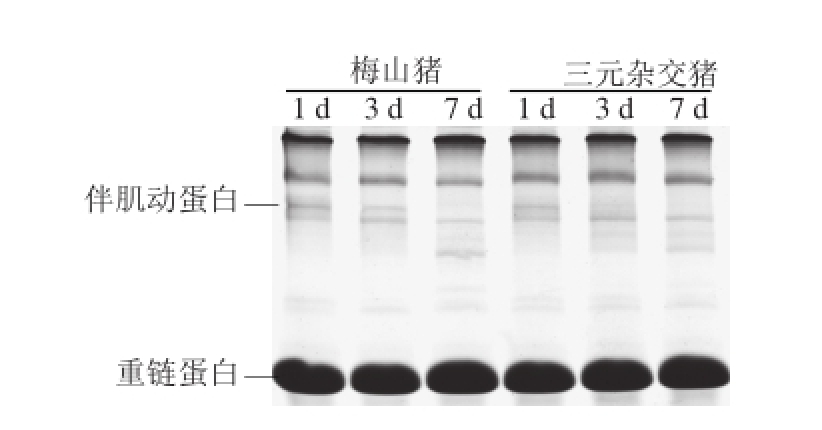
图3 伴肌动蛋白降解的连续变性聚丙烯酰胺凝胶电泳图谱
Fig.3 Sodiumdodecyl sulfate PAGE profiles of nebulin degradation
2.4 相关性分析
表4 剪切力、肌内脂肪含量、μ-钙蛋白酶、整联蛋白和伴肌动蛋白的相关性分析
Table4 Correlation among shear force, intramuscular fat, -calpain,integrin and nebulin

注:*.显著相关,P<0.05;**.极显著相关,P<0.01。
3 d伴肌动蛋白光密度值剪切力-0.825**0.4270.506-0.510肌内脂肪含量-0.545-0.708*0.580 μ-钙蛋白酶(76 kD)光密度值 0.677-0.894** 3 d整联蛋白降解率-0.858**指标肌内脂肪含量μ-钙蛋白酶(76 kD)光密度值3 d整联蛋白降解率
由表4可知,肌肉的剪切力值与肌内脂肪含量呈极显著负相关(r=-0.825),这说明肌内脂肪含量对肌肉的剪切力值具有一定的影响,对猪肉的嫩度具有一定的改善作用。肌内脂肪含量通过切断肌纤维束间的交联结构,有利于肌纤维的断裂,从而增加了肌肉的嫩度。μ-钙蛋白酶的活性与剪切力值没有显著相关性(r=0.427),整联蛋白和伴肌动蛋白与剪切力值也没有显著相关性(r=0.506,r=-0.510)。这说明μ-钙蛋白酶,整联蛋白和伴肌动蛋白的降解对不同猪种的嫩度的影响不大,不同猪种的嫩度的差异可能是有其自身肌内脂肪含量等各种因素作用的结果。尽管Veiseth等 [25]指出羊的背最长肌的嫩度与宰后成熟过程中的蛋白水解和肌肉的肌节长度有关。而对于梅山猪和三元杂交猪这两个不同的猪种而言,μ-钙蛋白酶和蛋白的降解不是起主要作用。μ-钙蛋白酶的76 kD产物与伴肌动蛋白呈极显著负相关(r=-0.894),这说明μ-钙蛋白酶的降解影响伴肌动蛋白的降解。
与三元杂交猪相比,梅山猪肉的剪切力值较低,嫩度较高。肌内脂肪含量通过切断肌纤维束间的结构从而对肌肉的嫩度具有一定的改善作用。梅山猪相对较高的肌内脂肪含量在一定程度上解释了其具有较高嫩度的原因。梅山猪的μ-钙蛋白酶的降解程度比三元杂交猪小,这与整联蛋白和伴肌动蛋白的降解程度相一致。较高的的μ-钙蛋白酶活性会促进细胞骨架蛋白的降解。细胞骨架蛋白的降解会破坏肌纤维的结构,提高肌肉的嫩度。而对于梅山猪和三元杂交猪而言,剪切力值只与肌内脂肪含量有一定的相关性,与μ-钙蛋白酶和蛋白降解的相关性不大。这说明,对于梅山猪和三元杂交猪这两个不同的猪种,其自身的肌内脂肪含量对肌肉嫩度具有一定的影响,μ-钙蛋白酶和蛋白降解对肌肉嫩度的影响不大。
参考文献:
[1] 周光宏, 罗欣, 徐幸莲, 等. 肉品加工学[M]. 北京: 中国农业大学出版社, 2008: 130-132.
[2] 汤晓艳, 周光宏, 徐幸莲, 等. 肉嫩度决定因子及牛肉嫩化技术研究进展[J]. 中国农业科学, 2007, 40(12): 2835-2841.
[3] PEARCE K L, ROSENVOLD K, ANDERSEN H J, et al. Water distribution and mobility in meat during the conversion of muscle to meat and ageing and the impacts on fresh meat quality att ributes: a review[J]. Meat Science, 2011, 89(2): 111-124.
[4] GOLL D E, THOMPSON V F, LI H, et al. The calpain system[J]. Physiological Reviews, 2003, 83(3): 731-801.
[5] HUFF-LONERGAN E, ZHANG W, L ONERGAN S M. Biochemistry of postmortem muscle: lessons on mechanisms of meat tenderization[J]. Meat Science, 2010, 86(1): 184-195.
[6] CRUZEN S M, PAULINO P V, LONERGAN S M, et al. Postmortem proteolysis in three muscles from growing and ma ture beef cattle[J]. Meat Science, 2014, 96(2): 854-861.
[7] ZHANG Wangang, LONERGAN S M, GARDNER M A, et al. Con tribution of postmortem changes of integrin, desmin and μ-calpain to variation in water holding capacity of pork[J]. Meat Science, 2006,74(3): 578-585.
[8] 师希雄, 余群力, 党欣. 宰后牦牛肉成熟过程中钙激活酶与嫩度指标的相关性分析[J]. 肉类研究, 2013, 27(6): 1-4.
[9] 邓方, 潘道东, 曹锦轩, 等. 不同日龄及宰后成熟对樱桃谷鸭嫩度的影响[J]. 中国食品学报, 2013, 13(6): 167-174.
[10] ELLIS M, LYMPANY C, HAL EY C, et al. The eating quality of pork from Meishan and Large White pigs and their reciprocal crosses[J]. Animal Science, 1995, 60(1): 125-131.
[11] 王晓宇, 周光宏, 徐幸莲, 等. 猪肉剪切力的测定方法[J]. 食品科学,2012, 33(21): 64- 67.
[12] FOLCH J, LEES M, SLOANE-STANLEY G. A simple method for the isolation and purification of total lipid s from animal tissues[J]. Journal of Biological Chemistry, 1957, 226(1): 497-509.
[13] LONERGAN S, HUFF-LONER GAN E, ROWE L, et al. Selection for lean growth efficiency in Duroc pigs influences pork quality[J]. Journal of Animal Science, 2001, 79(8): 2075-2085.
[14] CANDIANO G, BRUS CHI M, MUSANTE L, et al. Blue silver: a very sensitive colloidal Coomassie G-250 staining for proteome analysis[J]. Electrophoresis, 2004, 25(9): 1327-1333.
[15] 刘顺德, 刘孟洲, 王玉涛, 等. 宁夏几个主要品种猪背最长肌组织学特性的研究[J]. 农业科学研究, 2006, 27(2): 33-37.
[16] 郭明星. 肉的嫩度与烹饪致嫩[J]. 中国烹饪研究, 1998, 15(3): 50-55.
[17] van LAACK R, STEVENS S, STALDER K. The influence of ultimate pH and intramuscular fat content on pork tenderness and tenderization[J]. Journal of Animal Science, 20 01, 79(2): 392-397.
[18] GEESINK G, KUCHAY S, CHISHTI A, et al. μ-Calpain is essential for postmortem proteolysis of muscle proteins[J]. Journal of Animal Science, 2006, 84(10): 2834-2840.
[19] MELODY J, LONERGAN S, ROWE L, et al. Early postmortem biochemical factors influence tenderness and water-holding capacity of three porcine muscles[J]. Journal of Animal Science, 2004, 82(4):1195-1205.
[20] KOOHMARAIE M, GEESINK G. Contribution of postmortem muscle biochemistry to the delivery of consistent meat quality with particular focus on the calpai n system[J]. Meat Science, 2006, 74(1): 34-43.
[21] LAWSON M A. The role of integrin degradation in post-mortem drip loss in pork[J]. Meat Science, 2004, 68(4): 559-566.
[22] STRAADT I K, RASMUSSEN M, YOUNG J F, et al. Any link between integrin degradation and water-holding capacity in pork?[J]. Meat Science, 2008, 80(3): 722-727.
[23] HUFF-LONERGAN E, MITSUHASHI T, BEEKMAN D D, et al. Proteolysis of specific muscle structural proteins by mu-calpain at low pH and temperature is similar to degradation in postmortem bovine muscle[J]. Journal of Animal Science, 1996, 74(5): 9 93-1008.
[24] WU G, FAROUK M, CLERENS S, et al. Effect of beef ultimate pH and large structural protein changes with aging on meat tenderness[J]. Meat Science, 2014, 98(4): 637-645.
[25] VEISETH E, SHACKELFORD S, WHEELER T, et al. Factors regulating lamb longissimus tenderness are affe cted by age at slaughter[J]. Meat Science, 2004, 68(4): 635-640.
Effect of Intramuscular Fat Content, μ-Calpain and Protein Degradation on Pork Tenderness: a Comparative Study between Meishan and Three-Crossbred Pigs
WANG Juan, YAN Xianglin, ZHOU Guanghong, XU Xinglian, ZHANG Wangang*
(Key Laboratory of Meat Processing and Quality Control, Ministry of Education, Synergetic Innovation Center of Food Safety and Nutrition, College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Abstract:Objective: To compare the difference in shear force, intramuscular fat content, μ-calpain and protein degradation between Meishan and crossbred pigs in order to explore the factors contributing to the tenderness of Meishan pork. Methods:Six purebred Meishan pigs and six crossbred pigs (Duroc × Landrace × Yorkshire) were slaughtered. μ-Calpain at 45 min postmortem, integrin and nebulin degradation at 1, 3 and 7 d of postmortem aging were determined by polyacrylamide gel electrophoresis (PAGE) and western blotting. Results: Meishan pork presented lower shear force and higher intramuscular fat content compared to crossbred pork (P < 0.05). At 45 min postmortem, crossbred pork presented enhanced degradation of μ-calpain, as evidenced by significantly lower proportions of 80 kD fragments and significantly higher proportions of 78 kD and 76 kD fragments percentage compared to Meishan pork (P < 0.05). Lessened degradation of μ-calpain in Meishan pork at 45 min postmortem potentially forecasted that Meishan pork could have lower protein degradation during the subsequent aging time. The degree of integrin degradation was lower in Meishan pork compared to crossbred pork at 3 and 7 d of postmortem aging. Additionally, the relative optical density of nebulin was lower in Meishan pork compared to crossbred pork at 1 and 3 d of postmortem aging, which represents lower degradation of nebulin. Conclusion: μ-calpain and protein degradation may not be key factors contributing to the higher tenderness of Meishan pork, while the higher intramuscular fat content may help explain the lower shear force in Meishan pork.
Key words:Meishan pig; μ-calpain; integrin; nebulin
中图分类号:TS251.1
文献标志码:A
文章编号:1002-6630(2015)13-0052-05
doi:10.7506/spkx1002-6630-201513011
收稿日期:2014-09-02
基金项目:“十二五”国家科技支撑计划项目(2012BAD28B03)
作者简介:王娟(1991—),女,硕士研究生,研究方向为肉品质量安全控制。E-mail:wangjuan0322@163.com
*通信作者:张万刚(1977—),男,教授,博士,研究方向为畜产品加工与质量控制。E-mail:wangang.zhang@yahoo.com