刘露露,曹 慧*,徐 斐,于劲松,袁 敏
(上海理工大学医疗器械与食品学院,上海 200093)
摘 要:以水解度为指标,优化了中性蛋白酶酶解鸡胸软骨Ⅱ 型胶原的条件,在此基础上制备不同水解度Ⅱ型胶原酶解复合物,并以淋巴细胞增殖率为指标对其免疫活性进行研究。结果表明,中性蛋白酶的酶解能力最强,其最佳酶解条件为:酶解温度50 ℃、pH 7.5、底物质量浓度25 mg/mL、加酶量40 U/mg、酶解时间150 min。当Ⅱ型胶原在水解度为18%时,其对淋巴细胞的增殖活性达到58.69%。Ⅱ型胶原酶解复合物的质量浓度对淋巴细胞的增殖率也有显著影响,当其质量浓度达到1 mg/mL时,对淋巴细胞增殖能力达到最大。免疫活性较高的Ⅱ型胶原酶解复合物的分子质量主要分布于1 000~180 D范围内,占其总含量的75.21%。
关键词:Ⅱ型胶原;免疫活性肽;中性蛋白酶;淋巴细胞增殖活性
Ⅱ型胶原免疫活性肽是指以Ⅱ型胶原为原料制备的对机体的免疫功能具有生理调节作用的肽类化合物 [1-2]。它能够刺激淋巴细胞增殖,增强巨噬细胞的吞噬能力,而且不会引起机体的免疫排斥反应 [3]。近年来研究发现,类风湿性关节炎的发病与Ⅱ型胶原的自身免疫反应有关,通过口服Ⅱ型胶原来诱导免疫耐受对类风湿性关节炎具有显著防治作用 [4-6]。进一步研究显示,Ⅱ型胶原中的免疫活性肽能与人类的白细胞抗原HLA-DR4相结合,形成的复合物再经分泌途径呈现于抗原递呈细胞(antigen processing cells,APCs)细胞表面,供受体特异性T细胞表面受体(T cell receptor,TCR)所识别,进一步结合成TCR-HLA/DR4-抗原肽三分子复合体,T细胞被活化、增殖并分泌各种免疫因子而启动免疫应答 [7-12]。因而,本实验以鸡胸软骨Ⅱ型胶原为原料,采用酶法制备Ⅱ型胶原免疫活性肽,并对其免疫活性进行了研究,以期为免疫活性肽的开发提供理论依据。
1.1 材料与试剂
Ⅱ型胶原 上海理工大学医疗器械与食品学院资源综合利用实验室自制 [13]。
中性蛋白酶、碱性蛋白酶、木瓜蛋白酶 江苏锐阳生物科技有限公司;胰蛋白酶、胃蛋白酶 国药集团化学试剂有限公司;淋巴细胞 上海拜力生物科技有限公司。
1.2 仪器与设备
BX41显微镜 奥林巴斯有限公司;TLID-2005袖珍型低温恒温槽 宁波天恒仪器厂;UV-6000 PC紫外-可见分光光度计 上海元析仪器有限公司;Biocell ht2酶标仪 郑州博赛生物工程有限公司。
1.3 方法
1.3.1 不同蛋白酶酶解Ⅱ型胶原条件的优化
将制备的鸡胸软骨Ⅱ型胶原 [13]溶解于双蒸水中,并配制成一定质量浓度的溶液,置于酶反应器中,调节反应所需的温度和pH值,然后向其中加入不同蛋白酶,使其在各自最适的条件下进行酶解。于酶解过程中,不断向反应体系中加入0.5 mol/L的氢氧化钠维持其所需pH值,并记录碱液消耗量,酶解一定时间后,沸水浴中灭酶10 min,终止酶解反应。根据反应过程中消耗的碱量及水解度计算公式可计算出不同蛋白酶对Ⅱ型胶原的水解度 [14-15]。
式中:V为NaOH标准溶液体积/mL;c为NaOH标准溶液浓度/(mol/L);α为氨基离解度;m为底物中蛋白质总量/g;h tot为底物蛋白质肽键总数/(mmol/g)。
在最优水解酶的基础上考察酶解温度(40、50、60 ℃)、pH值(6.5、7、7.5)、底物质量浓度(20、25、30 mg/mL)、加酶量(20、30、40 U/mg)及酶解时间(0~300 min)对中性蛋白酶酶解Ⅱ型胶原能力的影响。
1.3.2 不同水解度Ⅱ型胶原酶解物的制备
取一定量的鸡胸软骨Ⅱ型胶原 [13],用双蒸水配制成25 mg/mL的溶液,放置在酶反应器中,根据1.3.1节中的反应条件进行酶解。达到一定的水解度后立即取出,沸水浴灭酶活10 min。冷冻干燥得到固体样品,贮藏于4 ℃备用。
1.3.3 不同水解度Ⅱ型胶原免疫活性的测定
于96 孔培养板中加入100 μL小鼠脾淋巴细胞悬液(1×10 6~2×10 6mL),再各加入100 μL不同水解度Ⅱ型胶原样品,混匀后,置37 ℃、5% CO 2培养箱中培养68 h。在无菌的条件下向每孔加入10 μL噻唑蓝(methyl thiazolyl tetrazolium,MTT),混匀,继续培养4 h,再向每孔加入100 μL二甲基亚砜,室温下放置10 min。采用酶联免疫检测仪于570 nm波长处测定吸光度,以培养液作为对照。
式中:A 对照为对照组样品在570 nm波长处的吸光度;A 实验为各样品在570 nm波长处的吸光度。
1.3.4 不同水解度Ⅱ型胶原酶解物分子质量分布的测定采用高效凝胶过滤色谱法测定Ⅱ型胶原酶解复合物分子质量的分布情况。色谱条件:色谱柱:TSKgel 2000 SWXL(300 mm×7.8 mm);流动相:乙腈-水-三氟乙酸(40∶60∶0.1,V/V);检测:UV220 nm;流速:0.5 mL/min;柱温:30 ℃。上柱样品制备:分别称取适量分子质量标样和样品溶于10 mL容量瓶中,用流动相稀释至刻度,微孔滤膜过滤后进样。凝胶过滤色谱柱分子质量标准:细胞色素C(M w12 500)、杆菌酶(M w1 450)、乙氨酸-乙氨酸-酪氨酸-精氨酸(M w451)及乙氨酸-乙氨酸-乙氨酸(M w189)。
1.4 统计分析
以上指标测定重复3 次,数据用3 次平均值表示,采用SPSS 17.0软件进行统计分析。
2.1 不同蛋白酶对Ⅱ型胶原蛋白酶解能力的比较
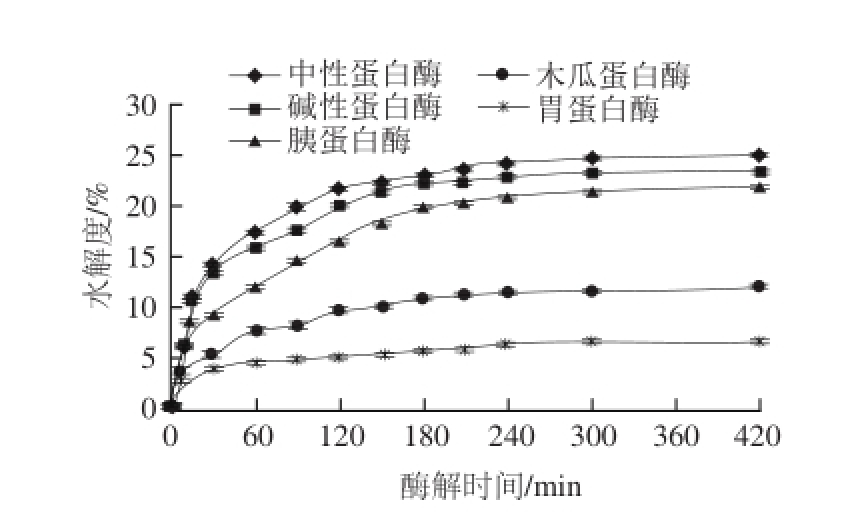
图1 不同蛋白酶酶解Ⅱ型胶原的动力学曲线
Fig.1 Hydrolysis curves for type II collagen with different proteases
以水解度为指标比较了几种蛋白酶在相同加酶量(30 U/mg)以及各自最适条件下对胶原蛋白的酶解效果,如图1所示。中性蛋白酶在最适酶解条件下,对Ⅱ型胶原水解度显著高于其他酶类(P<0.01)。中性蛋白酶能最大程度地酶解胶原蛋白,其水解度为25.10%。这可能因为中性蛋白酶来源于枯草芽孢杆菌,可裂解蛋白质中的Tyr、Trp、Phe等氨基酸的肽键,是温和的蛋白质水解内切酶,对很多蛋白质和肽类有酶解作用,因此选用中性蛋白酶作为酶解Ⅱ型胶原蛋白的工具酶。
2.2 中性蛋白酶对Ⅱ型胶原酶解条件的优化
2.2.1 酶解温度对Ⅱ型胶原蛋白水解度的影响
在pH值为7、底物质量浓度为25 mg/mL、加酶量30 U/mg、酶解时间300 min的条件下,考察不同酶解温度(40、50、60 ℃)对中性蛋白酶酶解Ⅱ型胶原的影响,结果如图2所示。酶解温度在50 ℃时,中性蛋白酶对Ⅱ型胶原的水解度显著高于其他温度(P <0.01),在酶解温度为50 ℃时酶解程度最大,为26.08%。这可能是由于50 ℃时能够达到中性蛋白酶催化酶解反应所需的活化能,反应速率加快;而温度过高或过低,会对中性蛋白酶的结构和活性产生影响,酶活性受到抑制,导致酶解能力降低。因此选择50 ℃作为中性蛋白酶酶解Ⅱ型胶原的最适温度。
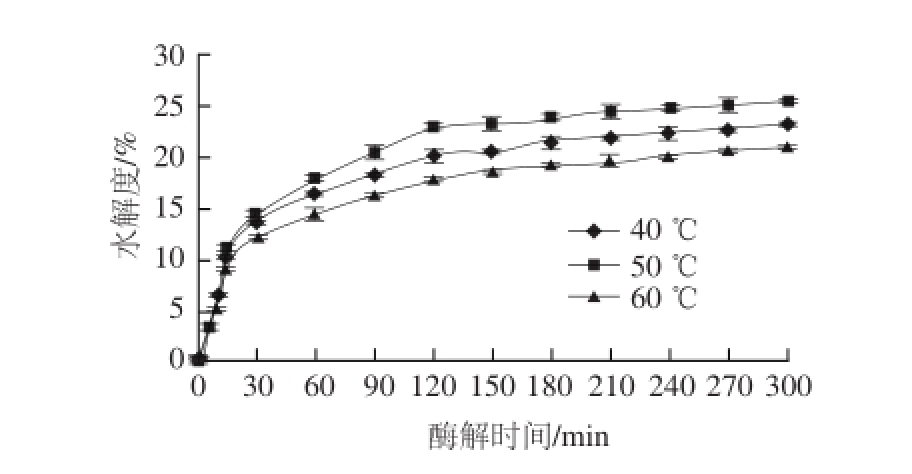
图2 酶解温度对Ⅱ型胶原水解度的影响
Fig.2 Effect of temperature on type II collagen hydrolysis
2.2.2 酶解pH值对Ⅱ型胶原蛋白水解度的影响
在酶解温度50 ℃、底物质量浓度25 mg/mL、加酶量30 U/g、酶解时间300 min的条件下考察不同pH值(6.5、7、7.5)对中性蛋白酶酶解Ⅱ型胶原的影响。结果如图3所示。

图3 酶解pH值对Ⅱ型胶原蛋白水解度的影响
Fig.3 Effect of pH on hydrolysis efficiency of type II collagen
由图3可知,中性蛋白酶对Ⅱ型胶原蛋白的酶解能力随pH值的升高而显著增大(P<0.01),当pH值为7.5时酶解程度达到最高。这可能是因为在酸性条件下,中性蛋白酶与底物所带电荷发生变化,导致中性蛋白酶的立体构象产生变化,从而改变了其与Ⅱ型胶原之间的亲和力,导致催化能力下降,进而Ⅱ型胶原水解度被降低。酶的最适pH值会受底物种类、质量浓度以及缓冲液组成等多种因素的影响,故而其最适pH值不是一个常数,只有在一定的条件下才有意义。因此选择pH 7.5作为中性蛋白酶酶解Ⅱ型胶原的最适pH值。
2.2.3 底物质量浓度对Ⅱ型胶原水解度的影响
在酶解温度50 ℃、pH值为7.5、加酶量30 U/g、酶解时间为300 min的条件下,考察不同底物质量浓度(20、25、30 mg/mL)对中性蛋白酶酶解Ⅱ型胶原的影响,结果如图4所示。
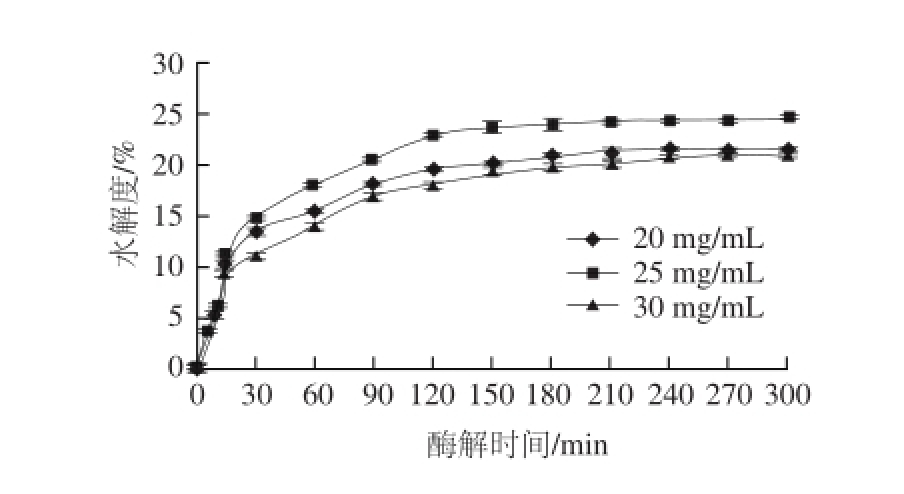
图4 底物质量浓度对Ⅱ型胶原水解度的影响
Fig.4 Effect of substrate concentration on hydrolysis of type II collagen
由图4可知,Ⅱ型胶原质量浓度为25 mg/mL时,中性蛋白酶对Ⅱ型胶原的水解度显著高于其他质量浓度(P<0.01)。这是由于高质量浓度Ⅱ型胶原降低了水的有效浓度,阻碍了分子扩散,从而降低了酶促反应速率;同时质量浓度过高,使得反应体系过于黏稠,不利于反应的操作和进行。因此选择25 mg/mL作为中性蛋白酶酶解Ⅱ型胶原的最佳底物质量浓度。
2.2.4 加酶量对Ⅱ型胶原水解度的影响
在酶解温度为50℃、pH值为7.5、底物质量浓度为25 mg/mL、酶解时间为300 min的条件下,考察不同加酶量(20、30、40 U/g)对中性蛋白酶酶解Ⅱ型胶原的影响,结果如图5所示。

图5 加酶量对Ⅱ型胶原水解度的影响
Fig.5 Effect of enzyme concentration on hydrolysis efficiency of type II collagen
由图5可知,Ⅱ型胶原水解度随酶解时间的延长、加酶量的增大而显著增加(P<0.01)。当加酶量为40 U/mg时中性蛋白酶对Ⅱ型胶原的酶解程度与30 U/mg时的水解度差异不显著(P>0.05),但显著高于20 U/mg时水解度(P<0.01)。因此选择40 U/mg作为中性蛋白酶酶解Ⅱ型胶原的最佳加酶量。
2.2.5 最适酶解条件下中性蛋白酶对Ⅱ型胶原的酶解动力学曲线
综合以上单因素试验结果,得出中性蛋白酶对Ⅱ型胶原的最佳酶解参数分别为:酶解温度50 ℃、pH 7.5、底物质量浓度25 mg/mL、加酶量40 U/mg。根据此最佳酶解条件绘制中性蛋白酶对Ⅱ型胶原的酶解动力学曲线。
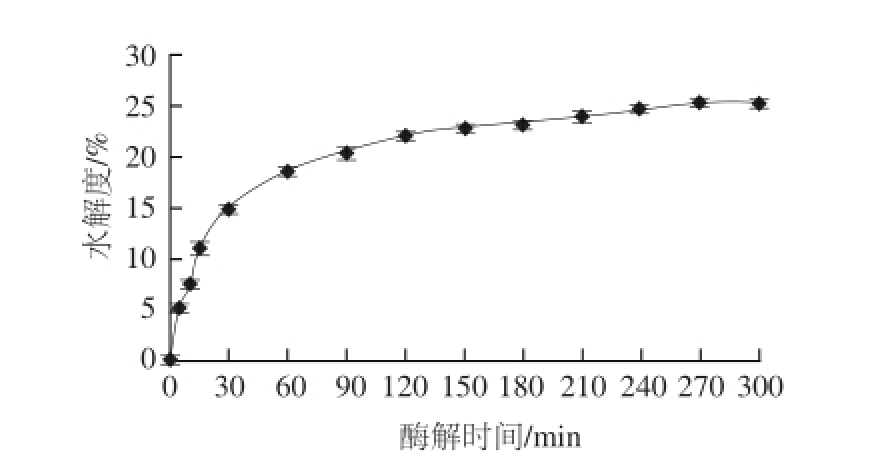
图6 中性蛋白酶酶解Ⅱ型胶原的动力学曲线
Fig.6 Hydrolysis curve for type II collagen with neutral protease
由图6可知,在最适酶解条件下,Ⅱ型胶原水解度随酶解时间的延长呈增长趋势,最后趋于平缓。中性蛋白酶具有一定专一性的酶,有其特定的肽键作用位点,随着酶解反应的进行,蛋白底物的特定的肽键会越来越少,反应速率也会越来越慢。因此蛋白酶的酶解作用大多集中在前60~120 min。此外,随着反应的进行,酶的活力会有所下降,这也是制约中性蛋白酶进一步酶解Ⅱ型胶原的原因之一。
2.3 不同水解度Ⅱ型胶原酶解复合物的免疫活性
根据中性蛋白酶酶解Ⅱ型胶原的最佳条件,制备不同水解度的Ⅱ型胶原酶解复合物,并对其淋巴细胞增殖活性进行测定,结果如图7所示。
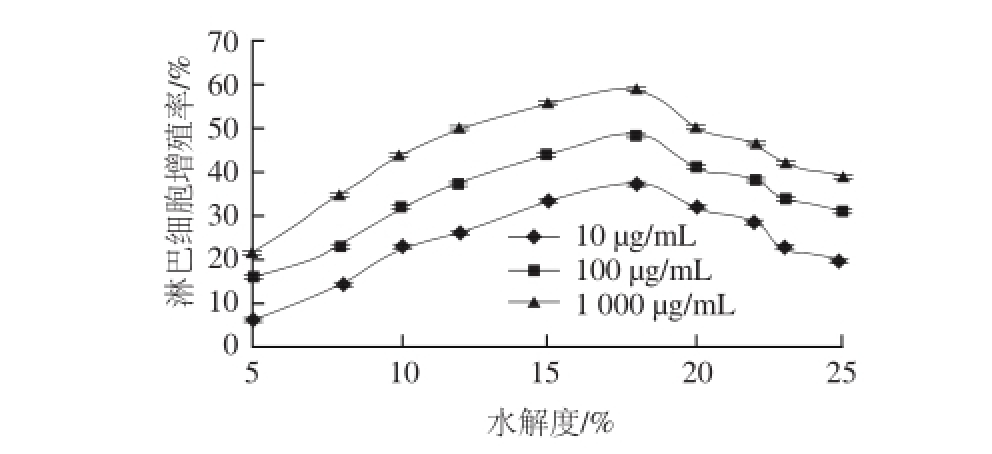
图7 不同水解度Ⅱ型胶原酶解复合物促进淋巴细胞的增殖能力
Fig.7 Effect of enzymatic hydrolysates with different DH fro m type II collagen on the proliferation of lymphocytes
由图7可知,不同水解度Ⅱ型胶原酶解复合物对淋巴细胞均有一定的增殖作用,且酶解复合物促进淋巴细胞增殖能力随水解度的增加呈先增强后降低的趋势。当Ⅱ型胶原水解度达到18%时,酶解复合物促进淋巴细胞增殖能力达到最高,为58.69%。这可能是由于在水解的初始,Ⅱ型胶原中的多肽链紧密折叠在一起,其具有免疫活性的氨基酸残基或基团被包埋在分子内部,从而活性较低。随着酶解反应的进行,大分子肽段被切割,释放出具有免疫活性的小分子肽和游离氨基酸,暴露出能够参与反应的氨基酸侧链基团,从而使其免疫活性得以表现。但肽段的免疫活性与氨基酸的排列顺序、空间结构和数量有关,当进一步水解,具有免疫活性的肽段被水解成更小的肽段或游离氨基酸,从而使该肽段丧失了免疫活性。
2.4 Ⅱ型胶原酶解复合物质量浓度对淋巴细胞增殖能力的影响
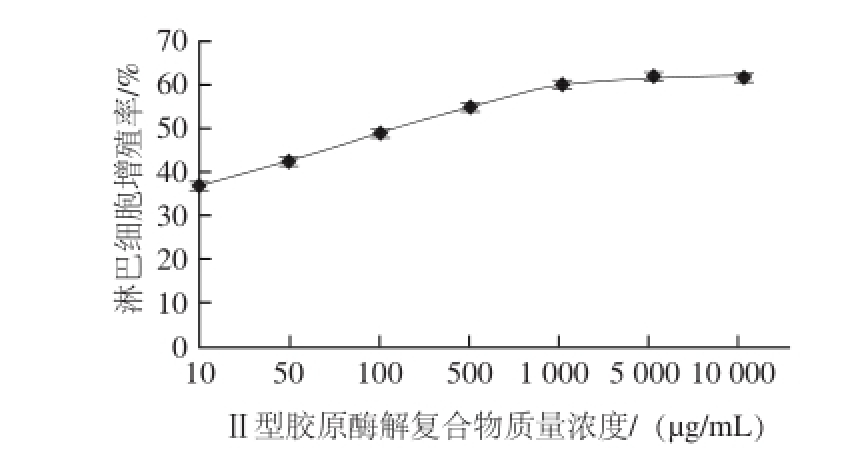
图8 Ⅱ型胶原酶解复合物的质量浓度对促进淋巴细胞增殖能力的影响
Fig.8 Effect of enzymatic hydrolysate concentration from type II collagen on the proliferation of lymphocytes
由图8可知,淋巴细胞增殖能力随Ⅱ型胶原酶解复合物质量浓度的增加呈显著增强的趋势(P<0.01)。当酶解复合物质量浓度达到1 mg/mL时,淋巴细胞增殖率趋于稳定,达到59.93%。这可能是因为较高质量浓度的Ⅱ型胶原酶解复合物有利于其抗原表位与APC表面的HLAⅡ类分子相结合,并形成HLA-抗原肽复合物,该复合物可与T细胞表面受体分子发生特异性结合,进而激活自身反应性T淋巴细胞的免疫应答,使其活化并促进淋巴细胞的增殖。
2.5 Ⅱ型胶原酶解复合物分子质量的分布
采用高效凝胶过滤色谱法对淋巴细胞增殖能力在最低(水解度5%)和最高(水解度18%)时的Ⅱ型胶原酶解复合物的分子质量分布进行测定,其洗脱曲线如图9、10所示,酶解复合物分子质量分布如表1所示。
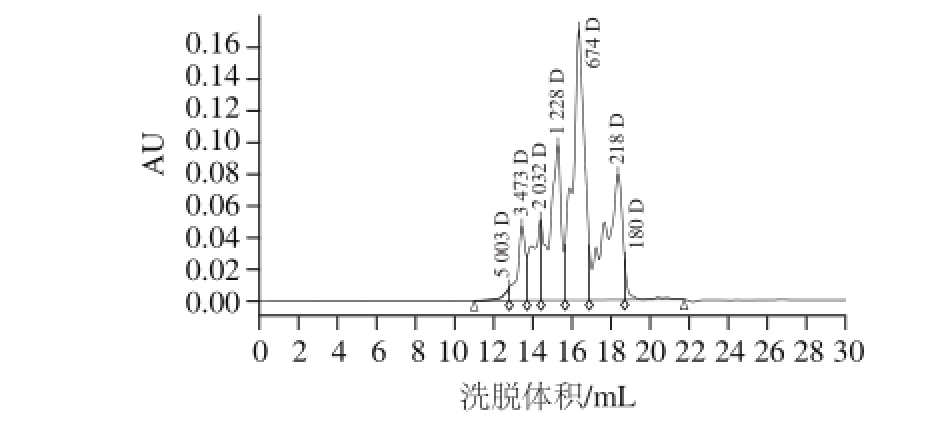
图9 水解度为55%时Ⅱ型胶原酶解复合物分子质量分布
Fig.9 Molecular weight distribution profile of enzymatic hydrolysates with 5% DH from type II collagen

图10 水解度为18%时Ⅱ型胶原酶解复合物分子质量分布
Fig.10 Molecular weight distribution profile of enzymatic hydrolysates with 18% DH from type II collagen
表1 水解度5%和18%Ⅱ型胶原酶解复合物的分子质量分布百分比
Table1 Molecular weight distribution of enzymatic hydrolysates with 5% and 18 d 18% DH from type II collagen %

分子质量/D>5 000 5 000~3 000 3 000~2 000 2 000~1 000 1 000~500500~180<180水解度5%0.796.858.0821.1536.7024.911.52水解度18%0.402.894.5213.1538.7936.423.81
如图9和图10所示,随着水解度的增大,Ⅱ型胶原酶解复合物的分子质量分布总体表现为大分子质量肽的含量逐渐减少,小分子质量肽的含量逐渐增加。由表1可知,水解度为18%时肽段的分子质量主要分布于1 000~180 D,含量达75.21%,而水解度为5%时分布于1 000~180 D的肽段仅占61.61%。结合淋巴细胞增殖实验结果可知水解度为18%时Ⅱ型胶原酶解复合物促淋巴细胞增殖的能力最强,由此可以初步推断Ⅱ型胶原酶解复合物的免疫活性与其分子质量有一定的相关性,分子质量在1 000~180 D的肽类物质可能是Ⅱ型胶原酶解复合物促进淋巴细胞增殖的主要活性来源。由于氨基酸的平均分子质量大约为120 D,因此对于分子质量为1 000~180 D的Ⅱ型胶原酶解复合物而言,大约2~8 个氨基酸组成的多肽可能对Ⅱ型胶原酶解复合物的免疫活性贡献较大。Sakanaka等 [16]研究也发现免疫活性较高的肽段主要分布于分子质量小于1 000 D的范围内;Wang Jinshui等 [17]从小麦面筋酶解复合物中筛选到分子质量小于4 200 D的免疫活性肽;徐明生 [18]探讨了卵白蛋白酶解复合物中不同分子质量肽段的免疫活性,发现小于3 000 D的肽段免疫活性最强;程云辉 [19]筛选出具有较强免疫活性的麦胚蛋白酶解复合物,其分子质量小于1 000 D的组分比例为53.01%。这些研究都表明了分子质量较小的肽段具有较高的免疫活性。
中性蛋白酶对鸡胸软骨Ⅱ型胶原具有较高的水解能力,其最佳酶解条件为:酶解温度50 ℃、pH 7.5、底物质量浓度25 mg/mL、加酶量40 U/mg、酶解时间150 min。Ⅱ型胶原在水解度为18%时对淋巴细胞的增殖能力达到最高,为58.69%。Ⅱ型胶原酶解产物浓度对淋巴细胞增殖能力也有显著影响,当其质量浓度达到1 mg/mL时,对淋巴细胞增殖能力达到59.93%。淋巴细胞增殖能力较强的Ⅱ型胶原酶解复合物的分子质量主要分布于1 000~180 D范围内,占总含量的75.21%。在今后的工作中,将利用各种分离技术对酶解复合物进行分离纯化,以期获得目标活性组分,并对其构效关系进行研究。
参考文献:
[1] 谭刘欣, 奚永志. Ⅱ型胶原免疫活性肽研究的进展[J]. 中华风湿病学杂志, 2009, 13(5): 341-343.
[2] 陆雪芹, 许时婴, 曹慧. 鸡胸软骨粉中Ⅱ型胶原的提取及结构分析[J].食品科学, 2009, 30(4): 76-80.
[3] MERISEL H. Overview on milk protein-derived peptides[J]. International Dairy Journal, 1989, 8(5/6): 363-373.
[4] HOLM L, BOCKERMANN R, WELLNER E, et al. Side-chain and backbone amide bond requirements for glycopeptide stimulation of T-cells obtained in a mouse model for rheumatoid arthritis[J]. Bioorganic and Medicinal Chemistry, 2006, 14(17): 5921-5932.
[5] 曹慧, 张忠慧, 许时婴. 鸡胸软骨酶解产物的表征及对类风湿关节炎大鼠的免疫调节作用[J]. 食品科学, 2012, 33(3): 243-247.
[6] TANG Bo, DAVID D B, MA Zhijun, et al. Pathogenesis of collageninduced arthritis: modulation of disease by arthritogenic T-cell epitope location[J]. Immunology, 2004, 113(3): 384-391.
[7] 程永静, 周强, 栗占国. HLA-DRB1特异性II型胶原多肽序列中氨基酸替换对T淋巴细胞免疫的影响[J]. 中华风湿病学杂志, 2004(8):210-214.
[8] ROSLONIEC E F, WHITTINGTON K B, ZALLER D M, et al. HLA-DR1 and DR4 use the same anchor residues for binding an immunodominant peptide derived from human type II collagen[J]. The Journal of Immunology: Offi cial Journal of the American Association of Immunologists, 2002, 168(1): 253-259.
[9] 李茹, 李霞, 栗占国. 利用Ⅱ型胶原变构肽抑制类风湿关节炎患者T细胞活化的研究[J]. 现代免疫学, 2006, 26(3): 217-221.
[10] 王宏坤, 朱平, 李晓燕. 重组人Ⅱ型胶原250-270多肽对特异性体液免疫的抑制作用[J]. 细胞与分子免疫学杂志, 2006, 22: 742-744.
[11] MYERS L K, TANG Bo, ROSLONIEC E F, et al. An altered peptide ligand of type II collagen suppresses autoimmune arthritis[J]. Critical Reviews in Food Science and Nutrition, 2007, 27(4): 345-356.
[12] TADASHI Y, ELENA T, KUNITAKA O, et al. Peptides of type II collagen can induce the cleavage of type II collagen and aggrecan in articular cartilage[J]. Matrix Biology, 2006, 25(7): 419-429.
[13] 石服鑫, 曹慧, 徐斐. 不同来源的Ⅱ型胶原结构及其免疫活性[J]. 食品与发酵工业, 2014, 40(2): 22-26.
[14] NISSAN J A. Enzymatic hydrolysis of food proteins[M]. London:Elsevier Applied Science Publishers, 1986: 132.
[15] 朱玉冰, 曹慧, 徐斐, 等. 猪皮胶原酶解产物的制备及其热滞活性的研究[J]. 食品与发酵工业, 2014, 40(2): 10-15.
[16] SAKANAKA S, TACHIBANA Y, ISHIHARA N, et al. Antioxidant activity of egg-yolk protein hydrolysates in a linoleic acid oxidation system[J]. Food Chemistry, 2004, 86(1): 99-103.
[17] WANG Jinshui, ZHAO Mouming, ZHAO Qiangzhong, et al. Antioxidant properties of papain hydrolysates of wheat gluten in different oxidation systems[J]. Food Chemistry, 2007, 101(4):1658-1663.
[18] 徐明生. 鸡蛋卵白蛋白酶解物抗氧化肽研究[D]. 西安: 陕西师范大学, 2006.
[19] 程云辉. 麦胚蛋白酶解物的制备、结构及其活性功能的研究[D]. 无锡: 江南大学, 2006.
Preparation and Properties of Immunologically Active Peptide from Type II Collagen from Chicken Sternal Cartilage
LIU Lulu, CAO Hui*, XU Fei, YU Jinsong, YUAN Min
(School of Medical Instrument and Food Engineering, University of Shanghai for Science and Technology, Shanghai 200093, China)
Abstract:The hydrolysis conditions of type II collagen from chicken sternal cartilage were optimized to obtain increased degree of hydrolysis (DH). Based on the optimal hydrolysis parameters, enzymatic hydrolysates with different DHs were prepared, and then lymphocyte proliferation test was utilized to evaluate their immunological activ ity. The results showed that neutral protease was the most suitable enzyme for hydrolyzing type II collagen and the optimal hydrolysis conditions were hydrolysis temperature of 50 ℃, hydrolysis pH of 7.5, collagen concentration of 25 mg/mL, enzyme dosage of 40 U/mg,and hydrolysis time of 150 min. The hydrolysates with a DH of 18% could result in proliferation of lymphocytes by up to 58.69%, and the maximal proliferative activity of lymphocytes was found at a concentration of 1 mg/mL. The molecular weight distribution of collagen hydrolysates with higher immunological activity was 1 000-180 D (accounting for 75.21% of the total hydrolysates).
Key words:type II collagen; immunologically active peptide; neutral protease; lymphocyte proliferation
中图分类号:TS202.3
文献标志码:A
文章编号:1002-6630(2015)13-0084-05
doi:10.7506/spkx1002-6630-201513017
收稿日期:2014-08-31
基金项目:国家高技术研究发展计划(863计划)项目(2013AA102207);国家自然科学基金青年科学基金项目(31201421)
作者简介:刘露露(1991—),女,硕士研究生,研究方向为功能性配料及添加剂。E-mail:liululu511@126.com
*通信作者:曹慧(1976—),女,副教授,博士,研究方向为功能性配料及添加剂。E-mail:caohuian@126.com