迟 涛 1,张国芳 2,徐学博 2,李 春 2,武玉婷 2,刘丽波 2,*,王辰旭 2,刘 宁 1,2,*
(1.黑龙江省乳品工业技术开发中心,黑龙江 哈尔滨 150028;2.东北农业大学 乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
摘 要:采用经高碘酸钠活化的葡聚糖修饰米根霉脂肪酶,以获得具有较高酸解催化活性的脂肪酶。研究反应时间、反应pH值、还原剂浓度及葡聚糖质量分数对化学修饰效果的影响,并利用Box-Behnken设计法及响应面优化法对米根霉脂肪酶的化学修饰条件进行优化,当反应pH值为7.63、反应时间为15.53 h、还原剂浓度为0.20 mol/L、葡聚糖质量分数为0.3%时,脂肪酶酸解率可达到最高值37.28%。在40 ℃最适温度条件下,修饰酶的活性是原酶的2.2 倍,且经化学修饰后脂肪酶的稳定性有显著提高。
关键词:米根霉脂肪酶;化学修饰;葡聚糖;响应面法;酸解活性
米根霉脂肪酶(Rhizopus oryzae lipase,ROL)是根霉属的丝状真菌米根霉产生的一种具有严格1,3位置特异性和对中长链底物专一性的脂肪酶 [1]。ROL在众多工业领域中具有良好的应用价值,有着崭新而广阔的发展前景。但ROL的稳定性差,造成酶活性损失严重。目前已有多种方法可用于提高酶的活性及稳定性,包括固定化法 [2-5]、分子交联法 [6-7]、蛋白质工程法 [8-9]及化学修饰法 [10-16]等。其中化学修饰法以快速、直接和高效的特点获得了广泛的应用。然而利用现有的技术对酶进行化学修饰,改变酶活性的过程中,也对酶的稳定性造成了很大影响,很难达到活性和稳定性的同步提高 [17-18]。葡聚糖作为修饰剂 [19-20],可与酶表面的基团反应,覆盖酶表面的大部分,在极性条件下对酶起到一定的保护作用;同时,葡聚糖中包含了很多的活性基团,能够很好地改善酶的性能。因此,用葡聚糖修饰ROL会促进其性能提升。
本实验以ROL为研究对象,利用葡聚糖为修饰剂,首先采用单因素试验筛选影响ROL葡聚糖化学修饰的主要因素,再通过Box-Behnken设计试验并进行响应面法优化,建立二次多项回归模型,对模型进行方差分析及回归系数显著性检验,从而得到更精确的工艺条件 [21],最后获得ROL葡聚糖化学修饰的最佳参数,以提高ROL的催化反应效率。
1.1 材料与试剂
米根霉脂肪酶(ROL),购自美国Sigma公司。
葡聚糖(相对分子质量7 万、20 万)、聚蔗糖(相对分子质量7 万、40 万) 国药集团化学试剂有限公司;高碘酸钠、硼氢化钠、正己烷(色谱纯)等 天津市富宇精细化工公司。
1.2 仪器与设备
真空冷冻干燥机 上海医用仪器厂;7890A气相色谱仪 安捷伦科技(中国)有限公司;旋涡振荡仪上海精科实业有限公司;紫外-可见分光光度计 美国Beckman公司。
1.3 方法
1.3.1 葡聚糖的活化 [19]
将葡聚糖溶解配制为10 mg/mL的溶液,向溶液中加入高碘酸钠使其终浓度为50 mmol/L。将上述体系在室温、黑暗条件下反应2 h后再于4 ℃、黑暗条件下反应24 h,最后加入500 ☒L乙二醇混匀以终止反应。1 h后将产物透析处理,得到葡聚糖氧化物,分装为1 mL于4 ℃冰箱中保存。
1.3.2 ROL的化学修饰及结构表征
称取20 mg ROL在2 mL pH 6~8的磷酸盐缓冲液(0.02 mol/L Na 2HPO 4-NaH 2PO 4)中溶解。将一定体积的葡聚糖氧化物加入到酶溶液中,混合均匀后在室温下放置8~48 h后加入不同浓度的硼氢化钠,不断搅拌混匀,1 h后将样品经透析处理移去溶剂,再经冻干处理即得到经葡聚糖修饰的米根霉脂肪酶(dextran-ROL)。取相同浓度的葡聚糖、dextran-ROL和ROL进行紫外光谱扫描,以表征ROL经修饰后的结构变化。
1.3.3 ROL酸解方法 [22]
将猪油和辛酸以3∶1(V/V)的比例置于5 mL离心管中,振荡混匀后放于40 ℃水浴锅中,再加入底物质量5%的脂肪酶催化酸解反应,2 h后取出离心管,9 000 r/min离心5 min,吸取上层油相保存于4 ℃冰箱中,待分析。
1.3.4 薄层色谱分离酶催化产物 [23]
分离条件:硅胶板G,展开剂为石油醚-乙醚-乙酸(80∶20∶2,V/V)。硅胶板G浸入展开剂的深度为距离板底边0.5~1.0 cm。展开完成后取出硅胶板G,晾干,均匀喷洒0.1% 2,7-二氯荧光素显色。甘油脂肪酸分离后,各组分的Rf值分别为:固醇0.81、甘三酯0.69、1,3-甘二酯0.31、1,2-甘二酯0.22、甘一酯0.02、脂肪酸0.50。
1.3.5 甲酯化方法
将薄层色谱分离得到的甘三酯和甘二酯置于25 mL圆底烧瓶中,加入2 mL 0.5 mol/L的KOH-甲醇溶液振荡混匀,在70 ℃水浴中反应10 min,取出冷却后加入即时配制的BF 3-甲醇(1∶3,V/V)溶液3 mL,再于70 ℃水浴回流反应5 min,取出冷却后加入2 mL正己烷充分振荡,使样品完全萃取于正己烷中,再加入饱和氯化钠溶液,静置5 min后吸取上层正己烷于样品瓶中保存。
1.3.6 气相色谱测定条件
酶催化产物分析采用安捷伦7890气相色谱仪和氢火焰离子检测器。色谱柱:FFAP柱(100 m×0.25 mm,0.20 ☒m);燃气:H 2,流量30 mL/min;助燃气:空气,流量300 mL/min;载气:He,流量1 mL/min;柱前压:37.5 MPa;分流比50∶1;进样量1 ☒L;进样口温度:240 ℃;炉温:140 ℃,维持5 min;检测器温度:2 5 0 ℃。使用安捷伦化学工作站(HP3398A GC ChemStation)进行数据采集分析,采用面积归一化法计算酶催化产物含量。
1.3.7 ROL酸解活性的测定
酸解反应是在脂肪酶的催化下,甘油三酯与脂肪酸之间发生酰基转移从而改变甘油三酯结构组成的反应。本实验以猪油和辛酸为底物,通过测定辛酸在甘油三酯上的结合率(酸解率)来反映脂肪酶的酸解活性,具体计算公式如下:
1.4 葡聚糖对ROL化学修饰的优化
1.4.1 单因素试验
采用相对分子质量为20万的葡聚糖作为修饰剂对ROL进行化学修饰,以反应时间、反应pH值、还原剂浓度、葡聚糖质量分数为主要影响因素,在反应时间8~48 h、反应pH 6~8、还原剂浓度0.05~0.40 mol/L和葡聚糖质量分数0.1%~0.6%条件下进行单因素试验,考察各因素对酶修饰效果的影响。
1.4.2 响应面法优化
根据响应面试验设计原理,在上述单因素试验的基础上,设计四因素三水平共计29 组试验。以反应时间、反应pH值、还原剂浓度和葡聚糖质量分数为自变量,酸解率为响应值建立二次多项式回归模型,得到最优组合水平,确定葡聚糖化学修饰ROL的最佳条件,并进行最佳工艺条件的验证实验。
2.1 ROL修饰剂的选择
酶的催化功能本质上是由其特定的空间结构,特别是活性中心的特定构象所决定的,水溶性大分子与酶蛋白的侧链基团通过共价键结合后,可使酶的空间构象发生改变,使酶活性中心更有利于底物结合,并形成准确的催化部位,从而使酶活性提高。
选择适合的修饰剂,利用化学修饰的方法改变脂肪酶的性能是提高脂肪酶催化活性是高效手段。由于ROL的稳定性较差,在提高其活性的同时保持或提高其稳定性也尤为重要。选择大分子多糖对ROL进行修饰,不仅可以提高其催化活性,而且多糖通过与酶表面的氨基共价结合,对酶分子进行修饰,在酶分子外围形成保护层,在极端条件下对酶分子可起到一定的保护作用,对酶稳定性的提高有很好的效果。本实验中选择不同相对分子质量的水溶性多糖(葡聚糖、聚蔗糖、菊糖)作为修饰剂,对比修饰后ROL催化酸解反应活性的高低,判断修饰效果。
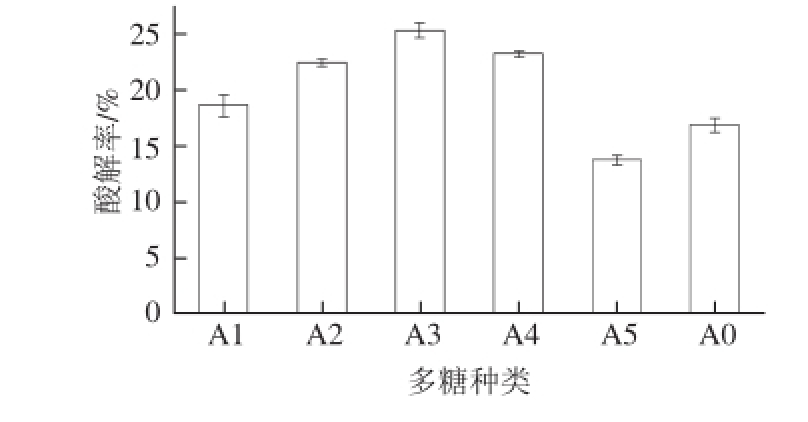
图1 不同多糖修饰对ROL酸解活性影响
Fig.1 Effect of modification with different polysaccharides on the activity of Rhizopus oryzae lipase
由图1可知,相对分子质量20万的葡聚糖(A3)修饰的ROL酸解率最高,是原酶(A0)酸解率的1.5 倍。相对分子质量2万的葡聚糖(A2)修饰的ROL酸解率高于相对分子质量7万的聚蔗糖(A1)修饰的ROL,A3修饰的ROL酸解率高于相对分子质量40万的聚蔗糖(A4)修饰的ROL,说明相对分子质量的相近的多糖,葡聚糖对ROL的修饰效果优于聚蔗糖;而A3的酸解率高于A2,A4的酸解率高于A1,可见同种多糖,相对分子质量大越大,其所修饰的ROL酸解率越高,即修饰效果越好。综合以上结果,选择相对分子质量20万的葡聚糖作为修饰剂进行修饰条件的具体优化。
2.2 产物的结构表征
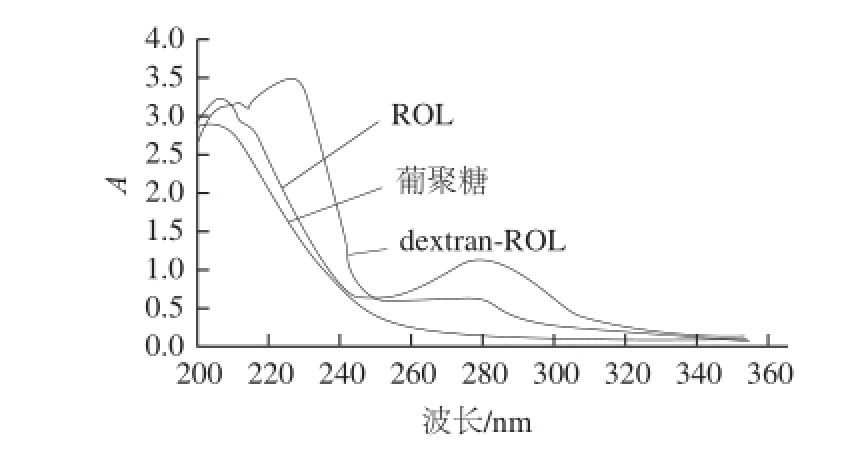
图2 葡聚糖、ROL和dextran-ROL紫外吸收光谱
Fig.2 UV absorption spectra of dextran, ROL and dextran-ROL
由图2可知,经过化学修饰后,dextran-ROL在200~230 nm波长范围内最大吸收峰的吸光度增大,最大吸收波长也有偏移。ROL经修饰后,在280 nm波长附近的特征吸收峰值明显减弱,这是因为葡聚糖氧化后生成的醛基可与ROL表面的氨基反应,使酶与葡聚糖连接到一起,从而对酶蛋白表面的色氨酸和酪氨酸等基团(在280 nm波长处有特征吸收峰)造成影响,影响酶蛋白的结构。因此该峰的变化反映了蛋白质结构的变化,证明了葡聚糖与酶蛋白结合,使酶蛋白结构发生了变化。
2.3 葡聚糖修饰ROL的单因素试验结果
2.3.1 反应时间对修饰酶dextran-ROL活性的影响
当反应pH值为7.5、还原剂浓度为0.2 mol/L、葡聚糖质量分数为0.5%时,考察反应时间对修饰酶活性的影响,结果见图3。随着反应时间的延长,葡聚糖与酶充分接触,反应完全。但反应时间也不是越长越好,活化后的葡聚糖不够稳定,可能会因为反应时间过长而使葡聚糖失去活性。由图3可知,当反应时间小于16 h时,酶活性随时间的延长而升高,在16 h时达到最高点,而后又随反应时间的延长降低。因此在后续优化实验时,反应时间的中心值选择为16 h。

图3 反应时间对修饰酶活性的影响
Fig.3 Effect of reaction time on the activity of modified ROL
2.3.2 反应pH值对修饰酶dextran-ROL活性的影响
当反应时间为20 h、还原剂浓度为0.2 mol/L、葡聚糖质量分数为0.5%时,考察反应pH值对修饰酶活性的影响,结果见图4。pH值的变化能够改变肽链侧链基团的电荷,从而引起肽链构象的变化。同理,pH值也会对酶蛋白表面基团的电荷产生影响,进而影响基团与修饰剂的结合,从而影响修饰效果。由图4可知,ROL在酸性条件下被修饰后活性较低,随着pH值的升高,dextran-ROL的活性有显著提高,在pH 7.6时达到最高,随后又快速降低。因此在后续优化实验中,反应pH值的中心值选为7.6。
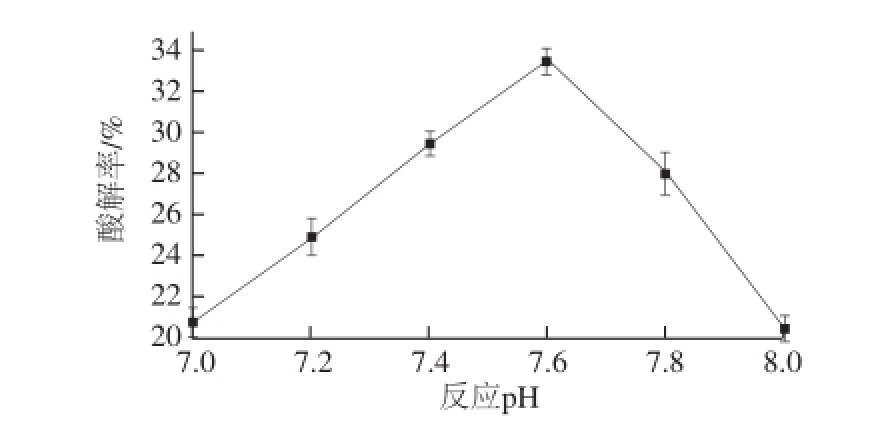
图4 反应pH值对修饰酶活性的影响
Fig.4 Effect of pH on the activity of modified ROL
2.3.3 还原剂浓度对修饰酶dextran-ROL活性的影响
当反应时间为20 h、反应pH值为7.5、葡聚糖质量分数为0.5%时,考察还原剂浓度对修饰酶活性的影响,结果见图5。还原剂硼氢化钠的作用是使酶与葡聚糖反应形成的不稳定双键还原为高稳定性的单键,所以还原剂的添加量对产物稳定性会产生一定影响。由图5可知,dextran-ROL的活性随还原剂浓度的增加先升高后缓慢降低,在还原剂浓度为0.2 mol/L时达到最高点。因此在后续优化实验中,还原剂浓度的中心值选择为0.2 mol/L。
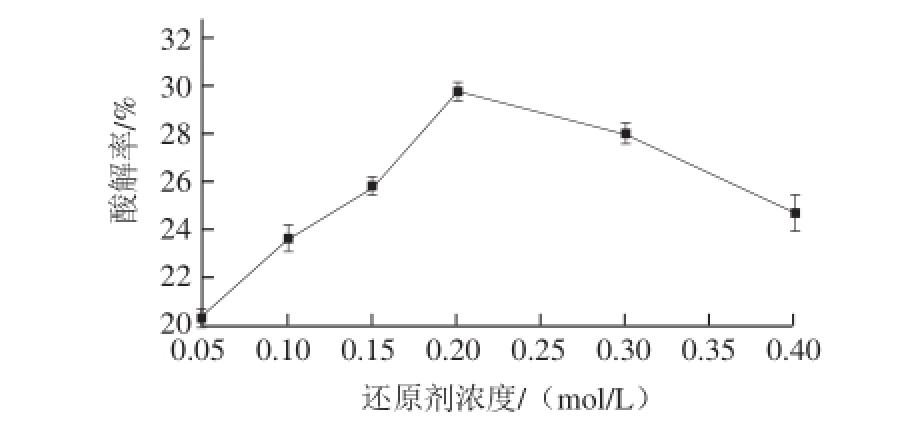
图5 还原剂浓度对修饰酶活性的影响
Fig.5 Effect of reductant concentration on the activity of modified ROL
2.3.4 葡聚糖质量分数对修饰酶dextran-ROL活性的影响

图6 葡聚糖质量分数对修饰酶活性的影响
Fig.6 Effect of dextran concentration on the activity of modified ROL
当反应时间为20 h、反应pH值为7.5、还原剂浓度为0.2 mol/L时,考察葡聚糖质量分数对修饰酶活性的影响,结果见图6。葡聚糖的用量对修饰效果也会产生一定的影响,当葡聚糖用量太少时,酶分子的基团未能被完全修饰;葡聚糖用量过多则会造成资源的浪费。由图6可知,dextran-ROL的活性随着葡聚糖质量分数的增加先升高后降低,在葡聚糖质量分数为0.3%时达到最高点。因此在后续优化试验中,葡聚糖质量分数的中心值选择为0.3%。
2.4 响应面法优化葡聚糖修饰ROL结果分析
2.4.1 试验结果
根据Box-Behnken设计原理 [24],进行29 组响应面优化试验,设计方案及结果见表1。
表1 葡聚糖修饰ROL的Box-Behnken试验设计方案及结果
Table1 Box-Behnken experimental design with experimental results for dextran-modified ROL
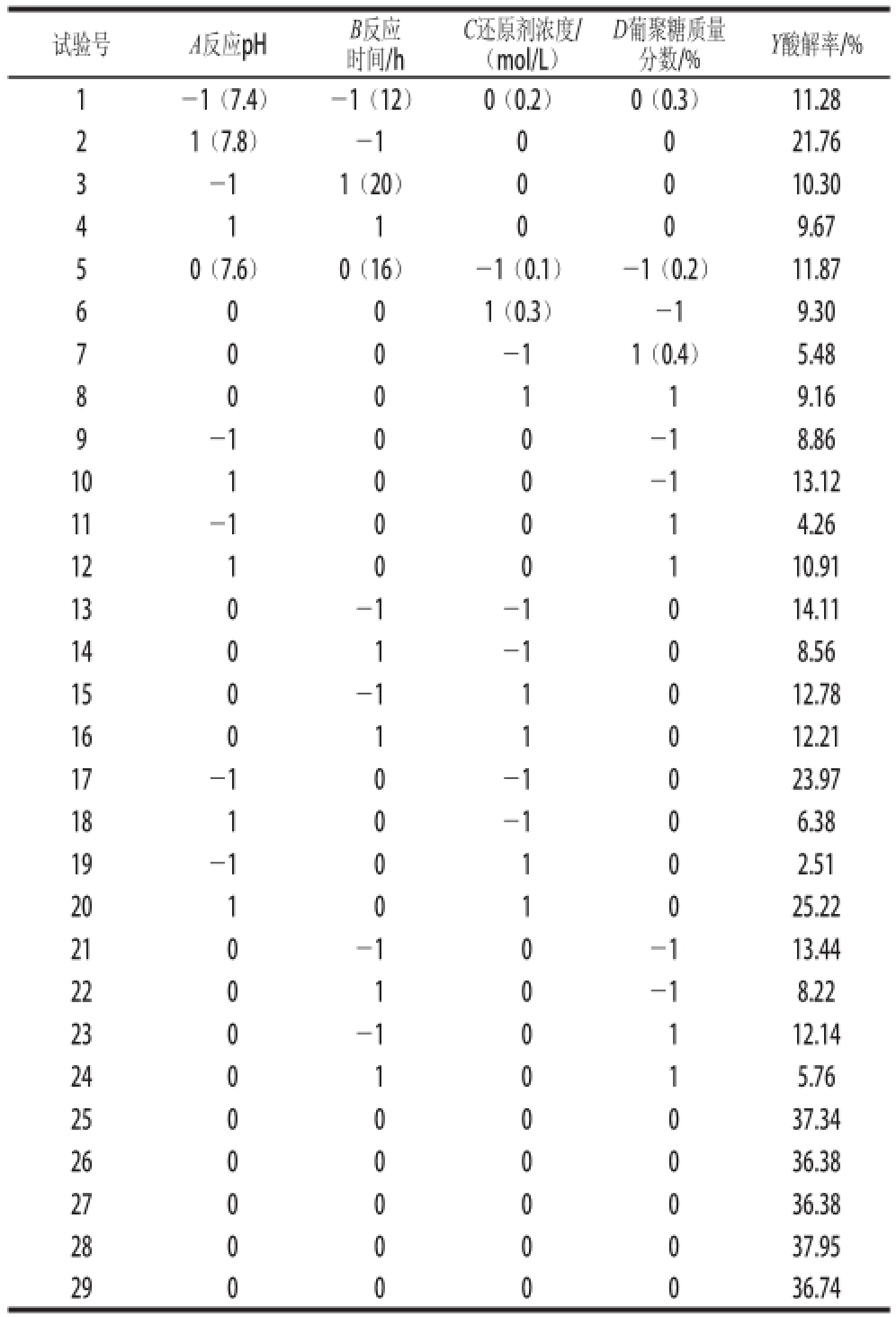
试验号A反应pHB反应时间/h C还原剂浓度/(mol/L)D葡聚糖质量分数/%Y酸解率/% 1-1(7.4)-1(12)0(0.2)0(0.3)11.28 21(7.8)-10021.76 3 -11(20)0010.30 4 1 1 0 0 9.67 50(7.6)0(16)-1(0.1)-1(0.2)11.87 6 0 01(0.3)-19.30 -11(0.4)5.48 8 0 0 1 1 9.16 7 0 0 -100-18.86 10100-113.12 11-10014.26 12100110.91 130-1-1014.11 1401-108.56 150-11012.78 16011012.21 17-10-1023.97 1810-106.38 19-10102.51 20101025.22 210-10-113.44 22010-18.22 230-10112.14 2401015.76 25000037.34 26000036.38 27000036.38 28000037.95 29000036.74 9
对表1中的数据利用Design Expert 7.0.0软件分析,获得酸解率(Y)对反应pH值(A)、反应时间(B)、还原剂浓度(C)和葡聚糖质量分数(D)的二次多项回归模型:
Y=36.96+2.16A-2.57B+0.067C-1.42D-2.78AB+ 10.07AC+0.60AD+1.24BC-0.29BD+1.56CD-11.25A 2-12.25B 2-12.09C 2-15.72D 2(2)
对模型进行方差分析及回归系数显著性检验,结果见表2。二次多项式模型极显著(P<0.01,R 2=0.991 7);失拟项不显著(P=0.051 8>0.05)。一次项A、B,交互项AC和二次项的影响均极显著(P<0.01);一次项D、交互项AB和CD的影响显著(P<0.05);其他项均为不显著。由F值检验可知,4 个因素对酸解率影响作用的大小依次为B>A>D>C,说明反应时间对ROL酸解活性的影响最大,其次是反应pH值和葡聚糖质量分数,还原剂浓度对修饰酶的活性影响最弱。
表2 回归模型方程方差分析
Table2 Analysis of variance (ANOVA) for response surface quadratic model
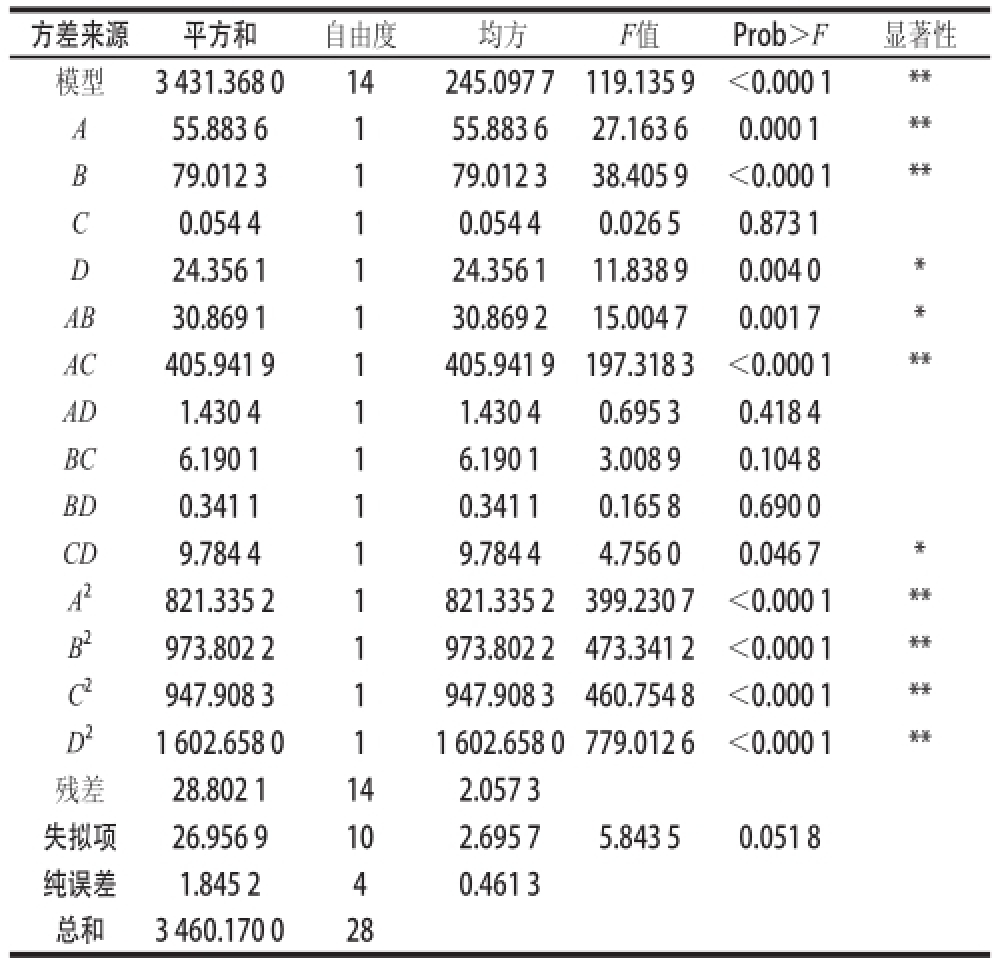
注:*. P<0.05,表示差异显著;**. P<0.01,表示差异极显著。
方差来源平方和自由度 均方F值Prob>F显著性模型3 431.368 014245.097 7119.135 9<0.000 1** A55.883 6155.883 627.163 60.000 1** B79.012 3179.012 338.405 9<0.000 1** C0.054 410.054 40.026 50.873 1 D24.356 1124.356 111.838 90.004 0* AB30.869 1130.869 215.004 70.001 7* AC405.941 91405.941 9197.318 3<0.000 1** AD1.430 411.430 40.695 30.418 4 BC6.190 116.190 13.008 90.104 8 BD0.341 110.341 10.165 80.690 0 CD9.784 419.784 44.756 00.046 7* A 2821.335 21821.335 2399.230 7<0.000 1** B 2973.802 21973.802 2473.341 2<0.000 1** C 2947.908 31947.908 3460.754 8<0.000 1** D 21 602.658 011 602.658 0 779.012 6<0.000 1**残差28.802 1142.057 3失拟项26.956 9102.695 75.843 50.051 8纯误差1.845 240.461 3总和3 460.170 028
2.4.2 响应面优化与分析
响应面三维空间曲线图是不同因素对响应值影响强弱的立体直观反映,当曲线面陡峭时,表明因素对响应值影响较大;当曲线面平缓时,表明因素对响应值影响较小。二维等高线是两种因素交互作用的结果,通过其形状可以判断出各因素交互作用的大小,椭圆形表示两因素交互作用对响应值影响显著,圆形则说明两因素的交互作用不显著 [25]。
基于二次回归模型绘制各因素间交互作用 的响应面图,如图7所示。
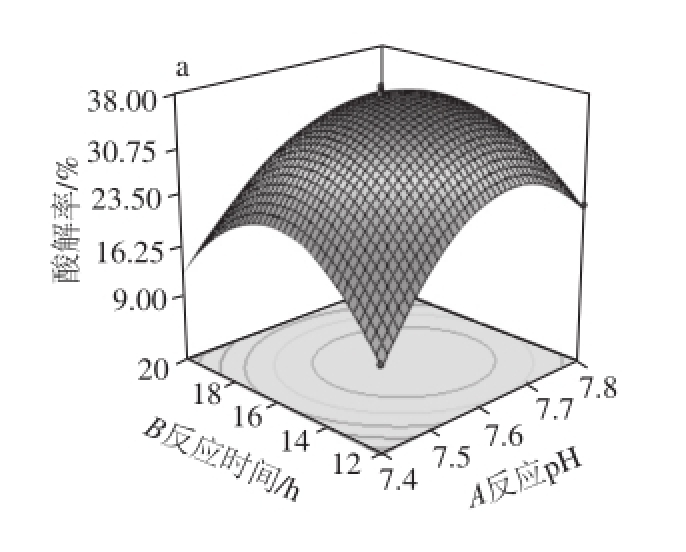
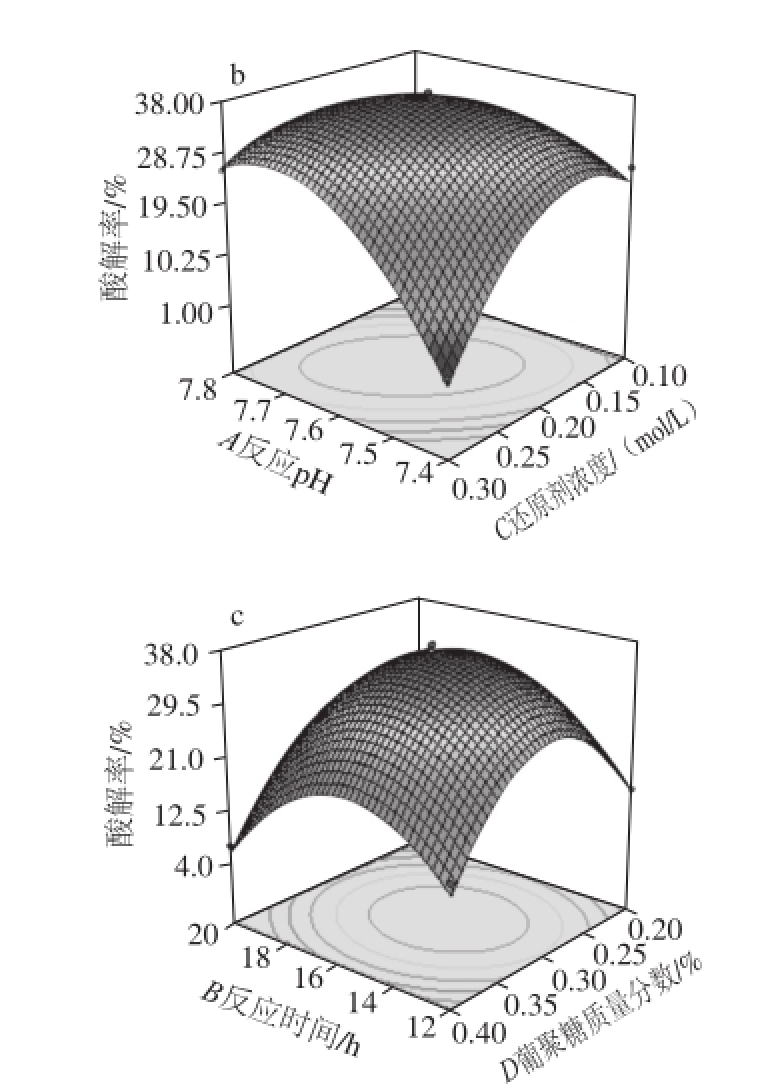
图7 不同因素影响修饰酶酸解活性的响应面图
Fig.7 Response surface plots for the effects of different factors on the activity of modified lipase
图7 a为反应pH值和反应时间对修饰酶酸解活性影响的响应曲面图,图中等高线呈椭圆形,表明反应pH值和反应时间的交互作用显著。响应曲面陡峭,表明反应pH值和反应时间对修饰酶酸解活性的影响均为显著(P<0.05)。当还原剂浓度和葡聚糖质量分数固定在0水平上,反应时间不变时,随着反应pH值的变化,修饰酶酸解活性呈现先升高后降低的趋势,当反应pH值在7.6附近时,修饰酶酸解活性达到最大;当反应pH值不变时,随着反应时间的延长,修饰酶酸解活性在反应时间为16 h左右达到最大值。在实验设计的条件范围内,二者交互作用表现为修饰酶酸解活性的增大。
图7b为反应pH值和还原剂浓度对修饰酶酸解活性影响的响应曲面图,图中响应曲面的坡度较为陡峭,表明反应pH值和还原剂浓度两个因素对修饰酶酸解活性的影响均较大,等高线呈明显的椭圆形,表明二者的交互作用极显著。
图7c为反应时间和葡聚糖质量分数对修饰酶酸解活性影响的曲面图,当还原剂浓度和反应pH值固定在0水平上,葡聚糖浓度不变时,随着反应时间的延长,修饰酶酸解率先升高后降低;在反应时间保持不变时,随着葡聚糖质量分数的增大,修饰酶酸解活性也呈现先升高后降低。所以,当反应时间在14~18 h之间,葡聚糖质量分数在0.25%~0.35%之间时,修饰酶的酸解活性达到最高值。且二者的交互作用表现为修饰酶酸解活性增大,但等高线形状近圆形,表明两因素交互作用对修饰酶酸解活性的影响不够显著。
基于以上分析,进一步通过软件分析计算,得到修饰酶酸解活性达到最大值时的各因素水平为:反应pH 7.63、反应时间15.53 h、还原剂浓度0.20 mol/L、葡聚糖质量分数0.3%,此时修饰酶的酸解率预测值为37.28%。
2.4.3 最佳工艺条件的验证结果
为了验证模型预测的准确性,在反应pH 7.63、反应时间15.53 h、还原剂浓度0.20 mol/L、葡聚糖质量分数0.3%的条件下重复进行3 次实验,得到酸解率分别为37.80%、36.07%和38.83%,平均值为37.57%,相对误差为0.77%,与优化模型分析中所得到的理论值基本一致,证明此模型合理有效。因此采用响应面法优化的工艺条件参数准确,是可靠的实用依据。
2.5 ROL和dextran-ROL酶学性质
2.5.1 酶的最适反应温度
在反应温度为35、40、45、50、55、60 ℃条件下,以猪油和辛酸为底物,测定ROL及dextran-ROL的酸解活性,得到两种酶的最适反应温度。
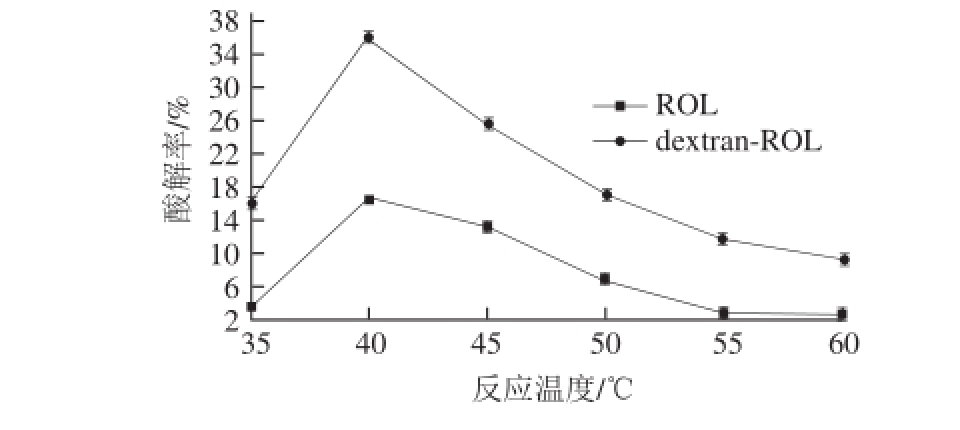
图8 原酶与修饰酶的最适反应温度
Fig.8 Optimum temperatures for ROL and dextran-ROL
由图8可知,ROL和dextran-ROL酸解活性随温度的变化趋势基本一致,随着反应温度的升高,ROL及dextran-ROL的酸解率先升高后降低,都在40 ℃时达到最大值,因此ROL和dextran-ROL的最适反应温度为40 ℃,此时dextran-ROL的酸解活性是ROL的2.2 倍,且ROL在55 ℃已经几乎失去活性,而dextran-ROL在60 ℃时仍具有一定的活性,所以dextran-ROL有一定耐高温能力。温度对酶催化活性的影响表现在适当升高温度可以提高催化反应速率,在相同时间内可获得更多的产物,但是当温度过高时会使酶蛋白发生变性而失去活性。
2.5.2 酶的热稳定性
将ROL和dextran-ROL溶液分别于在45、50、55、60、65℃水浴中保温30 min后,测定酶的酸解活性,定义酶活性最高一组的相对酶活力为100%。
由图9可知,dextran-ROL在40~45 ℃之间的热稳定性较好,保温30 min后,相对酶活力仍能保持在98%以上,之后随着温度的升高缓慢下降,在65 ℃保温30 min后,相对酶活力剩余不到5%,酶几乎已经失去全部活性。ROL的稳定性较差,随着温度的升高,相对酶活力大幅度下降。
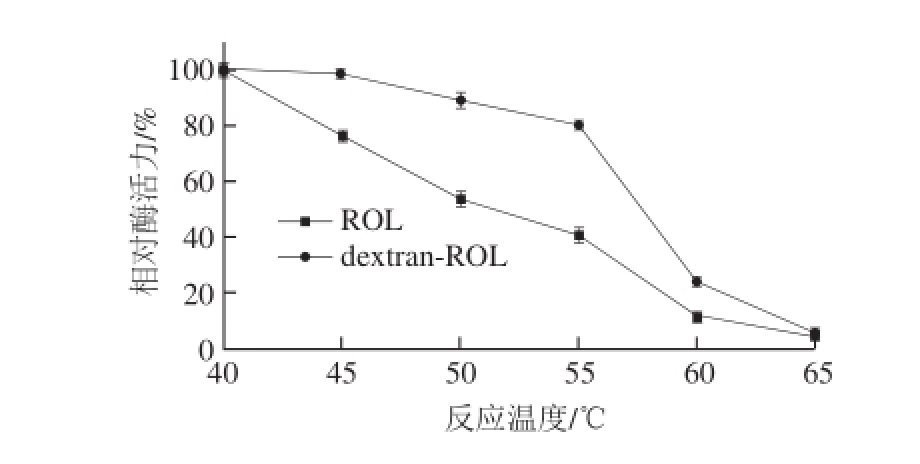
图9 反应温度对原酶与修饰酶稳定性的影响
Fig.9 Effect of temperature on the stability of the native and modified enzyme
2.5.3 酶的pH值稳定性
将酶溶于不同pH 4~9的磷酸盐缓冲液中,于4 ℃冰箱中保存1 h后,对酶的酸解活性进行测定。定义酶活性最高一组的相对酶活力为100%。
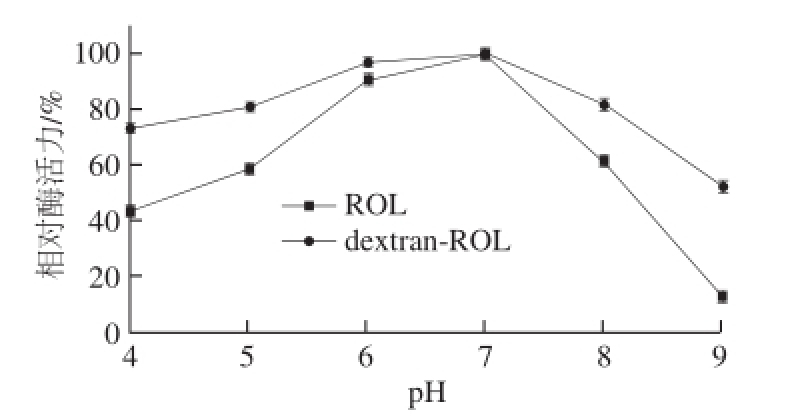
图10 pH值对原酶与修饰酶稳定性的影响
Fig.10 Effect of pH on the stability of the native and modified enzyme
由图10可知,dextran-ROL和ROL在中性溶液中保存后对其活性影响较小,仍能保持较高活力。dextran-ROL比ROL的耐酸耐碱性明显提高,在pH 6的弱酸性溶液中保存后,dextran-ROL仍保留了95%以上的相对酶活力,而ROL仅剩余90%;在弱碱性条件下(pH 8),dextran-ROL保留活力高于ROL 20%,且在pH 9时,ROL几乎失活,而dextran-ROL仍保留50%以上的相对酶活力。
经过化学修饰,ROL的稳定性有显著性的提高,主要有以下两个可能的原因:1)葡聚糖与酶蛋白分子表面的共价连接减弱了酶分子内部的热振动,使酶不易延展失活,即分子构象变得“刚性”,从而提高了酶的热稳定性 [26]。2)葡聚糖与酶表面的多位点交联,有效地提高了酶结构的整体稳定性,葡聚糖上的众多羟基有效地维持了酶表面的亲水性微环境 [27]。
本实验利用葡聚糖为修饰剂,采用化学修饰的方法,使ROL的酸解活性提高。在单因素试验的基础上,利用响应面法对修饰条件进行优化。当反应pH值为7.63、反应时间为15.53 h、还原剂浓度为0.20 mol/L、葡聚糖质量分数为0.3%时,dextran-ROL的酸解率达到最高值37.28%,验证实验结果与模型预测分析值基本相符。
通过响应面试验分析可知,各因素对修饰酶活性的影响大小依次为:反应时间>反应pH值>葡聚糖质量分数>还原剂浓度。且反应pH值与还原剂浓度、反应pH值与反应时间、还原剂浓度与葡聚糖质量分数的交互作用对修饰酶酸解活性影响显著。
实验还确定了dextran-ROL的最适反应温度为40 ℃。在最适反应温度下,dextran-ROL的酸解活性是ROL的2.2 倍。葡聚糖修饰使ROL的热稳定性及pH值稳定性均有了明显提高。
参考文献:
[1] TAKAHASHI S, UEDA M, TANAKA A. Independent production of two molecular forms of a recombinant Rhizopus oryzaelipase by KEX2-engineered strains of Saccharomyces cerevisiae[J]. Applied Microbiology and Biotechnology, 1999, 52(4): 534-540.
[2] LI W, CHEN B, TAN T. Comparative study of the properties of lipase immobilized on nonwoven fabric membranes by six methods[J]. Process Biochemistry, 2011, 46(6): 1358-1365.
[3] 徐坚, 杨立明, 王玉军, 等. 介孔分子筛SBA-15表面改性对脂肪酶固定化的强化作用[J]. 化工学报, 2006, 57(10): 2407-2410.
[4] 曾淑华, 杨江科, 徐莉, 等. 脂肪酶固定化及其稳定性研究[J]. 生物技术, 2006, 16(4): 54-57.
[5] 高阳, 谭天伟, 聂开立, 等. 大孔树脂固定化脂肪酶及在微水相中催化合成生物柴油的研究[J]. 生物工程学报, 2006, 22(1): 114-118.
[6] BARBOSA O, RUIZ O, ORTIZ C, et al. Modulation of the properties of immobilized CALB by chemical modification with 2,3,4-trinitrobenzenesulfonate or ethylendiamine. Advantages of using adsorbed lipases on hydrophobic supports[J]. Process Biochemistry,2012, 47(5): 867-876.
[7] 薛勇, 李树白, 张海涛, 等. 木瓜蛋白酶的化学修饰及对其酶活力的影响[J]. 化学学报, 2009, 67(20): 2390-2394.
[8] REET M T. Lipases as practical biocatalysts[J]. Current Opinion in Chemical Biology, 2002, 6(2): 145-150.
[9] ANG E L, OBBARD J P, ZHAO H M. Directed evolution of aniline dioxygenase for enhanced bioremediation of aromatic amines[J]. Applied Microbiology and Biotechnology, 2009, 81(6): 1063-1070.
[10] 熊亚红, 高敬忠, 郑坚鹏, 等. 丁二酸酐修饰对漆酶稳定性和除酚效率的影响[J]. 催化学报, 2011, 32(10): 1584-1587.
[11] 唐苏苏, 胡燚, 余定华, 等. 功能化离子液体修饰的SBA-15固定化Burkholderia cepacia脂肪酶[J]. 催化学报, 2012, 33(9): 1565-1571.
[12] 郭诤, 张根旺. 脂肪酶的结构特征和化学 修饰[J]. 中国油脂, 2003,28(7): 5-10.
[13] 张松平, 王平. 化学修饰: 提高酶催化性能的重要工具[J]. 生物加工过程, 2006, 4(1): 4-8.
[14] 于忠良, 陈义伦, 李娜. 根霉ZM-10脂肪酶的分离纯化和活性部位的化学修饰[J]. 食品与发酵工业, 2010, 36(2): 39-42.
[15] YVKSEL A, YESILCUBUK N S. Enzymatic production of human milk fat analogues containing stearidonic acid and optimization of reactions by response surface methodology[J]. Food Science and Technology, 2012, 46: 210-216.
[16] ESTEBAN L, JIMENEZ M J. Production of structured triacylglycerols rich in palmitic acid at sn-2 position and oleic acid at sn-1, 3 positions as human milk fat substitutes by enzymatic acidolysis[J]. Biochemical Engineering Journal, 2011, 54: 62-69.
[17] GODOY C A, de las RIVAS B, FILICE M, et al. Enhanced activity of an immobilized lipase promoted by site-directed chemical modification with polymers[J]. Process Biochemistry, 2010, 45(4): 534-541.
[18] 陈忍忍, 袁久刚, 余圆圆, 等. 壳聚糖修饰羊毛防毡缩用蛋白酶的制备及其酶学性质[J]. 食品与生物技术学报, 2012, 31(5): 505-510.
[19] SIDDIQUI K S, CAVICCHIOLI R. Extremophiles improved thermal stability and activity in the cold-adapted lipase B from Candida antarctica following chemical modification with oxidized polysaccharides[J]. Extremophiles, 2005, 9(6): 471-476.
[20] 伍志权, 黎春怡, 麦小珊, 等. 右旋糖苷修饰酵母蔗糖酶条件的筛选及修饰酶性质的研究[J]. 华南农业大学学报, 2009, 30(4): 48-52.
[21] 龚红升, 胡文斌, 廖列文, 等. 响应面法优化合成1,1,1,3,5,5,5-七甲基三硅氧烷[J]. 化工学报, 2013, 64(10): 3633-3639.
[22] 赵海珍, 陆兆新, 别小妹, 等. 脂肪酶酸解猪油制备减热量型功能性脂[J]. 应用化学, 2006, 23(2): 203-206.
[23] 朱启思, 唐家毅, 周瑢, 等. 猪油酸解制备人乳脂替代品的研究[J].中国油脂, 2009, 34(2): 39-42.
[24] MASON R L, GUNST R F, HESS J L. Statistical design and analysis of experiments[M]. New Jersey: John Wiley and Sons, 2003: 585-586.
[25] MURALIDHAR R V, CHIRUMAMILA R, MARCHANT R, et al. A response surface approach for the comparison of lipase production by Candida cylindracea usi ng two different carbon sources[J]. Biochem ical Engineering Journal, 2001, 9(1): 17-23.
[26] JENE Q, PERSON J, L OWE C. Surfactant modified enzymes:solubility and activity of surfactant-modified catalase in organic solvents[J]. Enzyme and Microbial Technology, 1997, 20(1): 69-74.
[27] 李苏, 闫明, 戈钧, 等. 葡聚糖修饰漆酶的制备及其催化特性和稳定性[J]. 化工学报, 2007, 58(12): 3046-3052.
Optimization of Rhizopus oryzae Lipase Modified with Dextran and Its Stability
CHI Tao
1, ZHANG Guofang
2, XU Xuebo
2, LI Chun
2, WU Yuting
2, LIU Libo
2,*, WANG Chenxu
2, LIU Ning
1,2,*
(1. Heilongjiang Dairy Industry Technical Development Center, Harbin 150028, China;2. Key Laboratory of Dairy Science, Ministry of Education, Northeast Agricultural University, Harbin 150030, China)
Abstract:In order to obtain a high activity of acidolysis, Rhizopus oryzae lipase (ROL) was modified with NaIO 4-oxidized dextran. The effects of reaction time, reaction pH, reductant concentration and dextran concentration on modification efficiency were studied. Box-Behnken experimental design and response surface methodology were used to optimize the modification conditions as follows: pH 7.63; reaction time, 15.53 h; reductant concentration, 0.20 mol/L; and dextran concentration, 0.3%. Under these conditions, the maximum predicted acidolysis rate of lipase of 37.28% was obtained, which was basically consistent with the experimental value. The effect of the above four factors on the acidolysis rate of lipase was in the decreasing order of reaction time, reaction pH, dextran concentration and reductant concentration. After chemical mod ification, ROL had obvious changes in absorption characteristics in the ultraviolet region. The maximum absorption wavelength was obviously different. At the optimum temperature of 40 ℃, the activity of dextran-ROL was increased 2.2 times compared to ROL, and the stability of dextran-ROL was also improved significantly.
Key words:Rhizopus oryzae lipase; chemical modification; dextran; response surface methodology; acid hydrolysis activity
中图分类号:TS252.54
文献标志码:A
文章编号:1002-6630(2015)13-0107-07
doi:10.7506/spkx1002-6630-201513021
收稿日期:2015-01-19
基金项目:“十二五”国家科技支撑计划项目(2011BAD09B0304);国家自然科学基金青年科学基金项目(31301519;31201397);黑龙江省科技厅面上项目(C201134)
作者简介:迟涛(1979—),女,工程师,硕士,研究方向为乳品科学。E-mail:ctlovegirl@sina.com
*通信作者:刘丽波(1979—),女,副研究员,博士,研究方向为乳品科学。E-mail:liboliu@126.com刘宁(1961—),男,教授,博士,研究方向为乳品营养。E-mail:ningliu66@126.com