 。应用SPSS 17.0软件进行显著性和相关性分析(P<0.05),采用Origin 8.5软件作图,运用QuantityOne 4.62软件对燕麦蛋白的SDS-PAGE图进行分析。
。应用SPSS 17.0软件进行显著性和相关性分析(P<0.05),采用Origin 8.5软件作图,运用QuantityOne 4.62软件对燕麦蛋白的SDS-PAGE图进行分析。
吴 寒,肖 愈,李 伟,芮 昕,王 丹,徐 笑,马宇潇,黄 璐,董明盛*
(南京农业大学食品科技学院,江苏 南京 210095)
摘 要:研究燕麦甜醅发酵过程中理化指标的动态变化,利用高效液相色谱法(high performance liquid chromatography,HPLC)测定燕麦发酵时产生的麦角固醇含量、利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)测定燕麦发酵过程中蛋白质水解情况。结果表明:随着发酵时间的延长,发酵产物pH值明显下降,最低达到pH 3.90;总酸含量随着发酵时间明显上升,最终达到0.74%;氨基酸态氮含量在24~36 h达到最大值0.06%,之后快速下降;还原糖含量在36 h内显著增加,达到41.17 g/100 g之后逐渐下降。麦角固醇含量持续上升,最终增加至213.64 ☒g/g。大分子燕麦蛋白被明显水解,小分子蛋白逐渐生成;其中分子质量为35.08 kD的蛋白水解速率最快,平均水解率为55.57%。
关键词:燕麦甜醅;甜酒曲;生化成分;麦角固醇;燕麦蛋白
燕麦属于禾本科燕麦属,按其外稃性状可将其分为带稃型燕麦(Avena sativa)和裸粒型燕麦(Avena nuda)两大类。我国燕麦栽培以裸粒型为主,占我国燕麦种植面积的90%以上,常称为裸燕麦,又称莜麦。燕麦甜醅是我国青海高原的民间小吃,广受汉、回、藏、土等多族人民的青睐。它以莜麦为原料,经甜酒曲长期发酵 而成,醅粒如果肉,醅汁似糖水,吃起来带有甘甜和醇酒的香味。
燕麦作为一种全价营养谷物,富含平衡全面的必需氨基酸、矿物质、维生素及膳食纤维,其中含有的活性多糖(β-葡聚糖)、亚油酸和生物活性成分(皂苷)具有保健作用 [1]。近几年来,国内外在燕麦的功能特性、保健功能等方面开展的研究日益增多,燕麦产品的开发越来越受到关注 [2-4]。胡博涵等 [5]报道采用糖化菌和啤酒酵母菌对燕麦进行发酵,可以酿造低酒精谷物发酵饮料。葛磊等 [6]报道以保加利亚乳杆菌和嗜热链球菌为菌种发酵剂生产燕麦发酵乳,不仅可提高必需氨基酸含量,降低植酸含量,还能够增加发酵后挥发性物质的种类,使产品具有良好的风味和保健功能。但以固态燕麦为研究对象对其发酵工艺及发酵过程中营养化学成分变化的研究仅见一些零星报道。周小莉 [7]优化了麦芽水解燕麦基质的工艺,确定了乳酸菌发酵燕麦水解燕麦糊基质开发合生元谷物发酵食品的可行性。张庆等 [8]则是研究了植物乳杆菌发酵燕麦酸面团过程中燕麦蛋白的溶解度和体外消化率、氨基酸组成和营养指标的变化情况,证实了通过发酵可以显著提高燕麦蛋白的溶解度和体外消化率。本实验以传统燕麦甜醅的发酵工艺为基础,研究了真菌固态发酵燕麦的相关情况,并围绕发酵过程中燕麦营养成分及微生物代谢产物的变化进行说明,为燕麦固态发酵产品的工业生产和相关功能性产品的开发提供了一定参考。
1.1 材料与试剂
燕麦仁,购于安徽燕之坊有限责任公司;甜酒曲安琪酵母股份有限公司。
正戊烷(优级纯) 沃凯试剂有限公司;甲醇(色谱纯) 南京试剂有限公司;麦角固醇 (色谱纯)美国Aladdin公司;标准蛋白 北京全式金生物技术有限公司。
1.2 仪器与设备
722S型可见分光光度计 上海精密科学仪器有限公司;64RL高速冷冻离心机 美国Beckman公司;PB-20型pH计 德国Sartarius公司;Mini-Protean型电泳仪 美国Bio-Rad公司;UVP GDS-8000型凝胶成像分析系统 美国UVP公司;Powerdry LL3000型冷冻干燥机 美国Heto公司;Agilent 1100型高效液相色谱仪美国Agilent公司;LHS-150SC恒温恒湿箱 上海一恒科技有限公司。
1.3 方法
1.3.1 燕麦发酵工艺流程 [9-12]
精选燕麦→浸泡→排出水分→煮燕麦→沥干冷却→装于容器→接种→保鲜膜封口,戳孔→发酵
1.3.2 发酵过程中的理化指标测定
pH值的测定 [13]:10 g捣碎的样品加入100 mL无CO 2蒸馏水,边浸泡边摇动15 min,过滤,取滤液用酸度 计直接测定。
总酸含量的测定 [13]:采用滴定法,用0.1 mol/L NaOH标准溶液滴定。总酸含量定义为1 g样品所含酸的百分含量,以乳酸计。
氨基酸态氮含量的测定 [13]:甲醛滴定法。
还原糖含量的测定 [14]:3,5-二硝基水杨酸比色 法。
1.3.3 发酵过程中麦角固醇含量测定 [15]
精确称取10 g燕麦样品,将其转移至三角瓶中,加入37.5 mL甲醇,25 mL 95%乙醇和5 g氢氧化钾。在100 ℃水浴中加热15 min后,加入适量蒸馏水,取上清液用正戊烷萃取,重复操作2 次。收集上清液,旋转蒸发(30 ℃,100 r/min,1 min),溶于0.5 mL甲醇中。高效液相色谱(high-performance liquid chromatography,HPLC)条件为,分析柱:C 18色谱柱 (12.5 mm×4.6 mm,5 ☒m);柱温25 ℃;流动相:100%甲醇;流速:1.5 mL/min;检测器:可变波长检测器;检测波长:282 nm。
1.3.4 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)法检测燕麦蛋白 [16-17]
准确称取样品冻干粉40 mg,加入0.1 mol/L Tris-HCl pH 8.8缓冲液,振荡1 h后离心 (12 000 ×g,20 min,5 ℃)。将蛋白质提取液与2×上样缓冲液1∶1(V/V)混匀,并在100 ℃沸水浴中保温3~5 min,取出待用。SDS-PAGE的浓缩胶体积分数为4%,分离胶体积分数为15%。电泳时,先将电压调至60 V,当样品进入分离胶后调节电压使之恒定在120 V,直至溴酚蓝移至离底部约0.5 cm时,切断电源,停止电泳。
1.4 数据处理与分析
实验数据均是3 次重复实验的平均值,结果表示为
 。应用SPSS 17.0软件进行显著性和相关性分析(P<0.05),采用Origin 8.5软件作图,运用QuantityOne 4.62软件对燕麦蛋白的SDS-PAGE图进行分析。
。应用SPSS 17.0软件进行显著性和相关性分析(P<0.05),采用Origin 8.5软件作图,运用QuantityOne 4.62软件对燕麦蛋白的SDS-PAGE图进行分析。
2.1 发酵过程中理化指标变化
2.1.1 发酵产物温度变化

图1 燕麦甜醅发酵过程中产物温度的变化
Fig.1 Temperature change during fermentation of sweet oat
温度的变化可以有效且直接地反映发酵的情况,由图1可知,发酵最初,燕麦甜醅的中心温度下降至培养温度,约30 ℃,之后迅速上升,在发酵24 h时达到最高温度34.20 ℃,之后呈现平缓下降的趋势,最终稳定在33.90 ℃。发酵前期的降温与淀粉降解速率慢有着很大关系,由于燕麦种皮较厚,微生物较难将其中的淀粉利用;之后甜醅的品温提高,说明微生物的生长代谢进入旺盛期,大量产热,逐渐进入酒精发酵阶段;在发酵48 h后,温度的变化逐渐趋于稳定,可能是由于微生物的活动进入稳定期所致。
2.1.2 pH值变化
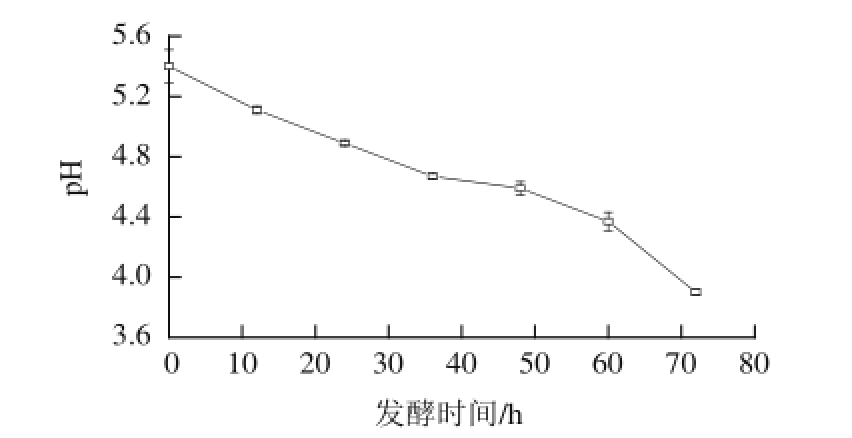
图2 燕麦甜醅发酵过程中pH值的变化
Fig.2 Cha nge in pH of sweet fermented oat during fermentation
燕麦甜醅发酵过程中的pH值与微生物繁殖和代谢产物的积累有密切关系,是微生物在特定环境下代谢活动的综合指标,能够判断酒精发酵是否正常。由图2可知,甜酒药发酵后的燕麦,其pH值在0~36 h期间持续显著下降(P<0.05),降低到4.67。之后pH值降低缓慢,在36~48 h期间下降不显著,这可能是由于发酵后期糖类物质供应不足,使生成的部分碳源被微生物利用所导致的结果。
2.1.3 总酸含量变化
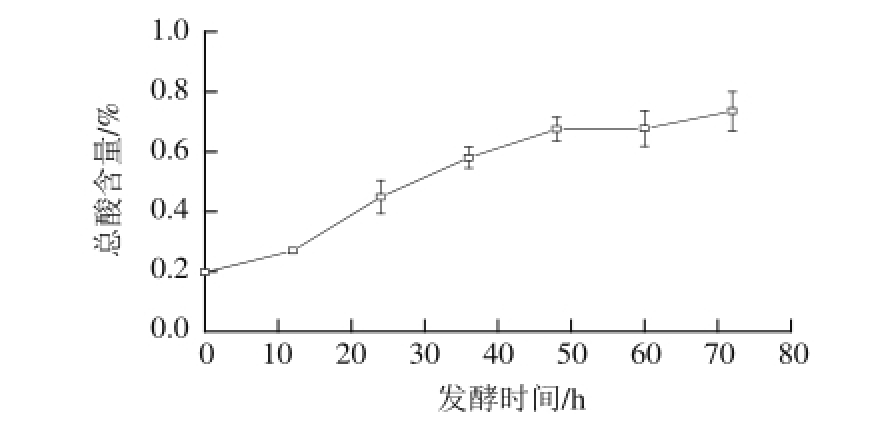
图3 燕麦甜醅发酵过程中总酸含量的变化
Fig.3 Change in total acidity of sweet fermented oat during fermentation
由图3可知,0~48 h燕麦甜醅发酵产生的总酸含量随发酵时间延长显著上升(P<0.05),之后上升缓慢,最终达到0.74%。总酸含量的变化趋势与pH值的下降呈显著负相关性(P<0.05),说明该发酵产生的酸种类较少,酸性较强,有利于对产品质量的控制 [18]。由于本实验研究所用甜酒曲的主要成分为米根霉,因此,发酵过程中pH值、总酸的变化与米根霉分解燕麦中淀粉,利用碳源从而大量产酸有着密切关系 [19]。
2.1.4 还原糖和氨基酸态氮含量变化
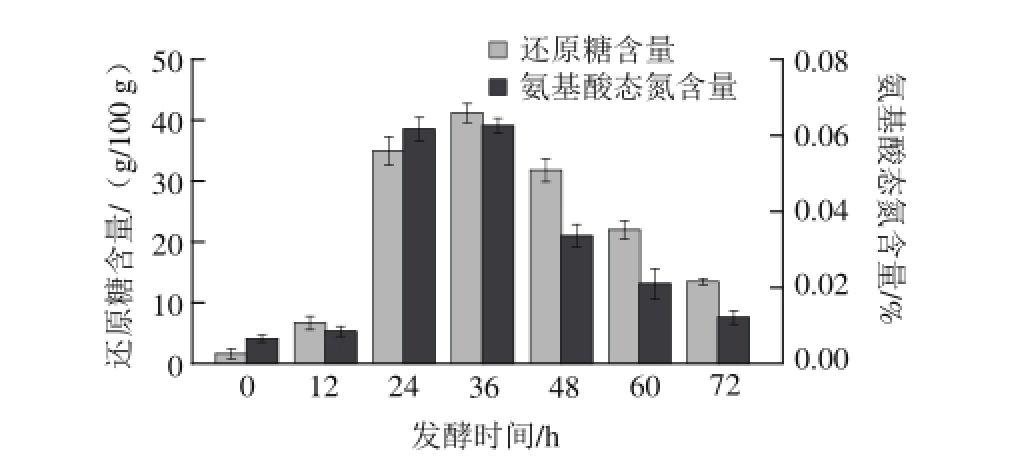
图4 燕麦甜醅发酵过程中还原糖和氨基酸态氮含量的变化
Fig.4 Changes in reducing sugar content and ammonium nitrogen content of sweet fermented oat during fermentation
还原糖作为微生物可直接利用的碳源,在发酵过程中的含量变化会直接影响微生物的生长情况,反映不同微生物相互作用的协调程度。由图4可知,在0~36 h内,由于甜酒曲中的霉菌分泌大量糖化酶,还原糖含量明显增加(P<0.05),最大值可达41.17 g/100 g。36 h后糖化酶活力则逐渐降低,还原糖被利用于酒精发酵,含量则随之显著下降(P<0.05)。发酵过程中较高的还原糖含量不仅增加了燕麦甜醅的甘甜口感,而且有利于延长甜醅的贮藏时间 [20]。
氨基酸态氮的含量变化与还原糖含量变化呈相同趋势,总体先升高再下降。在0~24 h期间,氨基酸态氮含量显著提高(P<0.05),直至36 h达到最大值0.06%,之后则显著下降(P<0.05),最小值为0.01%。由于前期燕麦的煮沸处理增加了蛋白的溶解度,在发酵过程中微生物才能够更有效地利用燕麦蛋白,分解产生自身生长所需的小分子氮源。与此同时,发酵使得蛋白质水解,氨基酸态氮含量增加,多种营养全面的氨基酸有效成分生成,极大提高了人体对谷物蛋白的利用率 [21-22]。此外,不同呈味氨基酸的产生与相互协调也对燕麦甜醅风味的形成发挥着重要作用 [23]。
2.2 发酵过程中麦角固醇含量变化
麦角固醇是真菌细胞膜的重要组成成分,其含量变化可以一定程度上反映甜酒曲中微生物的生长情况。如图5所示,图谱A和图谱B分别表示了麦角固醇标品和样品的出峰情况,虚线处的保留时间为7.88 min,并且该处的峰面积随着标品质量浓度的升高表现出良好的线性增加趋势。由此可知,麦角固醇在HPLC图中的出峰时间为7.88 min,处理样品图谱时可针对该处的峰进行分析。
由图6可知,燕麦甜醅发酵过程中产生的麦角固醇在0~72 h显著增加(P<0.05),最终在72 h达到最大值213.64 ☒g/g。作为真菌细胞膜的重要组分,麦角固醇在确保膜结构的完整性、膜的流动性、细胞活力及物质运输等方面起着重要作用,其含量的持续增加说明了甜酒曲中真菌在燕麦中的生长情况良好。此外,麦角固醇也是VD 2的前体物质,为人体对钙磷的吸收利用发挥着重要作用 [24]。
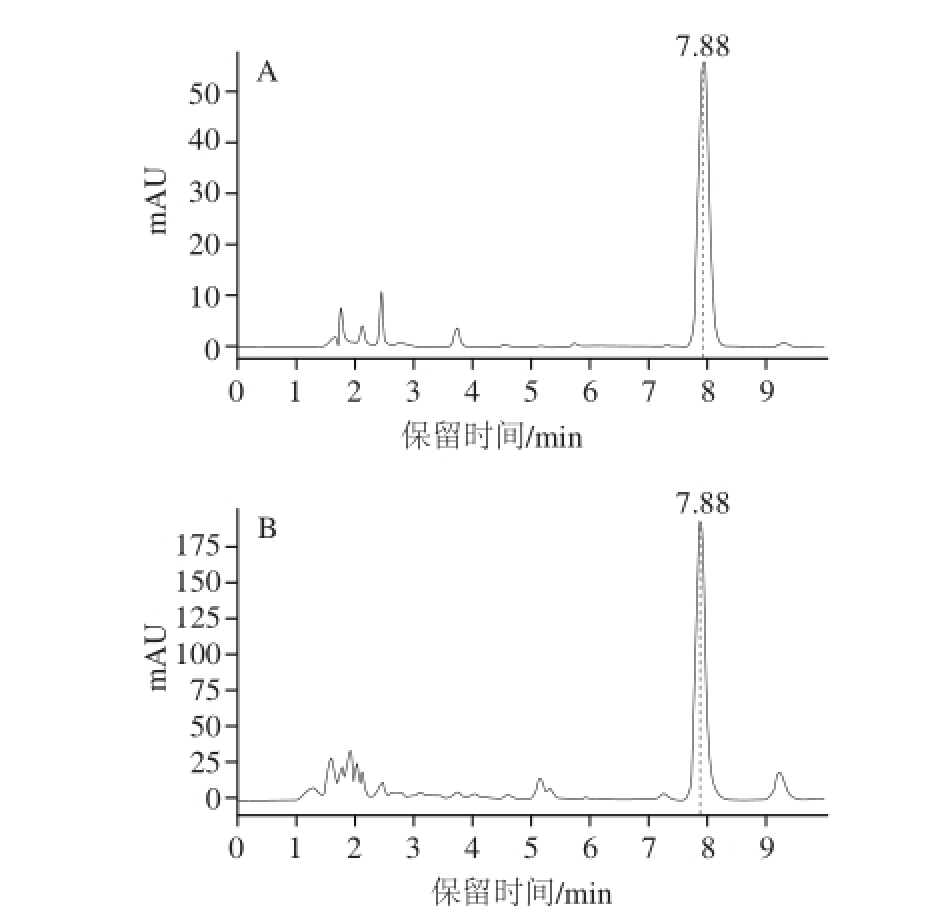
图5 麦角固醇高效液相色谱图
Fig.5 HPLC chromatogram of ergosterol standard and ergosterol from sweet fermented oat
A. 麦角固醇标准品;B. 燕麦甜醅麦角固醇。

图6 燕麦甜醅发酵过程中麦角固醇含量的变化
Fig.6 Change in ergosterol content of sweet fermented oat during fermentation
2.3 发酵过程中燕麦蛋白水解情况
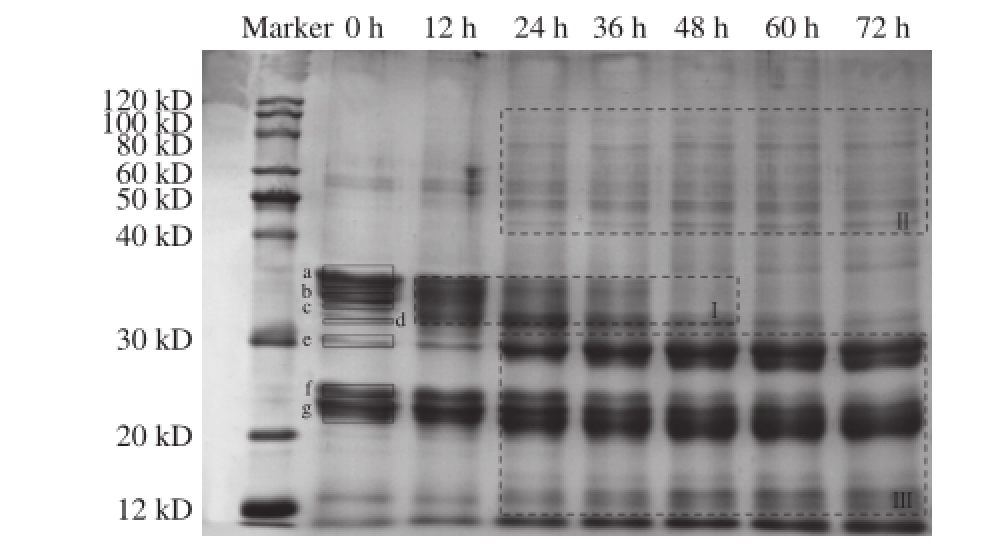
图7 发酵过程中燕麦蛋白的SDS-PAGE图
Fig.7 SDS-PAGE patterns of oat proteins from sweet fermented oat during fermentation
由图7可知,煮熟后的燕麦蛋白在发酵0 h时的分子质量主要分布在12~40 kD,共有7 条可见条带,分别为条带a(35.08 kD)、条带b(33.52 kD)、条带c(32.75 kD)、条带d(31.89 kD)、条带e(29.59 kD)、条带f(23.78 kD)和条带g(22.42 kD),并且根据相关报道可推测 [25-26],条带d和条带g分别为燕麦的12S球蛋白降解而成的α蛋白多肽亚基和β蛋白多肽亚基。除此之外,在分子质量为50~60 kD处也存在少量的燕麦蛋白条带。
表1 发酵过程中燕麦蛋白的降解情况
Table1 Degradation of oat proteins during fermentation
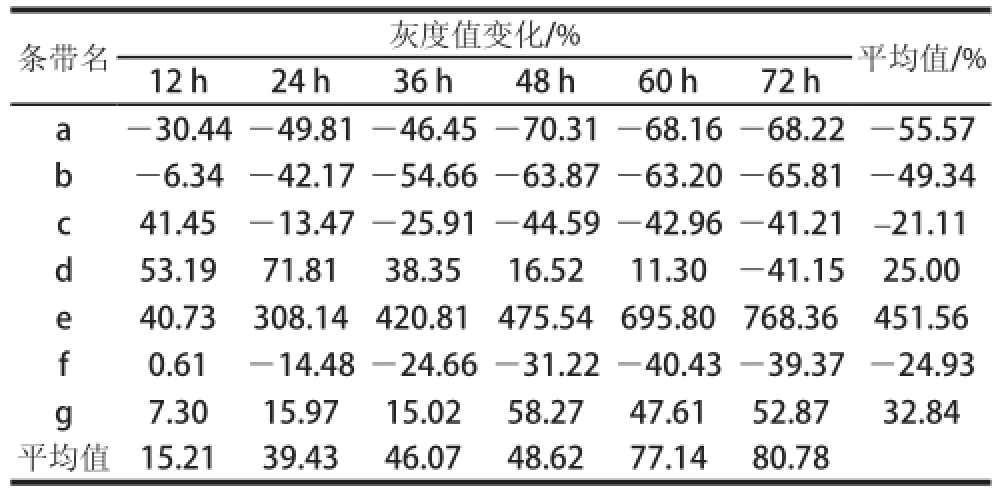
注:负值数据表示该条带的灰度值相对降低,说明此处燕麦蛋白被水解;正值数据表示该条带的灰度值相对增加,说明此处产生燕麦蛋白。
条带名灰度值变化/%平均值/% 12 h24 h36 h48 h60 h72 h a-30.44-49.81-46.45-70.31-68.16-68.22-55.57 b-6.34-42.17-54.66-63.87-63.20-65.81-49.34 c41.45-13.47-25.91-44.59-42.96-41.21-21.11 d53.1971.8138.3516.5211.30-41.1525.00 e40.73308.14420.81475.54695.80768.36451.56 f0.61-14.48-24.66-31.22-40.43-39.37-24.93 g7.3015.9715.0258.2747.6152.8732.84平均值15.2139.4346.0748.6277.1480.78
在整个发酵过程中不同的燕麦蛋白的条带变化情况均有所不同,被水解的蛋白主要集中在区域Ⅰ,由水解产生的小分子蛋白则集中在区域Ⅱ和区域Ⅲ,其中区域Ⅱ中的蛋白亚基主要是由分子质量大于120 kD的蛋白降解而成的。由QuantityOne 4.62软件分析得表1。通过比较,条带a、b、c、d在0~48 h降解明显,通过计算,最高降解率为70.31%,48~72 h期间则无明显变化;条带f在较长时间不断被降解,直至60 h达到稳定,最终降解率为39.37%。另一方面,条带d处的蛋白含量在0~24 h快速增加,之后逐渐减少;条带g处的蛋白含量则是先不断上升,在48 h时生成率达到最大值58.27%后略有减少;对于条带e处的蛋白,其含量随着发酵时间的延长,增加最快,增幅最大,平均增长率可达451.56%。根据上述分析,燕麦蛋白在燕麦甜醅生产过程中总体表现出前期大量水解,后期大量生成;大分子蛋白逐渐减少,小分子蛋白逐渐产生的情况。
本实验通过对甜酒曲发酵燕麦过程中理化成分的动态变化、微生物代谢生成麦角固醇的含量变化以及发酵过程中燕麦蛋白水解情况进行研究,结果表明在燕麦甜醅的制作过程中,燕麦的pH值明显下降,利于抑制发酵过程中腐败菌的生长,提高产品的安全性;氨基酸态氮和还原糖在发酵前期的快速增加,说明甜酒曲中微生物在生长过程中将许多大分子物质有效分解为易被吸收利用的小分子物质,为后期发酵提供了天然且充足的氮源及碳源。发酵至36~48 h,微生物对燕麦中蛋白质和糖类物质的利用程度达到最大,发酵基本彻底;同时,燕麦甜醅的酸甜口感和风味物质也在该阶段大量产生,这对于燕麦甜醅在工业生产中发酵终点的确定提供了理论依据。麦角固醇含量在0~72 h持续增加,反映了甜酒曲中真菌能够以燕麦为载体,持续快速生长,也说明了麦角固醇生物合成新途径和相关燕麦功能性产品的开发具有可能性。最后通过SDS-PAGE分析,从燕麦蛋白亚基的水平上解释了甜酒曲中微生物对不同分子质量的燕麦蛋白的降解情况,结果表明,大分子燕麦蛋白在前期水解较为明显,而在24~72 h则表现为小分子燕麦蛋白的明显增加。在此基础上,方便进一步探究燕麦蛋白被微生物降解后所生成的小分子肽的生物活性,为开发燕麦生物活性产品提供了新思路。
本实验所研究的燕麦甜醅是基于燕麦在真菌作用下的固态发酵,整个过程较为缓慢,周期较长,因此,在后续的研究中可以进一步讨论提高燕麦固态发酵速率的方法。对燕麦甜醅功能性成分的研究和益生产品的开发工作也将继续展开。
参考文献:
[1] 张燕. 熟化工艺对燕麦传统食品营养及加工品质的影响[D]. 杨凌:西北农林科技大学, 2013: 1-10.
[2] FENG Xinmei, PASSOTH V, EKLUND-JONSSON C, et al. Rhizopus oligosporus and yeast co-cultivation during barley tempeh fermentation-nutritional impact and real-time PCR quantification of fungal growth dynamics[J]. Food Microbiology, 2007, 24(4): 393-402.
[3] 葛磊. 燕麦发酵饮料的研制[D]. 无锡: 江南大学, 2012: 1-4.
[4] 王志伟. 谷物发酵食品-酸粥生产工艺的研究[D]. 呼和浩特: 内蒙古农业大学, 2010: 1-5.
[5] 胡博涵, 刘素纯, 夏延斌. 燕麦谷物酒精发酵饮料的研究[J]. 作物研究, 2011, 25(2): 145-148.
[6] 葛磊, 张晖, 王立, 等. 一种燕麦乳酸菌发酵饮料的研究[J]. 粮食与饲料工业, 2011(12): 26-29.
[7] 周小莉. 乳酸菌在燕麦基质中生长特性研究[D]. 无锡: 江南大学,2012: 15-25.
[8] 张庆, 王凤, 黄卫宁, 等. 植物乳杆菌发酵对燕麦蛋白溶解度和营养特性的影响[J]. 食品科学, 2011, 32(17): 204-209.
[9] 田亚红, 王巍杰, 贾长虹, 等. 甜酒酿发酵工艺及过程中成分变化规律的研究[J]. 食品科技, 2008, 33(6): 37-39.
[10] 蔡柳, 熊兴耀, 张婷婷, 等. 甜酒酿的发酵工艺及其稳定性研究[J].现代食品科技, 2012, 28(5): 527-528.
[11] 任飞, 韩珍琼. 甜酒酿发酵机理的初步研究[J]. 中国酿造, 2012,31(8): 140-142.
[12] 于军. 青稞清酒酿造工艺研究[J]. 酿酒科技, 2011(9): 35-37.
[13] 侯曼玲. 食品分析[M]. 北京: 化学工业出版社, 2004: 38-129.
[14] 王福荣. 酿酒分析与检测[M]. 北京: 化学工业出版社, 2005: 9-35.
[15] FENG Xinmei, ERIKSSON A R B, SCHNURER J. Growth of lactic acid bacteria and Rhizopus oligosporus during barley tempeh fermentation[J]. International Journal of Food Microbiology, 2005,104(3): 249-256.
[16] NIKOLIC L, DORDEVIC V, TORBICA A, et al. Legume s seed storage proteins characterization by SDS-PAGE and Lab-on-a-chip electrophoresis[J]. Journal of Food Composition and Analysis, 2012,28(2): 75-80.
[17] LIM J Y, KIM J J, LEE D S, et al. Physicochemical characteristics and production of whole soymilk from Monascus fermented soybeans[J]. Food Chemistry, 2010, 120(1): 255-260.
[18] 曹妍, 杜木英, 阚建全, 等. 多菌种发酵青稞酒化学成分变化研究[J].食品科学, 2012, 33(11): 252-256.
[19] 王蓉, 王远亮, 陈国平, 等. 米根霉发酵生产L(+)-乳酸研究进展[J].重庆大学学报: 自然科学版, 2004, 27(12): 95-97.
[20] 任飞, 韩珍琼. 甜酒酿发酵机理的初步研究[J]. 中国酿造, 2012,31(8): 140-143.
[21] 杜木英. 西藏青稞酒发酵微生物及酿造技术研究[D]. 重庆: 西南大学, 2008: 42-46.
[22] 杜木英, 伍怡郦, 阚建全, 等. 传统青稞酒发酵过程中化学成分动态变化研究[J]. 食品工业科技, 2007, 28(9): 94-98.
[23] 谷镇, 杨焱. 食用菌呈香呈味物质研究进展[J]. 食品工业科技, 2013,34(5): 363-367.
[24] 邓玉清, 王纪, 虞龙. 微生物麦角甾醇的研究进展[J]. 微生物学杂志,2001, 21(3): 45-47.
[25] 刘刚. 燕麦蛋白结构、自助装性质及其纳米纤维形成研究[D]. 广州: 华南理工大学, 2011: 34-45.
[26] CHANG Yuwei, ALLI I, KONISHI Y, et al. Characterization of protein fractions from chickpea (Cicer arietinum L.) and oat (Avena sativa L.) seeds using proteomic techniques[J]. Food Research International, 2011, 44(9): 3094-3104.
Dynamic Changes in Biochemical Components during Fermentation of Sweet Fermented Oat
WU Han, XIAO Yu, LI Wei, RUI Xin, WANG Dan, XU Xiao, MA Yuxiao, HUANG Lu, DONG Mingsheng*
(College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Abstract:Tianpei (sweet fermented oat) is a famous local snack in Lanzhou which is traditionally made by fermentation of highland barley and oat for 2 or 3 days. In this paper, during fermentation, physicochemical changes were investigated, and the production of ergosterol and proteolysis were monitored by high performance liquid chromatography (HPLC) an d sodium dodecyl sulfate polyacrylamide-gel electrophoresis (SDS-PAGE), respectively. Results showed that pH value decreased rapidly and reached the lowest level of 3.90, and total acidity showed a gradual increase to the highest level of 0.74% as the fermentation progressed. The content of ammonium nitrogen increased to the highest value of 0.06% during 24-36 h and then dropped rapidly. Reducing sugar content increased significantly to the highest value of 41.17 g/100 g during the first 36 h and then decreased until the end of fermentation. Continually, the content of ergosterol augmented and reached its final value of 213.64 ☒g/g. High-molecular-weight oat proteins were significantly hydrolyzed during fermentation, especially for the protein with a molecular weight of 35.08 kD, which had a mean degradation rate of 55.57%.
Key words:sweet fermented oat; traditional culture starter; biochemical components; ergosterol; oat protein
中图分类号:TS210.4
文献标志码:A
文章编号:1002-6630(2015)13-0114-05
doi:10.7506/spkx1002-6630-201513022
收稿日期:2014-09-22
基金项目:“十二五”国家科技支撑计划项目(2013BAD18B01-4);国家高技术研究发展计划(863计划)项目(2011AA100903);国家自然科学基金青年科学基金项目(31201422);国家自然科学基金面上项目(31371807);江苏高校优势学科建设工程资助项目(PAPD)
作者简介:吴寒(1989—),女,硕士研究生,研究方向为食品微生物与生物技术。E-mail:blesscatherine2011@hotmail.com
*通信作者:董明盛(1961—),男,教授,博士,研究方向为食品微生物与生物技术。E-mail:dongms@njau.edu.cn