姚璐晔 1,李 想 2,邢 鋆 1,高 杏 1,曹叶萍 1,顾佳佳 1
(1.常熟理工学院生物与食品工程学院,江苏 常熟 215500;2.江南大学生物工程学院,江苏 无锡 214122)
摘 要:以甲醛降解菌——拟青霉菌(Paecilomyces variotii)CSLG1为出发菌株,对其进行紫外诱变,并考察突变株对甲醛的降解特性。选用功率15 W的紫外灯、照射距离30 cm、照射时间30 s、致死率为88%的诱变强度对出发菌株进行紫外诱变;通过初筛、复筛选育出一株甲醛抗性及其降解能力明显提高的诱变菌株F1-23。结果表明:F1-23临界甲醛抗性质量浓度为7.88 g/L,比诱变前提高22.2%;甲醛脱氢酶酶活力为83.6 U/mg,提高了23.8%。连续传代5 代,诱变菌株F1-23的甲醛抗性和降解力基本不变,证实其具有良好的遗传稳定性。诱变菌株F1-23对甲醛的抗性及降解能力均较出发菌株高。
关键词:甲醛降解;拟青霉菌;紫外诱变;甲醛脱氢酶;降解率
甲醛是一种常见的环境污染物,其特点为毒性大,毒性作用多样 [1-2]。常见的去除方法有活性炭去除、光催化去除、臭氧分解、甲醛去除剂、植物分解、微生物降解法 [3-4]、高负荷生物滤池、吸附再生曝气池等 [5]。微生物法则相对以生态环境中的有益菌为材料,成本低,效率好,且无二次污染。因此,甲醛的生物降解已成为研究的热点。
已有研究报道 [6],在自然界中分离得到的甲醛降解菌大部分为细菌和少部分的真菌。目前,甲醛降解细菌的种类大致有恶臭假单胞菌、铜绿假单胞菌、假产碱假单胞菌、睾丸酮假单胞菌、甲基营养菌等,它们能以甲醛为唯一的碳源和能源进行生长,具有一定的甲醛降解能力。虽然生物法可以将甲醛完全去除,但生物法所能降解的质量浓度较低,一般为0.1~0.8 g/L甚至更低,而化工废水中的甲醛含量高达10 g/L,这就需要选育耐受浓度更高、降解能力更强的菌株。
传统的微生物人工育种方法有:诱变育种、杂交育种(包括原生质体融合)和基因工程育种 [7]。其中诱变育种最为广泛,是采用物理或化学因素处理微生物细胞群体,促使其中少数细胞中的遗传物(主要是DNA)结构发生变化,从而引起微生物遗传性状发生改变,然后从群体中筛选出优良突变菌株的过程 [8]。物理诱变法设备简单、操作方便、价格低廉,目前广泛应用于微生物;而紫外线是常用的物理诱变因子。本研究以实验室保藏的甲醛降解菌拟青霉菌(Paecilomyces variotii)CSLG1为研究对象,通过紫外诱变筛选降解能力高、综合性状优良且遗传稳定的菌株,以期为进一步理论研究及应用提供良好的菌种资源。
1.1 菌种
甲醛降解菌——拟青霉菌CSLG1,保藏于常熟理工学院生物与食品工程学院生物示范中心实验室 [6]。
1.2 试剂及其配制
葡萄糖、NaNO 3、MgSO 4、FeSO 4、牛肉浸膏、KCl、乙酸铵、冰乙酸、乙酰丙酮均为分析纯 江苏省强盛化工有限公司;甲醛溶液(37%~40%) 苏州市振兴化工厂。
乙酰丙酮溶液 [9]:50 g乙酸铵、6 mL冰乙酸及0.5 mL乙酰丙酮试剂溶于100 mL水中。此溶液4 ℃冷藏。
邻甲苯胺试剂:称取硫脲2.5 g,用750 mL冰醋酸溶解,加邻甲苯胺150 mL和2.4%硼酸100 mL,用冰醋酸定容至1 000 mL。
pH 7.5、0.05 mol/L磷酸钾缓冲液:0.34 g K 2HPO 4溶于50 mL去离子水中,用1 mol/L KOH 在37 ℃调节pH值为7.5。
1.3 仪器与设备
722型分光光度计 上海菁华科技仪器有限公司;TU-1901双光束紫外-可见分光光度计 北京普析通用仪器有限责任公司;EL-20台式pH计 梅特勒-托利多仪器有限公司;紫外诱变台 济南杰康净化设备厂。
1.4 培养基
液体培养基(g/L):葡萄糖4、牛肉膏 0.4、KCl 0.05、MgSO 4·7H 2O 0.1、FeSO 4·3H 2O 0.01,pH 7.5。添加1 070 μL质量分数37.25%甲醛至90 mL的液体培养基中,配制甲醛质量浓度为8 g/L。
固体培养基(g/L):葡萄糖30、NaNO 32、K 2HPO 4·3H 2O 1、KCl 0.5、MgSO 4·7H 2O 0.5、FeSO 4·3H 2O 0.01、琼脂20、甲醛0.3,pH 6.7。
甲醛梯度双层琼脂培养基:在无菌平皿中倒入固体培养基,垫起平皿一侧,使培养基呈现三角状,待培养基凝固后,将平皿放平,倒入含有8 g/L的甲醛固体培养基,冷凝。
1.5 实验方法
1.5.1 诱变
1.5.1.1 制备孢子液
利用无菌脱脂棉,过滤从斜面上洗脱的孢子,并将孢子用玻璃珠充分打散,采用血球计数板进行观察计数,控制浓度在10 7个/mL左右,并确保无菌丝。
1.5.1.2 涂布孢子液
将孢子液适当稀释,涂布平板计数,作为计算紫外诱变致死率和正突变率的基础。
1.5.1.3 紫外诱变
采用15 W紫外灯,确定照射距离为30 cm,在照射时间为15、30、60、120、180 s和240 s的诱变强度下诱变。诱变结束后,将孢子液接入不含甲醛的液体培养基,避光、25 ℃、180 r/min培养6 h,稀释涂布,避光25 ℃培养过夜,观察计数。
1.5.1.4 确定最佳诱变强度
根据诱变后各平板上成活菌种个数计算在每一诱变强度下的死亡率,以确定最佳诱变强度。
式中:a为诱变前涂布平板菌落数/(CFU/mL);b为诱变后涂布平板菌落数/(CFU/mL)。
紫外诱变的致死率在90%左右的诱变强度最佳 [10],因此选择在此诱变强度下诱变。
1.5.1.5 初筛 [11]
诱变后采用梯度平板法筛选,吸取0.2 mL菌悬液涂布于甲醛梯度双层琼脂培养基,25 ℃培养10 d,挑选耐受浓度高的单菌落。
1.5.1.6 复筛
将初筛得到的菌株置于含有一定甲醛浓度的液体培养基中, 25 ℃、180 r/min培养5 d,测定生物量。
1.5.1.7 遗传稳定性
将筛选得到的菌株在其最高耐受甲醛质量浓度下连续接种5 代,检测生物量;在其最高甲醛质量浓度下连续接种5 代,测定其降解能力,确定遗传稳定性。
1.5.2 检测方法
1.5.2.1 甲醛质量浓度测定 [12]
参照修订后的HJ601—2011《水质 甲醛的测定 乙酰丙酮分光光度法》,试样稀释100 倍后取0.05 mL,加入1 mL乙酰丙酮溶液、4.95 mL蒸馏水,沸水浴煮沸10 min,室温冷却放置10 min,在414 nm波长处测其吸光度,从标准曲线上查出对应的甲醛含量。
1.5.2.2 葡萄糖质量浓度测定 [13]
过滤菌丝后的滤液,稀释10 倍,取0.2 mL加入5 mL邻甲苯胺试剂于沸水浴保温8~10 min,冷却至室温后,在412 nm波长处测定吸光度,在标准曲线上查出对应的质量浓度。
1.5.2.3 甲醛脱氢酶酶活力测定 [14]
滤纸过滤菌液,取菌丝置于冰浴中,菌丝-石英砂-缓冲液(pH 7.5)按1∶1∶2的比例研磨,4 ℃、10 000 r/min离心10 min,上清液即为粗酶液。
取0.2 mL去离子水、2 mL缓冲液(pH 7.5)、0.5 mL β-烟酰胺腺嘌呤二核苷酸(β-nicotinamide adenine dinucleotide,β-NAD)、0.1 mL甲醛和0.1 mL谷胱甘肽,于37 ℃水浴锅恒温,加0.1 mL粗酶液,反应5 min,在340 nm波长处测定吸光度。空白组加入0.1 mL缓冲液(pH 7.5)代替酶液。
酶活力单位的定义:在pH 7.5、30 ℃条件下,每分钟催化生成1 μmol的NADH为1 个酶活力单位,U/mg菌丝体表示。

式中:t为反应时间/min;6.22为每毫摩尔NADH在340 nm波长处的吸光系数。
1.5.2.4 生物量测定 [15]
将定量滤纸于60 ℃恒温干燥至恒质量,称质量,记录滤纸净质量(m 1,g)。用该滤纸过滤100 mL培养液,自然过滤,将滤纸于60 ℃恒温干燥至恒质量,称质量,记录质量(m 2,g)。两者之差表示菌体生物量,以生物量表示100 mL菌液中菌丝体浓度。
2.1 诱变时间的选择
前期实验确定照射距离为30 cm,分别选取15、30、60、120、180 s和240 s对出发菌株CSLG1进行照射。由图1可知,在照射仅15 s时,其致死率已达到75%,由此可见出发菌株对紫外线较敏感。根据致死率为90%左右的诱变效果最好,选取诱变时间为30 s。

图1 出发菌株CSLG1的致死曲线
Fig.1 Lethality curve of the initial strain CSLG1
2.2 菌种筛选
2.2.1 初筛
初筛采用甲醛梯度双层琼脂培养基筛选,随着甲醛质量浓度的提高,平板上菌落生长的时间明显延长,菌落数减少。在培养初期(≤72 h),在甲醛低质量浓度区域观察到孢子萌发后形成的菌落,菌落形成之初,以其萌发形成凸点为中心,呈放射状生长白色菌丝,后逐渐蔓延并在白色菌丝上生成孢子。高质量浓度区域孢子萌发时间较长,出现在培养144~240 h,在高质量浓度区域菌落彼此未接触前,挑取单菌落进行复筛。图2为筛选平板经25 ℃培养10 d即240 h的结果。

图2 紫外诱变后初筛结果
Fig.2 The first round of screening of mutant strains
2.2.2 复筛
通过初筛确定了60 个菌株,进行复筛。通过试管培养,逐步提高甲醛质量浓度;以生物量为指标,筛选出10 株菌株,此时甲醛质量浓度为6.85 g/L。筛选结果如表1所示,当甲醛质量浓度为7.88 g/L时,F1-23菌株和F1-48菌株仍能生长,但F1-23的长势明显优于F1-48菌株,菌丝多且厚,生物量亦为其1.6 倍,因此确定F1-23菌株为最终实验菌株。
表1 复筛结果
Table1 The second round of screening of selected mutants
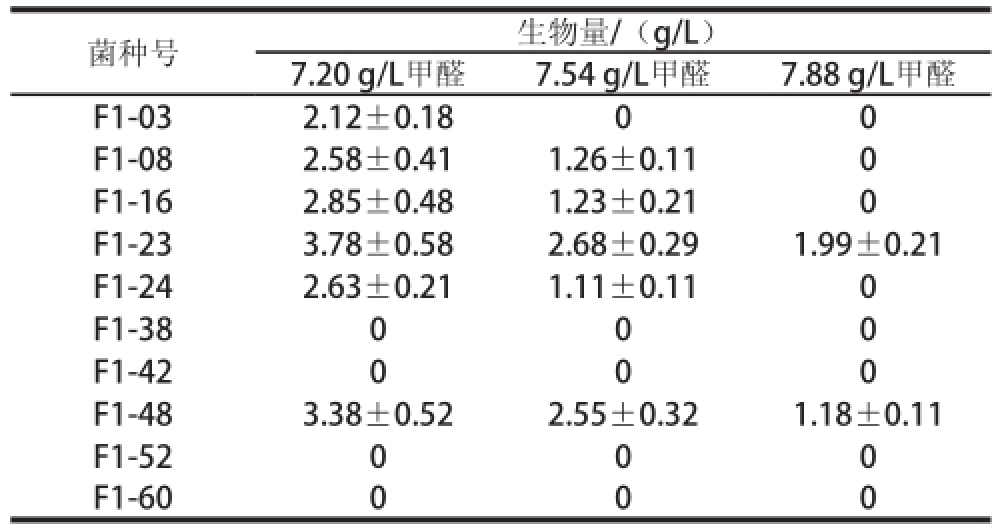
菌种号生物量/(g/L)7.20 g/L甲醛7.54 g/L甲醛7.88 g/L甲醛F1-032.12±0.1800 F1-082.58±0.411.26±0.110 F1-162.85±0.481.23±0.210 F1-233.78±0.582.68±0.291.99±0.21 F1-242.63±0.211.11±0.110 F1-38000 F1-42000 F1-483.38±0.522.55±0.321.18±0.11 F1-52000 F1-60000
2.3 诱变菌株F1-23与出发菌株CSLG1的性能比较
2.3.1 菌落形态变化
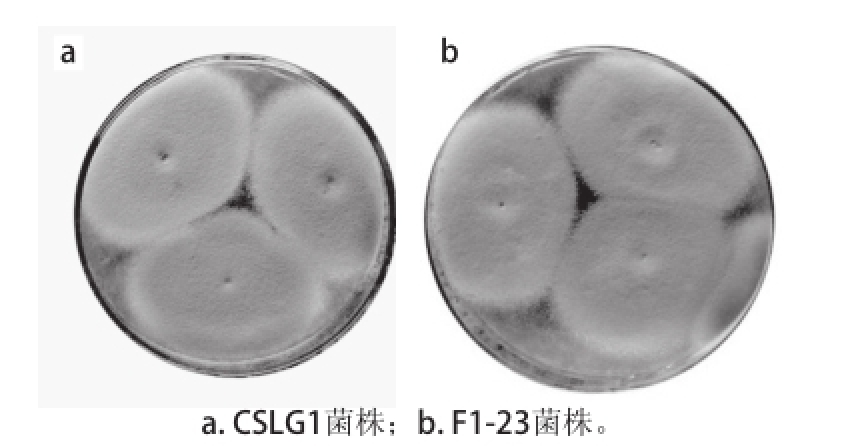
图3 诱变前后菌落形态对比
Fig.3 Morphological comparison of CSLG1 (a) and F1-23 (b)
由图3可知,诱变菌株F1-23的孢子颜色较出发菌株SCLG1发生了变化,CSLG1颜色淡黄褐色,F1-23的呈现棕褐色,颜色比CSLG1深。菌落形态没有发生明显变化,F1-23较CSLG1更致密,但差异不大,尤其在菌落形成初期,菌落较小时两者几乎没有差异。这一结果表明菌落形态对本实验诱变筛选的作用不大,这为今后进一步诱变筛选提供了借鉴。
2.3.2 甲醛降解能力比较
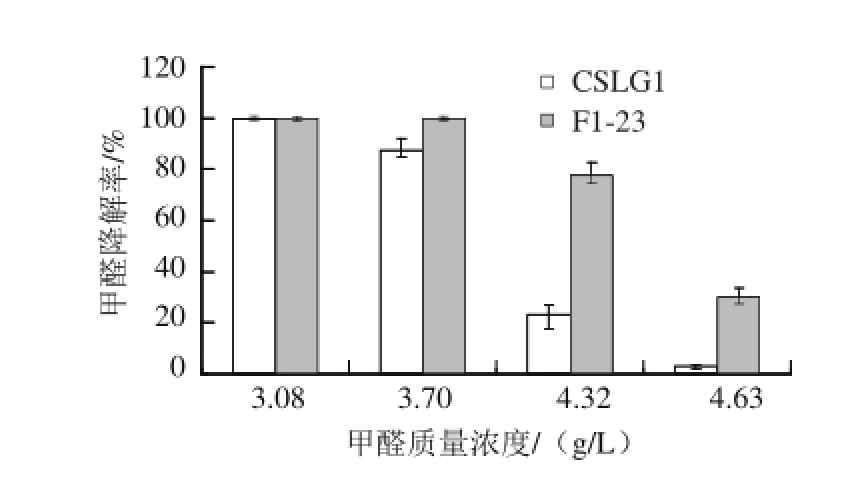
图4 诱变前后菌株甲醛降解能力的对比
Fig.4 Comparison of formaldehyde degradation ability of CSLG1 and F1-23
如图4所示,诱变菌株F1-23的甲醛降解能力显著提高。数据分析结果表明,在甲醛质量浓度为3.08 g/L,CSLG1和F1-23的甲醛降解率未达到显著差异水平(P>0.05),说明突变体对低质量浓度甲醛的降解能力并未受到影响。在不同甲醛质量浓度之间,CSLG1在低质量浓度(3.08、3.70 g/L)甲醛条件下,对甲醛的降解率之间无显著差异(P>0.05),但在3.7、4.32 g/L和4.63 g/L质量浓度条件下,降解率达到极显著差异水平(P<0.01)。F1-23在较高甲醛质量浓度(4.32、4.63 g/L)条件下,其降解率达到极显著差异(P<0.01)。这些结果说明,菌株CSLG1和F1-23对甲醛的降解率水平明显不同。培养120 h后,诱变菌F1-23能够基本降解4.32 g/L甲醛溶液,降解率为85%,而出发菌株CSLG1仅为25%,诱变之后菌株的降解能力提高了2.4 倍。
2.3.3 在含有甲醛的培养基中菌株生长特性比较
为了能更直观准确地对比诱变前后菌株生长特性的差异,分别在含有3.08 g/L甲醛的液体培养基中培养出发菌株CSLG1和诱变株F 1- 23,实验结果如图5、6。如图5所示,出发菌株CSLG1在最初的60 h内缓慢降解甲醛,在60~72 h内进入甲醛快速降解期,直至120 h时甲醛被完全降解。而葡萄糖的消耗在前96 h较低,当甲醛近乎耗尽时,开始利用葡萄糖,菌株进入快速生长期。
图6是诱变菌株F1-23的生长曲线。F1-23在最初72 h内以恒定速率降解甲醛,在72~84 h内进入甲醛快速降解期;84 h时已将甲醛完全降解,降解周期比出发菌株缩短了36 h。经过诱变之后的菌株与诱变前的在葡萄糖利用上基本相似,利用率由原来的28%上升至38%,同时导致生物量上升了15.9%。

图5 出发菌株CSLG1的生长曲线
Fig.5 The growth curve of the original strain CSLG1

图6 诱变菌株F1-23的生长曲线
Fig.6 The growth curve of themutant strain F1-23
2.3.4 甲醛脱氢酶酶活力比较
出发菌株CSLG1在培养60 h进入甲醛快速降解期,至72 h结束(图5);由此推测此阶段的甲醛脱氢酶酶活力最高,确定在培养66 h取样,根据1.5.2.3节测得酶活力为67.5 U/mg。
诱变菌株F1-23在72 h进入甲醛快速降解期,至84 h结束(图6),推断此阶段的甲醛脱氢酶酶活力最高,确定培养78 h后取样,根据1.5.2.3节测定酶活力,为83.6 U/mg,较诱变前提高了23.8%。
2.4 诱变菌株的稳定性
表2 诱变菌株F1-23甲醛抗性和甲醛降解能力遗传稳定性
Table2 Genetic stability of the formaldehyde resistance and degradation ability of F1-23

传代次数12345生物量/(g/L)2.06±0.211.98±0.122.02±0.212.00±0.212.03±0.21甲醛降解率/%27.40±1.5127.00±1.8127.40±1.4927.80±1.3827.20±1.49
如表2所示,诱变菌株F1-23在其甲醛最高耐受质量浓度(7.88 g/L)下,每一代均生长良好;而在其最高甲醛降解质量浓度(4.63 g/L)下,每一代的降解率基本维持在27%左右。因此,诱变菌株F1-23具有很好的遗传稳定性。
紫外诱变具有随机性,既可以引起抗性基因发生突变,也可导致与正常生长相关的基因发生突变,其中任何一种突变均有可能引起菌株生长发生变化。本研究中通过紫外诱变得到的突变菌F1-23在正常条件下的生长并未受到影响,其菌落形态的改变不显著;对于低质量浓度甲醛的降解率几乎无改变,但随着甲醛质量浓度的增高,抗性及其降解能力显著提高。因此,突变菌F1-23对甲醛降解率的提高是紫外照射导致的基因位点发生突变的结果。
通过紫外诱变、初筛及复筛方法筛选得到的甲醛降解菌F1-23,其最高甲醛耐受质量浓度已达到7.88 g/L,超过目前国内外报道的最高质量浓度7.5 g/L [16-20],这对研究极端微生物提供了很好的样本,同时也为生物降解高质量浓度甲醛废水提供了理论基础。同时,菌株F1-23的甲醛脱氢酶的酶活力为83.6 U/mg,高于国内外报道的其他甲醛降解菌 [2,21-22]。
目前,利用微生物降解甲醛已成为甲醛降解的研究热点。尽管诱变菌株F1-23在耐受质量浓度及酶活方面有显著的提高,但要应用于生产还需进一步驯化。Tetsuya等 [14]报道,其从土壤中分离了一株甲醛降解真菌Aspepgillus nomius IR1013,能在最高甲醛质量浓度为4.5 g/L中生长并将其完全消耗掉。Saeed等 [23]报道,其得到的一株P. pseudoalcaligenes OSS在培养24 h后,可将3.70 g/L甲醛100%消耗,培养72 h可将5.92 g/L甲醛消耗70%。而本实验菌株在培养84 h后,可将3.08 g/L甲醛完全降解,培养120 h后可将4.63 g/L甲醛消耗30%,无论从降解质量浓度还是降解时间都存在一定差距。因此今后的工作将放在提高其降解能力,以期得到更高的甲醛降解力菌株,为工业应用提供良好菌种资源。
参考文献:
[1] 齐瑞颖. 微生物降解室内甲醛污染物的理论与实验研究[D]. 天津:天津大学, 2008: 10.
[2] 黄赛花, 陈能场, 毕鸿亮. 3株霉菌对甲醛转化能力的研究[J]. 中国环境科学, 2008, 28(12): 111-115.
[3] 陈建孝, 吴彦宥, 钱瑞龙, 等. 利用酶清除室内甲醛气体的新方法[J].生物产业技术, 2009(4): 144-148.
[4] 李宁慧, 黄翔和, 谢乐飞. 一株甲醛降解菌的分离筛选与降解特性研究[J]. 微生物学通报, 2011, 38(11): 86-87.
[5] 廖宇静. 微生物遗传育种学[M]. 北京: 气象出版社, 2010: 3-7.
[6] 姚璐晔, 高杏, 曹叶萍, 等. 一株甲醛降解菌的鉴定及其甲醛降解[J].生物技术, 2014, 24(1): 85-88.
[7] 诸葛健. 工业微生物育种学[M]. 北京: 化学工业出版社, 2006: 32-38.
[8] 汪杏莉, 李宗伟, 陈林海, 等. 工业微生物物理诱变育种技术的新进展[J]. 生物技术通报, 2007(2): 114-118.
[9] 徐云, 金晶, 郑重, 等. 高活性高耐受甲醛降解菌株的分离鉴定及降解条件研究[J]. 环境科学, 2010, 31(10): 2481-2486.
[10] 施巧琴, 吴松刚. 工业微生物育种学[M]. 3版. 北京: 科学出版社,2009: 37-38.
[11] 周德庆. 微生物学教程[M]. 2版. 北京: 高等教育出版社, 1993: 218-223.
[12] 国家环境保护总局. HJ 601—2011 水质 甲醛的测定 乙酰丙酮分光光度法[S]. 北京: 国家质量监督检验检疫总局, 2011.
[13] 曹培义. 邻甲苯胺分光光度法测定甜饮料中的葡萄糖[J]. 职业与健康, 2001, 8(11): 45-46.
[14] TETSUYA K, YUTAKA M, NAOHIRO H, et al. Purification and characterization formateoxidase from a formaldehyde-resistant fungus[J]. FEMS Microbiology Letters, 2002, 214(1): 137-142.
[15] AZAHI M, HENIS Y, OREN A, et al. Transformation of formaldehyde by a Halomonas sp.[J]. Canadian Journal of Microbiology, 1995, 41:548-553.
[16] 谢文娟, 王洁, 孙珮石, 等. 高效降解甲醛菌株的分离鉴定及其特性[J]. 微生物学通报, 2011, 38(11): 1626-1631.
[17] 徐云, 金晶, 郑重, 等. 高活性高耐受甲醛降解菌株的分离鉴定及降解条件研究[J]. 环境科学, 2010, 31(10): 2481-2486.
[18] 黄赛花, 陈能场. 一株甲醛降解真菌Aspergillus spp. H4的分离鉴定[J].生态环境, 2007, 16(4): 1175-1179.
[19] 李章良, 林小园, 林勇, 等. 甲醛降解菌的筛选及降解特性研究[J].环境工程学报, 2011, 5(11): 2547-2551.
[20] TOMOHIOKO Y, WAKAKO T, KOJI S. Biodegradation of formaldehyde by a formaldehyde-resistant bacterium isolated from seawater[J]. Applied Biochemistry and Biotechnology, 2001,91/93(1/9): 213-217.
[21] RYOJI M, MASAHIRO O, HIDEAKI K, et al. Formaldehydelimited cultivation of a newly isolated methylotrophic bacterium,Methylobacterium sp. MF1: enzymatic analysis related to C1 metabolism[J]. Journal of Bioscience and Bioengineering, 2005, 99(1):18-22.
[22] YURIMOTO H, KATO N, SAKAI Y. Assimilation, dissimilation and detoxification of formaldehyde, a central metabolic intermediate of methylotrophic metabolism[J]. Chemical Record, 2005, 5(6): 367-375.
[23] SAEED M, AFSANEH R, POONEH K, et al. Isolation of bacteria able to metabolize high concentrations of formaldehyde[J]. Microbiology & Biotechnology, 2005, 21: 1299-1301.
Ultraviolet Mutagenesis of Paecilomyces variotii for Formaldehyde Degradation and Degradation Characteristics of Its Mutant Strain
YAO Luye
1, LI Xiang
2, XING Yun
1, GAO Xing
1, CAO Yeping
1, GU Jiajia
1
(1. School of Biotechnology and Food Engineering, Changshu Institute of Technology, Changshu 215500, China;2. School of Biotechnology, Jiangnan University, Wuxi 214122, China)
Abstract:Paecilomyces variotii CSLG1A, a strain able to degrade formaldehyde, was mutagenized by ultraviolet (UV)irradiation and the selected mutants were tested for their abilities to degrade formaldehyde. The UV mutagenesis was carried out by placing the original strain at a distance of 30 cm away from a 15-W UV light lamp for 30 s, yielding a mortality rate of 88%. The mutant stain F1-23 with significantly increased formaldehyde degradation ability was obtained by two rounds of screening. The critical formaldehyde concentration degraded by the mutant strain was 7.88 g/L, which was enhanced by 22.2% when compared with that obtain with the original strain. The activity of formaldehyde dehydrogenase produced by F1-23 was 83.6 U/mg, representing a 23.8% increase over that produced by the original strain. The formaldehyde resistance and degradation capacity of F1-23 remained substantially unchanged after 5 passages, suggesting good genetic stability. In summary, the strain F1-23 holds great promise for application in the exploration of formaldehyde biodegradation.
Key words:formaldehyde degradation; Paecilomyces variotii; ultraviolet mutagenesis; formaldehyde dehydrogenase; degradation
中图分类号:Q939.9
文献标志码:A
文章编号:1002-6630(2015)13-0143-05
doi:10.7506/spkx1002-6630-201513027
收稿日期:2014-08-13
基金项目:2012年全国大学生创新创业实践计划项目(201210333014);常熟理工学院校青年教师科研启动项目(KYZ2011178Z);常熟理工学院2014届本科毕业论文重点资助项目(LG79)
作者简介:姚璐晔(1983—),女,实验师,硕士,研究方向为微生物。E-mail:yaoluye@cslg.com