
张 雯,刘 康,罗霏霏,张敏娟,李彦军
(陕西科技大学生命科学与工程学院,陕西 西安 710021)
摘 要:为提高木醋杆菌(Acetobacter xylinum)发酵酿酒丢糟水解液生产细菌纤维素(bacterial cellulose,BC)的产量,采用响应面法对发酵培养基进行了优化,同时比较了发酵产物BC的性能和结构。通过单因素及响应面试验结果确定木醋杆菌发酵酿酒丢糟水解液生产BC的最佳培养基配方为:蔗糖39.33 g、蛋白胨20.01 g、MgSO 40.91 g、柠檬酸钠3.45 g、黄嘌呤1.02 g、乙醇10 mL、酒糟水解液1 000 mL、pH 6.0。在此条件下BC的产量为6.27 g/L,较优化前(4.4 g/L)提高了42.5%。利用傅里叶红外光谱、X射线衍射、扫描电子显微镜对发酵产物BC的性能和结构进行了比较,结果表明,酒糟水解液发酵产物BC结构性能与基本培养基发酵产物BC的基本一致,说明酒糟水解液能够替代部分发酵原料发酵生产BC,且不影响BC性能。
关键词:酿酒丢糟;细菌纤维素;培养基优化;响应面法;性能
细菌纤维素(bacterial cellulose,BC)是由生长在液态含糖基质中的革兰氏阴性菌产生的纤维素成分。与植物纤维素相比,BC不含半纤维素和木质素,具有高持水率(大于90%)、高分子质量以及较高的结晶度。目前,BC作为一种新型功能材料受到了科学界的广泛关注,如今已成功地应用于食品、生物医学、造纸、声学器材、化妆品、膜滤器等多个领域 [1-2]。但BC培养基成本高、产量低等问题却是其工业化生产和推广应用的瓶颈。利用各种废渣、废液进行生产,减轻环保压力,其应用前景比动植物多糖更为广阔 [3]。
我国是白酒生产和消费的大国,在酿制白酒的过程中不可避免地会出现酿酒副产物酒糟、黄水、酒尾等。通常每生产1 t白酒就要产生3 t酒糟,2008年我国白酒的产量约为600 万t,这样我国每年酒糟的产量就达1 800多万吨。一方面由于对其开发利用有限易造成污染环境,而另一方面酒糟中含有丰富的蛋白质、脂肪、氨基酸、维生素等营养物质,又造成资源的浪费。閻立平等 [4]曾研究了用米酒糟制备BC,沈金 朋等 [5]利用未经预处理的酒糟为主要原料发酵生产BC,发酵15 d后的BC产量为2.7 g/L。本研究拟利用白酒酒糟水解液作为发酵原料,采用响应面法对BC发酵培养基进行优化。同时利用傅里叶红外光谱(fourier transform infrared,FT-IR)、X射线衍射(X-ray diffraction,XRD)、扫描电子显微镜(scanning electron microscopy,SEM)研究发酵产物BC性能及结构,探索酒糟作为发酵原料对BC的影响。本研究可为BC发酵提供一种廉价原料,为其规模化生产提供技术依据,同时可为酒糟的综合利用、附加值的提升和酒类的清洁化生产提供一条新的途径,具有良好的社会效益及经济效益。
1.1 材料与试剂
木醋杆菌(Acetobacter xylinum) 陕西科技大学制药工程实验室;酒糟 西安酒厂;纤维素酶(700 EGU/g)、淀粉酶(135 KNU/g)、糖化酶(170 AGU/g)、碱性蛋白酶(2.4 AU/g) 诺维信(中国)生物技术有限公司。
固体培养基:蔗糖50.00 g、牛肉膏15.00 g、Na 2HPO 44.40 g、柠檬酸0.80 g、琼脂18.00 g、乙醇10 mL、自来水1 000 mL,pH 6.0;种子培养基:蔗糖50.00 g、牛肉膏15.00 g、Na 2HPO 44.40 g、柠檬酸0.80 g、乙醇10 mL、自来水1 000 mL,pH 6.0;基本发酵培养基:蔗糖50.00 g、牛肉膏15.00 g、乙醇10 mL、酒糟水解液1 000 mL,pH 6.0;其余试剂均采用国产分析纯或生化试剂。
1.2 仪器与设备
S-4800电镜扫描仪 日本日立公司;D/max2200PC全自动X射线衍射仪 日本Rigaku公司;VERTEX 70傅里叶变换红外光谱仪 德国Brucher公司;MG250B恒温培养箱、HYG-1A恒温振荡器 上海新瑞仪器有限公司;XPS-8CA光学显微镜 上海光学仪器有限公司;752型紫外分光光度计 上海光谱仪器有限公司。
1.3 方法
1.3.1 还原糖含量的测定
采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法 [6]测定。
1.3.2 氨基态氮含量的测定
采用凯氏定氮法 [7]测定。
1.3.3 BC膜处理
将发酵所得BC膜浸泡于0.10 mol/L NaOH溶液中,80 ℃浸泡30 min,继续加热煮沸2 h,再用蒸馏水反 复冲洗,直到pH值为7.0,冷冻干燥 [8-9]。
1.3.4 BC膜产量测定
采用称质量法 [10]测定。
1.3.5 BC鉴定及基团分析
采用傅里叶红外光谱扫描法 [9]。样品处理:取适量BC干膜放入红外光谱仪中进行测定,450 mW,扫描范围4 500~400 cm -1,设定分辨率4 cm -1,扫描速率为0.2 cm/s,室温下操作。
1.3.6 BC膜结晶度
采用X射线衍射光谱扫描法 [9]。样品处理:BC干膜平整固定在样品架上,铜靶,测试电压40 kV,测试电流100 mA,速率5°/min,步宽0.02°,2θ为0~80°范围扫描。根据X衍射参数,由下面两个计算公式分别计算细菌纤维素的结晶度(X c)和晶体的粒径(L)。

式中:I为衍射峰的衍射强度;I am为无定形区衍射强度;L为晶体的粒径/nm;β为半峰宽/rad;k为常数,通常取0.89;λ为X射线波长(0.154 06 nm);θ为布拉格衍射角/(°)。
1.3.7 BC膜表面形貌
采用扫描电镜法 [9]。样品处理:处理后的BC干膜置于液氮中,脆断处理,分别取断面及表面制样,喷金镀膜后利用扫描电子显微镜观察其微观结构,电压25 kV。
1.4 酒糟水解液的制备
取经粉碎干燥的酒糟,加自来水至液固比为10∶1(V/m),加纤维素酶至终浓度为25.00 EGU/g,pH 5.0~6.0、60 ℃条件下水解6 h,反应结束后升温至100 ℃,维持10 min灭酶,得水解液1。水解液1加淀粉酶至终浓度为25.00 KNU/g,pH 5.5~6.5、70 ℃水解60 min,反应结束后升温至100 ℃,维持10 min灭酶,得水解液2。水解液2加糖化酶至终浓度为15.00 AGU/g,pH 4.0~5.0、70 ℃水解40 h,反应结束后升温至100 ℃,维持10 min灭酶,得水解液3。水解液3加碱性蛋白酶至终浓度为0.10 AU/g,pH 8.0~9.0、70 ℃水解10 h,反应结束后升温至100 ℃,维持10 min灭酶,得酒糟水解液。
1.5 BC的发酵
斜面培养:挑取木醋杆菌保藏菌种划斜面,30 ℃恒温培养箱中培养2~3 d;种子液制备:挑取木醋杆菌活化菌种接种子培养基,30 ℃恒温培养箱中培养1 d,培养液置于30 ℃,160 r/min摇床振荡30 min,得种子液;发酵培养:移取木醋杆菌种子液接入发酵培养基,装液量30 mL/250 mL三角瓶,接种量20%,30 ℃恒温培养箱中静置培养10 d。
1.6 单因素试验
以发酵液中BC产量为指标,考察碳源种类及含量(葡萄糖、蔗糖、乳糖,设计质量浓度20.00、30.00、40.00、50.00、60.00、70.00、80.00 g/L)、氮源种类及含量(酵母膏、牛肉膏、蛋白胨,设计质量浓度10.00、20.00、30.00、40.00、50.00、60.00、70.00 g/L)、无机盐种类及含量(MgSO 4、Na 2HPO 4、柠檬酸钠,设计质量浓度1.00、1.50、2.00、2.50、3.00、3.50、4.00 g/L)、磷酸二酯酶(phosphodiesterase,PDE)抑制剂种类及含量(黄嘌呤、咖啡因,设计质量浓度0.10、0.30、0.50、0.70、0.90、1.10、1.50、2.00 g/L)等因素对BC产量的影响。初始培养基配方为:蔗糖50.00 g、牛肉膏15.00 g、乙醇10 mL、酒糟水解液1 000 mL、pH 6.0,后续因素的试验将前一个因素的较佳条件带入以置换初始条件。
1.7 响应面试验设计
在单因素试验结果基础上,采用Design Expert 7.0软件,根据Box-Behnken试验设计原理,选取影响较大的因素,以发酵液中BC产量为响应值设计试验。
1.8 发酵产物性能研究
以木醋杆菌(Acetobacter xylinum)为菌种,按照优化培养基配方制备酒糟水解液发酵培养基发酵生产BC,记为BC-YP,利用基本培养基发酵生产BC记为BC-DZ。利用FT-IR、SEM、XRD对BC-YP及BC-DZ进行检测,研究酒糟水解液作为发酵培养基原料对BC性能的影响。
1.9 数据处理方法
所有数据均用3 次平行实验的平均值表示,用SPSS 18软件对数据进行处理。
2.1 单因素试验结果
2.1.1 碳源对BC产量的影响
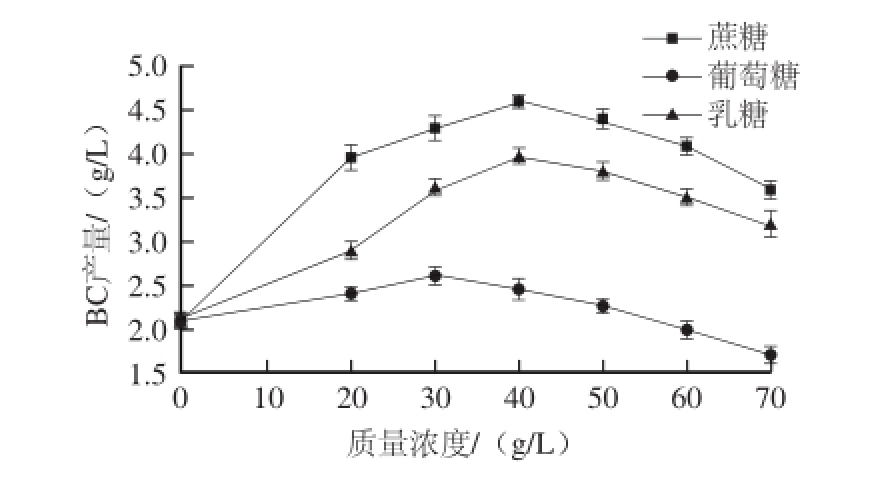
图1 碳源种类及质量浓度对BC产量的影响
Fig.1 Effect of carbon source type and mass concentration on the yield of BC
由图1可知,发酵培养基中所加入葡萄糖质量浓度低于30.00 g/L,蔗糖和乳糖质量浓度低于40.00 g/L时,BC产量随着糖质量浓度的增大呈上升趋势。随着所添加糖质量浓度继续增大,BC产量反而降低。相同质量浓度水平下,蔗糖作为碳源时BC产量最大,其次分别是乳糖、葡萄糖。分析原因,主要有以下四方面:1)培养基中糖含量过低,所提供碳源不能满足菌体细胞的生长及产物的合成,因此BC产量较低;2)培养基中糖含量过高,引起培养基渗透压过高,抑制菌体细胞的生长及产物的合成,使BC产量降低;3)相较于蔗糖和乳糖,葡萄糖为微生物可更快速利用的碳源。高质量浓度葡萄糖的快速利用,容易引起糖代谢途径中丙酮酸的积累及无氧酵解产物乳酸、醋酸等的产生,使发酵液pH值降低,不利于细胞的生长及产物的合成 [11]。同时快速利用基质的利用易产生对产物合成相关酶的阻遏作用,不利于发酵过程由细胞生长期转为产物生产期,从而降低产物产量;4)蔗糖和乳糖作为碳源时,微生物对其水解速率不同,其利用速率也不相同。培养基中添加40.00 g/L的蔗糖比相同质量浓度的乳糖发酵产BC产量高,可能是因为木醋杆菌(Acetobacter xylinum)在代谢过程中将蔗糖水解为葡萄糖及果糖,其代谢及利用速率更适宜于产物BC的合成,因而可促进BC的合成。因此选择蔗糖质量浓度40.00 g/L为较佳参数。
2.1.2 氮源对BC产量的影响
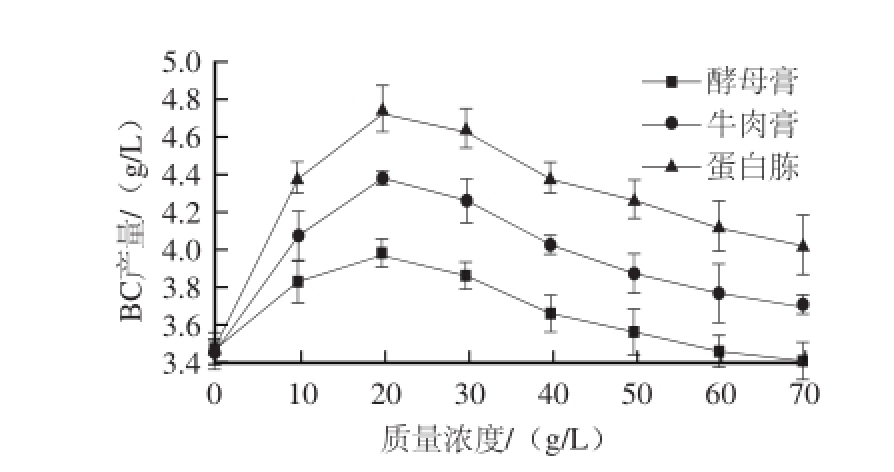
图2 氮源种类及质量浓度对BC产量的影响
Fig.2 Effect of nitrogen source type and mass concentration on the yield of BC
由图2可知,发酵培养中分别加入牛肉膏、酵母膏、蛋白胨作为氮源时,随着氮源质量浓度的升高,BC产量呈先上升再下降的趋势,其最大产量对应氮源质量浓度均为20.00 g/L。表明酒糟水解液中的蛋白质不能满足BC发酵所需氮源,需要外源添加氮源,最适添加量20.00 g/L。外源添加量继续增加时,发酵培养基中氮源的质量浓度过高,易引起菌体细胞生长速率过快,不利于发酵过程由细胞生长期转为产物生产期,从而降低BC产量。所添加3 种氮源中,蛋白胨作为氮源时,BC产量最高,可达4.75 g/L,表明蛋白胨为木醋杆菌发酵生产BC最佳氮源。因此选择蛋白胨质量浓度20.00 g/L为较佳参数。
2.1.3 无机盐对BC产量的影响

图3 无机盐种类及质量浓度对BC产量的影响
Fig.3 Effect of inorganic salt type and mass concentration on the yield of BC
由图3可知,发酵培养基中柠檬酸钠质量浓度为3.50 g/L时,BC产量最高。根据Zeng Xiaobo [11]、Chen Lin [12]等的研究结果,发酵过程中,糖的利用引起的pH值降低会抑制BC的合成,因此培养基中添加具有pH值缓冲能力的基质,能够提高BC的产量。本试验中,微生物代谢柠檬酸钠时生成碱性产物,能够起到上述作用,试验结果与文献[11]报道一致。图3表明,培养基中MgSO 4质量浓度为1.00 g/L时,BC产量最高,这与Son等 [13]的研究结果一致。Mg 2+是微生物代谢过程中多种酶的辅基,如大部分核酸复制转录相关酶均需Mg 2+保证其催化活性,因此,发酵培养基中添加合适质量浓度的Mg 2+,对BC的合成具有促进作用。同时,发酵培养基中Na 2HPO 4的加入并没有对BC的合成表现出促进作用,BC产量反而有所降低,分析原因,可能是培养基中过量的磷酸盐对糖代谢过程中戊糖磷酸途径产生了抑制作用,从而抑制BC的合成。因此培养基中无机盐选择柠檬酸钠和MgSO 4进行进一步研究。
2.1.4 PDE抑制剂对BC产量的影响

图4 PDE酶抑制剂对BC产量的影响
Fig.4 Effect of PDE inhibitors on the yield of BC
由图4可知,发酵培养基中黄嘌呤和咖啡因的加入对BC的合成具有明显的促进作用,添加黄嘌呤质量浓度为1.10 g/L,咖啡因质量浓度为0.90 g/L时,BC产量可分别提高17.7%、7.0%。BC生物合成过程如图5所示,纤维素合成酶在环鸟苷酸(C-di-GMP)的激活下能够保持较高活性,C-di-GMP又能被PDE水解为无活性的线状鸟苷酸,因此理论上PDE抑制剂能够促进BC的合成。咖啡因、黄嘌呤和茶碱等可抑制PDE的活性 [14],使C-di-GMP在细胞内保持较高水平,提高纤维素合成酶活性,从而提高BC的合成速率。试验结果与理论分析一致。同时结果表明,黄嘌呤对BC合成的促进作用优于咖啡因,因此培养基中PDE抑制剂选择黄嘌呤进行进一步研究。
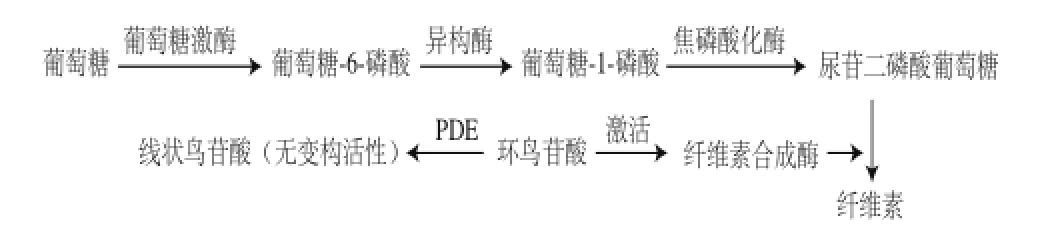
图5 BC生化合成过程
Fig.5 Biochemical synthesis process of BC
2.2 响应面优化发酵培养基配方
2.2.1 响应面试验设计及结果
综合单因素试验结果,进一步对蔗糖、蛋白胨、柠檬酸钠、MgSO 4及黄嘌呤质量浓度5 个因素进行优化。以这5 个因素为自变量,以BC产量为响应值,根据Box-Behnken试验设计原理,设计中心组合试验。试验设计方案及结果见表1。
表1 Box-Behnken试验设计与结果
Table1 Box-Behnken experimental design and results

试验号A蔗糖质量浓度/(g/L)Y BC产量/(g/L)10(40.00)0(20.00)-1(0.50)-1(3.00)0(1.10)5.49±0.09 201(30.00)0(1.00)0(3.50)1(1.40)4.30±0.11 30-1(10.00)0-104.10±0.05 4000-1-1(0.70)4.25±0.07 5000-114.03±0.18 6-1(30.00)-10004.32±0.07 7-100-104.65±0.06 8000006.02±0.14 9-101(1.50)004.43±0.07 10011004.17±0.13 110011(4.00)04.52±0.07 12-10-1005.17±0.14 1300-1014.06±0.10 14001014.15±0.08 150001-14.36±0.10 16001-104.78±0.09 171(50.00)00-104.28±0.11 1810-1004.78±0.14 1901-1004.53±0.05 20000006.72±0.12 210-1-1004.50±0.14 22010-104.54±0.07 230010-14.22±0.13 2400-1104.50±0.14 25100013.72±0.16 B蛋白胨质量浓度/(g/L)C柠檬酸钠质量浓度/(g/L)D MgSO 4质量浓度/(g/L)E黄嘌呤质量浓度/(g/L)
续表1
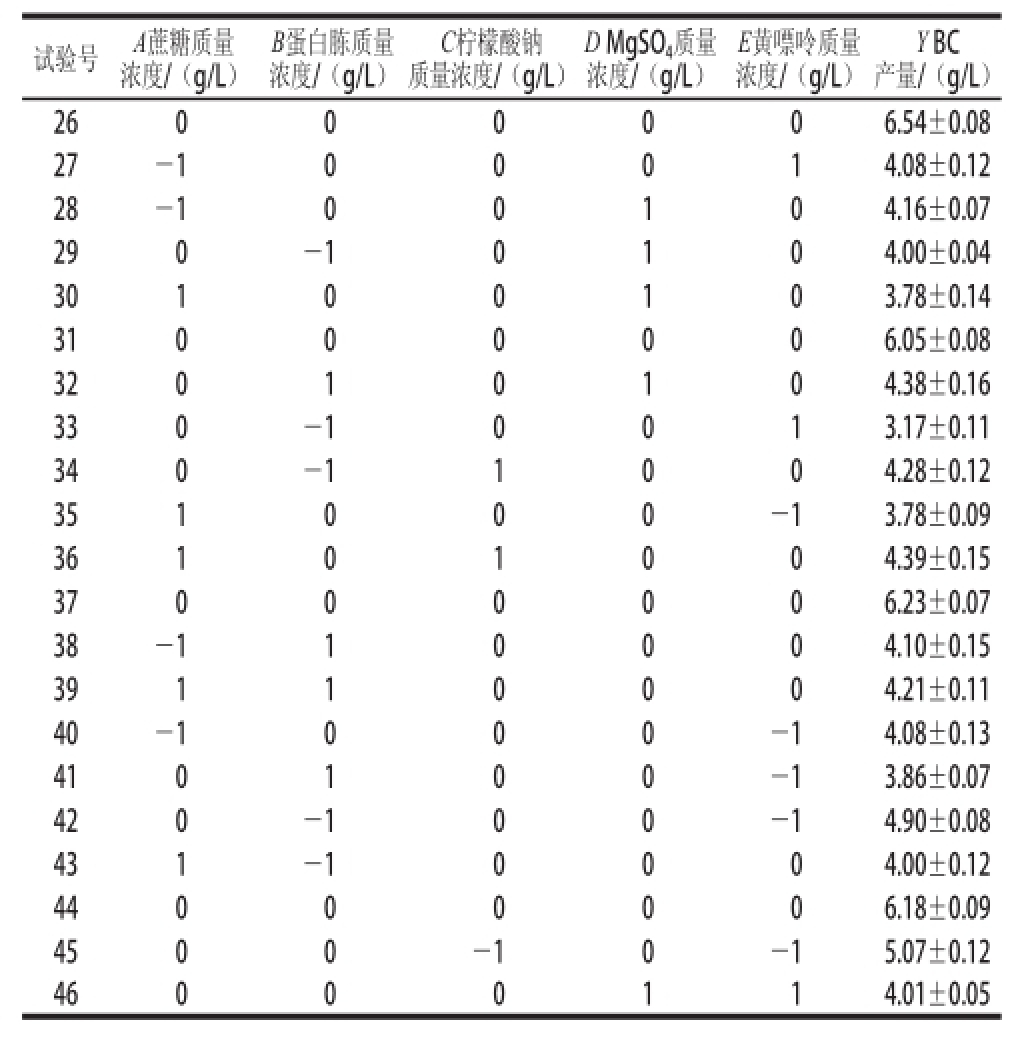
试验号A蔗糖质量浓度/(g/L)Y BC产量/(g/L)26000006.54±0.08 27-100014.08±0.12 28-100104.16±0.07 290-10104.00±0.04 30100103.78±0.14 31000006.05±0.08 32010104.38±0.16 330-10013.17±0.11 340-11004.28±0.12 351000-13.78±0.09 36101004.39±0.15 37000006.23±0.07 38-110004.10±0.15 39110004.21±0.11 40-1000-14.08±0.13 410100-13.86±0.07 420-100-14.90±0.08 431-10004.00±0.12 44000006.18±0.09 4500-10-15.07±0.12 46000114.01±0.05 B蛋白胨质量浓度/(g/L)C柠檬酸钠质量浓度/(g/L)D MgSO 4质量浓度/(g/L)E黄嘌呤质量浓度/(g/L)
利用Design Expert 7.0软件,以蔗糖、蛋白胨、柠檬酸钠、MgSO 4及黄嘌呤质量浓度为响应变量,以BC产量为响应值对表1数据进行多元二次回归拟合,得到回归模型方程为:Y=6.29-0.13A+0.052B-0.20C-0.15D-0.19E+0.11AB+0.086AC-3.75×10 -3AD-0.015AE-0.036BC-0.015BD+0.54BE+0.18CD+0.24CE-0.033DE-1.07A 2-1.12B 2-0.64C 2-0.91D 2-1.23E 2。
表2 回归方程方差分析结果Table2 Analysis of variance for the developed regression equation
Table2 Analysis of variance for the developed regression equation
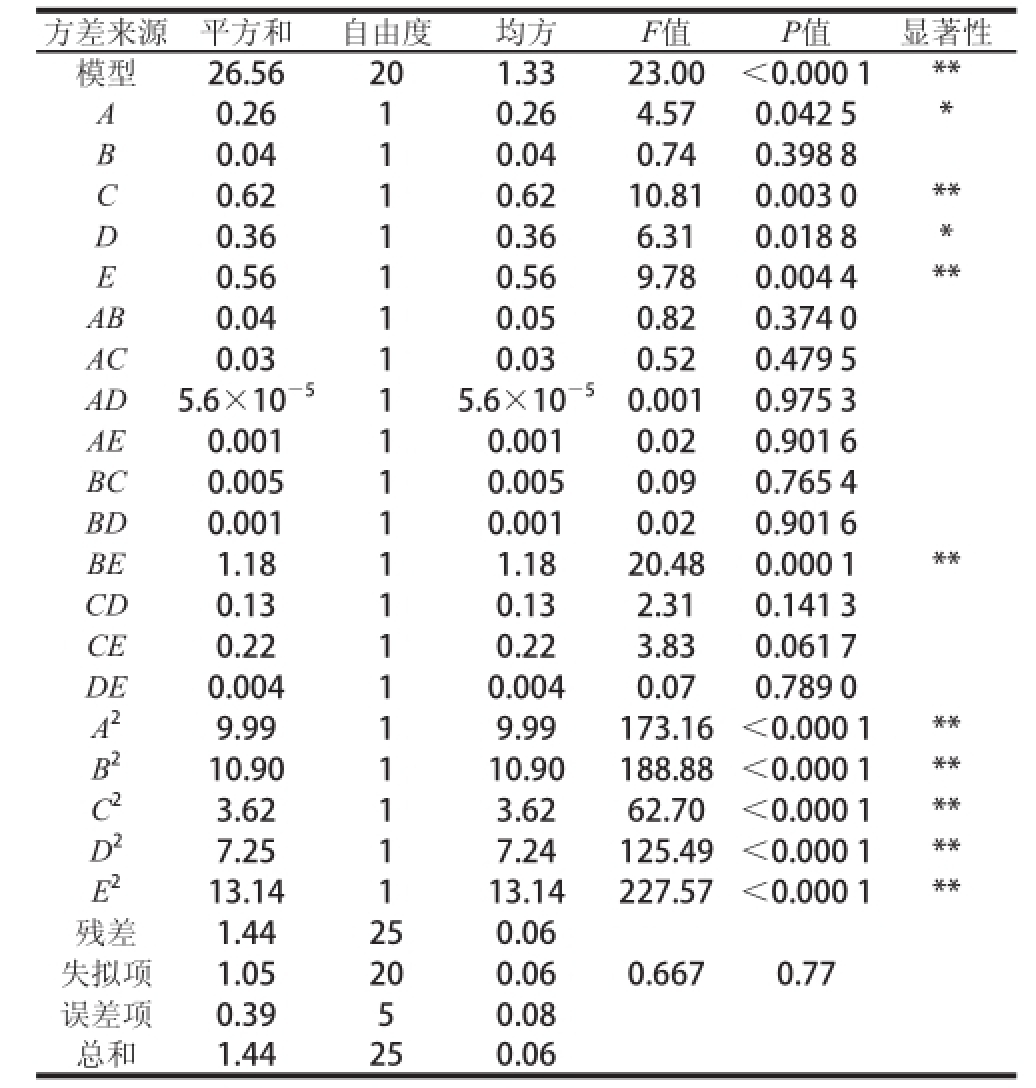
注:**. P<0.01,表示差异极显著;*. P<0.05,表示差异显著。
方差来源平方和自由度均方F值P值显著性模型26.56201.3323.00<0.000 1** A0.2610.264.570.042 5* B 0.0410.040.740.398 8 C 0.6210.6210.810.003 0** D 0.3610.366.310.018 8* E 0.5610.569.780.004 4** AB0.0410.050.820.374 0 AC0.0310.030.520.479 5 AD5.6×10 -515.6×10 -50.0010.975 3 AE0.00110.0010.020.901 6 BC0.00510.0050.090.765 4 BD0.00110.0010.020.901 6 BE1.1811.1820.480.000 1** CD0.1310.132.310.141 3 CE0.2210.223.830.061 7 DE0.00410.0040.070.789 0 A 29.9919.99173.16<0.000 1** B 210.90110.90188.88<0.000 1** C 23.6213.6262.70<0.000 1** D 27.2517.24125.49<0.000 1** E 213.14113.14227.57<0.000 1**残差1.44250.06失拟项1.05200.060.6670.77误差项0.3950.08总和1.44250.06
回归方程的方差分析结果见表2。回归模型极显著(P<0.000 1),失拟项不显著(P = 0.77>0.05),表明回归方程拟合程度良好;决定系数R
2= 0.948 5,说明因变量与考察的自变量之间的线性关系显著;模型校正决定系数
 即该模型能解释响应值变化的90.72%,
即该模型能解释响应值变化的90.72%,
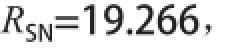 均说明模型可信度较高。
均说明模型可信度较高。
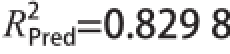 ,说明该模型预测性良好;一次项A、D对BC产量影响是显著的,C、E对BC产量影响是极显著的,二次项A
2、B
2、C
2、D
2、E
2及交互相BE对BC产量影响是极显著的,说明各具体试验因素对响应值的影响不是简单的线性关系;由F值判断,在选择范围内,5 个因素对BC产量的影响顺序为C>E>D>A>B。综上所述,使用该模型可以较好地对响应值(BC产量)进行分析和预测。
,说明该模型预测性良好;一次项A、D对BC产量影响是显著的,C、E对BC产量影响是极显著的,二次项A
2、B
2、C
2、D
2、E
2及交互相BE对BC产量影响是极显著的,说明各具体试验因素对响应值的影响不是简单的线性关系;由F值判断,在选择范围内,5 个因素对BC产量的影响顺序为C>E>D>A>B。综上所述,使用该模型可以较好地对响应值(BC产量)进行分析和预测。
2.2.2 响应面分析
利用Design Expert 7.0软件对二次回归模型进行规范分析,蔗糖、蛋白胨、柠檬酸钠、MgSO 4及黄嘌呤质量浓度之间交互作用对BC产量的影响见图6。
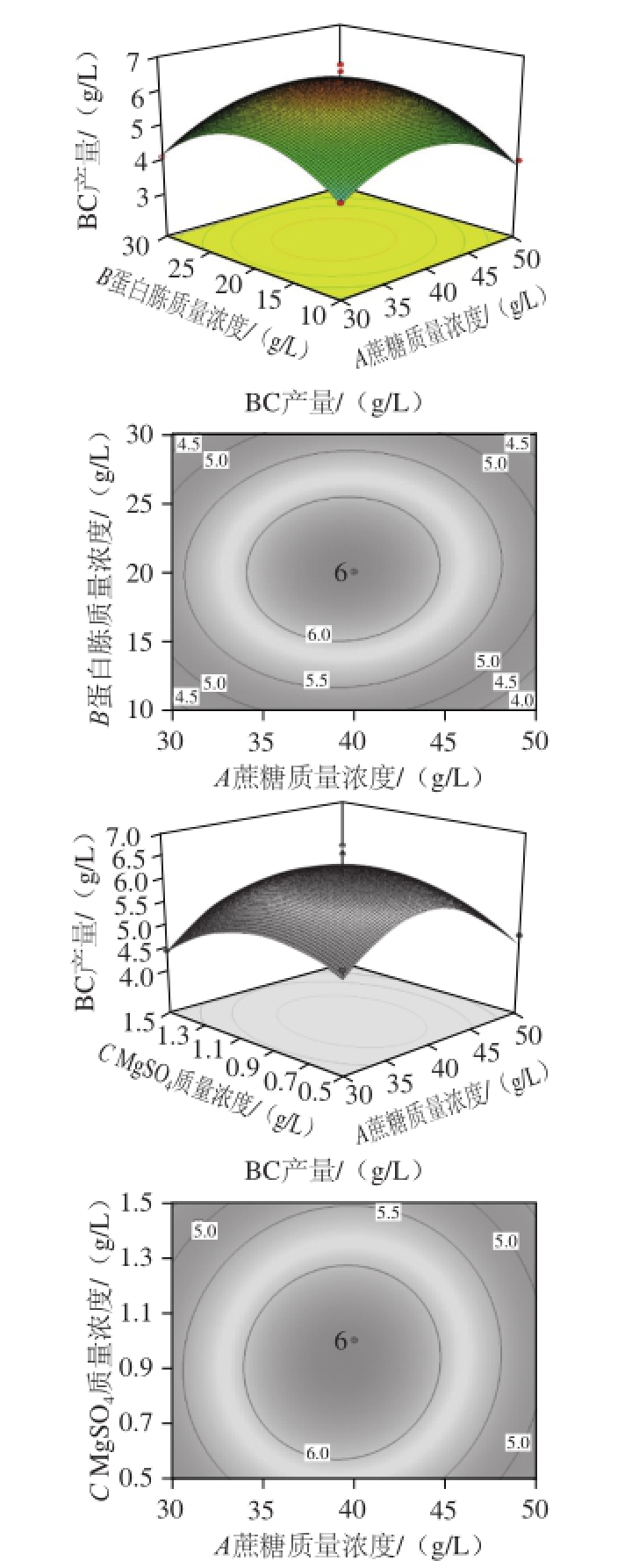
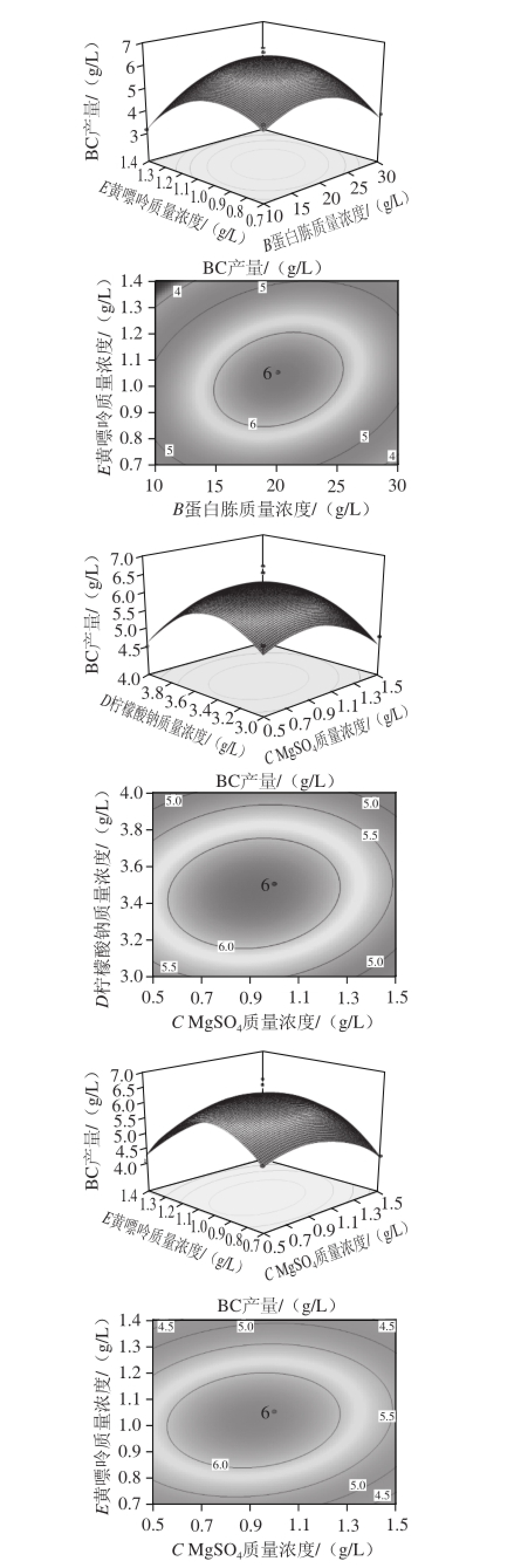
图6 各交互因素对BC产量影响的响应面及等高线图
Fig.6 Response surface plots showing the effects of medium components on the yield of BC
结合表2所示方差分析结果,由图6响应面曲线图及等高线图分析可知 [15]:黄嘌呤与MgSO 4、柠檬酸钠与MgSO 4、黄嘌呤与蛋白胨对BC产量影响的交互作用较强,蔗糖与蛋白胨、蔗糖与MgSO 4对BC产量影响的交互作用较弱。同时,黄嘌呤、MgSO 4、柠檬酸钠对BC产量的影响比较显著,曲线较陡;而蔗糖、蛋白胨对BC产量的影响相对较小,曲线较平缓,其数值的增加减少,对响应值的变化影响较小。
2.2.3 最佳发酵培养基
由Design Expert 7.0软件求出回归模型极值点,对应的最佳发酵培养基组分为:蔗糖质量浓度39.33 g/L、蛋白胨质量浓度20.01 g/L、MgSO 4质量浓度0.91 g/L、柠檬酸钠质量浓度3.45 g/L、黄嘌呤质量浓度1.02 g/L,此条件下,BC的理论产量为6.33 g/L。为检验响应面法的可靠性,在最佳培养基条件下进行验证实验。此条件下进行3 次平行实验,BC平均产量为(6.27±0.11) g/L,与预测值接近,说明回归方程能比较真实地模拟各因素对BC产量的影响,因此,使用该回归模型优化利用酒糟水解液发酵生产BC的培养基是可行的。
2.3 发酵产物的结构与性能
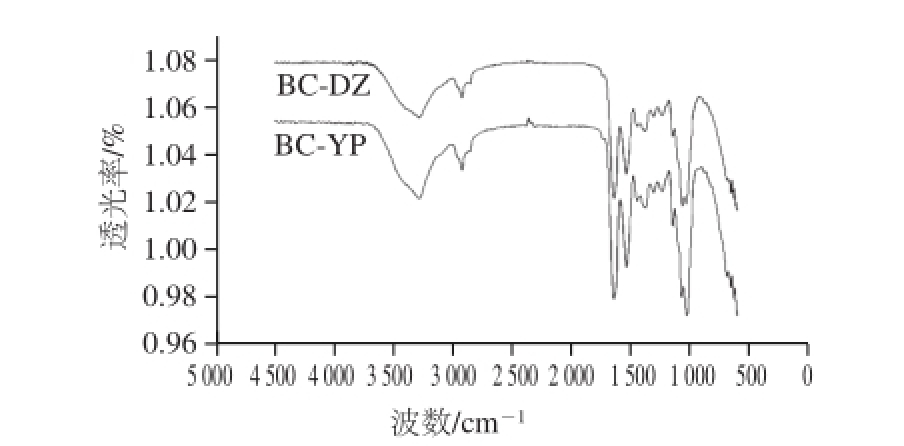
图7 基本培养基发酵BC(BC-DZ)与酒糟水解液发酵BC(BC-YP)红外图谱
Fig.7 FT-IR spectraof BC produced from basic culture medium (BC-DZ)and BC from culture medium containing vinasse hydrolysate (BC-YP)
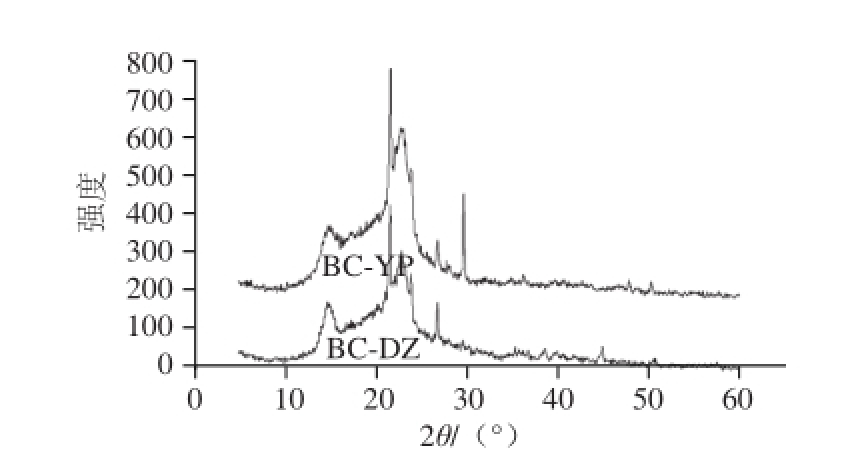
图8 基本培养基发酵BC(BC-DZ)与酒糟水解液发酵BC(BC-YP)XXRRDD图谱
Fig.8 XRD of BC produced from basic culture medium (BC-DZ) and BC from culture medium containing vinasse hydrolysate (BC-YP)
酒糟水解液发酵BC(BC-YP)与基本培养基发酵BC(BC-DZ)红外图谱如图7所示。吸收峰3 285、1 154、1 077、1 040 cm -1证实了样品中大量—OH的存在;吸收峰2 925、1 383、1 313、667、645 cm -1证实了—CH 2—、—CH和C—H的存在;吸收峰1 241 cm -1证实了环C—O—C的存在;吸收峰1 241、1 033 cm -1证实了直链C—O—C的存在 [16-17]。以上结果显示为细菌纤维素葡聚糖的特征吸收,可以推断出两种样品的主要成分均为细菌纤维素。由图7可知,BC-YP和BC-DZ红外图谱基本一致,说明两种样品的化学组成非常相似,酒糟水解液作为发酵原料不影响BC的化学结构。
酒糟水解液发酵BC(BC-YP)与基本培养基发酵BC(BC-DZ)XRD图谱如图8所示,BC-YP和BC-DZ的X射线图谱大致相同,且在相同位置处均含有主要衍射峰,分别在144.8°、16.8°和21.7°附近存在3 个衍射峰,此3 个峰分别对应纤维素晶体的<101>、<101>和<002>晶面 [18],据此可知BC-YP和BC-DZ为Ⅰ型纤维素。
两种样品的结晶度与晶体粒径实验结果表明,BC-YP和BC-DZ的结晶度基本相同,分别为23.73%及23.95%,BC-YP粒径为34 nm,BC-DZ粒径为13 nm。结晶度与纤维的抗张强度、杨氏模量、硬度、伸长率、吸湿性、润胀度、柔软性等性质有一定的关系 [19-20],说明酒糟水解液作为发酵原料不影响BC结晶度。晶体粒径与透明度、撕裂因子有关,酒糟水解液中含有纤维素未水解完全的多糖成分,部分多糖可在BC合成过程中结合到BC中,从而改变BC的晶体粒径。
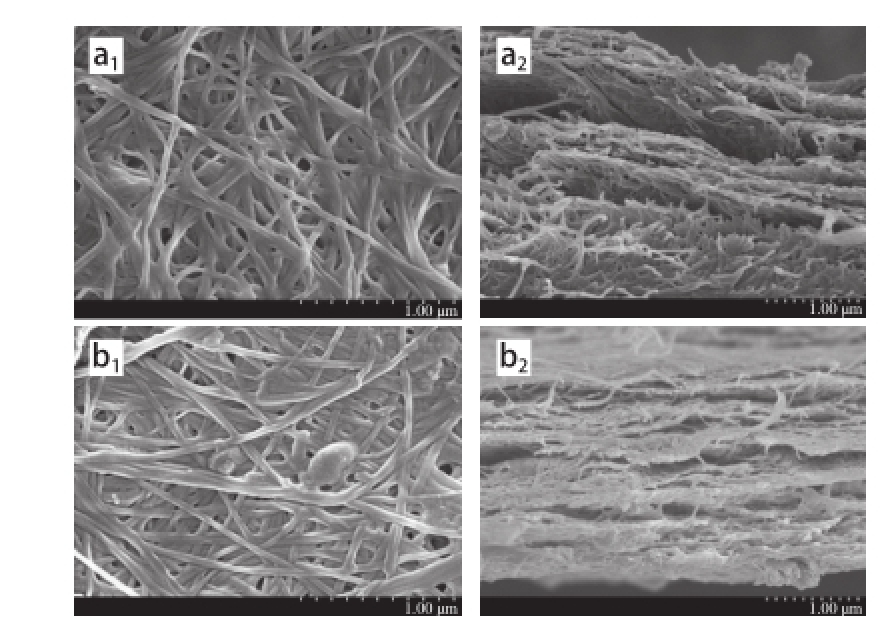
图9 基本培养基发酵BC(BC-DZ)与酒糟水解液发酵BC(BC-YYPP)SEM图谱
Fig.9 SEM of BC produced from basic culture medium (BC-DZ) and BC from culture medium with vinasse hydrolysate (BC-YP)
a. BC-DZ;b. BC-YP;下脚标1、2分别为表面和断面。
酒糟水解液发酵BC(BC-YP)与基本培养基发酵BC(BC-DZ)SEM图谱如图9所示,BC-YP和BC-DZ均由高密度纳米级微纤维相互缠绕形成,具有三维网状层状结构 [21]。SEM表面和断面图谱显示BC-YP的微纤丝之间有填充物存在。这可能是因为在BC合成过程中,酒糟水解液中的多糖成分能够直接结合在BC的网状结构中,这与XRD的检测结果一致。
通过单因素试验和响应面法对酒糟水解液发酵生产BC的发酵培养基配方进行优化,建立了蔗糖、蛋白胨、MgSO 4、柠檬酸钠和黄嘌呤5 个因素对BC产量的二次回归方程模型,经检验,模型准确有效,可以用该模型分析预测各因素对BC产量的影响。由单因素试验和响应面优化模型确定利用酒糟水解液发酵生产BC的最佳发酵培养基为:蔗糖39.33 g、蛋白胨20.01 g、MgSO 40.91 g、柠檬酸钠3.45 g、黄嘌呤1.02 g、乙醇10 mL、酒糟水解液1 000 mL、pH 6.0。在此条件下,得到BC产量为6.27 g/L,较优化前(4.40 g/L)提高了42.5%。利用FT-IR、XRD、SEM对发酵产物BC化学基团、结晶性能、微观结构进行了比较,结果表明,酒糟水解液发酵产物BC结构性能与基本培养基发酵产物BC基本一致,酒糟水解液能够替代部分发酵原料发酵生产BC,且不影响BC性能。
参考文献:
[1] SYBELE S, LUCAS N T, PAULO T O, et al. Bacterial cellulosecollagen nanocomposite for bone tissue engineering[J]. Journal of Materials Chemistry, 2012, 22: 22102-22112.
[2] CAI Zhijiang, YANG Guang. Bacterial cellulose/collagen composite:characterization and first evaluation of cytocompatibility[J]. Journal of Applied Polymer Science, 2011, 120: 2938-2944.
[3] 李静, 连宾, 胡鹏刚. 细菌多糖及其在食品工业中的应用[J]. 食品科学, 2006, 27(4): 255-259.
[4] 閻立平, 黃俊智, 顏文義, 等. 利用木醋酸菌A-7(Acetobacter xylinum A-7)發酵米酒糟生產細菌纖維素之研究(I)以反應曲面法探討米酒糟基質中最適蛋白腖與酵母萃取物之添加濃度[J]. 東海學報, 2007,48: 59-68.
[5] 沈金朋, 罗庆平, 段晓惠, 等. 利用酒糟浸出液制备细菌纤维素[J].食品科学, 2011, 32(3): 203-206.
[6] 史红兵, 宋纪蓉, 黄洁, 等. 果渣制备可溶性膳食纤维的工艺研究[J].西北大学学报: 自然科学版, 2004(4): 148-152.
[7] 张世仙, 余永华, 金茜, 等. 凯氏定氮法测定茅台香型酒酒糟蛋白质含量[J]. 中国酿造, 2013, 32(1): 130-132.
[8] 张雯, 齐香君. 细菌纤维素生产菌株菌体细胞收集方法的研究[J].食品工业科技, 2006, 27(9): 57-58.
[9] CHAO Yaping, ISHIDA T Y, SUGANO Y, et al. Bacterial cellulose production by Acetobacter xylinum in a 50-L internal-loop airlift reactor[J]. Biotechnology and Bioengineering, 2000, 68(3): 345-352.
[10] PUTRA A, KAKUGO A, FURUKAWA H, et al. Tubular bacterial cellulose gel with oriented fibrils on the curved surface[J]. Polymer,2008, 49: 1885-1891.
[11] ZENG Xiaobo, DARCY P S, WANKEI W. Statistical optimization of culture conditions for bacterial cellulose production by Acetobacter xylinum BPR 2001 from maple syrup[J]. Carbohydrate Polymers,2011, 85(3): 506-513.
[12] CHEN Lin, HONG Feng, YANG Xuexia, et al. Biotransformation of wheat straw to bacterial cellulose and its mechanism[J]. Bioresource Technology, 2013, 135: 464-468.
[13] SON H J, KIM H G, KIM K K, et al. Increased production of bacterial cellulose by Acetobacter sp. V6 in synthetic media under shaking culture conditions[J]. Bioresource Technology, 2003, 86(3): 215-219.
[14] 章国燕, 张奕华. 选择性磷酸二酯酶Ⅳ抑制剂的研究[J]. 药学进展,2002, 26(2): 86-91.
[15] SARYA A, PIERRE D, SELIM K. Lipase-catalyzed transesterification of krill oil and 3,4-dihydroxyphenyl acetic acid in solventfree medium using response surface methodology[J]. Journal of Molecular Catalysis B: Enzymatic, 2012, 84(212): 189-197.
[16] 张丽平, 卢红梅, 彭湘屏, 等. 淋浇发酵法生产细菌纤维素的结构与性质研究[J]. 食品工业科技, 2012, 33(22): 197-201.
[17] RAJALAXMI D, MARCUS F, ARTHUR J R. Improving the mechanical and thermal properties of gelatin hydrogels cross-linked by cellulose nanowhiskers[J]. Carbohydrate Polymers, 2013(91): 638-645.
[18] PEI Ying, YANG Juan, LIU Pan, et al. Fabrication, properties and bioapplications of cellulose-collagen hydrolysate composite films[J]. Carbohydrate Polymers, 2013, 92: 1752-1760.
[19] SASKA S, BARUD H S, GASPAR A M M, et al. Bacterial cellulosehydroxyapatite nanocomposites for bone regeneration[J]. International Journal of Biomaterials, 2011, 5(5): 1605-1613.
[20] 冯劲, 施庆珊, 冯静, 等. 不同干燥方式对细菌纤维素物理性能的影响[J]. 现代食品科技, 2013, 29(9): 2225-2229; 2101.
[21] WEI Bin, YANG Guang, HONG Feng. Preparation and evaluation of a kind of bacterial cellulose dry films with antibacterial properties[J]. Carbohydrate Polymers, 2011, 84: 533-538.
Optimization of Culture Medium Based on Vinasse Hydrolysate for Acetobacter xylinum by Response Surface Methodology for Enhanced Production of Bacterial Cellulose and Properties of the Product
ZHANG Wen, LIU Kang, LUO Feifei, ZHANG Minjuan, LI Yanjun
(College of Life Science and Engineering, Shaanxi University of Science and Technology, Xi'an 710021, China)
Abstract:Response surface methodology was used to optimize the fermentation medium based on vinasse hydrolysate for enhanced production of bacterial cellulose (BC). Meanwhile, the properties and structures of the BC were compared with those obtained with the basic culture medium. According t o the results of single factor experiments and response surface analysis, the optimal medium components were determined as follows: saccharose 39.33 g, peptone 20.01 g, magnesium sulfate 0.91 g, sodium citrate 3.45 g, xanthine 1.02 g, ethanol 10 mL, vinasse hydrolysate 1 000 mL and pH 6.0, yielding 6.27 g/L of BC, which was increased by 42.5% when compared with that before optimization (4.4 g/L). The properties and structures of BC produced with vinasse hydrolysate were confirmed to be basically the same as those of BC produced with the basic medium through Fourier transform infrared (FT-IR) spectroscopy, X-ray diffraction (XRD) and scanning electron microscopy (SEM), suggesting that vinasse hydrolysate could be used as an alternative raw material for the fermentation of BC without any influence on the properties of BC.
Key words:vinasse; bacterial cellulose; culture medium optimization; response surface methodology; property
中图分类号:TS201.1
文献标志码:A
文章编号:1002-6630(2015)13-0160-07
doi:10.7506/spkx1002-6630-201513030
收稿日期:2014-07-21
基金项目:酿酒生物技术及应用四川省重点实验室开放基金项目(NJ2012-14);陕西省2014年省级大学生创新创业训练计划项目(0913)
作者简介:张雯(1982—),女,副教授,硕士,研究方向为生物制药。E-mail:zwen102@163.com