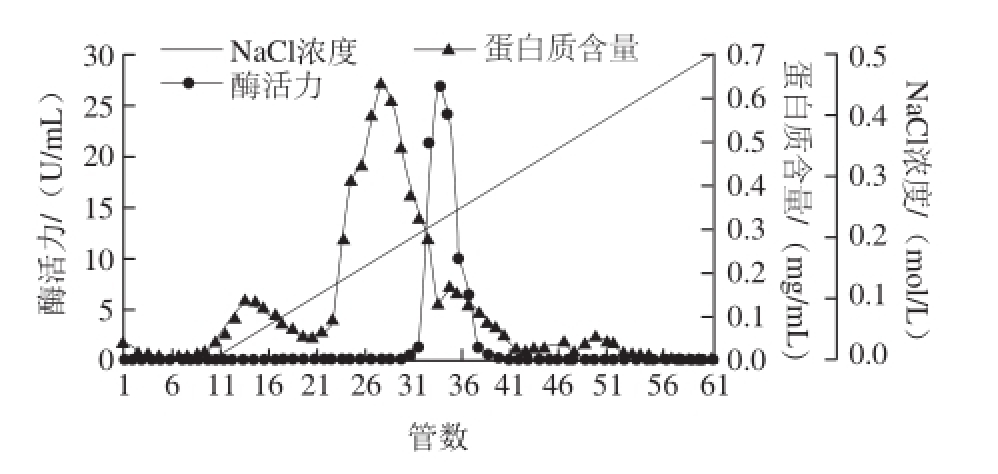
图1 牛肝GDH的DEAE-Sepharose离子交换层析
Fig.1 DEAE-Sepharose chromatography of GDH from bovine liver
王 丹,傅 婷,万 骥,唐云明*
(西南大学生命科学学院,重庆市甘薯工程研究中心,三峡库区生态环境教育部重点实验室,重庆 400715)
摘 要:取新鲜牛肝,经匀浆、缓冲液抽提、正丁醇脱脂、硫酸铵分级沉淀、DEAE-Sepharose离子交换层析、Superdex-200凝胶过滤层析等方法纯化,获得 了电泳纯的牛肝谷氨酸 脱氢酶(glutamate dehydrogenase,GDH)。经过纯化后的结果:GDH的酶比活力为306.0 6 U/mg,纯化倍数为 93.60 倍,酶活回收率为 23.12%。GDH的分子质量为380. 2 kD,亚基分子质量约为61.7 kD。酶学性质研究结果表明:GDH的最适反应温度为50 ℃,在温度为30 ℃以下时较稳定;最适反应pH值为8.2,该酶对烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)的K m值为0.696 mmol/L。甲醇、乙醇、异丙醇、Cd 2+、Co 2+、 Ca 2+、Ag +、Pb 2+、Zn 2+、Cu 2+对该酶具有抑制作用,低浓度Ba 2+、Mg 2+、K +、Li +与乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)对其具有一定的激活作用。
关键词:牛肝;谷氨酸脱氢酶;分离纯化;酶学性质
谷氨酸脱氢酶(glutamate dehydrogenase,GDH)以NAD(P)为辅酶,属于线粒体酶,广泛存在于动物、植物以及微生物体内 [1-2],是生物体内进行谷氨酸新陈代谢的关键酶之一 [3],主要催化α-酮戊二酸和谷氨酸之间的可逆转化,该酶以四聚体、六聚体的形式存在于生物体内 [4],在生物化学分析、医学药物分析以及食品酶制剂中具有非常重要的应用价值 [5-7]。目前,有多种来源的GDH提取及分子结构相关研究的详细报道 [8-12],但国内关于从牛肝中提纯GDH的方法及酶学性质的研究未见报道,且国内所需GDH主要来源于国外生产,价格昂贵。因此,获得来源较广、成本较低廉的GDH在理论及实践方面有十分重要的意义。牛肝是牛肉加工过程中总量十分丰富的副产品,价格较低且易取材,因此本实验尝试以牛肝为实验材料,从中分离纯化GDH并对部分酶学性质进行了研究,旨在为GDH更深入研究、在国内自主生产及应用该酶提供参考。
1.1 材料与试剂
以健康新鲜的牛肝脏作为材料,购于重庆市北碚区农贸市场。
DEAE-Sepharose、Superdex-200、凝胶过滤层析分子质量标准品和十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)标准品 美国GE Healthcare公司;丙烯酰胺、甲叉-双丙烯酰胺 瑞士Fluka公司;考马斯亮蓝R-250 美国Bio-Rad公司;牛血清白蛋白 美国Sigma公司;其余试剂均为国产分析纯。
1.2 方法
1.2.1 牛肝GDH粗酶液的制备
将新鲜牛肝去除结缔组织后,称取90 g,剪碎并用生理盐水浸泡30 min,用双蒸水清洗数次,按1∶3(m/V)的比例加入预冷的10 mmol/L pH 8.0的Tris缓冲液(内含0.5 mmol/L乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)),匀浆后,4 ℃冰箱中抽提2 h,4 ℃条件下12 000 r/min离心30 min,收集上清液;按10%的比例加入预冷的正丁醇,置于4 ℃冰箱中抽提2 h后12 000 r/min离心30 min,弃正丁醇层,收集上清液即为粗酶液。
1.2.2 硫酸铵分级沉淀
向粗酶液中加入干燥的硫酸铵粉末至25%饱和度,4 ℃冰箱中静置2 h,12 000 r/min离心30 min,收集上清液,再向其中加入干燥的硫酸铵粉末至55%饱和度,4 ℃冰箱中静置1 h,12 000 r/min离心30 min,收集沉淀;沉淀用10 mmol/L pH 8.0 的Tris缓冲液(内含0.5 mmol/L EDTA)完全溶解,于4 ℃条件下透析24 h后6 000 r/min离心20 min,收集上清液即为初步纯化的GDH酶液。
1.2.3 DEAE-Sepharose离子交换层析
DEAE-Sepharose离子交换层析柱经25 mmol/L pH 8.0的磷酸盐缓冲液(phosphate buffered saline,PBS)内含0.5 mmol/L EDTA,1 mmol/L β-巯基乙醇)平衡后,取10 mL初步纯化后的GDH酶液上样,用0~1 mol/L的NaCl(由25 mmol/L pH 8.0的PBS溶液配制而成,含0.5 mmol/L的EDTA,1 mmol/L的β-巯基乙醇)进行线性梯度洗脱,流速0.5 mL/min,每管收集5 mL,紫外检测波长为280 nm。测定各管GDH的酶活力和蛋白质含量,收集活性较高的酶液。
1.2.4 Superdex-200凝胶过滤层析
Superdex-200凝胶层析柱经25 mmol/L pH 8.0的PBS溶液(内含0.5 mmol/L EDTA,1 mmol/L β-巯基乙醇)平衡后,取经离子交换层析后活性较高的酶液上样,每次5 mL,用25 mmol/L pH 8.0的PBS溶液(内含0.5 mmol/L EDTA,1 mmol/L β-巯基乙醇)进行洗脱,流速0.5 mL/min,每管收集3 mL。测定各管GDH的酶活力和蛋白质含量,收集活性较高的酶液,4 ℃冰箱中超纯水透析24 h,冷冻干燥后,得到GDH纯品,置于-20 ℃冰箱保存备用。
1.2.5 GDH纯度鉴定及分子质量测定
通过SDS-PAGE法对凝胶过滤层析后获得的GDH进行纯度鉴定,制备5%浓缩胶和12%分离胶,上样量为10 μL,经SDS-PAGE法和凝胶过滤层析分别测定其亚基分子质量和全分子质量 [13]。
1.2.6 GDH活力的测定
参照文献[10]略有改进,测酶活力体系包含150 μL 0.1 mol/L的α-酮戊二酸,150 μL 1 mol/L(NH 4) 2SO 4,20 μL 18 mmol/L的二磷酸腺苷(adenosine diphosphate,ADP),50 μL 10 mmol/L的烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH),2.53 mL 50 mmol/L的Tris缓冲液与100 μL的酶液,混匀后,于50 ℃条件下进行反应。在340 nm波长处测定NADH 1 min内吸光度的减少值。酶活力单位定义:25 ℃时,每分钟氧化1 μmol NADH所需的酶量为1 个酶活力单位(U)。
1.2.7 蛋白质含量测定方法
采用紫外分光光度法和考马斯亮蓝染料(Bradford)法对蛋白质含量进行测定 [13]。
1.2.8 牛肝GDH酶学性质的研究
1.2.8.1 最适反应温度与热稳定性
在不同温度(25~70 ℃,梯度为5 ℃),pH 8.2条件下测定GDH的酶活力,以酶活力最高值为100%,计算其他温度下的相对酶活力,以确定其最适反应温度。将酶液分别置于不同温度(20~60 ℃,梯度为10 ℃)下保温不同的时间后,测定GDH的酶活力,以酶液不保温时的酶活力为100%,计算不同温度、时间下的相对酶活力,以研究该酶的热稳定性。
1.2.8.2 最适pH值和pH值稳定性
在不同pH 3~10条件下测定GDH的酶活力,以酶活力最高值为100%,计算其他各pH值下的相对酶活力,以确定GDH的最适反应pH值。将纯化后的GDH酶液分别置于不同pH 3~10的缓冲液中静置3 h后,测定GDH的酶活力,以酶活力最高值为100%,计算其他各pH值条件下的相对酶活力,以研究该酶的pH值稳定性。
1.2.8.3 米氏常数(K m)的测定
配制不同浓度(0.1~1 mmol/L)的NADH,50 ℃、pH 8.2的条件下测定牛肝GDH的酶活力,采用双倒数作图(Lineweaver-Burk)法 [14],求出GDH的K m值。
1.2.8.4 不同有机溶剂对GDH活性的影响
将不同体积分数(10%~50%)的甲醇、乙醇、异丙醇与GDH酶液等体积混合后,4 ℃冰箱中静置30 min,测定酶活力,以酶液中不加有机溶剂时的相对酶活力为100%,计算GDH的相对酶活力。
1.2.8.5 不同化合物对GDH活性的影响
将不同浓度(5~25 mmol/L)的抗坏血酸、EDTA、草酸、SDS、尿素酶液等体积混合后,4 ℃冰箱中静置30 min,测定酶活力,以酶液中不加化合物时的酶活力为100%,计算GDH的相对酶活力。
1.2.8.6 不同金属离子对GDH活性的影响
将不同浓度(10~50 mmol/L)金属离子与酶液等体积混合后,4 ℃冰箱中静置30 min,测定酶活力,以酶液中不加金属离子时的相对酶活力为100%,计算GDH的相对酶活力。
2.1 牛肝GDH的分离纯化

图1 牛肝GDH的DEAE-Sepharose离子交换层析
Fig.1 DEAE-Sepharose chromatography of GDH from bovine liver
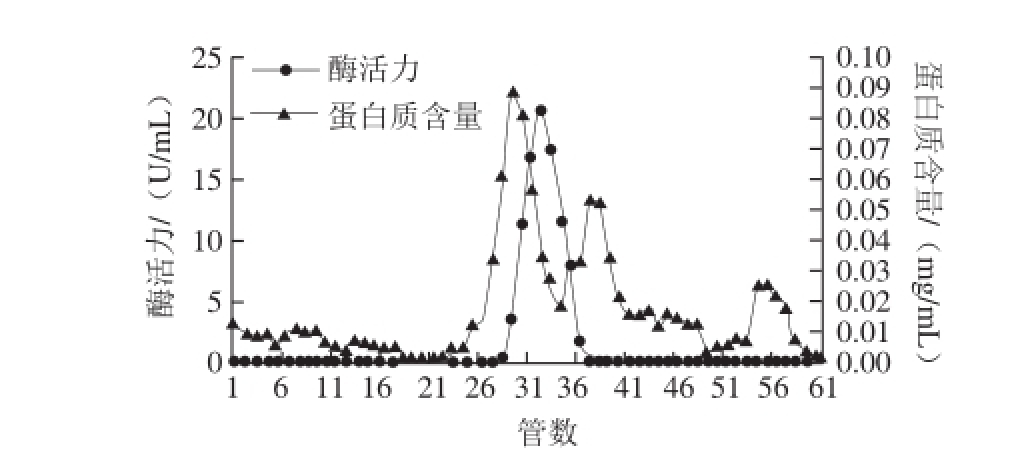
图2 牛肝GDH的Superdex-200凝胶过滤层析
Fig.2 Superdex-200 chromatography of GDH from bovine liver
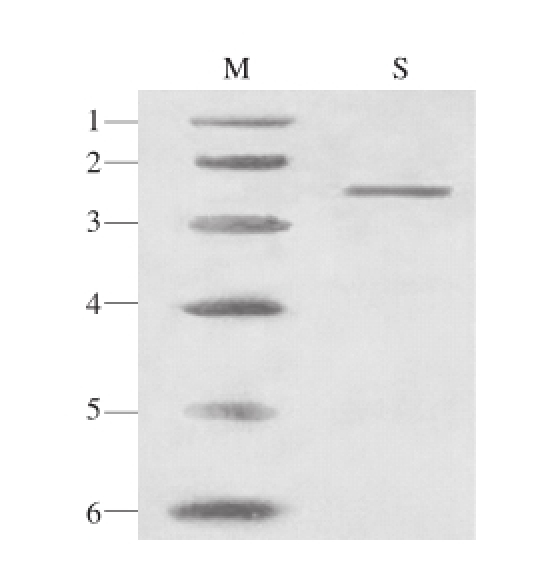
图3 牛肝GDH的SDS-PAGE图谱
Fig.3 SDS-PAGE of GDH from bovine liver
M.分子质量标准品:1.兔磷酸化酶 B 97.0 kD;2.牛血清白蛋白66.0 kD;3.鸡卵清蛋白 45.0 kD;4.牛碳酸酐酶 30.0 kD;5.大豆胰蛋白酶抑制剂 20.1 kD;6. α-牛乳白蛋白 14.4 kD;S. 牛肝GDH 61.7 kD。
牛肝GDH粗酶液经DEAE-Sepharose层析后结果如图1所示,可见酶活力峰主要集中在31~38 管;收集酶活力较高的各管酶液进行Superdex-200层析,洗脱图谱如图2所示,可见酶活力峰主要集中在30~35 管,收集较高酶活性峰的各管酶液;经透析冷冻浓缩后的样品,进行SDS-PAGE凝胶电泳后显示为单一条带,如图3所示,表明GDH已达到电泳纯;整个纯化结果如表1所示,最终得到牛肝GDH纯品的酶活回收率为23.12%,纯化倍数为93.60 倍,酶比活力达到306.06 U/mg。
表1 牛肝GDH的纯化结果
Table1 Purification of GDH from bovine liver
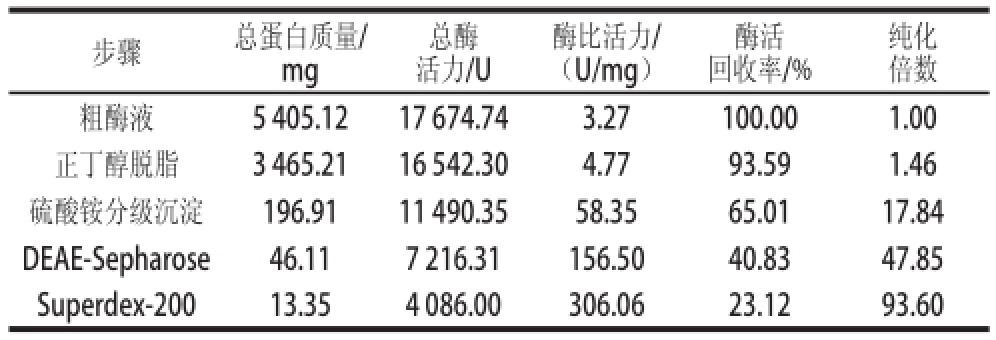
总酶活力/U步骤总蛋白质量/ mg酶比活力/(U/mg)酶活回收率/%纯化倍数粗酶液5 405.1217 674.743.27100.001.00正丁醇脱脂3 465.2116 542.304.7793.591.46硫酸铵分级沉淀196.9111 490.3558.3565.0117.84 DEAE-Sepharose46.117 216.31156.5040.8347.85 Superdex-20013.354 086.00306.0623.1293.60
2.2 牛肝GDH的分子质量
经过SDS-PAGE法,测得GDH的亚基分子质量约为为61.7 kD,经过Superdex-200层析测得其全酶分子质量约为380.2 kD,如图4所示,由此可以推测牛肝GDH由6 个亚基组成。
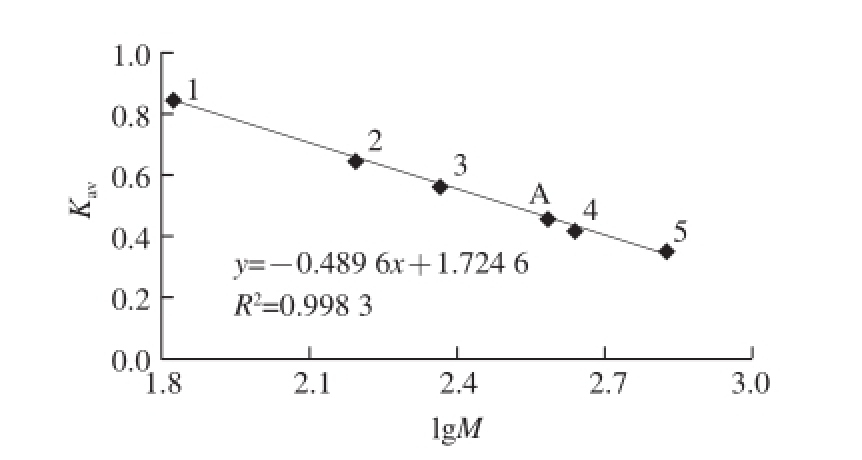
图4 Sephacryl-200凝胶过滤测定牛肝GDH分子质量
Fig.4 Estimation of molecular weight of GDH by Superdex-200 gel filtration chromatography
1.牛血清白蛋白66.45 kD;2.醛缩酶 158 kD;3.过氧化氢酶 232 kD;4.铁蛋白440 kD;5.甲状腺球蛋白669 kD;A.牛肝谷氨酸脱氢酶分子质量 380.2 kD。
2.3 牛肝GDH的部分酶学性质
2.3.1 最适反应温度与热稳定性
实验结果表明:随着温度的升高,酶活力出现先增大后减小的趋势,且在50 ℃时,酶活力达到最高,因此该酶的最适反应温度为50 ℃(图5),在45~55 ℃范围内,酶活力均保持在90%左右。酶的热稳定性(图6),在20~40 ℃范围内,保温1 h后酶活力均保持在较高水平(80%左右),超过1 h酶活力逐渐下降;温度超过40 ℃后,酶活力急剧下降,1 h之内完全丧失,主要原因是在较高温度的作用下,引起酶蛋白分子内部的基团间的相互作用发生变化,从而酶分子的天然构象被破坏,导致其催化功能的急剧减小甚至完全丧失,由此可推断,该酶不耐高温,在40 ℃以下时较稳定。
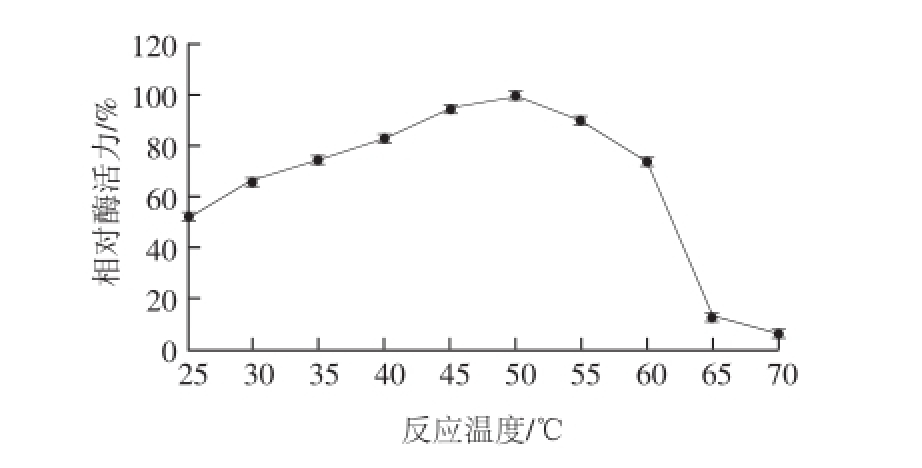
图5 反应温度对牛肝GDH活力的影响
Fig.5 Effect of temperature on the activity of GDH from bovine liver
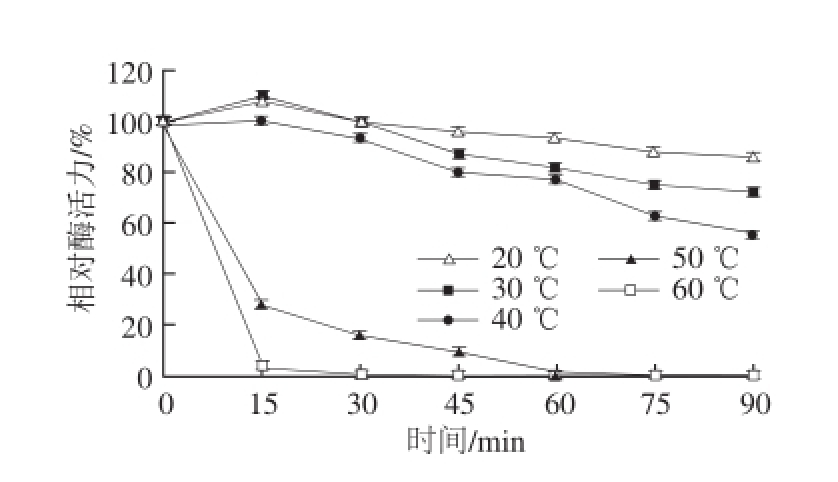
图6 牛肝GDH的热稳定性
Fig.6 Thermal stability of GDH from bovine liver
2.3.2 最适pH值和pH值稳定性
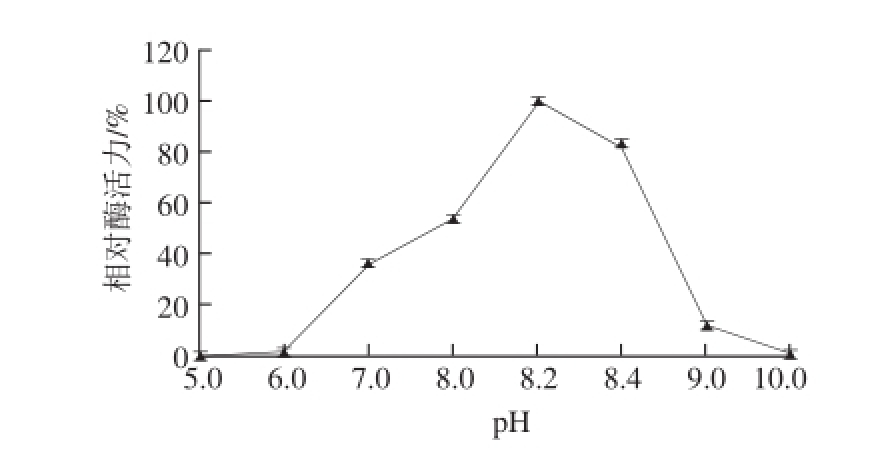
图7 pH值对牛肝GDH活力的影响
Fig.7 Effect of pH on the activity of GDH from bovine liver
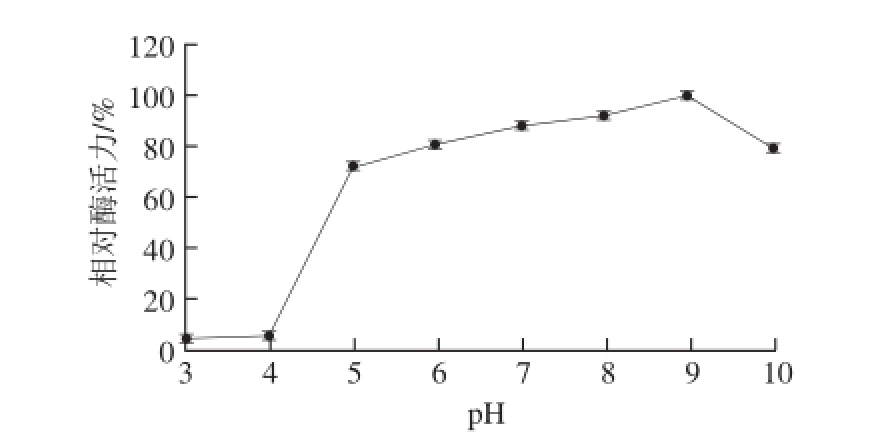
图8 牛肝GDH的pH值稳定性
Fig.8 pH Stability of GDH from bovine liver
由图7可知,该酶的最适pH值为8.2,在pH 7~9范围内,酶活力较高,当pH值小于6和大于10时,酶活力几乎完全丧失,其主要原因是pH值会影响酶的活性基团和底物的解离状态,同时过高或者过低的pH值也会影响酶分子活性中心的构象,从而导致其催化效率的降低。由图8可见,在pH 5~10范围内,放置3 h后,酶活力均保持在较高水平(70%以上),表明该酶具有较强的酸碱耐受性。
2.3.3 牛肝GDH的米氏常数
采用Lineweaver-Burk法,在50 ℃、pH 8.2的条件下,以不同浓度的NADH为底物,结果显示该酶的催化反应与米氏动力学规律相符合,1/[S]与1/v呈线性关系,由图9中直线方程得GDH的K m值为0.696 mmol/L,表明在酶的催化反应过程中,酶与底物NADH之间具有较高的亲和力。
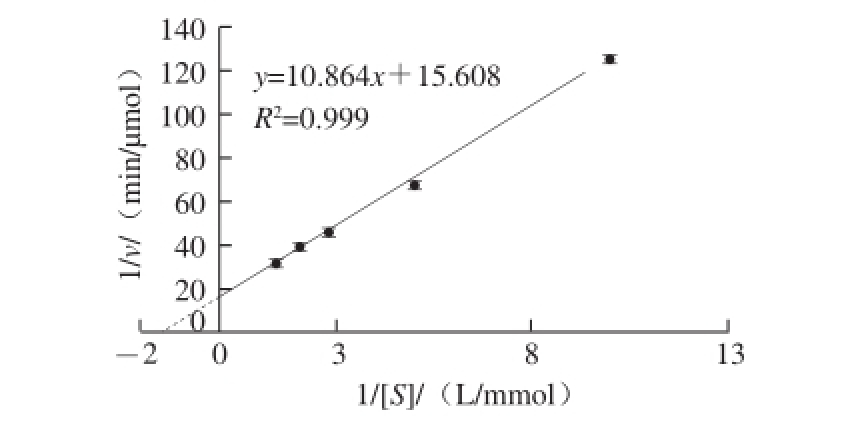
图9 双倒数法测牛肝GDH的米氏常数
Fig.9 K
mdetermination of GDH from bovine liver by Lineweaver-Burk plot
2.3.4 不同有机溶剂对GDH活性的影响
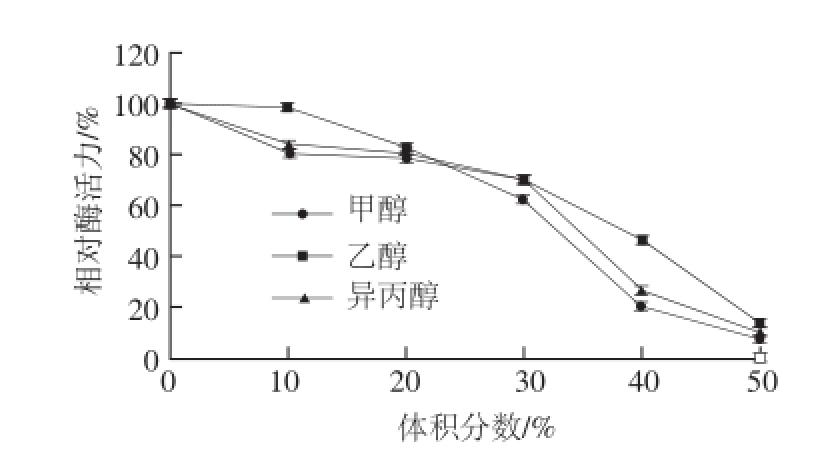
图10 不同有机溶剂对牛肝GDH活力的影响
Fig.10 Effect of various organic solvents on the activity of GDH from bovine liver
由图10可知,在3 种不同有机溶剂的作用下,酶活力均表现出被抑制的趋势,特别是在甲醇的体积分数升高的过程中,酶活力急剧下降;当甲醇、乙醇和异丙醇的体积分数超过30%时,酶活力均出现骤降的趋势且在体积分数达到50%时酶活力几乎完全丧失,其主要原因是由于有机溶剂中水的含量对酶的催化功能具有显著影响,因为水直接或者间接参与了酶天然构象中氢键、静电作用、范德华力等非共价键的相互作用,因此,随着有机溶剂浓度的增加,酶进行催化反应的必需水降低,导致其催化效率急剧减小甚至完全丧失。
2.3.5 不同化合物对GDH活性的影响

图11 不同化合物对牛肝GDH活力的影响
Fig.11 Effects of different compounds on the activity of GDH from bovine liver
由图11可知,EDTA对该酶活性表现出一定的激活作用,且随着EDTA浓度的增加,激活作用越显著,其主要原因是EDTA是一种金属螯合剂,它能有效地防止高浓度的Mg 2+和Ca 2+等对该酶的抑制作用,从而增大酶活力;尿素和抗坏血酸对该酶活性具有较小的影响,当浓度达到25 mmol/L时,相对酶活力依然保持在70%左右;SDS对该酶的抑制作用最显著,其原因是SDS破坏了酶蛋白分子中的氢键和疏水键,改变了该酶的空间构象,从而使其变性失活。草酸对该酶的抑制作用较为明显,当浓度达到20 mmol/L时,酶活力开始急剧下降,当浓度达到25 mmol/L时,活力完全丧失;SDS对该酶的抑制作用最为显著,当其浓度达到10 mmol/L时,酶活力已完全丧失。
2.3.6 不同金属离子对GDH活性的影响
由图12可知,在不同浓度的情况下,同一种金属离子以及不同金属离子对该酶均表现出不同的作用效果。Ba 2+、Mg 2+、K +、Li +低浓度时对该酶具有一定的激活作用,其原因主要是当低浓度的金属离子加入后,会形成金属离子,底物和酶蛋白的三元配合物的稳定过渡态,降低反应的活化能,从而加快酶促反应的速度 [15]。Cd 2+、Co 2+、Ca 2+对该酶较为显著的抑制作用;Ag +、Pb 2+、Zn 2+、Cu 2+对该酶的抑制作用非常强烈,当浓度达到20 mmol/L时,酶活性几乎完全丧失,其主要原因是这些金属离子的作用会影响酶的二级、三级和四级结构,主要影响酶活性中心的构象,从而导致酶活力的降低甚至完全丧失 [16]。
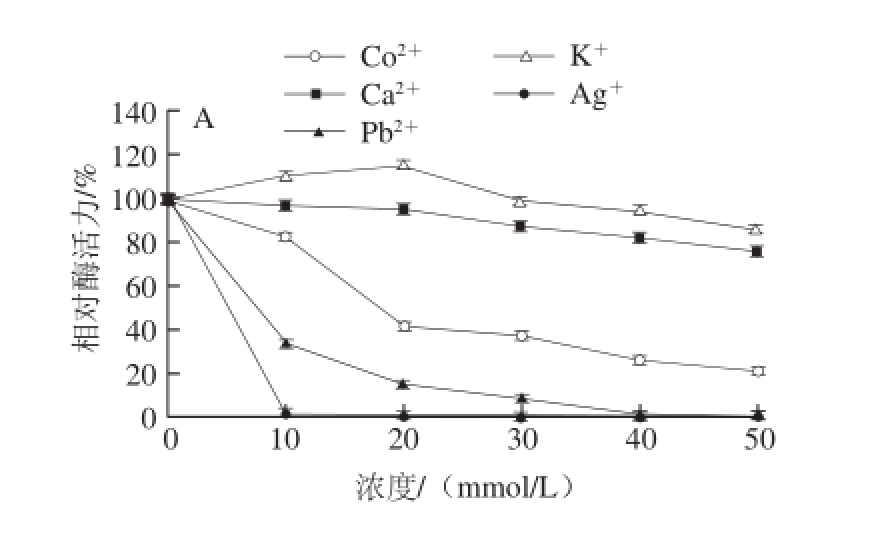
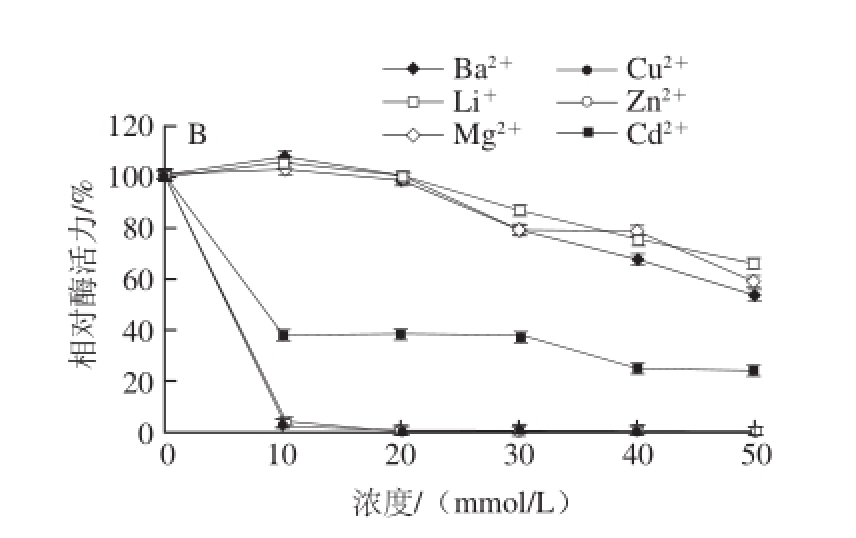
图12 不同金属离子对牛肝GDH活力的影响
Fig.12 Effect of various metal ions on the activity of GDH from bovine liver
本实验选取的材料为新鲜的牛肝,经一系列的纯化步骤从中分离纯化得到了电泳纯的GDH。在纯化过程中与鸭肝GDH [9]相比较,该实验步骤更简便,且经DEAESepharose离子交换层析纯化后收集到的酶液活性较高,不需冷冻干燥可直接上Superdex-200凝胶过滤层析柱,减少实验所需时间的同时也减少了酶活力的损失;与以牛肝细胞核为材料 [17]的报道中,本实验以DEAE-Sepharose离子交换层析替代其两次均使用的Sephadex G-200凝胶层析步骤,从而更高效的减少了杂蛋白,提高了纯化倍数;比较于谷氨酸棒杆菌S 9114GDH [18]与牛脑GDH [19]的纯化过程减少了层析次数,提高了纯化效率,同时得到了电泳纯的谷氨酸脱氢酶;与猪肝(75.5 倍) [8]、鸭肝(60.9 倍) [9]、猪脑(70.1 倍) [10]和牛肝细胞核(82、87.8 倍) [17,20]中的GDH相比,提高了纯化倍数。
该酶的亚基分子质量约为6 1.7 k D,与鸭肝(61.60 kD) [9]相接近,高于猪脑(56.04 kD) [10]亚基分子质量;表明来源不相同的在GDH分子结构具有物种特异性。该酶对NADH的K m值为0.096 mmol/L,相近于猪脑(0.084 mmol/L) [10]以及牛脑(0.12 mmol/L) [16]中GDH的K m值;高于鸭肝(53.19 μmol/L) [9]中的GDH,表明不同来源的GDH对底物的亲和力具有一定的差异。
该酶的最适温度为50 ℃,高于鸭肝(35 ℃)GDH [9],低于猪脑(55 ℃)GDH [10]的最适温度;但是该酶在此温度下稳定性较差,在保温1 h内,酶活力急剧下降;该酶的最适反应pH值为8.2,与来源于猪脑中的GDH [10]一样,低于来源于鸭肝(pH 10.0)中的GDH [9],高于谷氨酸棒杆菌S 9114(pH 7.5) [18]、类产碱假单胞菌(pH 8.0) [1]以及双色蜡蘑(pH 7.4) [21]中的GDH最适pH值,表明不同来源的GDH的最适pH值具有一定的差异。在pH 5~10范围内,放置3 h后,酶活力均保持在70%以上,表明该酶对酸碱环境的适应力更强,具有较好的应用价值。
Cd 2+、Co 2+、Ca 2+对该酶具有较为显著的抑制作用;Ag +、Pb 2+、Zn 2+、Cu 2+对该酶的抑制作用非常强烈,其原因可能是该酶的活性中心与金属离子直接结合,从而对该酶活性产生强烈抑制作用 [22];Ba 2+、Mg 2+、K +、Li +对该酶活性的影响表现出两重性 [15],这可能是由于低浓度时可以促进底物与该酶的活性部位结合,形成底物-酶-离子复合物,激活该酶的活性,随着浓度的不断增大,Ba 2+、Mg 2+、K +、Li +聚集从而改变该酶的带电状况,该酶的空间结构被影响,导致酶活性下降 [23];其中Li +、Zn 2+、Cu 2+、Co 2+的作用效果与鸭肝GDH [9]及猪脑GDH [10]一致。
目前,牛肝谷氨酸脱氢酶主要依赖于进口,价格昂贵,且在国内尚未发现对牛肝GDH的分离纯化及其酶学性质的相关研究。本实验从新鲜牛肝中提取谷氨酸脱氢酶,流程简易,纯度较高,且成本较低,具有很强的可操作性。因此,对国内牛肝GDH的工业化生产具有一定的参考价值。
参考文献:
[1] 丁诗华, 刘世贵. 类产碱假单胞菌谷氨酸脱氢酶的纯化和性质[J].微生物学报, 1999(5): 475-477.
[2] 黄国存, 田波. 高等植物中的谷氨酸脱氢酶及其生理作用[J]. 植物学通报, 2001, 18(4): 396-401.
[3] BURBAEVA G S H, TURISHCHEVA M S, VOROBYEVA E A, et al. Diversity of glutamate dehydrogenase in human brain[J]. Progress in Neuro-Psychopharmacology and Biological Psychiatry, 2002, 26(3):427-435.
[4] BRITTON K I, BAKER P J, RICE D W, et al. Structural relationships between the hexameric and terameric family of glutamate dehydrogenase[J]. European Journal of Biochemistry, 1992, 209: 851-859.
[5] 孙立伟, 王今堆. 脲酶和谷氨酸脱氢酶的制备及有关性质的研究[J].吉林师范学院学报, 1998, 19(5): 67-71.
[6] 庄一义, 吴建平. 尿素酶-谷氨酸脱氢酶偶联法测定尿素氮(摘要)[J].临床检验杂志, 1989, 7(4): 224.
[7] 王燕, 杨平平, 宋香, 等. 谷氨酸生产菌S-(9114)中谷氨酸脱氢酶分离纯化条件的初步研究[J]. 中国调味品, 2004, 11(10): 24-28.
[8] 顾雅君, 孙淑琴. 猪肝谷氨酸脱氢酶的提纯[J]. 微生物学研究与应用, 1989(2): 32-34.
[9] 朱鸿, 李想韵, 王松, 等. 鸭肝谷氨酸脱氢酶的纯化与酶学性质研究[J].食品科学, 2010, 31(19): 231-235.
[10] 邓玉. 猪脑谷氨酸脱氢酶的分离纯化及性质和功能集团研究[D]. 重庆: 西南大学, 2012.
[11] FISHER. L-Glutamate dehydrogenase from bovine liver[J]. Method in Enzymology, 1967, 113: 16-27.
[12] EISENBERG H, TOMKINS G M. Molecular weight of the subunits, oligomeric and associated forms of bovine liver glutamate dehydrogenase[J]. Journal of Molecular Biology, 1968, 31(1): 37-49.
[13] 李建武, 余瑞元. 生物化学实验原理和方法[M]. 北京: 北京大学出版社, 1994: 71-223.
[14] 陈钧辉, 陶力, 朱婉华, 等. 生物化学实验[M]. 北京: 科学出版社,2004: 92-93.
[15] 王健. 金属离子对酶功能所起的作用[J]. 宜宾师专学报, 1993(2):65-71.
[16] 张晓晴. 香樟果实酪氨酸酶的分离、纯化和性质分析[D]. 无锡: 江南大学, 2008: 40-42.
[17] PRISCO G, GAROFANO F. Crystallization and partial characterization of glutamate dehydrogenase from ox liver nuclei[J]. Biochemistry, 1975, 14(21): 4673-4679.
[18] 王燕, 宋香, 杨平平, 等. 谷氨酸生产菌S 9114中依赖于NADPH谷氨酸脱氢酶的纯化及性质[J]. 食品与发酵工业, 2003, 29(11): 5-9.
[19] CHO S W, LEE J, CHOI S Y. Two soluble forms of glutamate dehydrogenase is oproteins from bovine brain[J]. European Journal of Biochemistry, 1995, 233(1): 340-346.
[20] PRISCO G, GAROFANO F. Purification and some properties of glutamate dehydrogenase from ox liver nuclei[J]. Biochemical and Biophysical Research Communications, 1974, 58(3): 683-689.
[21] GAMIER A, BERREDJEM A, BOTTON B. Purification and characterization of the NAD-dependent glutamate dehydrogenase in the ectomycorrhizal fungus laccaria bicolor (Maire) orton[J]. Fungal Genetics and Biology, 1997, 22: 168-176.
[22] 高亚鹏, 苏茉, 梁建荣, 等. 绿豆酸性磷酸酶的分离纯化和部分性质研究[J]. 中国粮油学报, 2011, 26(5): 92-96.
[23] 胡瑞彬, 孙芳, 任美凤. 蒜苗过氧化氢酶的分离纯化及部分性质研究[J]. 食品科学, 2012, 33(9): 250-255.
Isolation, Purification and Partial Characterization of Glutamate Dehydrogenase from Bovine Liver
WANG Dan, FU Ting, WAN Ji, TANG Yunming*
(Key Laboratory of Eco-environments in Three Gorges Reservoir Region, Ministry of Education, Chongqing Sweetpotato Engineering Research Center, School of Life Science, Southwest University, Chongqing 400715, China)
Abstract:Electro phoresis-purity glutamat e dehydrogenase (GDH) from bovine liver was obtained after homogenization,buffer solution extraction, n-butanol degreasing, ammonium sulfate fractional precipitation, DEAE-Sepharose ion exchange chromatography and Superdex-200 gel filtration. After purification, the specific activity of GDH was 306.06 U/mg, with 93.60-fold purification; meanwhile, the recovery rate was 23.12%. The molecular weight of GDH was approximately 380.2 kD, in which the subunit molecular weight was roughly 61.7 kD. The results of enzymatic characterization illustrated that the optimal r eaction temperature for GDH was 50 ℃, and it was relatively stable at a temperature below 30 ℃. The optimal reaction was pH 8.2, and its K mwas 0.696 mmol/L towards NADH. The enzyme activity of GDH was inhibited by methanol, ethanol, isopropanol a nd metal ions such as Cd 2+, Co 2+, Ca 2+, Ag +, Pb 2+, Zn 2+, and Cu 2+, but enhanced to some extent by low concentrations of Ba 2+, Mg 2+, K +, Li +and EDTA.
Key words:bovine liver; glutamate dehydrogenase; isolation and purification; enzymatic properties
中图分类号:Q946.5
文献标志码:A
文章编号:1002-6630(2015)13-0178-06
doi:10.7506/spkx1002-6630-201513033
收稿日期:2014-08-08
基金项目:重庆市科委科技重点攻关项目(CSTC,2011AB1027)
作者简介:王丹(1991—),女,硕士研究生,主要从事蛋白质与酶工程研究。E-mail:wdswu911@163.com
*通信作者:唐云明(1960—),男,教授,博士,主要从事蛋白质与酶工程研究。E-mail:tbright@swu.edu.cn